二次电池电极名称的判断
2024-10-29高会

电化学试题是高考必考题型,其中结合原电池和电解池考查的二次电池是考试的热点,解决此类试题的关键是要明确电池的电极名称,理解电极发生的电极反应.
1 根据电极材料判断
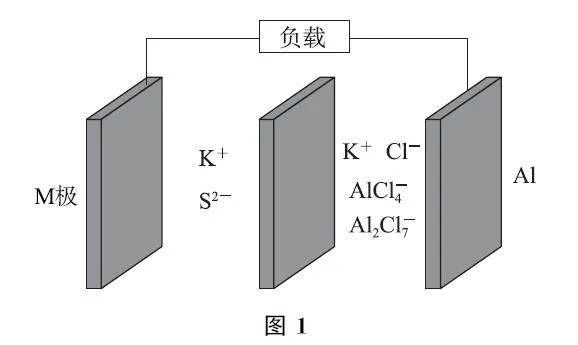
例1 铝硫二次电池是一种具有高能量密度、廉价原材料、有前途的替代储能装置.一种铝硫电池如图1所示,M 极为表面吸附了硫的活性电极,电解质为 K2S,KClGAlCl3(AlCl4-、Al2Cl7-).下列说法错误的是( ).
A.放电时,铝电极的电极反应式为Al-3e-+7AlCl4-=4Al2Cl7-
B.离子交换膜为阳离子交换膜
C.充电时,M 极为阳极,Al2Cl7-被氧化
D.充电时,每转移1mol电子,理论上阴极区的电解质质量增加30g
分析 题给装置为可充电的二次电池,该电池放电时Al失去电子发生氧化反应,为负极,电极反应式为Al+7AlCl4--3e-=4Al2Cl-7 ;M 为正极,硫得到电子发生还原反应,电极反应式为S+2e- =S2- ,选项A 说法正确.充放电过程中K+ 通过离子交换膜移动,故离子交换膜为阳离子交换膜,选项B说法正确.放电时M 极为正极,故充电时,M 极为阳极,电极反应为S2- -2e- =S,即S2- 被氧化,选项C说法错误.充电时,阴极电极反应为4Al2Cl7-+3e-=Al+7AlCl4-,则每转移1mol电子析出9gAl,同时有1molK+ 经过阳离子交换膜由阳极区进入阴极区,故理论上阴极区的电解质质量增加1 mol×39g·mol-1 -9g=30g,选项D说法正确.答案为C.
2 根据电池总反应判断
放电时,发生氧化反应的是原电池的负极,发生还原反应的是原电池的正极;充电时,发生氧化还原反应的是电解池的阳极,发生还原反应的是电解池的阴极.
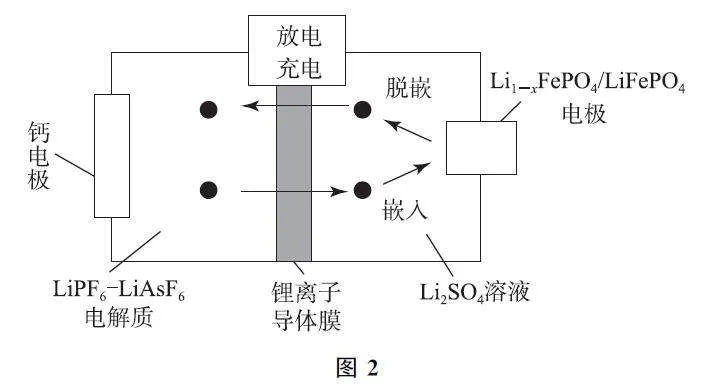
例2 科研人员新研发了一种CaGLiFePO4 可充电电池,工作原理如图2所示,电池总反应为xCa2+ +2LiFePO4←充电放电→xCa+2Li1-xFePO4+2xLi+ (0<x<1).下列说法不正确的是( ).
A.当x=0.6时,Li1-xFePO4 中的Fe2+ 和Fe3+个数之比为2∶3
B.放电时,正极反应为Li1-xFePO4 +xLi+ +xe- =LiFePO4
C.充电时,Li1-xFePO4/LiFePO4 电极发生Li+脱嵌,Li+ 从右室移向左室
D.充电时,理论上左室电解质的质量减轻4g,电路中有0.2mol电子转移
分析 当x =0.6时,设Li0.4FePO4 中有a 个Fe2+ 、1-a 个Fe3+ ,根据化合物中正、负化合价的代数和为0,有0.4×1+2a+3×(1-a)=3,可得a=0.4,则Fe2+ 和Fe3+ 个数之比为2∶3,选项A 说法正确.放电时,负极反应为Ca-2e- =Ca2+ ,使左室中正电荷数目增多,锂离子导体膜只允许Li+ 通过,因此LiPF6GLiAsF6 电解质中的Li+ 通过导体膜移入右室,正极反应为Li1-xFePO4+xLi+ +xe- =LiFePO4,选项B 说法正确.充电时,阳极发生反应:LiFePO4 -xe- =xLi+ +Li1-xFePO4,电极发生Li+ 脱嵌,Li+ 从右室移向左室,选项C说法正确.充电时左室阴极发生反应:Ca2+ +2e- =Ca,左室电解质中有0.1molCa2+ 得电子生成Ca沉积在钙电极上,电解质的质量减轻,转移0.2mol电子同时有0.2molLi+ 从右室移入左室,故左室中电解质的质量减轻4.0g-1.4g=2.6g,选项D说法错误.答案为D.
3 根据题给示意图中的信息判断
电化学试题中,示意图包含了很多信息,如充放电时电解质溶液中离子的移动方向、充放电时电极上物质的转化、连接电源或负载和对应电极上物质的转化等都可以判断电极名称.
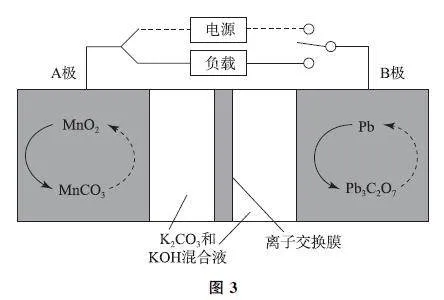
例3 某种新型可充电电池具有较高的循环使用寿命,工作原理如图3所示.下列说法错误的是( ).
A.放电时,A 极为正极
B.放电过程中转移1mole- ,正极质量增加14g
C.充电时B极电极反应式为Pb3C2O7+H2O+6e-=3Pb+2CO23-+2OH-
D.充电过程中转移0.5 mole- ,理论上有0.5molKOH被消耗
分析 当连接电源时,该装置为电解池,A 极从MnCO3 转化为MnO2,锰化合价升高,发生氧化反应,作阳极;B极从Pb3C2O7 转化为Pb,Pb化合价降低,发生还原反应,作阴极.当与负载相连时,该装置为原电池,A 极从MnO2 转化为MnCO3,锰化合价降低,发生还原反应,作正极,选项A 说法正确.放电时正极MnO2 转化为MnCO3,1molMnO2 转移2mol电子,相当于增加1molCO,转移1mole- ,正极质量增加14g,选项B说法正确.充电时B极为阴极,得到电子,电极反应式为Pb3C2O7+H2O+6e- =3Pb+2CO23-+2OH-,选项 C说法正确.总反应方程式为Pb3C2O7 +3MnCO3 +10KOH =3Pb+3MnO2+5K2CO3+5H2O,整个反应转移6 mol电子,消耗10molKOH,故充电过程中转移0.5mole- ,理论上有5/6molKOH 被消耗,选项D说法错误.答案为D.
例4 以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池的放电工作原理如图4所示,下列说法正确的是( ).
A.放电时,Mg箔为电池的正极
B.充电时,阳极反应为Fe[Fe(CN)6]+2e- +2Na+ =Na2Fe[Fe(CN)6]
C.充电时,Mo箔连接电源的正极,通过离子交换膜从右室移向左室
D.放电时,Mg箔溶解2.4g,则有机电解质中有0.2molNa+ 迁移
分析 由图可知,放电时右侧镁失去电子发生氧化反应,为原电池的负极,左侧Mo箔为原电池的正极,选项A 错误.放电时,左侧为正极,则充电时该极为阳极,失去电子发生氧化反应:Na2Fe[Fe(CN)6]-2e- =Fe[Fe(CN)6]+2Na+ ,选项B错误.充电时,Mo箔为阳极,接电源正极,Na+ 通过离子交换膜从左室移向右室,选项C 错误.放电时,Mg 箔溶解2.4g(0.1mol),则转移电子0.2mol,故有机电解质中有0.2molNa+ 迁移,选项D正确.答案为D.
总之,突破二次电池的关键是判断电池的电极名称,学生应扎实掌握相关判断方法,以提高解题效率.
本文系河北省教育科学研究“十四五”规划重点资助课题“教育数字化背景下高中化学学生学习水平评价研究”(课题编号:2302027)的阶段性成果.
(完)
