燕麦蒽酰胺功效特性研究进展
2024-10-16李颖奎肖付才黄斐
摘要:燕麦具有丰富的营养价值和保健功能,除了有β-葡聚糖、植酸、维生素E、黄酮类等生物活性物质,还有一种只存在于燕麦中的化合物-燕麦蒽酰胺,其中含量较高有燕麦蒽酰胺2c、燕麦蒽酰胺2f和燕麦蒽酰胺2p三类,已经得到了人们广泛研究。本文对燕麦蒽酰胺结构、分布、生物活性(抗氧化、抗炎、抗癌等)进行了系统的综述,并对燕麦蒽酰胺的生产进行展望,以期为燕麦蒽酰胺的综合利用及相关天然抗肿瘤药物开发提供参考。
关键词:燕麦蒽酰胺 抗氧化 抗炎症 抗癌
作者简介:李颖奎(1985—),男,河南许昌人,实验师,本科,主要从事食品功能性研究研究。
谷类食物一直是人类饮食的基础,大量的研究证实全谷物摄入量的增加与患某些与饮食有关的疾病(如2型糖尿病、肥胖、癌症和心血管疾病)的风险呈负相关[1],因此越来越多的研究学者重点开发以谷物作为原料的各类食品,包括早餐谷物、饮料、面包和婴儿食品等[2]。燕麦(Avena sativa L.)作为我国第六大粮食农作物,通常分为皮燕麦和裸燕麦两种类型[3],它含有大量的蛋白质、碳水化合物、矿物质、维生素、膳食纤维及多酚、类黄酮等营养物质[4],被人们认为是具有重要营养价值和功效价值的全谷物[5]。其中,β-葡聚糖被认为是燕麦的主要活性成分,能够降低血清胆固醇水平,减少葡萄糖的摄取,降低血浆胰岛素反应[6]。燕麦中还含有一种独特的、低分子量的可溶性酚类化合物,被称为燕麦蒽酰胺(Avenanthramide,Avns),这类化合物在燕麦中独有,因此认为是燕麦的标志化合物[7]。相关研究表明,Avns不仅具有抗氧化活性,还有抗增殖作用,有助于预防或治疗癌症等功效[8]。
本文对燕麦蒽酰胺的结构与分布进行了概述,并从燕麦蒽酰胺的抗氧化活性、抗炎活性、抗增殖等功效特性的研究进展进行叙述,并对燕麦蒽酰胺生产合成进行展望,为燕麦蒽酰胺功能性产品的研发提供理论基础和依据,提高全谷物燕麦的附加值和资源利用率。
一、燕麦蒽酰胺概述
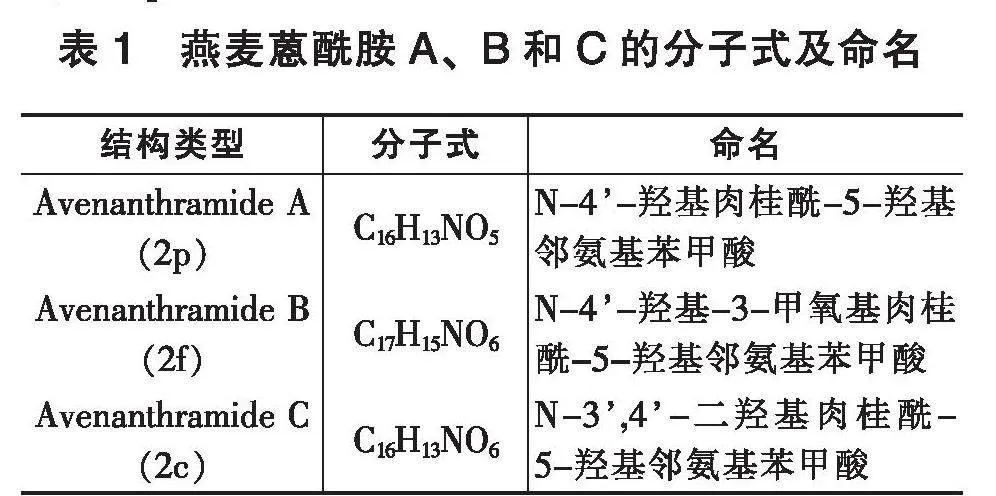
燕麦蒽酰胺主要分布在籽粒外层的麸皮中及次级糊粉层,是通过酰胺键连接的一类具有环状结构的碱性有机化合物,由邻氨基苯甲酸及其衍生物与肉桂酸及其衍生物组成。Dimberg 对Avns的命名进行了系统描述,邻氨基苯甲酸衍生物以不同数字命名:数字1表示邻氨基苯磺酸,数字2表示5-羟基邻氨基苯酸等;肉桂酸衍生物以字母命名:c代表咖啡酸,f代表阿魏酸,p代表对香豆酸[9]。目前,在燕麦中至少检测到约35种不同的Avns,其中含量最高的是燕麦蒽酰胺A、B和C,即2p、2f和2c[3]。
大多数的Avns存在于燕麦籽粒中,尤其以燕麦麸皮中的含量为榜首,少部分在叶片等组织中存在,叶片中Avns的浓度约在5-120mg/kg之间。燕麦籽粒中Avns的含量也受品种、年份、地点、栽培条件等因素影响,不同条件下Avns的含量差别较大。Peterson等人表明,与酚酸相比,燕麦Avns在麦粒内的分布更为均匀[10]。Dimberg等人研究了长期储存、热处理、pH值和紫外线(UV)光对燕麦Avns (2c, 2f和2p)稳定性的影响[11-12]。结果表明,长期贮藏对AVA浓度没有显著影响;2f和2p在室温24h内对pH变化不敏感,但2f在pH 为7和12的条件下,高温处理后稳定性较差。然而相比之下,2c能在碱性溶液中完全降解,但在同样高温和pH条件下,其稳定性更差。此外,还研究了各种燕麦食品(如面包、松饼、新鲜意大利面、通心粉)加工前后的Avns浓度,研究结果表明,在所有测定产品中,Avns (2c, 2f和2p)的浓度均有所增加,这可能是由于重新合成、不溶结合形式的释放、可提取性的提高等因素交互作用影响所导致[12]。Bryngelsson等人[13]研究了汽蒸工艺、高压灭菌、滚筒干燥工艺对燕麦中Avns浓度的影响,结果表明,三种工艺对Avns浓度均有一定的影响,在燕麦汽蒸过程中,2p有所降低,而2c和2f的保持稳定水平。高压灭菌使2c和2p浓度降低,而滚筒干燥工艺过程中2c, 2f和2p均呈下降趋势。因此,可以得知在加工过程中可以改进加工方法来减少Avns的损失,如在热处理过程中降低温度和pH值或增加原料中Avns的含量等。此外,Bryngelsson等人[14]还比较了干燕麦或浸泡燕麦、磨燕麦或未磨燕麦、生燕麦或热处理燕麦中Avns含量,研究发现浸泡完整的燕麦麸Avns的含量会随时间和温度的增加而增加,在20℃下浸泡10 h后,Avns含量达到最大值。这可能是由于谷物谷物种子在水中浸泡后发芽,以软化籽粒结构,从而导致营养成分含量有所增加。
二、燕麦蒽酰胺功效特性
(一)抗氧化活性
抗氧化活性通过减少活性氧(ROS)对细胞成分的氧化损伤,大多数燕麦中的Avns具有强大的抗氧化特性,Avns的抗氧化活性明显高于其他酚类抗氧化剂,如香兰素和咖啡酸等[10]。大量研究已经证明了AVAs的抗氧化特性,Lee-Manion等人[15]对2p、2f和2c进行了体外抗氧化活性研究。结果表明,在铁还原能力试测定中,2c表现出较高的抗氧化性能,且2c和丁基羟基甲苯具有大致相同的抑制β-胡萝卜素氧化的能力;另外,在清除DPPH自由基方面,2f和2c的抗氧化能力高于水溶性维生素E。Dimberg和Yang等人[16-17]研究发现2f抗氧化能力比α-生育酚高约20%。研究还发现2p、2f和2c对羟基自由基、超氧阴离子等均表现出一定抗氧化活性,但三者的抗氧化能力有所不同,其中2c的总抗氧化能力最高。
Ji等人[18]通过动物试验研究了富含Avns的燕麦提取物的抗氧化能力,研究结果表明,每日提供大鼠20 mg/kg的Avns能够有效增加骨骼肌、肝脏和肾脏中的超氧化物歧化酶活性,也能增强心脏和骨骼肌中的谷胱甘肽过氧化物酶活性,这一结论与Chen等人研究结论相似。Chen等人[19]研究发现食用富含Avns的燕麦提取物能够增加血浆中还原性谷胱甘肽的浓度,进而提高抗氧化性能。在摄入0.1g的Avns的混合物后,血浆谷胱甘肽水平在15min内比基线增加了21%,且没有明显的不良副作用。另外,Ren等人[20]研究发现富含Avns的燕麦提取物对D-半乳糖诱导的氧化应激反应具有一定的抑制作用,主要通过上调基因表达和抗氧化酶(如超氧化物歧化酶)的活性来逆转D -半乳糖诱导的氧化应激,且能够有效抑制脂氧化酶活性,这与Landberg等人研究结果相吻合。Landberg等人[21]研究发现含有咖啡酸或辛酸的2p对脂氧化酶有明显的抑制作用,能达到60~90%,这些研究结果表明燕麦Avns具有较强的抗氧化活性。
Liu等人[22]研究了燕麦Avns对健康个体血浆脂质过氧化水平和抗氧化状态的影响。研究结果表明,120名健康个体连续1个月服用燕麦Avns胶囊后,血清超氧化物歧化酶水平增加了8.4%,还原性谷胱甘肽水平增加了17.9%,丙二醛水平下降了28.1%,这表明燕麦Avns对血浆脂质过氧化水平和抗氧化状态有显著的影响。此外,Koenig等[23]学者也对健康人群进行了燕麦Avns抗氧化活性研究,发现与对照组相比,受试者连续8周每天食用含有9.2 mg Avns的燕麦饼干后,其血浆总抗氧化能力和红细胞超氧化物歧化酶活性表现得更高。此外,有学者研究发现Avns与维生素C协同作用,能够保护仓鼠和人类免受低密度脂蛋白氧化,而且Avns还能降低运动诱导的活性氧水平[24-25]。
综上,燕麦Avns具有一定抗氧化活性,虽然大量地来自体内和体外研究表明燕麦Avns具有很强的抗氧化能力,但在一定程度上抗氧化作用机制具有不确定性,可能与邻氨基苯甲酸和肉桂酸基团上羟基的数量和位置有一定关系,这有待进一步深入研究。
(二)抗炎症
燕麦Avns被认为具有一定的抗炎活性,这已被许多体外和体内研究证实。一项研究表明,燕麦Avns能够抑制IL-1β-刺激的内皮细胞分泌促炎因子(IL-6)和趋化因子(IL-8和MCP-1)、表达粘附分子(ICAM-1、VCAM-1和e -选择素)以及单核细胞对内皮细胞单层的粘附,具有一定的抗炎作用。Guo等人[26]进一步研究显示促炎内皮细胞因子表达下降可能是通过抑制NF-κB激活和抑制蛋白酶体活性所导致。Koenig等人[23]研究不仅发现每天食用含有9.2 mg Avns的燕麦饼干能够显著提高抗氧化活性,还对运动后的健康个体进行了炎症评估,分别在休息、运动后24小时和运动后48小时采集血样,对24小时的中性粒细胞呼吸爆发和48小时的c反应蛋白水平评估。结果表明,补充9.2 mg Avns能够显著降低女性的全身炎症反应,还能抑制促炎细胞因子的产生。此外,另一项研究也得到相似的研究结果。研究学者评估了18-30岁年龄段的女性运动后补充 Avns对全身炎症反应的影响。结果显示,补充Avns后中性粒细胞呼吸爆发、NF-κB活化、血浆IL-6浓度和红细胞谷胱甘肽过氧化物酶活性显著降低,还原性谷胱甘肽水平显著升高。因此,长期补充Avns是一种有效的饮食策略,可以减少年轻和老年妇女体育锻炼后的炎症。Boz等人[27]研究发现2c 能够抑制磷酸肌肽3-激酶和磷脂酶Cγ1的磷酸化,还能通过抑制免疫球蛋白E (IgE)刺激的肥大细胞脱颗粒,降低细胞内钙水平,且口服一定剂量2c能够有效减轻活动性全身过敏反应。此外,研究还发现2c能抑制被动皮肤过敏反应,如耳部肿胀和血浆外渗,这说明2c可以作为肥大细胞介导的过敏性炎症的潜在治疗物。
(三)抗癌作用
Avns通过调节不同途径来表现其潜在的抗增殖活性,包括激活细胞凋亡和衰老,阻断细胞增殖,抑制上皮间充质转移等[28]。Nie等人[29]研究了Avns抑制VSMC增殖的分子机制,发现Avns通过调节细胞周期调节蛋白,如p53, p21cip1, p27kip1, cyclin-D1和pRb,抑制细胞周期信号在G1期到S期的转变。Guo等人[30]研究了Avns对几种癌细胞系的抗增殖作用,发现富含Avns的燕麦提取物、2c和2c的甲酯衍生物对结肠癌细胞系(包括Caco-2, HT29, LS174T, and HCT116)比前列腺或乳腺癌细胞系更有效。Antonini等人[31]在Hep 3B肝癌细胞系中也证实了2f具有通过caspase-8激活外源性凋亡通路的能力。Scarpa等人[32]评估了P3(含2f 95%)和P4[含2c (37%),2f(8%)和2p(35%)]在Caco-2和Hep G2细胞系中的抗增殖活性。研究结果表明,在两种细胞系中,相对于P3来说,P4对细胞生长的抑制作用更强;另研究了在不同的癌细胞系中Avns对caspase 8、9和3的影响。结果发现在120μM下,P3和P4均能显著提高Caco-2细胞中Caspase-8和caspase-3的活性,而在HepG2细胞中,只有P4能诱导caspase-3和Caspase-8的活性。此外,Scarpa等人还探究了Avns对肿瘤细胞中两种促生存基因[血管内皮生长因子(VEGF)、缺氧诱导因子1-α(HIF1A)]调节的影响。癌细胞可以通过上调HIF1A和VEGF来对抗氧化应激,从而为癌细胞提供更多的氧气,而研究发现P4混合物可显著下调Caco2和HepG2癌细胞中VEGF和HIF1A的表达。Wu等人[33]发现糖基化(Avns 2c- o -glc)和非糖基化形式的Avns 2c对两种结肠癌细胞系HT29和HCT116具有相似的生长抑制活性,这也就意味着糖基化对Avns的抗增殖作用几乎没有影响。
研究证实Avns可以通过诱导细胞衰老抑制肿瘤活性,衰老的形态学和生化特征包括细胞增大,β-半乳糖苷酶活性增加,端粒缩短等。一项研究表明,Avns 2p与H2A蛋白结合会导致结肠癌细胞(HCT116和HCT8)的细胞衰老,表现为细胞尺寸增大、β-半乳糖苷酶活性升高等。X阳性染色,G1期细胞周期阻滞[34]。miRNAs是一种非编码RNA,能够调节基因表达,越来越多的证据表明 miRNAs在癌症中起着关键作用,而Avns 2p能够显著增加miR-129-3p的表达[35]。Fu等人[34]研究报道发现Avns 2p能够下调肿瘤抑制因子miR-129-3p的另外两个靶点:IGF2BP3和CDK6,这两个靶点对G1期进展和G1/ s转变有重要影响。因此,我们可以发现Avns 2p可以通过激活miR-129-3p诱导结肠癌细胞衰老,对抑制结肠癌生长有积极治疗作用。
癌症转移是癌症死亡的主要原因,抗癌药物靶向治疗和早期预防是改善临床结果的基础。在上皮细胞-间充质转化(Epithelial-mesenchymal transition,EMT)过程中,上皮细胞获得间充质状态,具有一定转移能力,移动性、侵袭性和抗凋亡能力也表现较强[36]。Finetti等[37]研究发现天然Avns(2p和2c)和酵母衍生的重组Avns(YAvn I和II)在抑制人类结直肠癌细胞(HT29, WiDr)细胞生长和存活方面具有大致相同的作用效果。然而,YAvn I和II在阻断EMT和减少肿瘤细胞转移方面表现出更强的能力。E-cadherin表达的测定进一步表明,与天然Avns相比,YAvn I和II能更有效地下调上皮细胞钙粘蛋白。c-Myc是一种致癌基因,在多种人类癌症中过度表达,并驱动癌细胞的代谢改变。Wang等[38]证实了Avns 2p在人宫颈癌细胞中的促凋亡作用,主要是通过消除异常β-连环蛋白信号介导。Avns 2p降低了细胞质中β-连环蛋白,减少了其核积累,并降低了Wnt靶基因(如c-Myc)的转录激活。
目前,通过体外方式探索Avns的抗癌作用潜力的研究较多,但也有学者开展了对Avns的抗癌活性的体内研究。有学者通过向雌性瑞士白化小鼠腹腔注射埃利希氏腹水癌细胞,研究了Avns 2c甲酯对小鼠乳腺腺癌抗肿瘤活性的影响。试验以每天50ng/kg Avns 2c甲酯灌胃治疗小鼠,发现两周后小鼠肿瘤体积减小,生长减少。血清肿瘤标志物如甲胎蛋白(Alpha-fetoprotein,AFP)和癌胚抗原( Carcinoembryonic antigen,CEA)水平在接种埃利希癌细胞的小鼠组中升高,而在Avns治疗组,这两项指标均显著降低。此外,研究观察到增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)的降低,表明采用Avns治疗对肿瘤细胞增殖有抑制作用[39]。Fu等人[34]探究了Avns 2p对结肠直肠癌的抗肿瘤活性。向雄性C57BL/6J小鼠腹腔连续7天单次注射基因毒性致癌物偶氮氧甲烷(AOM)和非基因毒性致癌物葡聚糖硫酸钠(DSS)后,每天用30 mg/mL的Avns 2p灌胃,治疗14天后,发现Avns 2p可降低宏观息肉的肿瘤发生率和肿瘤直径。
以上的体外和体内试验研究证实Avns是一种很有前途的化学预防和抗癌植物化学物质,可以通过激活细胞凋亡和衰老,阻断细胞增殖,抑制上皮间充质转移来表现出较强的抗增殖活性,能够有效抑制肿瘤活性,但仍需要进一步的临床试验和毒理学研究来确定其在预防和减轻癌症疾病负担方面的功效。
三、研究展望
人们对燕麦蒽酰胺的健康益处已经有了清晰的认知,它具有抗氧化、抗炎症、抗癌等生理活性,故在人类食品和动物饲料中的应用也会大幅度增加,进而导致市场需求量会增加。然而,燕麦蒽酰胺的生产仍然面临着诸多的问题和挑战。蒽酰胺是燕麦的次级代谢产物,其生产会受靶基因调节因子水平、生长应激和季节环境等因素的影响,因此燕麦蒽酰胺的生产不具备可持续性,亟须一种低成本的、可持续操作的燕麦蒽酰胺生产方法。总体来看,利用现代育种、生物工程等技术制备燕麦蒽酰胺是一种高效、可持续,安全环保的方法,也将满足市场的需求,具有广阔的发展前景,这值得进一步地深入研究与探讨。此外,研究证实燕麦蒽酰胺可以阻断活性物质来预防癌症,因此,利用其进行天然产物的开发也是对抗癌症的重要途径,对人类健康具有重要意义。
参考文献:
[1]Cho, S. S., Qi, L., Fahey, G. C., Jr., Klurfeld, D. M., Consumption of cereal fiber, mixtures of whole grains and bran, and whole grains and risk reduction in type 2 diabetes, obesity, and cardiovascular disease. The American journal of clinical nutrition 2013, 98, 594-619.
[2]刘会省 , 王彦明, 任文秀.燕麦营养成分研究进展[J].现代食品,2021(06):127-130+141.
[3]任长忠, 闫金婷, 董锐等.燕麦营养成分、功能特性及其产品的研究进展[J].食品工业科技,2022,43(12):438-446.
[4]姚望,彭毛,姚芬.燕麦生物活性成分及生理功能研究进展[J].粮食与油脂,2020,33(08):11-14.
[5] Xie X, Lin M, Xiao G, et al. Phenolic amides (avenanthramides) in oats - an update review. [J]. Bioengineered, 2024, 15 (1): 2305029-2305029.
[6]吴玉杰, 袁娟丽, 陈红兵.燕麦生物碱的结构与功能研究进展[J].食品工业科技,2018,39(15):328-333.
[7]武娇.燕麦生物碱合成的诱导调控研究[D].山西农业大学,2015.
[8]唐娅茹,王力伟,安江红等.燕麦生物碱的研究进展与应用[J].北方农业学报,2023,51(06):37-50.
[9]Dimberg, L. H., Gissen, C., Nilsson, J., Phenolic compounds in oat grains (Avena sativa L.) grown in conventional and organic systems. Ambio 2005,34,331-337.
[10]Peterson DM, Emmons CL & Hibbs AH (2001) Phenolic antioxidants and antioxidant activity in pearling fractions of oat groats. J Cereal Sci 33, 97 – 103.
[11]Dimberg, L. H., Molteberg, E. L., Solheim, R., Frolich, W., Variation in oat groats due to variety, storage and heat treatment .1. Phenolic compounds. J Cereal Sci 1996, 24, 263-272.
[12]Dimberg, L. H., Sunnerheim, K., Sundberg, B., Walsh, K., Stability of oat avenanthramides. Cereal Chem 2001, 78, 278-281.
[13]Bryngelsson, S., Dimberg, L. H., Kamal-Eldin, A., Effects of commercial processing on levels of antioxidants in oats (Avena sativa L.). J Agric Food Chem 2002, 50, 1890-1896.
[14]Bryngelsson, S., Ishihara, A., Dimberg, L. H., Levels of avenanthramides and activity of hydroxycinnamoyl-CoA: Hydroxyanthranilate N-hydroxycinnamoyl transferase (HHT) in steeped or germinated oat samples. Cereal Chem 2003, 80, 356-360.
[15]Lee-Manion AM, Price RK, Strain JJ, et al. In vitro antioxidant activity and antigenotoxic effects of avenanthramides and related compounds. J Agric Food Chem. 2009;57:10619–10624.
[16]Dimberg, L. H., Theander, O., Lingnert, H., Avenanthramides - a Group of Phenolic
Antioxidants in Oats. Cereal Chem 1993, 70, 637-641.
[17]Yang, J., Ou, B. X., Wise, M. L., Chu, Y. F., In vitro total antioxidant capacity and anti inflammatory activity of three common oat-derived avenanthramides. Food Chem 2014, 160, 338-345.
[18]Ji LL, Lay D, Chung E, et al. Effects of avenanthramides on oxidant generation and antioxidant enzyme activity in exercised rats. Nutr Res. 2003;23(11):1579–1590.
[19]Chen CYO, Milbury PE, Collins FW, et al. Avenanthramides
are bioavailable and have antioxidant activity in humans after acute consumption of an enriched mixture from oats. J Nutr. 2007;137:1375–1382.
[20]Ren Y, Yang X, Niu X, et al. Chemical characterization of the avenanthramide-rich extract from oat and its effect on d-galactose-induced oxidative stress in mice. J Agric Food Chem. 2011;59:206–211. doi: 10.1021/jf103938e
[21]Landberg R, Sunnerheim K, Dimberg LH. Avenanthramides
as lipoxygenase inhibitors. Heliyon. 2020;6:e04304. doi: 10.1016/j.heliyon.2020.e04304
[22]Liu, S., Yang, N., Hou, Z. H., Yao, Y., et al., Antioxidant Effects of Oats Avenanthramides on Human Serum. Agric. Sci. China 2011, 10, 1301-1305.
[23]Koenig, R., Dickman, J. R., Kang, C. H., Zhang, T. O., et al., Avenanthramide supplementation attenuates exercise-induced inflammation in postmenopausal women. Nutr J 2014, 13.
[24]Chen, C. Y., Milbury, P. E., Kwak, H. K., Collins, F. W., et al., Avenanthramides and phenolic acids from oats are bioavailable and act synergistically with vitamin C to enhance hamster and human LDL resistance to oxidation. J Nutr 2004, 134, 1459-1466.
[25]Meydani, M., Potential health benefits of avenanthramides of oats. Nutr Rev 2009, 67, 731- 735.
[26]Guo, W., Wise, M. L., Collins, F. W., Meydani, M., Avenanthramides, polyphenols from oats, inhibit IL-1 beta-induced NF-kappa B activation in endothelial cells. Free Radical Bio Med 2008, 44, 415-429.
[27]Boz H. Phenolic amides (avenanthramides) in oats - a review. Czech J Food Sci. 2015;33:399–404.
[28]任祎,马挺军,崔林.燕麦生物碱及其潜在的保健作用[J].中国粮油学报,2012,27(01):124-128.
[29]Nie L, Wise M, Peterson D, Meydani M. Mechanism by which avenanthramide-c, a polyphenol of oats, blocks cell cycle progression in vascular smooth muscle cells. Free Radic Biol Med. 2006;41:702–708.
[30]Guo, W. M., Nie, L., Wu, D. Y., Wise, M. L., et al., Avenanthramides Inhibit Proliferation of Human Colon Cancer Cell Lines In Vitro. Nutr. Cancer 2010, 62, 1007-1016.
[31]Antonini, E.; Iori, R.; Ninfali, P.; Scarpa, E.S. A Combination of Moringin and Avenanthramide 2f Inhibits the Proliferation of Hep3B Liver Cancer Cells Inducing Intrinsic and Extrinsic Apoptosis. Nutr. Cancer 2018, 70,1159–1165.
[32]Scarpa, E.S.; Antonini, E.; Palma, F.; Mari, M.; Ninfali, P. Antiproliferative activity of vitexin-2-O-xyloside and avenanthramides on CaCo-2 and HepG2 cancer cells occurs through apoptosis induction and reduction of pro-survival mechanisms. Eur. J. Nutr. 2018, 57, 1381–1395.
[33]Wu, W.; Tang, Y.; Yang, J.; Idehen, E.; Sang, S. Avenanthramide Aglycones and Glucosides in Oat Bran:Chemical Profile, Levels in Commercial Oat Products, and Cytotoxicity to Human Colon Cancer Cells.J. Agric. Food Chem. 2018, 66, 8005–8014.
[34]Fu, R.; Yang, P.; Amin, S.; Li, Z. Avenanthramide A induces cellular senescence via miR-129-3p/Pirh2/p53signaling pathway to suppress colon cancer growth. J. Agric. Food Chem. 2019, 67, 4808–4816.
[35]Visone, R.; Croce, C.M. MiRNAs and cancer. Am. J. Pathol. 2009, 174, 1131–1138.
[36]Prieto-Garcia, E.; Diaz-Garcia, C.V.; Garcia-Ruiz, I.; Agullo-Ortuno, M.T. Epithelial-to-mesenchymal transitionin tumor progression. Med. Oncol. 2017, 34, 122.
[37]Finetti, F.; Moglia, A.; Schiavo, I.; Donnini, S.; Berta, G.N.; Di Scipio, F.; Perrelli, A.; Fornelli, C.; Trabalzini, L.;Retta, S.F. Yeast-Derived Recombinant Avenanthramides Inhibit Proliferation, Migration and Epithelial Mesenchymal Transition of Colon Cancer Cells. Nutrients 2018, 10, 1159.
[38]Wang, D.; Wise, M.L.; Li, F.; Dey, M. Phytochemicals attenuating aberrant activation of beta-catenin in cancer cells. PLoS ONE 2012, 7, e50508.
[39]Wang, S.C. PCNA: A silent housekeeper or a potential therapeutic target? Trends Pharmacol. Sci. 2014, 35,178–186.
