互花米草根系促生菌的筛选及其挥发性有机物质鉴定
2024-10-15林子彦王锟黄点秋宁美凤姜明国高亚慧丰景












摘要:【目的】从互花米草根系菌当中筛选获得具有释放挥发性有机化合物(VOCs)促进植物生长能力的菌株,并对其释放的VOCs成分进行分析鉴定,为促进植物生长提供菌株资源和理论依据。【方法】以从互花评定米草根系中分离85株细菌为供试细菌,用二分隔培养皿与拟南芥共培筛选VOCs促生菌株,进一步评估多重促生功能,利用熵值法评定出最佳菌株;并通过形态学、生理生化、16S rRNA及gyrB基因分析定类;使用固相微萃取与气相色谱—质谱联用技术(GC-MS)鉴定该菌株VOCs成分。【结果】筛选出6株可通过释放VOCs促进拟南芥生长的细菌,即GXMZU2281、GXMZU2346、GXMZU2401、GXMZU3251、GXMZU3294、GXMZU4388。其中,GXMZU4388菌株具有溶磷、固氮、产铁载体、产吲哚乙酸(IAA)的促生活性,与对照组相比,在稀释20倍与100倍浓度菌液处理下,GXMZU4388菌株均能明显促进番茄生长,鲜重分别增加144.0%和186.2%,熵值法综合评定结果显示GXMZU4388菌株为最高分。GC-MS鉴定结果表明该菌株能产生9种VOCs成分,其中8种成分已被报道具有抑菌或促进植物生长的功能;6-甲基-2-庚酮、5-甲基-2-己酮、5-甲基-2-庚酮和3-甲基-2-戊酮的相对含量较高,占据主导地位。结合形态学观察、生理生化特性分析及16S rRNA和gyrB基因序列的分子生物学鉴定结果,确定GXMZU4388菌株为沙福芽孢杆菌(Bacillus safensis)。【结论】GXMZU4388菌株在促进植物生长各方面均表现优秀,在低浓度下也能显著发挥其促进植物生长的能力,能释放多种有利于植物生长与抑菌的VOCs,在菌肥开发上有极佳的应用潜力。
关键词:互花米草;植物根际促生菌(PGPR);挥发性有机化合物(VOCs);沙福芽孢杆菌;拟南芥
中图分类号:S543.9;Q939文献标志码:A文章编号:2095-1191(2024)07-2169-12
Screening of growth-promoting rhizobacteria from Spartina al⁃terniflora and identification of their volatile organic compounds
LIN Zi-yan,WANG Kun,HUANG Dian-qiu,NING Mei-feng,JIANG Ming-guo,GAOYa-hui,FENG Jing*
(School of Marine Sciences and Biotechnology,Guangxi Minzu University/Guangxi Key Laboratory for PolysaccharideMaterials and Modifications,Nanning,Guangxi 530008,China)
Abstract:【Objective】The strains with the ability to release volatile organic compounds(VOCs)to promote plant growth were screened from the rhizosphere bacteria of Spartina alterniflora,and the components of VOCs released were analyzed and identified to provide strain resources and theoretical basis for promoting plant growth.【Method】A total of 85 strains of bacteria were isolated from the rhizosphere soil of S.alterniflora as tested bacteria,and the VOCs growth-promoting strains were screened by co-culture with Arabidopsis thaliana in a two-partition culture dish.To further evalua-te the multiple growth-promoting functions,the entropy method was used to select the best strain.It was classified by morphology,physiological and biochemical features,16S rRNA and gyrB gene analysis.Finally,the VOCs components of the strain were identified by solid-phase microextraction and gas chromatography-mass spectrometry(GC-MS).【Re-sult】Six bacteria that could promote the growth of A.thaliana by releasing VOCs were screened:GXMZU228 GXMZU2346,GXMZU240 GXMZU325 GXMZU329 GXMZU4388.Among them,GXMZU4388 strain had the ability of solubilizing phosphorus,nitrogen fixation,siderophore and heteroauxin(IAA)production.Compared with the control group,GXMZU4388 strain could greatly promote the growth of tomato under the treatment of 20 times and 100 times diluted bacterial solution,and the fresh weight increased by 144.0%and 186.2%respectively.The comprehensive evaluation scores of entropy method were the highest in GXMZU4388 strain.GC-MS was used to identify that the strain could produce 9 VOCs components,of which 8 components have been reported to have the function of inhibiting bacteria or promoting plant growth.The relative contents of 6-methyl-2-heptanone,5-methyl-2-hexanone,5-methyl-2-heptanone and 3-methyl-2-pentanone were relatively high,which occupied a dominant position.Combined with morphological ob-servation,physiological and biochemical characteristics analysis and molecular biological identification of 16S rRNA and gyrB gene sequences,GXMZU4388 strain was identified as Bacillus safensis.【Conclusion】GXMZU4388 had excellent performance in promoting plant growth in all aspects.It can also significantly exert its ability to promote plant growth at low concentrations,and can release a variety of VOCs that are beneficial to plant growth and bacteriostasis.It has exce-llent application potential in the development of bacterial fertilizer.
Key words:Spartina alterniflora;plant growth-promoting rhizobacteria(PGPR);volatile organic compounds(VOCs);Bacillus safensis;Arabidopsis thaliana
Foundation items:Regional Project of National Natural Science Foundation of China(32360024);Youth Project of Guangxi Natural Science Foundation(2023GXNSFBA026041);Guangxi Minzu University Introduced Talent Research Start-up Project(2019KJQD13);Graduate Education Innovation Project of Guangxi Minzu University(gxun-chxs2022090)
0引言
【研究意义】当前由于化肥的过度依赖和使用不当,导致土壤重金属累积、营养失调、酸化、微生物活性降低及化肥残留污染水源等一系列问题。中共中央、国务院于2021年发布的《关于深入打好污染防治攻坚战的意见》指出,预计到2025年,我国化肥农药利用率将达43%,对化肥农药行业提出新目标。在当前形势下迫切需要开发更多绿色环保的肥料,以减少化肥的使用量。研究证实,许多植物的根际细菌对植物的生长、产量和质量有益,被称为植物根际促生菌(Plant growth-promoting rhizobacteria,PGPR),PGPR可分为细胞外根际促生菌(ePGPR)和细胞内根系促进菌(iPGPR)(Cochard etal.,2022),适当施肥并结合PGPR接种的技术是减少化肥使用、降低环境污染的良好策略。比起需要大量耗用石油资源的化肥,由PGPR所构成的菌肥更环保,更符合可持续发展原则。菌肥区别于传统化肥,仅由1种菌株组成的菌肥就能拥有多种功能,例如固氮、溶磷、抑菌等,挖掘多功能菌株能更大程度减少化肥使用,成为菌肥资源开发的重要趋势。有的PGPR还可通过释放挥发性有机化合物(Volatile organic com-pounds,VOCs)促进植物生长,抑制植物病原菌,诱导植物系统抗性(Farag etal.,2013)。VOCs本身物质特性决定其更易传播,可远离产生点在土壤、液体或空气中传播。对细菌VOCs的成分鉴定不仅丰富了微生物代谢物质库,也能为揭示微生物与植物互作机理提供研究基础。因此,筛选多功能且具有释放VOCs促进植物生长的微生物,在减少化肥使用和丰富PGPR资源库上具有重要意义。【前人研究进展】互花米草(Spartina alterniflora)为禾本科米草属的多年生草本植物,有缓冲强潮、淤积泥沙等作用,我国为了保护海滩于1979年引入该植物。Andrades-Moreno等(2014)从生长在西班牙廷托河口、与互花米草同科的密花米草(S.densiflora)根系中分离出22种不同的耐铜细菌菌株,其中70%的菌株表现出一种或多种植物生长促进特性,包括溶磷、铁载体或产吲哚乙酸(IAA),以及对铜的高抗性。而互花米草有耐盐碱、根系发达、生命力强等特点,其根系能富集大量微生物(Yang et al.,2016),有获取优质PGPR的极大潜力。PGPR通过释放VOCs,在不与植物产物物理接触的情况下诱导系统抗性及促进植物生长,相关研究表明,VOCs对微生物相互作用的贡献比非VOCs大得多(Kanchiswamy et al.,2015),在根际细菌群落与植物的互作关系中起重要作用。枯草芽孢杆菌(Bacillus subtilis)VOCs可增强植物对铁和硒的吸收(Wang et al.,2017)及调节大豆生长(Bavaresco et al.,2020);解淀粉芽孢杆菌(B.amylo-liquefaciens)的VOCs可抑制链格孢属的Alternaria brassicae(Asari etal.,2016),提高薄荷抗盐能力(del Rosario Cappellari and Banchio,2020),同时通过释放的VOCs调节质膜氢酶(H+-ATPase)活性,增强植物对碱性胁迫的抗性(Li etal.,2020)。细菌VOCs功能多样,巨大芽孢杆菌(B.megaterium)释放的VOCs也具有溶磷效果(Barghiet al.,2021)。VOCs浓度对植物存在双重效应,在一定浓度下会促进植物生长,浓度过大则会不利于植物生长,2,5-二甲基吡嗪很有可能就是一个重要的抑制植物生长的微生物VOC成分(Song et al.,2022)。分析VOCs常用方法是使用固相微萃取技术吸附VOCs,再使用气相质谱仪对VOCs进行成分分离与鉴定。大多数PGPR可通过释放的2,3-丁二醇和乙酰乙酸等VOCs促进植物生长和诱导抗病性(Ryu et al.,2004)。细菌除释放VOCs促进植物生长之外还有其他促生功能,微生物的生物固定在很大程度上促进土壤总氮的固定(Johnson et al.,2000)。豆科植物可通过与根瘤菌或弗兰克氏菌属(Frankia)结合获得氮元素(Franche et al.,2009);在非豆科植物中微生物固氮也有很大应用价值(Bhattacharjee et al.,2008)。磷肥中磷大部分与土壤中无机离子结合成难溶的磷酸盐,植物很难吸收,PGPR分泌的有机酸可将不溶的无机磷溶解,使植物更易吸收,真菌当中,拜赖青霉(Penicil-liumbilaiae)就有很强溶磷能力(Wakelin et al.,2004);PGPR固定并溶解土壤中的铁元素,分泌螯合剂,有助于将铁元素转运到植物根系表面,将植物无法吸收的三价铁离子还原成二价铁离子,创造低铁环境,也有助于抑制病原菌的生长(Guerinot,1994);土壤中钾元素大量以矿物钾和固定钾的形式存在,PGPR能分解矿物钾,使其能被植物根系直接吸收(高俊程,2019),蜡样芽孢杆菌(B.cereus)能溶解矿物质中的钾,并促进马铃薯生长和增加产量。PGPR通过代谢产生植物生长激素,最常见的植物生长激素是IAA,目前研究表明有80%的PGPR可分泌IAA(Nastasijaetal.,2012)。互花米草凭借出色的环境适应性包括耐盐、耐淹及抗风浪能力,在潮间带快速繁衍,构建起庞大的单优种群落。研究发现,这种植物对土壤环境和动物群落具有显著影响,进而可能对整个生态系统产生深远而潜在的效应(Yang and Guo,2018)。具体而言,互花米草促进了沿海湿地中碳与氮的横向流动,强化了生态系统的物质循环,并提升了沿海土壤的功能性(Gao et al.,2020)。互花米草发达的根系为微生物提供了丰富的栖息环境,其在改善土壤营养结构方面扮演重要角色(李慧颖,2021)。【本研究切入点】互花米草根系微生物丰富,对于PGPR的挖掘有非常大的前景。当前,关于VOCs促生菌株的分离筛选研究较为匮乏,多数PGPR菌株的筛选研究仅限于接触型PGPR,对于具有VOCs促生功能的PGPR研究报道较少。【拟解决的关键问题】从互花米草根系筛选出具有VOCs促生功能的PGPR,并对其各种促生功能进行评价,以期筛选出1株具有释放促生VOC功能的优势菌株,并鉴定其具体VOCs成分,为微生物促进植物生长提供新策略。
1材料与方法
1.1试验材料
供试细菌:从广西北海市铁山港区互花米草根系分离并保存的85株菌株(李慧颖,2021)。供试作物:哥伦比亚野生型拟南芥(Arabidopsis thaliana),作为初步筛选具有释放VOC促生菌株的模式植物;贵妃番茄(Lycopersicon esculentum),用于评价菌株实际应用于盆栽的效果。供试种子于4℃冰箱中保存。
培养基:LB培养基(HB0129)、阿须贝无氮培养基(HB8540)、PKO培养基(HB8670)、蒙金娜有机磷培养基(HB8673-1)、CAS培养基(HB9132)、MS培养基(HB8469)均购自青岛海博生物技术有限公司;解钾培养基配方参照薛永萍等(2022)的试验。主要试剂:IAA,Salkowskis(FeCl3 4.5 g,溶于1 L 10.8 mol/L浓硫酸)比色液,2×Taq PCR MasterMix(北京康润诚业生物科技有限公司),27F/1492R引物(5'-A GAGTTTGATCCTGGCTCAG-3'/5'-TACGACTTAAC CCCAATCGC-3'),UP-1/UP-2r(5'-GAAGTCATCAT GACCGTTCTGCAYGCNGGNGGNAARTTYGA-3'/5'AGCAGGATACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3')(兰成忠等,2023)。
1.2 VOCs促生菌株的筛选
于2021年11月对保藏的85株互花米草根系菌株进行VOCs促生菌株的筛选。采用高亚慧等(2022)的方法对拟南芥和菌株进行无直接接触共培养,拟南芥与细菌使用二分隔培养皿置于人工智能气候箱培养(光照时间16h,光照强度8000 lx,温度23°C,相对湿度50%),以接种无菌水的培养基为空白对照,15 d后测量、统计拟南芥各项指标。
1.3 VOCs促生菌株的促生能力测定
将VOCs促生菌株接种于LB培养基活化培养出单菌落。挑取单菌落,使用无菌水重悬菌体,5000 r/min离心5 min,倒掉上清液,重复3次,保证菌体不含培养基,接菌环取洗净菌体划线于阿须贝培养基中,在30°C培养箱倒置培养5 d,观察菌株是否生长,生长则表示该菌株有固氮功能。挑取单菌落分别点涂于PKO培养基、蒙金娜有机磷培养基、CAS培养基、解钾培养基上,如在相应功能培养基上出现透明圈,则表示具有对应功能。用接菌环取菌株接种于LB液体无色氨酸培养基中,将菌液培养至OD600 nm=1左右,取10μL菌液接种于色氨酸浓度为0.5 mg/mL的20 mL LB培养基,培养3 d后,采用Salkowskis比色法测定优势菌株产IAA能力。
1.4菌株对番茄的促生试验
挑选大小一致且颗粒饱满的番茄种子,使用75%乙醇消毒3次,每次3 min,再使用无菌水清洗3~4次,每次3min。将灭菌好的种子播种入已灭菌土壤。等待1周左右番茄2片真叶完全展出,挑取长势一致的番茄幼苗移至含有灭菌土壤的小型花盆中,每盆3株番茄幼苗,每株幼苗间距相等。待番茄幼苗定植成功后对其进行灌根,灌根菌液由1×108 CFU/mL的菌液分别稀释20和100倍,以无菌水为空白对照组(CK),每组3个重复,每次每株苗灌根5 mL,每5 d处理1次,共计4次。20 d后进行番茄植株各项指标的测量与统计。
1.5熵值法
以拟南芥和番茄生长参数及菌株的溶磷、固氮、铁载体、解钾、产IAA能力为评价指标,利用熵值法计算赋予各指标权重(朱喜安和魏国栋,2015),综合评定出促生优势菌株。
1.6菌株挥发物成分鉴定
1.6.1菌株挥发性物质收集滴加100μLOD600 nm=1的菌稀释液涂布于LB固体培养基,30°C培养箱培养2 d,采用1 mL枪头对培养基打孔获得直径为8 mm、厚度为5 mm的菌块,每个顶空瓶[安捷伦科技(上海)有限公司]装20个菌块,盖子密封于30°C培养箱继续培养5d,对照组顶空瓶装20个同规格无菌LB固体培养基块。
1.6.2菌株产VOCs成分检测采用固相微萃取与气相—色谱质谱联用技术(GC-MS)分析鉴定菌株VOCs成分。含有样品的顶空瓶放在30℃水浴锅[群安科学仪器(浙江)有限公司]中平衡20min,固相微萃取探针(青岛贞正分析仪器有限公司)插入顶空瓶萃取20min。将含有VOCs样品的固相微萃取针头插入气相质谱仪[QP2020 NX,岛津企业管理(中国)有限公司],运行设定程序,进样口高温释放VOCs样品,每组试验设3个重复(Wang et al.,2023)。GC-MS分析条件:色谱柱为弱极性固定相且对活性化合物有优良惰性的SH-Rxi-5Sil MS[岛津企业管理(中国)有限公司],膜厚0.25μm、长度30m、内径0.25 mm,最高使用温度350℃,载气为99.999%氦气,柱箱温度40℃,进样温度250℃,进样模式为不分流,进样时间0.5 min,压力63.9 kPa,总流量50 mL/min,柱流量1.2 mL/min;初始温度40℃,保持3 min,然后以10℃/min的速率上升至60℃,保持1 min,以10℃/min的速率上升至70℃,保持1 min,以5℃/min的速率上升至160℃,以10℃/min的速率上升至180℃,保持1 min,以20℃/min的速率上升至250℃,保持1 min,结束时间为32.5 min;离子源温度200℃,接口温度250℃;采集方式为扫描,扫描速度2000u/s,扫描范围35~550 m/z。数据采集与分析平台为GCMSsolution 4.50。采用自动整合与识别,并在NIST 17库中自动检索。
1.7基于16S rRNA和gyrB基因序列的菌株鉴定与生理生化鉴定
对筛选出的优势促生菌株进行菌落观察和生理生化测定。使用煮沸法提取VOCs促生菌株全DNA进行16S rRNA和gyrB基因PCR扩增,扩增程序:95℃预变性4 min;95℃1 min,55℃1 min,72℃2 min,进行32个循环,送至生工生物工程(上海)股份有限公司测序。测序结果使用SeqMan 7.1.0拼接,EzBioCloud网站(https://www.ezbiocloud.net/)进行在线分析,采用MEGA 11对VOCs促生菌株中优势菌株近源性最高的菌株和1株外源菌株的序列进行比对,基于最大似然法(Maximum likelihood,ML)构建系统发育进化树,采用自举法(Bootstrap)评估分支可信度,Bootstrap设为1000次。
1.8统计分析
采用Excel 2019整理数据。采用SPSS 21.0对数据进行单因素方差分析,多重比较采用LSD检验,对不符合单因素方差分析的数据采用非参数检验中独立样本检验。
2结果与分析
2.1促生菌株分离筛选
从互花米草根系中筛选出的85株菌株中,成功获得6株细菌,其通过释放VOCs有效促进了拟南芥的生长,分别编号为GXMZU2281、GXMZU2346、GXMZU2401、GXMZU3251、GXMZU3294、GXMZU 4388。与对照组相比,在6株VOCs促生菌株处理下,拟南芥的叶长、叶宽、根数和鲜重有不同程度增加(表1),其中GXMZU3251菌株处理的叶长、叶宽、根数和鲜重均增幅最大,分别极显著增加57.3%、69.4%、227.8%和403.3%(P<0.0 下同);除GXMZU2346菌株增加根长(增幅3.6%)外,其他5株菌株表现为抑制拟南芥根长,但该5株菌株对拟南芥根数增加具有作用,其中GXMZU2401、GXMZU3251和GXMZU4388菌株极显著促进拟南芥根部发育,根的数量分别增加218.4%、227.8%和138.9%,GXMZU2346菌株根数增加,但差异未达显著水平(P>0.05,下同),说明GXMZU2346菌株通过增加根长促进植物根系发达,而其他5株菌株通过增加根数以达到根系发达。6株菌株均极显著增加拟南芥鲜重,增幅在270.0%~403.8%,说明6株菌株释放的VOCs在增加植物生物量方面具有一定潜力。
2.2菌株促生能力
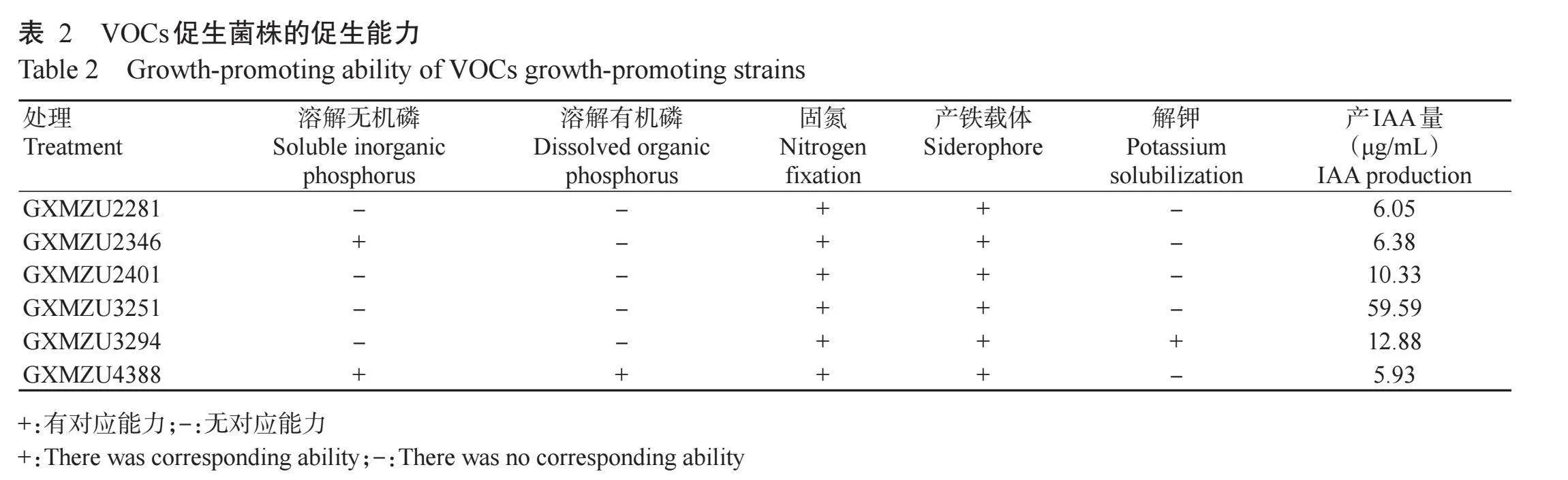
由表2可知,6株菌株均有固氮、产铁载体和产IAA的能力。其中,GXMZU3251菌株产IAA量达59.59μg/mL,其产IAA能力远强于其他菌株;GXMZU 3294菌株具有解钾能力;GXMZU2346和GXMZU4388菌株表现出溶解无机磷的能力,GXMZU4388菌株还能溶解有机磷。
2.3促生菌株对番茄的促生作用
使用1×108 CFU/mL的菌液稀释20倍对番茄进行灌根处理,结果(表3)显示,6株促生菌株均显著(P<0.05,下同)或极显著促进番茄叶长、叶宽、株高、鲜重和干重增加。其中,6株菌株处理的叶长、叶宽、株高和鲜重均极显著增加;GXMZU2281、GXMZU3251和GXMZU3294菌株处理使番茄茎粗极显著增大,GXMZU2346菌株处理显著增大茎粗;GXMZU4388菌株处理极显著增加番茄根长,GXMZU2281和GXMZU2346菌株处理显著增加番茄根长;除GXMZU2401菌株外其余5株菌株处理均极显著增加番茄干重。
由表4可知,在稀释100倍的浓度菌液处理下,6株菌株均极显著增加番茄的叶长、叶宽和株高,但在根长方面均与对照组无显著差异;GXMZU3294和GXMZU4388菌株处理分别显著或极显著增加叶片数;GXMZU2281和GXMZU4388菌株处理下番茄茎粗极显著增大,GXMZU3294菌株处理显著增大番茄茎粗;GXMZU2281和GXMZU4388菌株处理极显著增加番茄的鲜重和干重,GXMZU2401和GXMZU3294菌株处理分别极显著或显著增加鲜重。
总体来说,GXMZU4388菌株在促进番茄植株生长上表现较佳。在GXMZU4388菌株菌液稀释20倍浓度下,番茄的叶长、叶宽、叶片数、茎粗、株高、鲜重和干重分别增加34.8%、37.2%、53.0%、37.5%、57.1%、144.0%和183.3%;在稀释100倍菌液浓度下,番茄的叶长、叶宽、叶片数、茎粗、株高、鲜重和干重分别增加28.1%、25.0%、56.6%、50.0%、45.3%、186.2%和366.7%。
2.4熵值法评定VOCs促生优势菌株
经过熵值法综合评定得出,GXMZU4388为优势促生菌株,其得分(0.6447)为6株菌株中最高(表5)。GXMZU4388释放的VOCs显著促进拟南芥生长,拟南芥莲座部分面积明显增大(图1);该菌稀释液处理下的番茄植株株高和茂密程度明显增加(图2)。综上,GXMZU4388在释放VOCs促生、接触促生方面均有优秀表现。
2.5 GXMZU4388菌株VOCs鉴定分析
使用GC-MS分别测定GXMZU4388菌株菌块(含LB固体培养基)样品与对照组(无菌LB固体培养基块)所释放的VOCs成分,并得到2组样品的气相色谱图(图3)。通过GCMSsolution 4.50自动积分气相色谱图峰高≥30000的物质,扣除LB固体培养基的背景VOCs成分、固相微萃取针头产生的硅氧化合物与峰型异常的化合物,即得到9个化合物,其峰面积及保留时间等详见表6。峰面积表示化合物相对含量,由此可知6-甲基-2-庚酮、5-甲基-2-己酮、5-甲基-2-庚酮和3-甲基-2-戊酮等4个VOCs化合物相对含量占比较大,占据主导地位。
2.6 GXMZU4388菌株特征及生理生化特性
GXMZU4388菌株培养初期为橙色光滑菌落,经过一定时间会转变为白色皱褶菌落(图4-A),在显微镜下,该菌株为短杆形态,革兰氏染色为阳性(图4-B);培养1个月后,细菌会完全从营养体转变为芽孢形态(图4-C),此时使用革兰氏染色无法对GXMZU4388菌株着色,菌株培养4 d后会有大量的代谢物(图4-D)。
对GXMZU4388菌株进行生理生化鉴定,其鉴定结果如表7所示,GXMZU4388为发酵型菌株,可在有氧及无氧条件下利用葡萄糖。石蕊牛乳试验表明,GXMZU4388菌株能使蛋白胨化;V-P试验结果为阳性,证明细菌含有丙酮酸脱羧酶;吲哚和明胶液化试验结果为阳性,同时GXMZU4388菌株可利用水杨苷、七叶苷和柠檬酸盐。结合该菌株产芽孢的特性初步判定GXMZU4388菌株为芽孢杆菌。
2.7菌株的分子鉴定
GXMZU4388菌株的16S rRNA序列在EzBio-Cloud网站在线比对发现与Bacillus safensis(ASJD 01000027)相似度为99.79%,菌株16S rRNA序列(NMDCN0001DQ8)已上传至国家微生物科学数据中心(https://www.nmdc.cn/)。用最大似然法构建VOCs促生优势菌株GXMZU4388的基于16S rRNA序列相似性的系统发育进化树(图5),GXMZU4388菌株与沙福芽孢杆菌(Bacillus safensis)同源性最高,序列相似性为99.79%。由于用16S rRNA比对很难对芽孢杆菌进行种的分类(喻国辉等,2010),本研究基于gyrB基因对其他GXMZU4388菌株的16SrRNA近源菌株进行构建系统发育进化树(图6),GXMZU4388菌株与沙福芽孢杆菌同源性最高。结合上述关于GXMZU4388菌株形态与生理生化鉴定结果可将GXMZU4388菌株认定为沙福芽孢杆菌。
3讨论
在国际社会日益关注粮食安全和土壤环境质量的背景下,利用Ps0AwUrVL21Ipb6sPPlz6XKVpE4jTOtd6ktMlYlWDZFc=GPR相关产品代替部分化肥已成为时下关注的热点。PGPR已应用于各种作物,以促进植物生长、种子出苗和提高作物产量,不少的PGPR产品现已成功商业化。细菌是土壤中数量最多的生物,能大量富集在植物根际,VOCs已成为细菌与植物间的新型信号传递方式,不需要细菌直接接触植物。许多研究报告称,栖息于根际的PGPR可刺激植物生长。从VOCs方面分析PGPR促生机制也成为解读细菌促进植物生长机理的重要研究方向。VOCs促生具有非接触、传播快、可复刻等特点,有很大潜力成为新型菌肥挑选的优良指标,甚至成为一种新型气态肥料。VOCs类型众多,其在植物上的作用机理通常是诱导与植物生长激素相关的信号通路以促进植物生长,还通过诱导植物系统抗性使植物抵御生物或非生物胁迫(Jain et al.,2017)。
本研究筛选出的GXMZU4388菌株为沙福芽孢杆菌,该菌无致病性,在工业酶生产当中也有应用(Lateefetal.,2015),在农业上大多数研究关注其抑菌的作用,很少关注其在VOCs促生上的能力。GXMZU4388菌株在菌悬液稀释了20和100倍的情况下均能明显促进番茄生长,2种稀释倍数的鲜重与干重增长相差并不明显,而稀释20倍处理相较稀释100倍处理更加有助于株高增加,研究表明小果型番茄的单株前期产量与株高呈负相关(董华芳等,2009),因此在贵妃番茄培养的实际应用上应选择稀释100倍菌液浓度。
通过GC-MS对GXMZU4388菌株释放挥发性物质的具体成分进行鉴定,筛选出9种VOCs。除5-甲基-2-庚醇之外的8种化合物均有一定的植保或促生方面的研究报道。在高浓度的3-甲基-2-戊酮处理下可抑制淡紫拟青霉(Paecilomyceslilacinus)、粉红粘帚霉(Clonostachys rosea)生长(Xu etal.,2004)。5-甲基-2-己酮可刺激皱叶酸模(Rumex acetosa L.)暗萌发(Leather and French,1990),并能导致小孢根霉(Rhizopus microsporus)死亡(王恩召等,2020)。6-甲基-2-庚酮在100μL/L的浓度下完全抑制桃褐腐病菌(Moniliniafructicola)(Liu et al.,2018)。2-庚酮在浓度为10ng/μL时对拟南芥幼苗鲜重的增加作用最强(Wu et al.,2019),但GXMZU4388菌株释放的2-庚酮量较少,有文献报道在枯草芽孢杆菌(B.sub-tilis)中2-庚酮很可能通过转化为6-甲基-2-庚酮而避免成为线虫的食物(Zhu et al.,2019),GXMZU4388菌株是否有相同的机制值得进一步研究。2,5-二甲基吡嗪对北方根结线虫(Meloidogynehapla)有直接触杀活性,对其卵的孵化有抑制活性(Wu et al.,2023),同时2,5-二甲基吡嗪参与了解淀粉芽孢杆菌(B.amyloliquefaciens)对植物的双重性的调节,高浓度的2,5-二甲基吡嗪会抑制植物生长,从而促进免疫(Songet al.,2022)。5-甲基-2-庚酮对青枯雷尔氏菌(Ralstonia solanacearum)表现出显著的抑菌活性。2-壬酮在10 nmol/L的极低浓度下也可保护番茄幼苗免受丁香假单胞菌(Pseudomonas syringae)番茄致病变种的侵害(Riu etal.,2022),剂量为0.1μg的2-壬酮能刺激萌发期水稻的生长(Fincheira et al.,2017);2-壬酮可提高莴苣(Lactuca sativa)幼苗根毛密度和根毛长(Fincheira and Quiroz,2019)。
综上所述,GXMZU4388是可作为菌肥制剂的优良菌株,但实现其应用还需要深入研究,包括温室和田间条件下的效率测试,以明确PGPR作为生物肥料的作用及对植物生长和发育产生的有益影响。GXMZU4388菌株在产生VOCs促生方面有优良表现,通过对其VOCs具体成分的分析证明该菌株还有开发抑菌、抑虫等促生功能的潜力。由于GXMZU4388菌株是从具有强大耐盐能力的互花米草根系筛选而得,而2,5-二甲基吡嗪可影响植物免疫相关的水杨酸和茉莉酸通路(Song et al.,2022),表明GXMZU4388菌株很可能在互花米草抗盐碱过程中提供了一定帮助。本研究筛选出1株有释放促进植物生长的VOCs功能的促生菌株,并鉴定该菌株释放的VOCs具体成分,测试该菌株在番茄种植上的应用;一定程度上阐释了GXMZU4388菌株通过VOCs促进植物生长的原因,为沙福芽孢杆菌释放VOCs促生机制的研究提供一定的理论支持。
4结论
GXMZU4388菌株在促进植物生长各方面均表现优秀,在低浓度下也能显著发挥其促进植物生长的能力,能释放多种有利于植物生长与抑菌的VOCs,在菌肥开发上有极佳的应用潜力。
参考文献(References):
董华芳,王海龙,许延波.2009.番茄主要农艺性状及前期产量的相关分析[J].北方园艺,(4):20-22.[Dong H F,Wang H L,Xu Y B.2009.Correlation analysis between tomato main agronomic characters and pre-production[J].Nor-thern Horticulture,(4):20-22.]
高俊程.2019.土壤解钾菌研究现状概述[J].青海草业,28(2):21-23.[Gao J C.2019.Summary of the research sta-tus of potassium-solubilizing bacteria in soil[J].Qinghai Prataculture,28(2):21-23.]
高亚慧,姜明国,丰景,周桂.2022.产生促生挥发性物质的潜在PGPR菌株筛选及其促生特性研究[J].生物技术通报,38(3):103-112.[Gao Y H,Jiang M G,Feng J,Zhou G.2022.Screening of potential PGPR strains producting growth-promoting volatile compounds and study on their growth-promoting characteristics[J].Biotechnology Bulle-tin,38(3):103-112.]doi:10.13560/j.cnki.biotech.bull.1985.2021-0619.
兰成忠,甘林,代玉立,刘晓菲,杨秀娟,蒋军喜.2023.黄瓜枯萎病菌拮抗菌的筛选、鉴定和防效测定[J].中国生物防治学报,39(1):184-193.[Lan C Z,Gan L,Dai Y L,Liu X F,Yang X J,Jiang J X.2023.Screening,identification and biocontrol effect of antagonistic strain against Fusarium oxysporumf.sp.cucumerinum[J].Chinese Jour-nal of Biological Control,39(1):184-193.]doi:10.16409/j.cnki.2095-039x.2023.02.006.
李慧颖.2021.广西北部湾滩涂入侵植物互花米草根际微生物群落分析及促生菌、新种的挖掘[D].南宁:广西民族大学.[Li H Y.2021.Analysis of the rhizosphere microbe community of the invasive plant Spartina alterniflora in the mudflats of Beibu Gulf,Guangxi,and identification of growth promting bacteria and novel species[D].Nanning:Guangxi University for Nationalities.]
王恩召,范分良,李艳玲,刘雄舵,卢玉秋,宋阿琳.2020.水稻根系细菌挥发性有机物对小孢根霉的非接触性抑制作用[J].中国农业科学,53(10):1986-1996.[Wang E Z,Fan F L,Li Y L,Liu X D,Lu Y Q,Song A L.2020.Non-contact inhibitory of volatile organic compounds from rice root bacteria on Rhizopus microsporus[J].Scientia Agri-cultura Sinica,53(10):1986-1996.]doi:10.3864/j.issn.0578-1752.2020.10.006.
薛永萍,汤璐,冯健,谢婷婷,池汝安.2022.一株可分解钾长石真菌的分离筛选及鉴定[J].化学与生物工程,39(12):42-45.[Xue Y P,Tang L,Feng J,Xie T T,Chi R A.2022.Isolation,screening,and identification of a fungus dis-solving potassium feldspar[J].Chemistry&Bioenginee-ring,39(12):42-45.]doi:10.3969/j.issn.1672-5425.2022.12.007.
喻国辉,牛春艳,陈远凤,陈燕红,杨紫红.2010.利用16S rDNA结合gyrA和gyrB基因对生防芽孢杆菌R31的快速鉴定[J].中国生物防治,26(2):160-166.[Yu G H,Niu C Y,Chen Y F,Chen Y H,Yang Z H.2010.Use of 16S rDNA gyrA and gyrB gene sequence to identify a biocon-trol Bacillus sp strain R31[J].Chinese Journal of Biologi-cal Control,26(2):160-166.]doi:10.16409/j.cnki.2095-039x.2010.02.017.
朱喜安,魏国栋.2015.熵值法中无量纲化方法优良标准的探讨[J].统计与决策,(2):12-15.[Zhu X A,Wei G D.2015.Discussion on the excellent standard of dimensionless method in entropy method[J].Statistics&Decision,(2):12-15.]doi:10.13546/j.cnki.tjyjc.2015.02.003.
Andrades-Moreno L,del Castillo Madrigal I,Parra R,Doukkali B,Redondo-Gómez S,Pérez-Palacios P,Caviedes M A,Pajuelo E,Rodríguez-Llorente I D.2014.Prospecting metal-resistant plant-growth promoting rhizobacteria for rhizoremediation of metal contaminated estuaries usingSpartinadensiflora[J].Environmental Science and Pollu-tion Research,21(5):3713-3721.doi:10.1007/s 11356-013-2364-8.
Asari S,Matzén S,Petersen M A,Bejai S R,Meijer J.2016.Multiple effects of Bacillus amyloliquefaciens volatile compounds:Plant growth promotion and growth inhibition of phytopathogens[J].FEMS Microbiology Ecology,92(6):fiw070.doi:10.1093/femsec/fiw070.
Barghi A,Esposti L D,Iafisco M,Adamiano A,Casado G E,Ivanchenko P,Mino L,Yoon H Y,Joe E N,Jeon J R,Chang Y S.2021.Microbial volatile organic compound(VOC)-driven dissolution and surface modification of phosphorus-containing soil minerals for plant nutrition:Anindirect route for VOC-based plant-microbe communica-tions[J].Journal of Agricultural and Food Chemistry,69(48):14478-14487.doi:10.1021/acs.jafc.1c05187.
Bavaresco L G,Osco L P,Araujo A S F,Mendes L W,Bonifa-cio A,Araújo F F.2020.Bacillus subtilis can modulate the growth and root architecture in soybean through volatile organic compounds[J].Theoretical and Experimental Plant Physiology,32(2):99-108.doi:10.1007/s40626-020-001 73-y.
Bhattacharjee R B,Singh A,Mukhopadhyay S N.2008.Use of nitrogen-fixing bacteria as biofertiliser for non-legumes:Prospects and challenges[J].Applied Microbiology and Biotechnology,80(2):199-209.doi:10.1007/s00253-008-1567-2.
Cochard B,Giroud B,Crovadore J,Chablais R,Arminjon L,Lefort F.2022.Endophytic PGPR from tomato roots:Isolation,in vitro characterization and in vivo evaluation of treated tomatoes(Solanum lycopersicum L.)[J].Mi-croorganisms,10(4):765.doi:10.3390/microorganisms 10040765.
del Rosario Cappellari L,Banchio E.2020.Microbial volatile organic compounds produced by Bacillus amyloliquefa-ciens GB03 ameliorate the effects of salt stress in Mentha piperita principally through acetoin emission[J].Journal of Plant Growth Regulation,39(2):764-775.doi:10.1007/s00344-019-10020-3.
Farag M A,Zhang H M,Ryu C M.2013.Dynamic chemicalcommunication between plants and bacteria through air-borne signals:Induced resistance by bacterial volatiles[J].Journal of Chemical Ecology,39(7):1007-1018.doi:10.1007/s 10886-013-0317-9.
Fincheira P,Quiroz A.2019.Physiological response of Lactuca sativa exposed to 2-nonanone emitted by Bacillus sp.BCT9[J].Microbiological Research,219:49-55.doi:10.1016/j.micres.2018.11.002.
Fincheira P,Parada M,Quiroz A.2017.Volatile organic com-pounds stimulate plant growing and seed germination of Lactuca sativa[J].Journal of Soil Science and Plant Nutri-tion,17(4):853-867.doi:10.4067/S0718-9516201700040 0002.
Franche C,Lindström K,Elmerich C.2009.Nitrogen-fixing bacteria associated with leguminous and non-leguminous plants[J].Plant and Soil,321(1):35-59.doi:10.1007/s11104-008-9833-8.
Gao Y,Peng R H,Ouyang Z T,Shao C L,Chen J Q,Zhang T T,Guo H Q,Tang J W,Zhao F,Zhuang P,Zhao B.2020.Enhanced lateral exchange of carbon and nitrogen in a coastal wetland with invasive Spartina alterniflora[J].Journal of Geophysical Research:Biogeosciences,125(5):e2019JG005459.doi:10.1029/2019JG005459.
Guerinot M L.1994.Microbial iron transport[J].Annual Re-view of Microbiology,48(1):743-772.doi:10.1146/ann-urev.mi.48.100194.003523.
Jain S,Varma A,Tuteja N,Choudhary D K.2017.Bacterial volatiles in promotion of plant under biotic stress[M]//Choudhary D K,Sharma A K,Agarwal P,Varma A,Tuteja N.Volatiles and Food Security.Singapore:Springer singa-pore:299-311.doi:10.1007/978-981-10-5553-9_16.
Johnson D W,Cheng W,Burke I C.2000.Biotic and abiotic nitrogen retention in a variety of forest soils[J].Soil Scien-ce Society of America Journal,64(4):1503-1514.doi:10.2136/sssaj2000.6441503x.
Kanchiswamy C N,Malnoy M,Maffei M E.2015.Chemical diversity of microbial volatiles and their potential for plant growth and productivity[J].Frontiers in Plant Science,6:151.doi:10.3389/fpls.2015.00151.
Lateef A,Adelere I A,Gueguim-Kana E B.2015.The biology and potential biotechnological applications of Bacillus safensis[J].Biologia,70(4):411-419.doi:10.1515/bio-log-2015-0062.
Leather G R,French R C.1990.Evaluation of volatile com-pounds on the germination of seventeen species of weedseeds[J].Journal of Agricultural and Food Chemistry,38(3):856-859.doi:10.1021/jf00093a056.
Li F,Shi T L,Tang X X,Tang M,Gong J Y,Yi Y.2020.Bacil-lus amyloliquefaciens PDR1 from root of karst adaptive plant enhances Arabidopsis thaliana resistance to alkaline stress through modulation of plasma membrane H+-ATPase activity[J].Plant Physiology and Biochemistry,155:472-482.doi:10.1016/j.plaphy.2020.08.019.
Liu C,Yin X H,Wang Q G,Peng Y,Ma Y R,Liu P,Shi J Y.2018.Antagonistic activities of volatiles produced by two Bacillus strains against Moniliniafructicola in peach fruit[J].Journal of the Science of Food and Agriculture,98(15):5756-5763.doi:10.1002/jsfa.9125.
Nastasija M,Mirjana J,Ivica,Đ,Đorđe J.2012.Importance of PGPR application and its effect on microbial activity in maize rhizosphere[J].Field and Vegetable Crops Research,49(3):335-344.doi:10.5937/ratpov49-1915.
Riu M J,Kim M S,Choi S K,Oh S K,Ryu C M.2022.Elicita‐tion of innate immunity by a bacterial volatile 2-nonanone at levels below detection limit in tomato rhizosphere[J].Molecules and Cells,45(7):502-511.doi:10.14348/mol‐cells.2022.2009.
Ryu C M,Farag MA,Hu C H,Reddy M S,Kloepper J W,ParéP W.2004.Bacterial volatiles induce systemic resistance in Arabidopsis[J].Plant Physiology,134(3):1017-1026.doi:10.1104/pp.103.026583.
Song G C,Jeon J S,Sim H J,Lee S H,Jung J H,Kim S G,Moon S Y,Ryu C M.2022.Dual functionality of natural mixtures of bacterial volatile compounds on plant growth[J].Journal of Experimental Botany,73(2):571-583.doi:10.1093/jxb/erab466.
Wakelin S A,Warren RA,Harvey P R,Ryder M H.2004.Phos‐phate solubilization by Penicillium spp.closely associated with wheat roots[J].Biology and Fertility of Soils,40(1):36-43.doi:10.1007/s00374-004-0750-6.
Wang J F,Zhou C,Xiao X,Xie Y,Zhu L,Ma Z Y.2017.Enhanced iron and selenium uptake in +MQ5cfmpbmli0zvvfcunRhKGwovbjOeO2rPyFTlsHiU=plants by volatile emissions of Bacillus amyloliquefaciens(BF06)[J].App-lied Sciences,7(1):85.doi:10.3390/app7010085.
Wang K,Lin Z Y,Dou J,Jiang M G,Shen N K,Feng J.2023.Identification and surveys of promoting plant growth
VOCs from biocontrol Bacteria paenibacilluspeoriae GXUN15128[J].Microbiology Spectrum,11(3):e0434622.doi:10.1128/spectrum.04346-22.
Wu W T,Zeng Y L,Yan X R,Wang Z H,Guo L W,Zhu Y Y,Wang Y,He X H.2023.Volatile organic compounds of Bacillus velezensis GJ-7 against Meloidogynehapla through multiple prevention and control modes[J].Molecules,28(7):3182pkdSQ719x5QOluZdrg3ZqS/HLIRReC3teBteigfAyJ8=.doi:10.3390/molecules28073182.
Wu Y C,Zhou J Y,Li C G,Ma Y.2019.Antifungal and plant growth promotion activity of volatile organic compounds produced by Bacillus amyloliquefaciens[J].Microbiology Open,8(8):e00813.doi:10.1002/mbo3.813.
Xu C K,Mo M H,Zhang L M,Zhang K Q.2004.Soil volatile fungistasis and volatile fungistatic compounds[J].Soil Bio-logy and Biochemistry,36(12):1997-2004.doi:10.1016/j.soilbio.2004.07.020.
Yang R M,Guo W W.2018.Exotic Spartina alterniflora enhances the soil functions of a coastal ecosystem[J].Soil Science Society of America Journal,82(4):901-909.doi:10.2136/sssaj2017.12.0411.
Yang W,Jeelani N,Leng X,Cheng X L,An S Q.2016.Spar-tina alterniflora invasion alters soil microbial community composition and microbial respiration following invasion chronosequence in a coastal wetland of China[J].Scien‐tific Reports,6:26880.doi:10.1038/srep26880.
Zhu M,Xu X E,Li Y H,Wang P F,Niu S Z,Zhang K Q,Huang X W.2019.Biosynthesis of the nematode attractant 2-heptanone and its co-evolution between the pathogenic bacterium Bacillus nematocida and non-pathogenic bacte‐rium Bacillus subtilis[J].Frontiers in Microbiology,10:1489.doi:10.3389/fmicb.2019.01489.
(责任编辑邓慧灵)
