贵州省核桃叶斑病病原菌鉴定、生物学特性及防治药剂筛选
2024-10-15敖显禧欧阳浩杨文佳樊瑞冬吕周乐吴朝明陈孝玉龙








摘要:【目的】明确贵州省核桃叶斑病的病原菌分类地位及生物学特性,筛选有效的杀菌剂,为核桃叶斑病的田间防治提供理论参考。【方法】以采集自贵州省毕节市赫章县核桃种植基地的核桃叶斑病病叶为材料,采用组织分离法分离纯化病原菌,利用柯赫氏法则对病原菌进行致病性测定,对病原菌的ITS、β-tubulin和TEF1-α基因序列进行扩增,结合形态学特征及多基因序列联合分析对病原菌进行分类鉴定,采用单因子变量法测定病原菌的生物学特性,采用室内毒力测定评估17种常用杀菌剂对病原菌的抑制效果。【结果】从贵州省赫章县核桃病叶样品中共分离得到18株菌株,选取代表性菌株C5进行形态学和致病性测定。致病性测定结果显示,菌株C5为核桃叶斑病的致病菌,该菌的形态特征与木贼镰刀菌(Fusarium equiseti)相似,且多基因联合聚类分析显示与F.equiseti yl-1聚为一支。菌株C5生长最适温度为20~25℃、最适光周期为18 h∶6 h(光照∶黑暗),可利用多种碳源和氮源,最佳碳源为蔗糖、最佳氮源为牛肉膏;湿度为70%时分生孢子的萌发率最高。17种供试杀菌剂中,45%咪鲜胺ME、30%唑醚·戊唑醇SC、0.15%四霉素AS、40%腈菌唑SC、10%苯醚甲环唑WG和1%申嗪霉素SC对菌株C5菌丝生长的抑制效果较好,其抑制中浓度(EC50)分别为0.0006、0.0016、0.0046、0.0062、0.0084和0.0097μg/mL。【结论】贵州省毕节市赫章县核桃种植区核桃叶斑病的病原菌为木贼镰刀菌,首选45%咪鲜胺ME或0.15%四霉素AS防治该病害,30%唑醚·戊唑醇SC、40%腈菌唑SC、10%苯醚甲环唑WG和1%申嗪霉素SC可作为备选防治药剂。
关键词:核桃;叶斑病;木贼镰刀菌;生物学特性;药剂筛选;贵州省
中图分类号:S436.629文献标志码:A文章编号:2095-1191(2024)07-2126-11
Identification and biological characteristics of walnut leaf spot disease pathogen in Guizhou and screening of fungicides
AO Xian-xi OUYANG-Hao YANG Wen-jia FAN Rui-dong LYU Zhou-le WU Chao-ming CHEN Xiao-yu-long
(1College of Biological and Environmental Engineering/Key Laboratory of Surveillance and Management of InvasiveAlien Species in Guizhou Institutions of Higher Learning,Guiyang University,Guiyang,Guizhou 550005,China;2College of Agriculture/College of Life Sciences,Guizhou University,Guiyang,Guizhou 550025,China)
Abstract:【Objective】This study aimed to clarify the classification status and biological characteristics of the potho-gen of walnut leaf spot disease in Guizhou and screen effective fungicides,so as to provide theoretical basis for contro-lling the walnut leaf spot disease in the field.【Method】The leaves of walnut leaf spot disease collected from walnut plan-ting base in Hezhang,Bijie,Guizhou were used as materials.Tissue separation method was used to isolate and purify the pathogenic bacteria,and Koch’s rule was used to determine the pathogenicity of the pathogen.The sequences of ITS,β-tubulin and TEF1-αgenes in the pothogen were amplified respectively.Based on morphological characteristics and mul-tigenes sequence analysis,the pathogen was classified and identified.Biological characteristics of the pathogen was deter-mined by one-way variation method.Indoor toxicology test was conducted to evaluate the inhibtion effects of 17 common fungicides on leaf spot disease.【Result】Eighteen fungal isolates were obtained from the diseased walnut leaves in He-zhang,Bijie,Guizhou,and representativestrain C5 was selected for morphological and pathogenicity determination.The pathogenicity detection results indicated that strain C5 was the pathogen causing walnut leaf spot disease.Morphological characteristics of strain C5 was similar to those of Fursariumequiseti,and multigenes cluster analysis showed that the pathogen was clustered in the same branch with F.equiseti yl-1.The optimum growth temperature of strain C5 was 20-25℃,the optimum photoperiod were 18 h∶6 h(light∶dark).Diverse carbon and nitrogen resources could be used,the optimum carbon source was sucrose,the best nitrogen source was beef paste.The germination rate of conidia was the highest under 70%humidity.Among the tested 17 fungicides,45%prochloraz ME,30%pyraclostrobin·tebuconazole SC,0.15%tetramycin AS,40%myclobutanil SC,10%difenoconazole WG and 1%phenazino-1-carboxylic acid SC had better inhibitory effects on the growth of strain C5 mycelium,and their median inhibitory concentrations(EC50)were 0.0006,0.0016,0.0046,0.006 0.0084 and 0.0097μg/mL respectively.【Conclusion】The pathogen of leaf spot disease from the walnut growing area in Hezhang,Bijie,Guizhou is F.equiseti.45%prochloraz ME or 0.15%tetramycin AS can be the first choice for controlling the disease,and 30%pyraclostrobin·tebuconazole SC,40%myclobutanil SC,10%di-fenoconazole WG and 1%phenazino-1-carboxylic acid SC can be used as alternative fungicides.
Key words:walnut;leaf spot disease;Fusarium equiseti;biological characteristics;fungicide screening;Guizhou
Foundation items:National Natural Science Foundation of China(32360705);Guizhou High-level Innovation Ta-lents Project(QKHPTRC-GCC〔2023〕071);Guizhou Forestry Science and Technology Research Project(Qianlinkehe〔2021〕04);Key Laboratory Project of Guizhou Education Department(Qianjiaoji〔2023〕024)
0引言
【研究意义】核桃(Juglans regia L.)又名胡桃,隶属于胡桃科(Juglandaceae)胡桃属(Juglans),与扁桃、腰果和榛子并称为世界“四大干果”,是一种营养价值和经济价值都很高的珍贵果木(张黎丽等,2019;计雅男等,2022)。核桃营养丰富,富含蛋白质、不饱和脂肪酸、维生素、矿物质、黄酮及多酚类等物质,具有健脑益智、健胃补血、润肺养神以及护肝、降血糖、降血脂和预防心血管疾病等功效(张亭等,2018;唐佳佳等,2023)。其分布广泛,主要分布在华北、华中、华南、华东以及西北、西南地区(冯贞和方晓璞,2018)。贵州赫章县、河北赞皇县和山东东平县更是被誉为“中国核桃之乡”(杨玉婷等,2021;崔潇,2023;于春彦等,2023)。目前,贵州赫章县核桃种植面积超1.1万ha,是当地农业发展的支柱产业,“赫章核桃”也率先被国家质检总局审核批准为国家地理标志保护产品(孙超等,2020)。然而,由于近年来核桃的种植面积快速增长,集中栽培程度不断提高,但在栽培管理上却仍沿用传统的粗放模式,致使核桃病害越来越严重,炭疽病、基腐病和叶斑病等多种病害制约着核桃产量的提高,给核桃种植户带来巨大经济损失。核桃叶斑病是核桃叶部黑斑病和褐斑病的统称(吴天昊等,2022),该病主要危害叶片,通常从叶尖和叶缘开始发病,形成圆形或近圆形的褐色至黑褐色坏死斑,严重时病斑面积不断扩大,并逐渐向内扩展,最后连成一片,造成叶片大面积坏死和焦枯。因此,当前迫切需要对核桃叶斑病病原菌进行分离鉴定,并对病原菌的生物学特性进行研究和病害防治药剂筛选,为制定核桃叶斑病田间防控策略提供参考。【前人研究进展】随着对核桃叶斑病研究的深入,发现多种病原菌能侵染核桃叶片引起叶斑病,但病原菌的种类、发生特点、流行规律和危害情况存在一定差异。已报道引起核桃叶斑病的病原菌有互隔交链孢(Alternaria alternata)、核桃炭疽菌(Colletotrichum juglandissp.nov.)、胡桃叶点霉[Phyllostictajuglandis(DC.)Sacc]、镰孢属(Fusarium)、间座壳属(Diaporthe)、蛇形单座菌属(Boeremia)、亚隔孢壳属(Didymella)、拟滴孢壳菌属(Stagonospo-ropsis)、葡萄孢属(Botrytis)、葡萄座腔菌属(Neofusi-coccum)、炭垫菌属(Nemania)和大豆茎点霉(Boeremiaexigua)等(韩敏等,2014;贺占雪等,2019;Zarei et al.,2019;Wang et al.,2022;Weiet al.,2022)。目前,核桃叶斑病的防治主要依赖化学药剂。韩敏等(2014)在防治研究中发现,使用10%咪鲜胺微乳剂和10%苯醚甲环唑水分散粒剂对由链格孢菌引起的新疆核桃叶斑病具有较好防效。雷明山等(2015)对甘肃省天水市核桃黑斑病田间防治药剂筛选试验结果显示,3%噻霉酮可湿性粉剂、20%苯醚甲环唑微乳剂和50%退菌特可湿性粉剂的防治效果较好,在高温多雨季节交替使用药剂可对病害进行有效防控。黄雄等(2016)调查发现,四川省石棉县核桃炭疽病和黑斑病主要高发期在7月中旬,选择分子颗粒小、附着力强的杀菌剂可提高药物利用率,减少对土壤的污染,25%咪酰胺乳油1000倍液+70%甲基硫菌灵可湿性粉剂1000倍液对叶片黑斑病的防效最佳,而25%咪酰胺乳油500倍液+70%甲基硫菌灵可湿性粉剂1000倍液对果实炭疽病和黑斑病的防效最佳。杨莉等(2017)对四川核桃褐斑病进行调查鉴定,发现引起该病的病原菌为链格孢菌,当日间温度16℃时,病原菌孢子开始侵染核桃叶片,致使叶片逐渐出现黑色小斑点,7—8月时病叶开始掉落,之后病原菌在落叶和病果上越冬,来年反复进行侵染。郭安柱等(2020)研究发现,引起陕西商洛市核桃黑斑病的病原菌为成团泛菌(Pantoea agglomerans),通过抑菌试验和田间防治试验发现,中生菌素对核桃果实黑斑病和叶片黑斑病的防治效果最好,其次为噻霉酮,氟啶胺的防治效果最差;在使用化学杀菌剂防治的同时,应加强虫害防治,减少伤口,降低病菌侵染率;防治过程中,不仅应合理选择低毒有效药剂,同时也应加强对病原微生物生长习性研究,为防治提供基础。瞿佳等(2021)研究发现,春雷霉素和含铜锌制剂等对细菌性引起的核桃黑斑病病害具有较好的防效。席军强等(2022)调查发现,甘肃天水市核桃黑斑病由核桃黄极毛杆菌(Xanthomonas campestris pv.juglandis)和链格孢菌复合侵染引起;对病原菌的生物学特性研究结果显示,链格孢菌菌丝生长和孢子萌发最适温度为25~30℃,全光照条件下有利于菌丝生长,pH 9有利于菌丝生长和孢子萌发。曹荣(2023)在陕西省商洛市对核桃褐斑病进行防治效果试验,结果发现在核桃发芽前使用80%必备可湿性粉剂、68.75%杜邦易保水分散粒剂、80%喷克可湿性粉剂和78%科博可湿性粉剂可获得较好的防治效果。周洁璐等(2023)试验结果表明,可交替或混合使用咪鲜胺和吡唑嘧菌酯防治由镰孢菌引起的薄壳山核桃叶斑病。【本研究切入点】目前,有关西南地区核桃叶斑病病害防治的研究报道较少,有必要开展其病原菌鉴定、生物学特性及防治药剂筛选研究。【拟解决的关键问题】采用组织分离法对贵州省核桃叶斑病进行病原菌分离纯化,利用柯赫氏法则测定病原菌的致病性,结合病原菌形态特征及多基因序列联合分析,确定病原菌的分类地位,进一步进行病原菌生物学特性测定及防治药剂筛选,以期为核桃叶斑病的田间防治提供理论参考。
1材料与方法
1.1试验材料
1.1.1供试病样于2022年7月20日从贵州省毕节市赫章县施家大坪子核桃种植区(27°07′67″N,104°64′61″E)采集核桃发病叶片,核桃品种为黔核七号。
1.1.2主要试剂马铃薯葡萄糖琼脂培养基(PDA)、真菌基因组DNA提取试剂盒E.Z.N.A®Fungal DNA Min Kit(美国Omega Bio-Tek公司)。引物ITS1/ITS4、Bt2a-F/Bt2b-R和TEF1-728F/TEF1-986R(重庆擎科生物技术有限公司)。供试药剂选用生产上常用的17种杀菌剂,详见表1。
1.2病原菌分离与纯化
参照方中达(2001)的组织分离法分离病原菌。将采集的叶片用自来水冲洗后,切取病健交界处5 mm×5 mm组织块。先将切取的组织块置于75%酒精漂洗1 min,随后用0.4%次氯酸钠溶液漂洗30 s,再用无菌水漂洗3次(每次1 min)。待组织块表面没有明显水珠后,将组织块放在PDA培养基上于28℃恒温培养箱中培养3d,待组织块周围长出菌丝后,挑取边缘菌丝接种于新的PDA培养基上进行纯化,直至得到单一菌落。
1.3病原菌致病性测定
采用菌丝饼法接种(陈业等,2021)。选取健康的核桃叶片,接种前用75%酒精漂洗1min,0.4%次氯酸钠溶液清洗30 s,然后用无菌水冲洗3次(每次1 minPmVOvtlDapvUzzh8sOx3HQ==)。将清洗后的叶片用无菌纸吸干表面水分,利用无菌接种针对叶片进行划伤处理,将直径5mm的病原菌菌饼接种于消毒后的叶片上,以接种无菌PDA培养基饼的叶片为对照,每张叶片接种3个病原菌菌饼,随后用无菌脱脂棉保湿,于恒温培养箱中28℃、相对湿度80%条件下培养,8 d后观察叶片发病情况。根据柯赫氏法则,将接种后发病的核桃叶片进行病原菌分离培养,观察分离获得的菌株与原始菌株的培养性状和形态特征是否一致。
1.4病原菌形态学鉴定
将分离纯化得到的病原菌菌丝接种于PDA培养基上,置于恒温培养箱中28℃培养7d,观察菌落颜色、形态等培养性状,并在Nikon Digital Sight 10显微镜下观察菌落的孢子形态特征。
1.5病原菌分子生物学鉴定
选取纯化接种5 d的病原菌,刮取菌丝体,用真菌基因组DNA提取试剂盒提取病原菌的基因组DNA,将得到的DNA保存于-20℃冰箱。利用ITS1/ITS4、Bt2a-F/Bt2b-R和TEF1-728F/TEF1-986R引物分别对ITS、β-tubulin和TEF1-α基因序列进行扩增,引物类型及序列见表2。扩增体系25.0μL:DNA模板1.0μL,正、反向引物各1.0μL,2×Taq Master Mix 12.5μL,ddH2O 9.5μL。扩增程序:94℃预变性3min;94℃45 s,(ITS:56℃;β-tubulin:53℃;TEF1-α:46℃)45 s,72℃1 min,进行35个循环;72℃延伸10 min。将获得的PCR扩增产物送至擎科生物(重庆)技术有限公司进行测序。最后获得的序列在GenBank中进行比对分析。按照ITS-β-tubulin-TEF1-α进行序列拼接,并用MEGA 7.0以Neighbor-Joining法构建系统发育进化树。
1.6病原菌生物学特性测定
采用单因子变量法测定病原菌的生物学特性。1.6.1不同温度对病原菌菌丝生长、产孢量和孢子萌发率的影响参照Fan等(2023)的方法,使用无菌打孔器(直径5mm)打取菌饼,利用无菌接种针将菌饼接种到PDA培养基中央,分别置于5、10、15、20、25、30和35℃下进行培养,每处理3次重复。培养8 d后,采用十字交叉法测量菌落直径。从培养8 d的菌落边缘挑取10个直径为5mm的菌饼,置于10 mL离心管中,涡旋30min,移液枪吸取菌液于血球计数板,显微镜下统计孢子产生量及孢子萌发率,并进行显著性检验。
产孢量=(X·N·104)/nπr2
式中,X为稀释倍数,N为血球计数板中5中格内的孢子总数,n为打孔菌饼数,r为打孔器内径(曹伟平等,2022)。
1.6.2不同光照对病原菌菌丝生长、产孢量和孢子萌发率的影响设置不同光周期(光照∶黑暗)6 h∶18 h、10 h∶14 h、14 h∶10 h和18 h∶6 h处理,每处理3次重复。菌落直径、产孢量和孢子萌发率测定方法与1.6.1相同。
1.6.3不同碳源、氮源对病原菌菌丝生长、产孢量和孢子萌发率的影响以察氏培养基为基础,将蔗糖分别用等量葡萄糖、麦芽糖、可溶性淀粉、D-果糖和乳糖替代,制成不同碳源培养基,每个碳源处理3次重复。以察氏培养基为基础,将硝酸钠分别用等量硫酸铵、牛肉膏、蛋白胨、甘氨酸和尿素替代,制成不同氮源培养基,每个氮源处理3次重复。菌落直径、产孢量和孢子萌发率测定方法与1.6.1相同。
1.6.4不同湿度对病原菌孢子萌发率的影响将分生孢子悬液(1×105分生孢子/mL)涂布在玻片上,用无菌空气干燥,置于封闭的培养皿中。参照杨迪等(2021)的方法分别将相对湿度设置为50%、60%、70%、80%和90%,于28℃黑暗培养24 h后显微镜下观察并计算孢子萌发率。每个湿度处理3次重复。
1.7病原菌防治药剂室内筛选试验
采用菌丝生长速率法测定17种供试杀菌剂的抑菌活性。用直径为5mm的打孔器在活化培养5d的病原菌菌落边缘打取菌饼,并接种至含不同浓度供试杀菌剂的PDA培养基中心,以含等量无菌水的PDA培养基为对照,置于28℃恒温箱中培养,8 d后采用十字交叉法测量菌落直径,按照菌落平均直径计算杀菌剂对菌丝生长的抑制率。以药剂有效浓度对数值为自变量(x),抑制率的几率值为因变量(y),计算毒力回归方程y=ax+b和相关系数(r),由毒力回归方程计算抑制中浓度(EC50)(金程凡,2014)。
抑制率(%)=(对照菌落平均直径-处理菌落平均直径)/对照菌落平均直径×100
1.8统计分析
利用Excel 2010进行数据统计,采用SPSS 26.0以单因素方差分析法进行数据分析,运用Duncan’s新复极差法进行显著性检验,DPS 7.05分析抑菌率和EC50。
2结果与分析
2.1核桃叶斑病病原菌分离纯化结果
核桃叶斑病多发生在7—8月,病害最初从叶尖和叶缘开始,形成圆形或近圆形的褐色至黑褐色坏死斑,严重时病斑逐渐向内扩展连成片,造成叶片大面积坏死和焦枯。经组织分离法从核桃病叶上分离获得18株真菌分离物(图1),其中,C1~C13共13株分离物的孢子形态与感病叶片上挑取的孢子形态相似,将13株分离菌进行分子生物学鉴定,鉴定结果13株分离菌均为同种菌株。对13株疑似病原菌分离物进行致病性检测,发现13株接种菌株均能使健康核桃叶片发病且与田间发病症状一致,其中C5在核桃叶片上发病特征最明显,因此选取菌株C5进行后续研究。
2.2菌株C5的形态特征
将分离纯化菌株C5接种到PDA培养基上,于28℃恒温培养箱中培养,观察菌株菌落颜色、形态等培养性状。菌株生长7 d后,菌落正面呈米黄色,菌丝疏松,棉絮状,背面呈淡黄色;显微镜下观察菌丝分生孢子为单生,呈纺锤形或镰刀形,分生孢子内有2~3个分隔,形态稍弯曲,大小为22.0~36.3μm×1.8~2.5μm(图2)。菌株C5的菌落颜色、分生孢子大小及形态特征等与Xia等(2019)描述的镰孢属(Fusarium sp.)基本一致,因此初步鉴定核桃叶斑病病原菌为镰孢属。
2.3病原菌致病性测定结果
采用菌丝饼法将菌株C5接种到健康的核桃叶片上,于28℃、相对湿度80%的恒温培养箱中培养8 d后,在核桃叶片上可观察到有明显的发病症状,且发病症状与田间症状一致(图3)。将接种后发病核桃叶片进行再分离培养,分离所得菌株与原接种菌株的培养性状和形态特征相同,表明接种菌株即为核桃叶斑病病原菌。
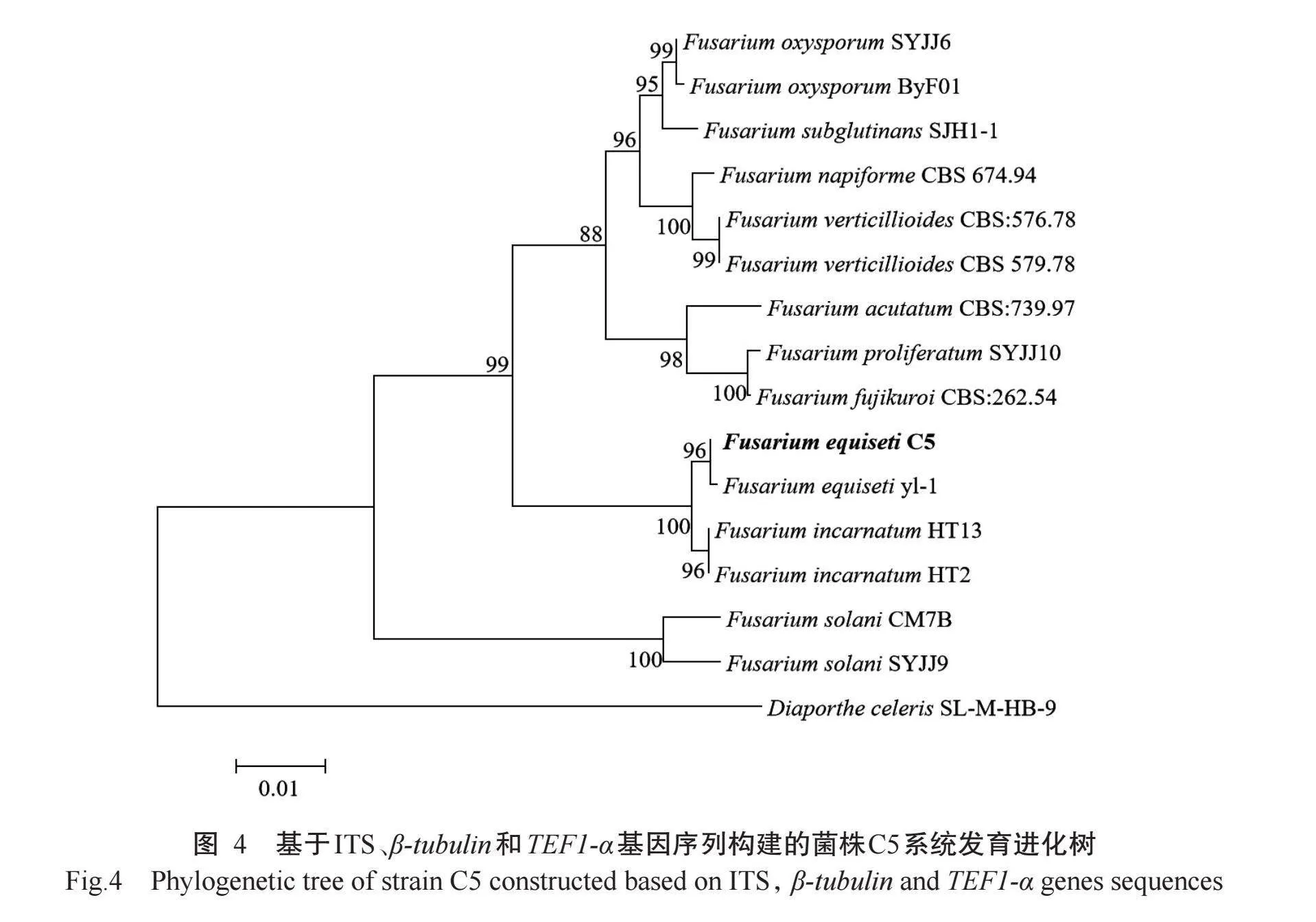
2.4病原菌分子生物学鉴定结果
以菌株C5的基因组DNA为模板,用ITS1/ITS4、Bt2a-F/Bt2b-R和TEF1-728F/TEF1-986R引物对菌株C5进行ITS、β-tubulin和TEF1-α基因序列扩增并测序,得到大小分别为553、318和200 bp的片段。将ITS、β-tubulin和TEF1-α基因序列提交至GenBank数据库获得登录号分别为PP086706、PP178577和PP178650。BLAST同源性比对结果显示,ITS区域与NR_121457.1的相似性为99.25%,β-tubulin与MN128582.1的相似性为100%,TEF1-α与MN128581.1的相似性为100%。基于ITS、β-tubulin和TEF1-α基因序列构建系统发育进化树,结果(图4)显示,菌株C5与Fusarium equiseti yl-1聚为一支。结合形态学特征和系统发育分析将菌株C5鉴定为木贼镰刀菌(F.equiseti)。
2.5病原菌生物学特性测定结果
2.5.1不同温度对菌株C5菌丝生长、产孢量和孢子萌发率的影响由表3可知,菌株C5菌丝在5~30℃均能正常生长,其中在20和25℃下生长最好,菌落平均直径达6.47和6.53 cm,与其他温度处理差异显著(P<0.05,下同);30℃时产孢量最多,为1.26×107个/mL,显著高于其他温度处理;10℃时孢子萌发率最高,为20.52%;35℃时菌丝不能生长和产孢。
2.5.2不同光照对菌株C5菌丝生长、产孢量和孢子萌发率的影响由表4可知,光周期为10h∶14 h、14 h∶10 h和18h∶6 h时加速了菌株C5菌丝的生长,与6h∶18 h处理相比差异显著,其中以18h∶6 h菌丝生长最好;光周期为18h∶6 h时能增加菌株C5的产孢量,与其他处理相比差异显著;而光周期6h∶18 h和14h∶10 h时能提高菌丝的孢子萌发率。
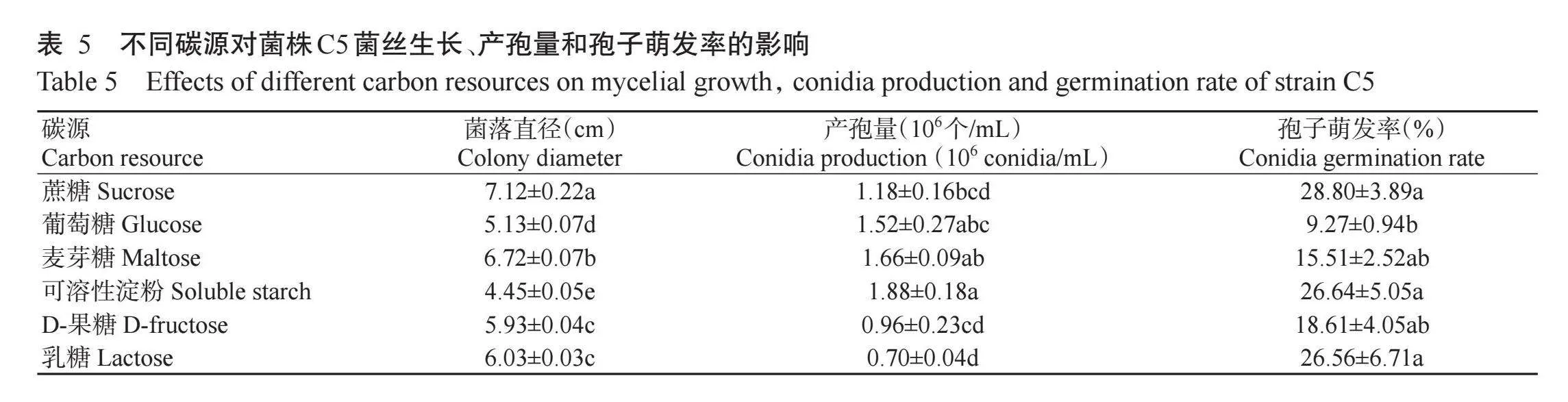
2.5.3不同碳源对菌株C5菌丝生长、产孢量和孢子萌发率的影响由表5可知,以蔗糖为碳源时最有利于菌株C5的菌丝生长,菌落直径达7.12 cm,其次是麦芽糖,菌落直径为6.72 cm;当以可溶性淀粉、麦芽糖和葡萄糖为碳源时菌丝产孢量较多,且与乳糖处理差异显著;6种碳源中,相比于葡萄糖,可溶性淀粉、乳糖和蔗糖能显著提高菌株C5的孢子萌发率。
2.5.4不同氮源对菌株C5菌丝生长、产孢量和孢子萌发率的影响由表6可知,菌株C5以牛肉膏为氮源时最有利于菌丝生长,菌落直径达6.62 cm;当氮源为牛肉膏时,相比蛋白胨、甘氨酸和尿素能显著增加菌株C5的产孢量;在6种氮源中,相比于硝酸钠,牛肉膏、甘氨酸和尿素可显著提高菌株C5的孢子萌发率。
2.5.5不同湿度对菌株C5孢子萌发率的影响由表7可知,在5种湿度条件下,湿度为70%时菌株C5的孢子萌发率最高,与湿度50%处理差异显著。
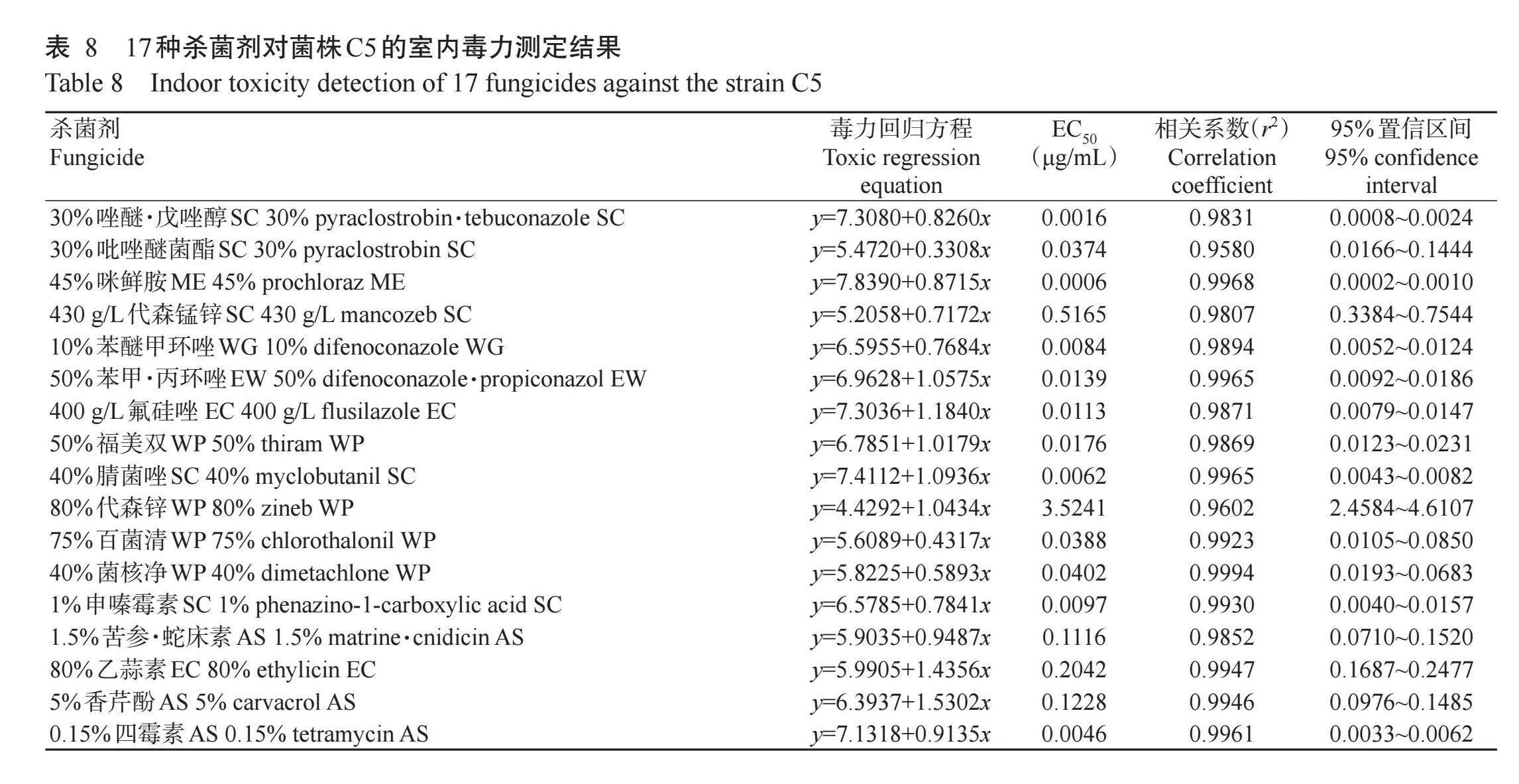
2.6病原菌防治药剂室内筛选结果
杀菌剂对核桃叶斑病病原菌的室内毒力测定结果(表8)显示,不同杀菌剂对菌株C5均有一定毒力,对菌株C5菌丝生长均有不同程度的抑制作用,其中45%咪鲜胺ME、30%唑醚·戊唑醇SC、0.15%四霉素AS、40%腈菌唑SC、10%苯醚甲环唑WG和1%申嗪霉素SC的抑菌效果最好,EC50均小于0.0100μg/mL,分别为0.0006、0.0016、0.0046、0.0062、0.0084和0.0097μg/mL;其次是400 g/L氟硅唑EC、50%苯甲·丙环唑EW、50%福美双WP、30%吡唑醚菌酯SC、75%百菌清WP和40%菌核净WP,EC50介于0.0100~0.1000μg/mL;1.5%苦参·蛇床素AS、5%香芹酚AS、80%乙蒜素EC和430 g/L代森锰锌SC的EC50介于0.1000~1.0000μg/mL;80%代森锌WP的抑菌效果相比其他16种杀菌剂差,EC50为3.5241μg/mL。
3讨论
镰孢菌种类繁多,且该属的真菌形态相似,小孢子种间序列相似性较高,需多种方法相结合才能进行准确鉴定(魏敏等,2023)。本研究结合形态学特征和分子生物学方法,利用ITS、β-tubulin和TEF1-α基因序列分析,对核桃叶斑病病原菌进行鉴定,明确该病害的病原菌为木贼镰刀菌。木贼镰刀菌能侵染多种作物引起病害,阻碍多种相关产业发展,如可侵染引起大豆软腐病(Gally et al.,1998)、青稞叶斑病(赵鹏,2013)、山核桃枯萎病(Lazarotto et al.,2014)、薄叶二行芥叶斑病(Garibaldi et al.,2015)、短穗鱼尾葵叶斑病(Ashfaq et al.,2017)、柳枝稷叶斑病(Jia et al.,2020)和苦瓜叶斑病(Rehman et al.,2023)等。本研究首次从西南地区的核桃叶斑病病叶中分离鉴定出其病原菌为木贼镰刀菌。
对菌株C5的生物学特性测定结果表明,核桃叶斑病菌木贼镰刀菌菌丝在5~30℃均可生长,最适生长温度为20~25℃,与赵鹏(2013)的研究结果一致;当温度为30℃时,菌丝产孢量最高,与王乐等(2023)的研究结果一致;光周期为18 h∶6 h时菌株C5的产孢量最高,而光周期为6h∶18 h时孢子萌发率最大,与王晓敏等(2013)报道光照有利于木贼镰刀菌菌丝生长,交替光照能促进菌丝生长的结论一致;在6种碳源和氮源中,菌株C5菌丝均能生长,最适碳源为蔗糖,相比于葡萄糖为碳源,可溶性淀粉、乳糖和蔗糖能显著提高菌株C5的孢子萌发率,与秦云霞等(2017)的研究结果一致;最适氮源为牛肉膏,相比硝酸钠为氮源,牛肉膏、甘氨酸和尿素可显著提高菌株C5的孢子萌发率,与张富美等(2022)的研究结果相似。
明确杀菌剂对靶标菌的毒力,对于选择靶标作物的防治药剂具有重要的参考价值(王丽等,2023;于世成等,2023)。本研究测定了17种杀菌剂对核桃叶斑病病原菌的室内抑菌活性,结果表明,45%咪鲜胺ME的抑菌效果最好,EC50最小,与周洁璐等(2023)研究发现咪鲜胺对共享镰孢菌、茶藨子葡萄座腔菌和灰葡萄孢的毒力最强相似;其次是30%唑醚·戊唑醇SC、0.15%四霉素AS、40%腈菌唑SC、10%苯醚甲环唑WG和1%申嗪霉素SC。45%咪鲜胺ME、30%唑醚·戊唑醇SC、0.15%四霉素AS、40%腈菌唑SC和10%苯醚甲环唑WG均属于低毒杀菌剂,其中咪鲜胺为咪唑类杀菌剂,唑醚·戊唑醇、腈菌唑和苯醚甲环唑属于三唑类杀菌剂,其作用机制均为通过抑制病原菌细胞膜上麦角甾醇的去甲基化,使得病原菌无法形成细胞膜,从而抑制病原菌正常生长;而四霉素由大环内酯类、肽嘧啶核苷酸类和含氮杂环芳香族抗生素等组成,既能高效防控叶斑病在内的多种植物病害,又能提高作物免疫力(崔文艳等,2023)。在今后的核桃叶斑病防治中,为了防止长期使用单一药剂产生抗药性,可交替或混合使用咪鲜胺、唑醚·戊唑醇、腈菌唑和苯醚甲环唑,以达到良好的防治效果,也可单独使用四霉素或申嗪霉素生物农药对其进行防治。大田环境中杀菌剂对核桃叶斑病的防控效果有待进一步试验验证。
4结论
引起贵州省毕节市赫章县核桃种植区叶斑病的病原菌为木贼镰刀菌,可首选45%咪鲜胺ME或0.15%四霉素AS防治该病害,30%唑醚·戊唑醇SC、40%腈菌唑SC、10%苯醚甲环唑WG和1%申嗪霉素SC可作为备选药剂。
参考文献(References):
曹荣.2023.核桃褐斑病防治效果试验[J].现代农村科技,(3):86-87.[Cao R.2023.Experiment on control effect of walnut brown spot disease[J].XiandaiNongcun Keji,(3):86-87.]doi:10.3969/j.issn.1674-5329.2023.03.063.
曹伟平,甄伟,陈丹,丰硕,宋健.2022.生长调节剂对球孢白僵菌产孢和分生孢子性能的影响[J].中国生物防治学报,38(3):555-564.[Cao W P,Zhen W,Chen D,Feng S,Song J.2022.Influence of plant growth regulators on sporulation and conidia characteristics of the entomopatho-genic fungus Beauveria bassiana[J].Chinese Journal of Biological Control,38(3):555-564.]doi:10.16409/j.cnki.2095-039x.2021.05.022.
陈业,袁盛勇,梁文凯,李芝丽,刘峻秀,张红丽,孔琼.2021.莲雾灰斑病病原菌鉴定及室内药剂筛选[J].中国植保导刊,41(10):24-29.[Chen Y,Yuan S Y,Liang W K,Li Z L,Liu J X,Zhang H L,Kong Q.2021.Pathogen identifica-tion and fungicides screening for grey spot of Syzygiumsamarangense[J].China Plant Protection,41(10):24-29.]doi:10.3969/j.issn.1672-6820.2021.10.004.
崔文艳,罗喜燕,吴小云,陈永超,李明伟,彭玲,何朋杰.2023.贵州省金银花白粉病病原鉴定、生物学特性及防治药剂筛选[J].南方农业学报,54(6):1711-1719.[Cui WY,Luo X Y,Wu X Y,Chen Y C,Li M W,Peng L,He P J.2023.Identification and biological characteristics of hon-eysuckle powdery mildew pathogen and screening of fun-gicide in Guizhou[J].Journal of Southern Agriculture,54(6):1711-1719.]doi:10.3969/j.issn.2095-1191.2023.06.012.
崔潇.2023.东平县核桃产业调查与分析[J].中国果业信息,40(6):21-23.[Cui X.2023.Survey and analysis of wal-nut industry in Dongping County[J].China Fruit News,40(6):21-23.]doi:10.3969/j.issn.1673-1514.2023.06.004.
方中达.2001.植病研究方法[M].第3版.北京:中国农业出版社:122-125.[Fang Z D.2001.Plant disease research method[M].The 3rd Edition.Beiiing:China Agricultural Press:122-125.]
冯贞,方晓璞.2018.核桃加工副产物综合利用途径[J].中国油脂,43(9):71-74.[Feng Z,Fang X P.2018.Comprehen-sive utilization ways of by-products from walnut proces-sing[J].China Oils and Fats,43(9):71-74.]doi:10.3969/j.issn.1003-7969.2018.09.015.
郭安柱,张力元,李岩,朱姝颖,唐光辉.2020.防治核桃黑斑病药剂筛选及田间药效试验[J].西北林学院学报,35(1):177-182.[Guo A Z,Zhang L Y,Li Y,Zhu S Y,Tang G H.2020.Selection and field application of effective bac-tericides against walnut blight[J].Journal of Northwest Forestry University,35(1):177-182.]doi:10.3969/j.issn.1001-7461.2020.01.27.
韩敏,闫军,陈九方,蒋萍.2014.新疆核桃叶斑病病原菌的室内杀菌剂筛选及田间试验[J].新疆农业大学学报,37(1):60-64.[Han M,Yan J,Chen J F,Jiang P.2014.Screening of laboratory fungicide and field trials for Alter-nariaalternata leaf spot pathogen of walnut in Xinjiang[J].Journal of Xinjiang Agricultural University,37(1):60-64.]
贺占雪,泽桑梓,杨斌,赵宁.2019.云南主栽核桃品种对Phyllostictajuglandis叶斑病的抗性评价[J].浙江农业科学,60(11):1989-1992.[He Z X,Ze S Z,Yang B,Zhao N.2019.Evaluation of resistance to leaf spot caused by Phyllostictajuglandis of walnut cultivars in Yunnan Pro-vince[J].Journal of Zhejiang Agricultural Sciences,60(11):1989-1992.]doi:10.16178/j.issn.0528-9017.20191113.
黄雄,罗永飞,肖千文,朱鹏,蒲光兰,王琳莹,李元会,史丽会.2016.16种杀菌剂组合对核桃炭疽病和黑斑病的防控效果[J].湖南农业大学学报(自然科学版),42(6):631-634.[Huang X,Luo Y F,Xiao Q W,Zhu P,Pu G L,Wang L Y,Li Y H,Shi L H.2016.Field efficacy trial forsixteen fungicide groups against walnut anthracnose and black spot[J].Journal of Hunan Agricultural University(Natural Sciences),42(6):631-634.]doi:10.13331/j.cnki.jhau.2016.06.009.
计雅男,贺海耘,张倩,杨洲,陈芮蝶,翟梅枝.2022.早实核桃杂交后代生长和叶绿素荧光特性比较研究[J].甘肃农业大学学报,57(1):114-122.[Ji Y N,He H Y,Zhang Q,Yang Z,Chen R D,Zhai M Z.2022.Comparison of growth and fluorescence characteristics of progeny of early bearing walnut hybrids[J].Journal of Gansu Agricultural University,57(1):114-122.]doi:10.13432/j.cnki.jgsau.2022.01.014.
金程凡.2014.油菜上链格孢菌的分离、鉴定、致病力比较及药剂筛选[D].长沙:湖南农业大学.[Jin C F.2014.Stu-dies on isolation,identification,virulence comparison andfungicide screening of pathogenic Alternaria on rapeseed[D].Changsha:Hunan Agricultural University.]
雷明山,杨世勇,王沛,黄亚萍.2015.10种杀菌剂防治核桃黑斑病的田间药效试验[J].山西果树,(5):9-10.[Lei M S,Yang S Y,Wang P,Huang Y P.2015.Field efficacy test of 10 fungicides against walnut black spot disease[J].Jour-nal of Fruit Resources,(5):9-10.]doi:10.16010/j.cnki.14-1127/s.2015.05.006.
秦云霞,卢基来,周慧珍,戚继艳,龙翔宇,方永军,唐朝荣.2017.橡胶树基腐病致病菌——木贼镰刀菌的分离及鉴定[J].农业科学,7(9):621-629.[Qin Y X,Lu J L,Zhou H Z,Qi J Y,Long X Y,Fang Y J,Tang C R.2017.Isola-tion and identification of Fusariuequiseti causing rubber tree stem rot[J].Journal of Agricultural Sciences,7(9):621-629.]doi:10.12677/hjas.2017.79084.
瞿佳,门欣,孙晓宇,赵玲侠,宁硕瀛,陈锐.2021.陕西核桃黑斑病病原菌鉴定及药剂防治研究[J].西北农业学报,30(3):452-461.[Qu J,Men X,Sun X Y,Zhao L X,Ning S Y,Chen R.2021.Study on identification of walnut blight pathogenic bacteria and its chemical control in Shaanxi Province[J].Acta AgriculturaeBoreali-occidentalis Sinica,30(3):452-461.]doi:10.7606/ji.ssn.1004-1389.2021.03.015.
孙超,郭亚慧,王梦宇,淡智鹏.2020.贵州核桃产业发展现状与策略:以赫章县为例[J].贵州农业科学,48(10):165-167.[Sun C,Guo Y H,Wang M Y,Dan Z P.2020.Deve-lopment status and strategy of walnut industry in Guizhou:Taking walnut industry in Hezhang County as an example[J].Guizhou Agricultural Sciences,48(10):165-167.]doi:10.3969/j.issn.1001-3601.2020.10.036.
唐佳佳,李秀珍,彭秀,周小舟,冯大兰.2023.重庆乡土核桃无性系坚果品质分析[J].西南大学学报(自然科学版),45(8):76-82.[Tang J J,Li X Z,Peng X,Zhou X Z,Feng D L.2023.Analysis on nut quality of asexual lines of Chongqing local walnut(Juglans regia L.)[J].Journal ofSouthwest University(Natural Science Edition),45(8):76-82.]doi:10.13718/j.cnki.xdzk.2023.08.007.
王丽,田玉洁,刘巍,黄丽丽,秦虎强.2023.21种化学药剂对猕猴桃黑点病菌(Diaporthephaseolorum)的室内毒力及田间防效[J].西北农业学报,32(5):772-780.[Wang L,Tian Y J,Liu W,Huang L L,Qin H Q.2023.Toxicity of 21 chemical fungicides against Diaporthephaseolorum of kiwifruit and fielo control effectiveness[J].Acta Agricul-turaeBoreali-Occidentalis Sinica,32(5):772-780.]doi:10.7606/j.issn.1004-1389.2023.05.013.
王乐,张园园,王娜,赵君,林克剑.2023.紫花苜蓿12种镰刀菌的菌落生长和产孢条件[J].中国草地学报,45(6):103-116.[Wang L,Zhang Y Y,Wang N,Zhao J,Lin K J.2023.Colonial growth and sporulation conditions of 12 Fusarium spp.in alfalfa[J].Chinese Journal of Grassland,45(6):103-116.]doi:10.16742/j.zgcdxb.20220233.
王晓敏,张燕,龚德勇.2013.贵州续随子立枯病病原菌鉴定及生物学特性研究[J].广东农业科学,40(15):93-95.[Wang X M,Zhang Y,Gong D Y.2013.Study on identifi-cation and biological characterization ofFusariumequiseti Corda Sacc.from Euphorbia lathyris[J].Guangdong Agri-cultural Sciences,40(15):93-95.]doi:10.16768/j.issn.1004-874x.2013.15.034.
魏敏,孙晓东,王亚强,庞强强,周曼,李申,陈家路.2023.树仔菜枯萎病的病原鉴定及防治药剂筛选[J].中国植保导刊,43(6):10-14.[Wei M,Sun X D,Wang Y Q,Pang Q Q,Zhou M,Li S,Chen J L.2023.Solation and identifica-tion of the pathogen ofFusarium wilt of Sauropus andro-gynus and fungicides screening[J].China Plant Protection,43(6):10-14.]doi:10.3969/j.issn.1672-6820.2023.06.002.
吴天昊,翟敏,胡龙娇,宣继萍,巨云为,何姣.2022.薄壳山核桃叶斑病病原鉴定[J].中国森林病虫,41(2):16-23.[Wu T H,Zhai M,Hu L J,Xuan J P,Ju Y W,He J.2022.Patho-gen identification of leaf spot of Carya illinoinensis[J].Forest Pest and Disease,41(2):16-23.]doi:10.19688/j.cnki.issn 1671-0886.20220005.
席军强,吕娥娥,李建龙,刘文强,冯华.2022.核桃黑斑病病原菌的生物学特性研究[J].防护林科技,(4):55-57.[Xi J Q,LüE E,Li J L,Liu W Q,Feng H.2022.Study on bio-logical characteristics of walnut black spot pathogen[J].Protection Forest Science and Technology,(4):55-57.]doi:10.13601/j.issn.1005-5215.2022.04.016.
杨迪,杜婵娟,叶云峰,张晋,潘连富,张欣,付岗.2021.广西香蕉煤污病病原菌的分离鉴定及其生物学特性[J].植物病理学报,51(4):507-514.[Yang D,Du C J,Ye Y F,Zhang J,Pan L F,Zhang X,Fu G.2021.Isolation,identifi-cation and characterization of the pathogen causing banana sooty blotch in Guangxi[J].Acta PhytopathologicaSinica,51(4):507-514.]doi:10.13926/j.cnki.apps.000720.
杨莉,杨双昱,麻文建,周建华.2017.核桃褐斑病病原菌的分离鉴定和发病规律的调查[J].林业科学研究,30(6):1004-1008.[Yang L,Yang S Y,Ma W J,Zhou J H.2017.Identification of pathogen of walnut brown spot and inves-tigation of the disease occurrence[J].Forest Research,30(6):1004-1008.]doi:10.13275/j.cnki.lykxyj.2017.06.017.杨玉婷,王华磊,李金玲,罗春丽,陈松树,李丹丹,刘红昌,罗
夫来,黄明进.2021.赫章核桃与半夏间作对半夏矿质元素含量的影响[J].特产研究,43(3):59-64.[Yang Y T,Wang H L,Li J L,Luo C L,Chen S S,Li D D,Liu H C,Luo F L,Huang M J.2021.Effects of intercropping of Hezhang Juglans regia and Pinelliaternata on the content of mineral elements in Pinelliaternata[J].Special Wild Economic Animal and Plant,43(3):59-64.]doi:10.16720/j.cnki.tcyj.2021.064.
于春彦,雷玲,郝俊梅,王秀峰,于艳良,孙淑娟.2023.浅析赞皇县核桃产业的可持续发展——由果园变耕地说起[J].果农之友,(7):106-108.[Yu CY,Lei L,Hao J M,Wang X F,Yu Y L,Sun S J.2023.Analyzing the sustainable deve-lopment of walnut industry in Zanhuang County—Starting from the orchard into arable land[J].Fruit Growers’Friend,(7):106-108.]doi:10.3969/j.issn.1671-7759.2023.07.035.
于世成,修志君,白松林,班瑞娟,徐林波,王凤梧,王千军,李云霞,张笑宇.2023.杀菌剂对燕麦炭疽病菌的毒力和田间防效[J].河南农业科学,52(12):97-106.[Yu S C,Xiu Z J,Bai S L,Ban R J,Xu L B,Wang F W,Wang Q J,Li Y X,Zhang X Y.2023.Evaluation of toxicity and field con-trol effect of different fungicides against oat anthracnose[J].Journal of Henan Agricultural Sciences,52(12):97-106.]doi:10.15933/j.cnki.1004-3268.2023.12.011.
张富美,罗妮星,尚晓静,侯瑞.2022.树莓叶斑病病原菌鉴定及其生物学特性分析[J].分子植物育种,20(18):6216-6225.[Zhang F M,Luo N X,Shang X J,Hou R.2022.Pathogen identification and biological characteristics of raspberry leaf spot[J].Molecular Plant Breeding,20(18):6216-6225.]doi:10.13271/j.mpb.020.006216.
张黎丽,杜安琪,王欣艺,李金宝,于海洋,刘祎良,周敏,孔心茹,徐娜.2019.核桃青皮乙醇提取物的抑菌效果测定[J].农业科学,9(10):980-984.[Zhang L L,Du AQ,Wang X Y,Li J B,Yu H Y,Liu Y L,Zhou M,Kong X R,Xu N.2019.The antibacterial effect of the alcoholic extract from walnut green peel[J].Scientia AriculturaSinica,9(10):980-984.]doi:10.12677/HJAS.2019.910137.
张亭,杜倩,李勇.2018.核桃的营养成分及其保健功能的研究进展[J].中国食物与营养,24(7):64-69.[Zhang T,Du Q,Li Y.2018.Nutritional component and health func-tions of walnuts[J].Food and Nutrition in China,24(7):64-69.]
赵鹏.2013.一种青稞叶斑病病原的分离鉴定及生物学特性研究[D].西宁:青海大学.[Zhao P.2013.A kind of bar-ley leaf spot pathogen isolation and identification of bio-logical characteristics research[D].Xining:Qinghai Uni-versity.]
周洁璐,吴天昊,巨云为,杨旭涛,梁甜,朱海军.2023.薄壳山核桃叶斑病病原菌生物学特性及室内药剂毒力测定[J].浙江农林大学学报,40(5):1018-1025.[Zhou J L,Wu T H,Ju Y W,Yang X T,Liang T,Zhu H J.2023.Biological characteristics and toxicity test of the pathogen of Carya illinoinensis leaf spot[J].Journal of Zhejiang A&F Uni-versity,40(5):1018-1025.]doi:10.11833/j.issn.2095-0756.20230029.
Ashfaq M,Anjum M A,Hafeez R,Ali A,Haider M S,Ali M,Chattha M B,Ahmad,Ahmad F S,Khan F,Sajjad M.2017.First report ofFusariumequiseti causing brown leafspot of fishtail palm(Caryota mitis)in Pakistan[J].PlantDisease,101(5):840.doi:10.1094/PDIS-11-16-1585-PDN.
Fan R D,Liu Y J,Bin Y L,Huang J Y,Yi B L,Tang X L,Li YX,Cai Y,Yang ZY,Yang M X,Song J H,Pan Q,lN/7Y7xvsJQwgDhfU7MjL+cdbt0JBuuJtXESokwM5qg=Liu Z L,Ghani M I,Hu X J,Chen X Y L.2023.Identification ofColletotrichum aenigma as the new causal agent of leafblight disease on Aucuba japonica Thunb.,and screenings of effective fungicides for its sustainable management[J].Frontiers in Microbiology,14:1222844.doi:10.3389/fmicb.2023.1222844.
Gally T,González B,Sobero Y Rojo M P,Lori G.1998.Plu-mele softrot caused by Fusarium equiseti,F.oxysporum,and F.pallidoroseum on soybean seedlings in Argentina[J].Plant Disease,82(9):1063.doi:10.1094/pdis.1998.8 2.9.1063a.
Garibaldi A,Gilardi G,Ortu G,Gullino M L.2015.First report of leaf spot of wild rocket(Diplotaxis tenuifolia)caused by Fusarium equiseti in Italy[J].Plant Disease,99(8):1183.doi:10.1094/PDIS-11-14-1169-PDN.
Jia C L,Wang Y H,Liu M J,Li S X,Zhang W H.2020.First report of leaf spot caused by Fusarium equiseti on Switch-grass in Shandong,China[J].Plant Disease,104(11):3074.doi:10.1094/PDIS-04-20-0873-PDN.
Lazarotto M,Muniz M F B,Dos Santos R F,Blume E,Hara-kawa R,Hamann F A.2014.First report ofFusariumequi-seti associated on pecan(Carya illinoinensis)seeds in Brazil[J].Plant Disease,98(6):847.doi:10.1094/PDIS-09-13-0976-PDN.
Rehman A U,RaufA,Ali A,Shakeel M T,Naqvi S A H,Sha-hid M R,Umar U U D.2023.First report of Fusarium equiseti causing leaf spots of bitter gourd(Momordica charantia)in Pakistan[J].Plant Disease,107(2):584-584.doi:10.1094/PDIS-04-22-0786-PDN.
Wang F F,Dun C Y,Tang T,Guo X L,Duan Y M,You J M.2022.Boeremia exigua causes leaf spot of walnut trees(Juglans regia)in China[J].Plant Disease,106(7):1993.doi:10.1094/PDIS-10-21-2304-PDN.
Wei X,Yang S Q,Jiang Z G,Cui M J,Deng J X,Zhang Y.2022.Colletotrichum juglandissp.nov.(Ascomycota:Glo-merellaceae)associated with walnut leaf spot in China[J].Phytotaxa,556(3):256-268.doi:10.11646/phytotaxa.556.3.2.
Xia J W,Sandoval-Denis M,Crous P W,Zhang X G,Lombard L.2019.Numbers to names-restyling the Fusarium incar-natum-equiseti species complex[J].Persoonia,43:186-221.doi:10.3767/persoonia.2019.43.05.
Zarei S,Taghavi S M,Banihashemi Z,Hamzehzarghani H,Osdaghi E.2019.Etiology of leaf spot and fruit canker symptoms on stone fruits and nut trees in Iran[J].Journal of Plant Pathology,101:1133-1142.doi:10.1007/s42161-019-00283-w.
(责任编辑麻小燕)
