龙眼DlSWC5基因克隆、亚细胞定位及表达特性分析
2024-10-15申序牟东岭周金忠郭萍陶平黄会张春渝林玉玲赖钟雄








摘要:【目的】克隆龙眼ATP依赖的染色质重塑相关基因DlSWC5,并分析其亚细胞定位及表达特性,为研究该基因在龙眼生长发育及早期体胚发生过程中的调控功能提供理论依据。【方法】以龙眼品种红核子体胚发生早期胚性愈伤组织(Embryogenic callus,EC)为试验材料,结合龙眼三代基因组数据,采用RT-PCR克隆DlSWC5基因cDNA序列,对其进行生物信息学分析,基于STRING数据库预测DlSWC5蛋白互作调控网络,并通过激光扫描共聚焦试验验证蛋白亚细胞定位情况。分别利用转录组测序技术和实时荧光定量PCR检测DlSWC5基因在体胚发生早期和不同组织及不同浓度吲哚乙酸(IAA)处理下EC中的表达情况。【结果】成功克隆出DlSWC5基因的cDNA序列,与基因组中DlSWC5基因CDS序列相似性达99.80%,共编码340个氨基酸残基,该蛋白不含信号肽和跨膜结构,共含有44个磷酸化位点,分子式为C1622H2599N459O542S8,相对分子质量为37458.71 Da,理论等电点(pI)为5.74。DlSWC5蛋白结构的预测结果显示,其二级结构包含48.53%的α-螺旋、40.29%的无规则卷曲、6.47%的延伸链、4.71%的β-转角,其三级结构与漾濞槭同源蛋白高度一致。蛋白互作预测结果显示,DlSWC5蛋白与PIE1、SWC2、SWC4等10个蛋白互作。亚细胞定位显示DlSWC5蛋白定位于细胞核中。DlSWC5基因的相对表达量在早期体细胞胚胎发生中无明显差异。DlSWC5基因在体胚发生早期及种子、根、茎、叶、花蕾、花、果皮、果肉、幼果等组织中均检测到表达,与对照组(0 mg/L)相比,DlSWC5基因的相对表达量在0.5、1.0、1.5和2.0 mg/L IAA处理24 h后均显著降低(P<0.05)。【结论】成功克隆了DlSWC5基因,其编码蛋白为不稳定的亲水性蛋白,呈酸性,定位于细胞核;DlSWC5基因在龙眼体胚发生早期EC阶段被IAA诱导下调表达。
关键词:龙眼;DlSWC5基因;亚细胞定位;表达特性;体胚发生;吲哚乙酸
中图分类号:S667.2文献标志码:A文章编号:2095-1191(2024)07-2137-11
Cloning,subcellular localization and expression characteriza⁃tion of DlSWC5 gene in longan(Dimocarpus longan Lour.)
SHEN Xu MOU Dong-ling ZHOU Jin-zhong GUO Ping TAO Ping HUANG Hui ZHANG Chun-yu LINYu-ling ,LAI Zhong-xiong
(1Economic Crops Workstation of Bijie City in Guizhou Province,Bijie,Guizhou 551700,China;2Institute of Horticul-tural Biotechnology,Fujian Agriculture and Forestry University,Fuzhou,Fujian 35000 China)
Abstract:【Objective】DlSWC5,a gene related to the ATP-dependent chromatin remodeling in longan(Dimocarpus longan Lour.),was cloned,and its subcellular localization and expression characterization were analyzed,to provide theoretical basis for investigating the regulatory function of this gene during the growth and development,and early stage of somatic embryogenesis process in longan.【Method】Embryogenic callus(EC)of the early stage of somatic embryogene-sis(SE)of longan variety Honghezi was used as primary experimental materials in this study,in combination with three generations of longan genome data,cloned the cDNA sequence of longanDlSWC5 gene by RT-PCR,conducted the bioin-formatics analysis,predicted the interaction regulation network of DlSWC5 protein based on STRING database,and veri-fied protein subcellular localization by laser scanning confocal experiment.Transcriptome sequencing and real-time fluo-rescence quantitative PCR were respectively used to detect the expression of DlSWC5 gene in the early stage of somatic embryogenesis and different tissues,and in EC under different auxin(IAA)concentration treatments.【Result】The cDNA sequence of DlSWC5 gene was cloned,which existing 99.80%similarity with CDS sequence of DlSWC5 gene in longan genome,and encoded 340 amino acid residues.DlSWC5 protein,without signal peptide and transmembrane structure,contained a total of 44 phosphorylation sites,its molecular formula was C1622H2599N459O542S8,its relative molecular weight was 37458.71 Da,its isoelectric point(pI)was 5.74.The predicted result of DlSWC5 protein structure showed that its se-condary structure contained 48.53%α-helix,40.29%random coil,6.47%extended strand and 4.71%β-turn,and itster-tiary structure was highly consistent with the homologous protein ofAceryangbiense.The prediction of protein interaction showed that DlSWC5 protein could interact with 10 proteins such as PIE SWC2 and SWC4.Subcellular localization showed that DlSWC5 protein was located in the nucleus.There was no obvious difference in the relative expression level of DlSWC5 gene during the early stage of somatic embryogenesis in longan.The expression of DlSWC5 gene was detected in the early stage of somatic embrgenesis and seeds,roots,stems,leaves,buds,flowers,pericarp,pulp and young fruits.Compared with the control group(0 mg/L),the relative expression level of DlSWC5 gene was significantly de-creased under 0.5,1.0,1.5 and 2.0 mg/L IAA treatments for 24 h(P<0.05).【Conclusion】DlSWC5 gene has been suc-cessfully cloned,and its encoded protein is unstable hydrophilic protein,which is acidic and localized in the nucleus.The expression of DlSWC5 gene is down-regulated by IAA induction in EC stage of the early stage of somatic embrgenesis.
Key words:longan(Dimocarpus longan Lour.);DlSWC5 gene;subcellular localization;expression characteriza-tion;somatic embrgenesis;auxin
Foundation items:National Natural Science Foundation of China(31572088,31672127);Fujian Plateau Discipline Construction Project(102/71201801101)
0引言
【研究意义】SWR1复合物蛋白5(SWR1-complex protein 5,SWC5)蛋白是Sick with RSC/Rat1(SWR1)染色质重塑复合物的一员,通过介导核小体中组蛋白变体H2A.Z与组蛋白H2A的交换来非共价改变DNA和八聚体的相互作用,并调控ATP依赖的染色质重塑过程来发挥生物学功能(Luk etal.,2010;Sun and Luk,2017)。龙眼(Dimocarpus longan Lour.)为无患子科(Sapindaceae)龙眼属(Dimocarpus)常绿木本植物,果肉中多糖、黄酮类、蛋白质和氨基酸等营养物质丰富(戴宏芬等,2010;黄岛平等,2010;董慧雪等,2014),因具有较高的食用和保健价值而被广泛栽植于世界各地(Matsumoto,2005;古小玲等,2008),已建立起优良的早期体细胞胚胎发生模式试验系统(赖钟雄和陈振光,1997),并完成最新三代基因组测序(Chen et al.,2023),龙眼体胚发生调控研究基础日益夯实。近年的研究揭示龙眼早期体胚发生可能是由组蛋白修饰(申序等,2019)、DNA甲基化(Chen et al.,2020)、染色质重塑(申序等,2022)、microRNA(Xu etal.,2023)等多种表观遗传调控机制共同参与调控的复杂过程。因此,克隆与龙眼染色质重塑密切相关的SWC5基因,分析DlSWC5基因在体胚发生早期的表达特性及其编码蛋白的分子特性和亚细胞定位,对进一步探究该基因在龙眼生长发育及早期体胚发生过程中的调控功能具有重要意义。【前人研究进展】SWC5蛋白,也称为YBR231C/AOR1蛋白,是SWR1 ATP依赖性染色质重塑复合物14个亚基中的一员(Wu et al.,2009),较早在酵母中完成纯化、鉴定和命名(Kroganetal.,2003)。随着研究的深入,酵母SWC5蛋白在越来越多的同源物种中被鉴定研究,尤其以在动物中的研究较多且命名形式多样,如在老鼠、鸡、果蝇中分别被命名为CP27、CENP-29和YETI(Messina et al.,2015),在斑马鱼中被命名为CFDP1(Itoh etal.,2021),在人类中被命名为CFDP1(Messina et al.,2015),相比较而言,在植物中的鉴定和命名比较简单一致,在拟南芥(March-Diaz and Reyes,2009;Gross,2021)、菠萝(Jakada et al.,2019)、番茄(Gross,2021)和龙眼(申序等,2023)等物种中均已进行了鉴定研究并统一命名为SWC5蛋白,龙眼中明确鉴定编码SWC5蛋白的SWC5基因是1个单拷贝基因。在生物进化史中SWC5蛋白具有高度进化保守性,植物SWC5蛋白(申序等,2023)与动物(Messina et al.,2015)和微生物(Huang et al.,2020)中同源蛋白近C端均存在一个BCNT-C结构域,且研究显示人类、牛、老鼠、斑马鱼、果蝇、拟南芥及酵母等生物中SWC5同源蛋白的C末端80个氨基酸残基的相似性达到45%(Messina et al.,2015)。SWC5蛋白的重要功能是参与介导催化ATP依赖的染色质重塑中核小体组蛋白H2A交换H2A.Z,以促进组蛋白H2A.Z的染色质沉积,这一过程中蛋白保守BCNT结构域发挥重要作用(Sun and Luk,2017),近年来在酵母中的持续研究加深了对SWC5参与组蛋白交换的分子作用机制的理解(Huang et al.,2020)。截至目前,有关SWC5蛋白参与植物生长发育、激素信号转导、胁迫应答等生物学过程中的研究较有限。在植物生长发育方面,已有研究表明拟南芥(Bonnard,2016)和番茄(Gross,2021)中swc5突变体开花提前,番茄swc5敲低系表现出果实较小、果实可溶性糖含量较低、结实率大大降低等表型(Gross,2021),菠萝SWC5基因在胚珠中显著表达、在萼片和果实中高表达(Jakada et al.,2019)。在植物逆境胁迫方面,菠萝SWC5基因在叶片和根中被NaCl处理诱导显著上调、被甘露醇诱导上调、被冷胁迫处理抑制下调,在叶片中被热胁迫处理诱导上调(Jakada et al.,2019),同样拟南芥swc5突变体表现出对盐胁迫敏感(Gross,2021)。此外,拟南芥(Bonnard,2016)、番茄(Gross,2021)swc5突变体显示对丁香假单孢菌(Pseudomonas syringaepv.tomato)侵染抗性显著增强。这些研究表明SWC5基因在植物生长发育和生物、非生物胁迫应答中发挥重要功能。而关于SWC5基因响应激素诱导及在植物体细胞胚胎发生中的调控功能研究更为罕见。【本研究切入点】SWC5蛋白在染色质重塑过程中扮演着重要角色,但其在植物中的研究仍然有限,其蛋白分子特性、功能作用尚待进一步研究。【拟解决的关键问题】参考基因组数据库,通过PCR克隆获得DlSWC5的全长基因,结合生物信息学方法分析DlSWC5蛋白分子特性,通过实时荧光定量PCR分析DlSWC5基因表达,并结合激光共聚焦蛋白亚细胞定位试验验证DlSWC5蛋白的亚细胞定位情况,推测其功能,为进一步开展DlSWC5基因在龙眼生长发育及早期体胚发生过程中的调控功能研究提供理论依据。
1材料与方法
1.1试验材料
长期继代保存的龙眼品种红核子体胚发生早期胚性愈伤组织(Embryogenic callus,EC)由福建农林大学园艺植物生物工程研究所提供。主要试剂:2,4-二氯苯氧乙酸(2,4-D)和吲哚乙酸(IAA)购自福建荷瑞生物科技有限公司;TransZol Up试剂盒购自北京全式金生物技术股份有限公司;SMARTer®RACE 5'/3'Kit试剂盒购自日本TaKaRa公司;GeneJET Plasmid Miniprep Kit胶回收试剂盒购自美国ThermoFisher Scientific公司;大肠杆菌DH5α感受态细胞和根癌农杆菌GV3101感受态细胞购自上海唯地生物技术有限公司;HieffCloneTM Plus One Step Cloning Kit试剂盒购自南京诺唯赞生物医药科技有限公司。
1.2试验方法
参照赖钟雄(2003)、赖呈纯等(2012)的方法,在MS培养基中分别添加0.1和0.5 mg/L 2,4-D后黑暗培养20 d,诱导长期继代保存的EC分别分化为不完全胚性紧实结构(Incomplete embryogenic compact structures,ICpEC)和球形胚(Globular embryos,GE)等体胚发生早期材料。将继代培养20 d优良EC分别置于含0(对照组)、0.5、1.0、1.5、2.0 mg/L IAA的MS液体培养基中暗培养1 d。各培养到期材料及时液氮收取,置于-80°C冰箱保存备用,用于实时荧光定量PCR检测。
1.3 DlSWC5基因编码区(CDS)全长序列克隆验证
用TransZol Up试剂盒分离出体胚早期EC、ICpEC和GE混合材料的总RNA,按照SMARTer®RACE 5'/3'Kit试剂盒说明将总RNA反转录合成cDNA。提取龙眼三代基因组DlSWC5基因的CDS序列,通过DNAMAN 7.0设计特异引物(表1),引物委托福州尚亚生物技术有限公司合成。通过PCR扩增克隆DlSWC5基因的cDNA序列,验证DlSWC5基因的CDS序列,反应体系25.0μL:2×Dream Taq Green PCR Master Mix 12.5μL,上、下游引物各1.0μL,cDNA模板1.0μL,ddH2O 9.5μL。扩增程序:95℃预变性30 s;60℃30 s,72℃12 s,72℃10 min,进行34次循环共1.25 h。扩增产物经1%琼脂糖凝胶电泳检测后使用GeneJET Plasmid Miniprep Kit胶回收试剂盒回收,将纯化产物与pMD18-T载体连接后转化大肠杆菌DH5α感受态细胞,涂布于含氨苄西林(AMP)的LB培养基上倒置过夜培养,挑选阳性克隆经PCR鉴定后送铂尚生物技术(上海)有限公司测序。序列经比对去除T载体通用引物后即获得克隆cDNA序列。
1.4生物信息学分析
采用ExPASy中ProtParam(https://web.expasy.org/protparam/)对DlSWC5基因编码蛋白基本理化性质进行预测分析,使用ProtScale(https://web.expasy.org/protscale/)进行DlSWC5蛋白亲/疏水性预测。使用SignalP-6.0(https://services.healthtech.dtu.dk/services/SignalP-6.0/)预测信号肽;采用TMHMM-2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)进行蛋白跨膜结构预测;使用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)进行蛋白磷酸化位点预测。采用SOMPA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白二级结构,采用SWISS MODEL(https://swiss-model.expasy.org/interactive)同源建模法预测蛋白三级结构。使用WolfPSort(https://www.genscript.com/wolf-psort.html)和Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行亚细胞定位预测,使用UniProt(https://www.uniprot.org/uniprotkb/Q8 GX81/entry)检索蛋白在拟南芥中同源蛋白亚细胞定位GO功能注释,结合核定位序列预测工具NLStradamus(http://www.moseslab.csb.utoronto.ca/NLStradamus/)预测蛋白核定位特征序列(预测模型设置为4 state HMM static,Prediction Cutoff设置为0.4),综合预测亚细胞定位。
1.5 DlSWC5蛋白互作调控网络预测分析
基于STRING(https://string-db.org)数据库预测DlSWC5蛋白互作调控网络。在线登录STRING后,选择Proteins by Sequences,输入DlSWC5单个氨基酸序列,Organisms选择模式植物拟南芥为参考进行搜索预测,设置项Settings中最低互动评分设置为medium confidence(0.400),聚类项Clusters中k-means clustering设置为number of clusters(3),预测DlSWC5与其他蛋白之间的互作关系。
1.6 DlSWC5蛋白亚细胞定位验证
根据DlSWC5基因酶切位点分析结果,利用DNAMAN 7.0设计带有线性化1302表达载体5'端21 bp同源序列的上、下游特异引物DlSWC5-1302F和DlSWC5-1302R(表1),通过PCR扩增,扩增产物进行琼脂糖凝胶电泳后回收纯化目的条带。参照HieffCloneTM Plus One Step Cloning Kit试剂盒说明将目的片段和线性化1302载体进行重组,将重组产物转化大肠杆菌DH5α感受态细胞,活化后涂布于含50 mg/L卡那抗生素的LB培养基上倒置培养,筛选阳性单克隆子并设计绿色荧光蛋白(GFP)引物(表1)验证菌液PCR中重组质粒是否含有GFP以及含有GFP的重组质粒是否携带目的片段。菌液PCR验证成功后,提取pCAMBIA1302-DlSWC5-GFP重组质粒,采用冻融法分别将重组质粒及pCAM-BIA1302-35S-GFP空载体转入根癌农杆菌GV3101感受态细胞,转化、涂板、培养和挑单克隆验证菌液PCR后,通过扩繁、离心和重悬将菌液OD600 nm调至0.6~0.8,加入乙酰丁香酮(Acetosyringone,AS)和氯化镁(MgCl2)活化菌液后,注射侵染烟草叶下表皮置于28℃培养箱黑暗培养2~3 d,通过激光扫描共聚焦显微镜观察DlSWC5亚细胞定位情况。
1.7 DlSWC5基因组织表达分析
通过三代基因组DlSWC5基因编码蛋白序列比对到二代基因组蛋白序列数据库,在二代基因组中鉴定到仅有的DlSWC5基因(基因ID:Dlo_009754.1),结合转录组数据(SRA:PRJNA565345)提取DlSWC5基因在体胚发生早期及不同组织的FPKM值,在TBtools中以log2 FPKM绘制表达热图分析基因FPKM表达模式。利用DNAMAN对DlSWC5基因保守结构域位置序列进行实时荧光定量PCR特异性引物设计(表1),以泛素(UBQ)为内参基因(Lin and Lai,2010)进行实时荧光定量PCR检测,采用2-ΔΔCt法计算DlSWC5基因在体胚发生早期EC、ICpEC和GE阶段以及不同浓度IAA处理下EC中的相对表达量。
1.8统计分析
采用SPSS 20进行差异显著性分析,使用Graph-Pad Prism 6.0进行数据处理及制图。
2结果与分析
2.1 DlSWC5基因克隆验证结果
通过RT-PCR克隆扩增目的片段,经测序获得DlSWC5基因的cDNA序列(图1),长度为1023 bp,其编码340个氨基酸残基;将克隆得到的DlSWC5基因的cDNA序列与基因组编码区(CDS)序列进行序列比对,相似性高达99.80%,说明成功克隆DlSWC5基因。
2.2 DlSWC5蛋白生物信息学分析
利用在线网站ExPASy中的ProtParam分析DlSWC5蛋白的理化性质,结果表明,DlSWC5蛋白的分子式为C1622H2599N459O542S8,相对分子质量为37458.71 Da,理论等电点(pI)为5.7 小于7,说明该蛋白呈酸性;脂肪系数越高表明蛋白的热稳定性越高,DlSWC5脂肪系数为60.9 且不稳定系数为46.27,表明DlSWC5蛋白为不稳定蛋白;平均亲/疏水性系数为-0.91 表明DlSWC5蛋白为亲水性蛋白。利用SignalP-6.0和TMHMM-2.0在线工具分别对DlSWC5蛋白进行信号肽和跨膜结构预测,结果显示DlSWC5蛋白不含信号肽和跨膜结构,说明DlSWC5属于非分泌蛋白,不参与物质的跨膜运输。蛋白质磷酸化是一种蛋白质翻译后修饰,不同的磷酸化方式影响DlSWC5蛋白的翻译水平,进而影响蛋白质的结构和活性,因而产生功能差异。运用NetPhos 3.1 Server在线工具预测DlSWC5蛋白的磷酸化位点,结果显示,DlSWC5蛋白具有44个磷酸化位点,其中丝氨酸位点29个、苏氨酸位点9个和酪氨酸位点6个(图2)。WolfPSort、Cell-PLoc 2.0亚细胞定位预测和UniProt检索结果显示,DlSWC5蛋白定位于细胞核,NLStradamus在线工具预测结果可知DlSWC5蛋白存在细胞核定位序列264~IKKKPKLSVLDKTK~277。
2.3 DlSWC5蛋白结构预测分析结果
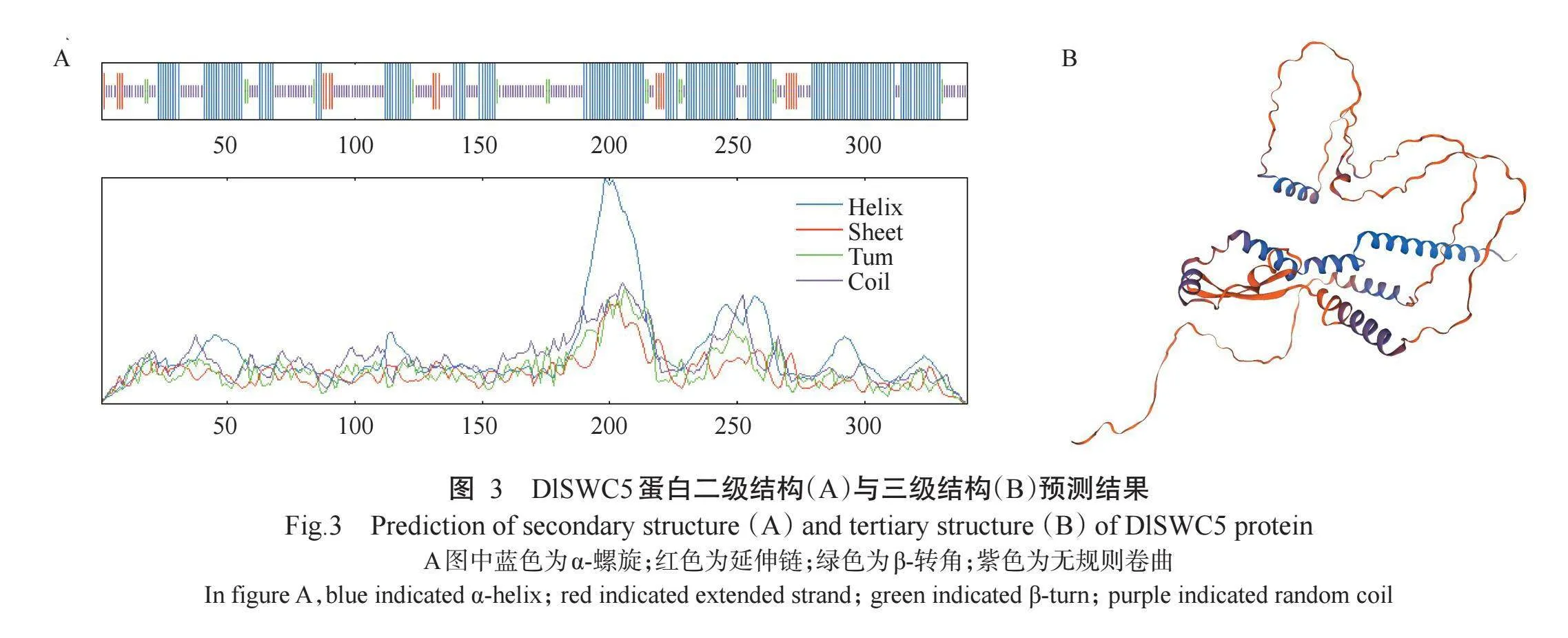
利用在线工具SOMPA对DlSWC5蛋白进行二级结构预测,结果(图3-A)显示,“-螺旋占48.53%,无规则卷曲占40.29%,延伸链占6.47%,β-转角占4.71%。
利用SWISS MODEL同源建模,SWISS MODEL自动挑选了PDB ID为A0A5C7IQT6.1.A(漾濞槭中同源蛋白)的结构作为模板建立DlSWC5蛋白三级结构(图3-B)。全局模型质量估计(GMQE)可信度值为0.5 在0~1正常范围,表明预测质量可靠;A0A5C7IQT6.1.A与目标蛋白DlSWC5的氨基酸序列相似性高达84.98%,除DlSWC5末端4个氨基酸REEP外,DlSWC5两端的氨基酸序列均被模板序列覆盖,表明DlSWC5蛋白与模板蛋白的匹配度较优。说明预测模型能代表DlSWC5蛋白的三级结构,且三级结构预测结果与二级结构预测结果基本一致。
2.4 DlSWC5蛋白互作调控网络分析结果
通过STRING数据库以拟南芥为参考预测DlSWC5蛋白互作调控网络,结果(图4)显示,DlSWC5蛋白(AtSWC5<AtQ8GX81>)与其他蛋白的互作关系可分为4种情况:一是与同属染色质重塑SWR1复合物蛋白PIE1、SWC2、SWC4和SWC6互作;二是与染色质重塑INO80复合物蛋白RIN1互作;三是与RuvB家族蛋白K9I9.20和T16K5.180互作;四是与H2A变体HTA8、HTA9和H2AV互作。通过拟南芥TAIR在线数据库(https://www.arabidopsis.org/)搜索显示HTA8(AT2G38810)和HTA9(AT1G52740)为2个H2A.Z蛋白。与DlSWC5互作的10个蛋白间也存在明显互作关系。推测这些蛋白与DlSWC5蛋白的功能发挥密切相关。
2.5 DlSWC5蛋白亚细胞定位结果
通过PCR扩增获得带有线性化1302载体同源序列的DlSWC5基因片段(图5-A),与线性化1302载体进行重组,并用菌液PCR验证重组质粒的GFP蛋白及是否存在DlSWC5基因片段,结果如图5-B和图5-C所示。挑选阳性克隆测序以获得带DlSWC5基因的融合重组质粒pCAMBIA1302-DlSWC5-GFP。
由图6可知,导入含目的基因DlSWC5的融合重组质粒pCAMBIA1302-DlSWC5-GFP的烟草叶下表皮细胞仅在细胞核中呈现绿色荧光信号,而将重组质粒及pCAMBIA1302-35S-GFP空载体分别注射不同株烟草叶下表皮细胞后,在导入空载体的烟草叶下表皮细胞中,GFP荧光信号分布广泛,荧光信号强且无特异性;表明DlSWC5蛋白定位于细胞核。
2.6 DlSWC5基因在体胚发生早期及不同组织中的表达模式
利用DlSWC5基因FPKM值绘制表达热图,对其在体胚发生早期及不同组织中的转录表达模式进行分析,结果(图7-A)显示,DlSWC5基因在体胚发生早期EC、ICpEC和GE阶段及种子、根、茎、叶、花蕾、花、果皮、果肉、幼果等组织中均检测到表达,其在体胚发生早期EC、ICpEC和GE阶段表达高于在不同组织中的表达,且表达趋势逐渐上调,在组织中表达量低于体胚发生早期,主要表现为3种水平,即在茎、叶和幼果中表达水平相当,在果皮、花、花蕾、根和种子中表达水平相当,在果肉中表达较低。推测该基因可能在龙眼早期体胚发生及不同组织的发育中具有广谱调控作用。实时荧光定量PCR检测结果(图7-B)显示,DlSWC5基因的相对表达量在龙眼体胚发生早期EC、ICpEC和GE阶段无明显差异,与其FPKM表达情况一致。
2.7不同IAA浓度处理下DlSWC5基因的表达模式
通过实时荧光定量PCR检测不同IAA浓度处理下DlSWC5基因的表达模式,结果(图8)表明,与对照组(0 mg/L)相比,DlSWC5基因的相对表达量在0.5、1.0、1.5和2.0 mg/L IAA处理24 h后均显著降低(P<0.05),说明DlSWC5基因参与IAA信号转导过程,并受IAA负调控。
3讨论
3.1 DlSWC5蛋白定位于细胞核
本研究基于龙眼三代基因组数据克隆验证到DlSWC5基因的cDNA,序列长度为1023bp,并对其编码蛋白DlSWC5进行生物信息学分析,结果显示DlSWC5蛋白为不稳定、亲水性蛋白,呈酸性,无信号肽和跨膜结构域,含丰富的丝氨酸、苏氨酸和酪氨酸磷酸化修饰位点,推测该蛋白与信号传导、细胞周期、生长发育等诸多生物学过程密切相关。蛋白质的核糖体生物合成完成后只有在转运到正确的细胞器或区域中才能发挥功能(王明会等,2015),因此,研究DlSWC5蛋白亚细胞定位对进一步解析其功能和分子调控机制具有重要意义。本研究通过根癌农杆菌介导转化烟草叶下表皮后,共聚焦显微镜下观察亚细胞定位,结果表明DlSWC5蛋白定位于细胞核,该结果与拟南芥和番茄SWC5蛋白定位结果一致(Gross,2021)。
3.2 DlSWC5基因参与龙眼生长发育和早期体胚发生
已有研究表明拟南芥SWC6突变(Lázaro et al.,2008)和RNAi抑制SWC4表达(Gómez-Zambrano et al.,2018)均可促进开花,拟南芥中SWC6基因突变体与Photoperiodindependent early flowering1(PIE1)基因突变体出现锯齿状叶,花序节间缺失及花数量和大小改变等相同表型,且SWC6蛋白可与PIE1蛋白互作(March-Diaz et al.,2007),番茄中SWC5蛋白可与染色质重塑SWR1复合物成员PIE1、ARP6和H2A.Z蛋白互作(Gross,2021),本研究的蛋白互作预测分析结果也显示DlSWC5可与蛋白PIE1、SWC4、SWC6及2个H2A.Z蛋白HTA8和HTA9互作,推测在龙眼中上述蛋白与DlSWC4、DlSWC6、DlPIE1和DlH2A.Z密切配合,在龙眼叶片发育和开花过程调控中发挥重要功能。
SWC5蛋白主要参与ATP依赖的染色质重塑过程,植物SWC5蛋白在酵母中的同源蛋白被报道可促进H2A.Z在体内沉积(Tramantanoetal.,2016),拟南芥中H2A.Z沉积可增加H3K27me3水平(Dai et al.,2018),ATP依赖的染色质重塑基因PKL(Zhang et al.,2012)和组蛋白赖氨酸甲基化基因CLF(Maka-revichetal.,2006)也能促进H3K27me3滞留以增加H3K27me3水平,且拟南芥胚胎主调控标记基因LEC1(Lotan et al.,1998;Mu et al.,2008)可被PKL(Ogas et al.,1999)和CLF基因(Makarevich et al.,2006)负调控激活从而促进体胚发生,表明龙眼中SWC5基因可能具有与PKL和CLF基因相似的体胚发生调控功能。拟南芥AtLEC1、AtLEC2和玉米ZmSERKs等体胚标记基因通过上调生长素合成途径基因YUC(YUC1、YUC4和YUC10)表达,提高内源生长素水平促进体胚发生(Stone et al.,2008;Zhang et al.,2011;Guo et al.,2013;Wójcikowska et al.,2013)。对龙眼早期体胚发生的研究表明,ICpEC和GE可通过添加低于0.5 mg/L的2,4-D诱导EC获得(赖钟雄,2003),本研究利用浓度为0.5、1.0、1.5和2.0 mg/L的IAA处理EC,均可诱导DlSWC5基因显著下调表达,说明DlSWC5基因负调控龙眼早期体胚发生,推测DlSWC5基因参与龙眼早期体胚发生调控的一个重要机制是DlSWC5基因被IAA或2,4-D诱导下调,H2A.Z沉积过程受阻,导致H3K27me3水平降低,从而促进LEC1、LEC2和SERKs等体胚标记基因表达,上调生长素合成途径基因YUC(YUC1、YUC4和YUC10)表达,最终提高内源生长素水平,促进早期体胚发生。
4结论
成功克隆了DlSWC5基因,其编码蛋白为不稳定的亲水性蛋白,呈酸性,定位于细胞核;DlSWC5基因在龙眼体胚发生早期EC阶段被IAA诱导下调表达。
参考文献(References):
戴宏芬,黄炳雄,王晓容,李建光,肖维强.2010.18个龙眼品种果肉中氨基酸含量的HPLC测定[J].广东农业科学,37(10):125-128.[Dai H F,Huang B X,Wang X R,Li J G,Xiao W Q.2010.Measurement of amino acids in flesh of 18 longan varieties by high performance liquid chroma-tography[J].Guangdong Agricultural Sciences,37(10):125-128.]doi:16768/j.issn.1004-874x.2010.10.035.
董慧雪,周燕蓉,田奇琳,赖恭梯,林玉玲,赖钟雄.2014.不同光质对龙眼胚性愈伤组织类黄酮含量的影响[J].热带作物学报,35(12):2374-2377.[Dong H X,Zhou Y R,Tian Q L,Lai G T,Lin Y L,Lai Z X.2014.Effects of different light qualities on the contents of flavonoids of embryonic callus in Dimocarpus longan Lour.[J].Chinese Journal of Tropical Crops,35(12):2374-2377.]doi:10.3969/j.issn.1000-2561.2014.12.010.
古小玲,李玉萍,梁伟红,刘燕群,董定超.2008.中国龙眼产业发展概况[J].中国农学通报,24(9):470-474.[Gu X L,Li Y P,Liang W H,Liu Y Q,Dong D C.2008.The sur-vey of longan industry development in China[J].Chinese Agricultural Science Bulletin,24(9):470-474.]
黄岛平,陈秋虹,陈建红,徐慧.2010.高效液相色谱法测定龙眼肉多糖的单糖组成[J].广西科学院学报,26(3):234-236.[Huang D P,Chen Q H,Chen J H,Xu H.2010.Analysis of monosaccharide composition in polysaccha-ride of arillus longan by high performance liquid chroma-tography[J].Journal of Guangxi Academy of Sciences,26(3):234-236.]doi:13657/j.cnki.gxkxyxb.2010.03.047.
赖呈纯,赖钟雄,方智振,何园,姜顺日.2012.龙眼体细胞胚发生早期的蛋白质组学[J].中国农业科学,45(9):1775-1790.[Lai C C,Lai Z X,Fang Z Z,He Y,Jiang S R.2012.Proteomic analysis of early somatic embryogenesis in longan(Dimocarpus longan Lour.)[J].Scientia Agri-cultura Sinica,45(9):1775-1790.]doi:10.3864/j.issn.0578-1752.2012.09.013.
赖钟雄,陈振光.1997.龙眼胚性愈伤组织的高频率体细胞胚胎发生[J].福建农业大学学报,26(3):271-276.[Lai Z X,Chen Z G.1997.Somatic embrgenesis of high fre-quency from longan embryogeniccalli[J].Journal of Fujian Agricultural University,26(3):271-276.]
赖钟雄.2003.龙眼生物技术研究[M].福州:福建科学技术出版社.[Lai Z X.2003.Study of longan biotechnology[M].Fuzhou:Fujian Science and Technology Press.]
申序,陈晓慧,徐小萍,霍雯,李晓斐,蒋梦琦,张婧,林玉玲,赖钟雄.2019.龙眼体细胞胚胎发生早期SDG基因家族的全基因组鉴定与表达分析[J].热带作物学报,40(10):1889-1901.[Shen X,Chen X H,Xu X P,Huo W,Li X F,Jiang M Q,Zhang J,Lin Y L,Lai Z X.2019.Genome-wide identification and expression analysis of SDG genefamily during early somatic embryogenesis in Dimocarpuslongan Lour.[J].Chinese Journal of Tropical Crops,40(10):1889-1901.]doi:10.3969/j.issn.1000-2561.2019.10.002.
申序,陈晓慧,张婧,陈荣珠,徐小萍,李晓斐,蒋梦琦,刘蒲东,倪珊珊,林玉玲,赖钟雄.2022.龙眼染色质重塑因子Snf2基因家族的进化动力学研究及在体胚发生早期的表达[J].园艺学报,49(1):41-61.[Shen X,Chen X H,Zhang J,Chen R Z,Xu X P,Li X F,Jiang M Q,Liu P D,Ni S S,Lin Y L,Lai Z X.2022.Evolutionary dynamics investigation and the expression analysis of chromatin remodeling factor Snf2 gene family during early somatic embryogenesis in Dimocarpus longan.[J].Acta Horticul-turaeSinica,49(1):41-61.]doi:10.16420/j.issn.0513-353x.2020-0726.
申序,牟东岭,黄健华,郭萍,孙川川,王慧,唐鹏,葛琴,赖钟雄.2023.龙眼DlSWI3、DlARP、DlSWC和DlBSH亚基的分子特性及其在体胚发生早期的基因表达模式[J].园艺与种苗,43(2):53-59.[Shen X,Mou D L,Huang J H,Guo P,Sun C C,Wang H,Tang P,Ge Q,Lai Z X.2023.
Molecular characterization and gene expression patterns of DlSWI3,DlARP,DlSWC and DlBSH subunits during early somatic embryogenesis in Dimocarpus longan Lour.[J].Horticulture&Seed,43(2):53-59.]doi:10.16530/j.cnki.cn21-1574/s.2023.02.020.
王明会,龚艺,王强,冯焕清,李骜.2015.整合序列与蛋白相互作用特征的亚细胞定位预测[J].电子科技大学学报,44(3):467-470.[Wang M H,Gong Y,Wang Q,Feng H Q,Li A.2015.Prediction of protein subcellular localiza-tion by incorporating sequence and protein-protein interac-tion features[J].Journal of University of Electronic Scien-ce and Technology of China,44(3):467-470.]doi:10.3969/j.issn.1001-0548.2015.03.026.
Bonnard A.2016.Histone variant H2A.Z substitution media-ted by the SWR1-like complex is a novel transcriptional regulatory mechanism controlling defense genes and immunity in plants[D].Texas:Texas State University.
Chen X H,Xu X P,Shen X,Li H S,Zhu C,Chen R Z,MunirN,Zhang Z H,Chen Y K,Xu X H,Lin Y L,Lai Z X.2020.Genome-wide investigation of DNA methylation dynamics reveals a critical role of DNA demethylation du-ring the early somatic embryogenesis of Dimocarpuslon-ganLour.[J].Tree Physiology,40(12):1807-1826.doi:10.1093/treephys/tpaa097.
Chen Y,Xie D,Ma X,Xue X D,Liu M Y,Xiao X C,Lai C W,Xu X P,Chen X H,Chen Y KWH6V28ScDoSGfctF5mLS6Q==,Zhang Z H,Xu X H,Lai Z X,Lin Y L.2023.Genome-wide high-throughput chromo-some conformation capture analysis reveals hierarchical chromatin interactions during early somatic embryogenesis[J].Plant Physiology,193(1):555-577.doi:10.1093/plphys/kiad348.
Dai X Z,Bai Y H,Zhao L H,Dou X Y,Liu Y H,Wang L L,Li Y,Li W M,Hui YA,Huang X Y,Wang Z H,Qin Y.2018.H2A.Z represses gene expression by modulating promoter nucleosome structure and enhancer histone modifications in Arabidopsis[J].Molecular Plant,11(4):635.doi:10.1016/j.molp.2018.03.011.
Gómez-Zambrano A,Crevillén P,Franco-Zorrilla J M,López J A,Moreno-Romero J,Roszak P,Santos-González J,Jurado S,Vázquez J,Köhler C,Solano R,Piñeiro M,Jarillo J A.2018.Arabidopsis SWC4 binds DNA andrecruits the SWR1 complex to modulate histone H2A.Z deposition at key regulatory genes[J].Molecular Plant,11(6):815-832.doi:10.1016/j.molp.2018.03.014.
Gross R.2021.Identification and characterization of the plant SWR1 subunit SWC5 and the globodera pallida effector GpPDI1[D].Idaho:University of Idaho.
Guo F D,Liu C L,Xia H,Bi Y P,Zhao C Z,Zhao S Z,Hou L,Li F G,Wang X J.2013.Induced expression of AtLEC1 and AtLEC2 differentially promotes somatic embryogene-sis in transgenic tobacco plants[J].PLoS One,8(8):e71714.doi:10.1371/journal.pone.0071714.
Huang Y,Sun L,Pierrakeas L,Dai L C,Pan L,Luk E,Zhou Z.2020.Role of a DEF/Y motif in histone H2A-H2B recogni-tion and nucleosome editing[J].Proceedings of the Natio-nal Academy of Sciences of the United States of America,117(7):3543-3550.doi:10.1073/pnas.1914313117.
Itoh T,Inoue S,Sun X D,Kusuda R,Hibi M,Shimizu T.2021.Cfdp1 controls the cell cycle and neural differentiation in the zebrafish cerebellum and retina[J].Developmental Dy-namics,250(11):1618-1633.doi:10.1002/dvdy.371.
Jakada B H,Aslam M,Fakher B,Greaves J G,Li Z Y,Li W M,Lai L Y,Ayoade O A,Cheng Y,Cao S J,Li G,Hu J M,Qin Y.2019.Identification of SWI2/SNF2-related 1 chro-matin remodeling complex(SWR1-C)subunits in pine-apple and the role of pineapple SWR1 COMPLEX 6(AcSWC6)in biotic and abiotic stress response[J].Bio-molecules,9(8):364.doi:10.3390/biom9080364.
Krogan N J,Keogh M C,Datta N,Sawa C,Ryan O W,Ding H M,Haw RA,Pootoola J,Tong A,Canadien V,Richards D P,Wu X R,Emili A,Hughes T R,Buratowski S,Greenb-latt J F.2003.A Snf2 family ATPase complex required for recruitment of the histone H2A variant Htz1[J].Molecular Cell,12(6):1565-1576.doi:10.1016/s 1097-2765(03)00497-0.
Lázaro A,Gómez-Zambrano A,López-González L,Piñeiro M,Jarillo J A.2008.Mutations in the Arabidopsis SWC6 gene,encoding a component of the SWR1 chromatin remodelling complex,accelerate flowering time and alter leaf and flower development[J].Journal of Experimental Botany,59(3):653-666.doi:10.1093/jxb/erm332.
Lin Y L,Lai Z X.2010.Reference gene selection for qPCR analysis during somatic embryogenesis in longan tree[J].Plant Science,178(4):359-365.doi:10.1016/j.plantsci.2010.02.005.
Lotan T,Ohto M,Yee K M,West M A,Lo R,Kwong R W,Yamagishi K,Fischer R L,Goldberg R B,Harada J J.1998.Arabidopsis LEAFY COTYLEDON1 is sufficient toinduce embryo development in vegetative cells[J].Cell,93(7):1195-1205.doi:10.1016/s0092-8674(00)81463-4.
Luk E,Ranjan A,Fitzgerald P C,Mizuguchi G,Huang Y Z,Wei D B,Wu C.2010.Stepwise histone replacement by SWR1 requires dual activation with histone H2A.Z and canonical nucleosome[J].Cell,143(5):725-736.doi:10.1016/j.cell.2010.10.019.
Makarevich G,Leroy O,Akinci U,Schubert D,Clarenz O,Goodrich J,Grossniklaus U,Kohler C.2006.Different Polycomb group complexes regulate common target genes in Arabidopsis[J].Embo Reports,7(9):947-952.doi:10.1038/sj.embor.7400760.
March-Diaz R,Garcia-Dominguez M,Florencio F J,Reyes J C.2007.SEF,a new protein required for flowering repressionin Arabidopsis,interacts with PIE1 and ARP6[J].PlantPhysiology,143(2):893-901.doi:10.1104/pp.106.092270.March-Diaz R,Reyes J C.2009.The beauty of being a variant:H2A.Z and the SWR1 complex in plants[J].MolecularPlant,2(4):565-577.doi:10.1093/mp/ssp019.
Matsumoto T K.2005.Genes uniquely expressed in vegetativeand potassium chlorate induced floral buds of Dimocarpus longan[J].Plant Science,170(3):500-510.doi:10.1016/j.plantsci.2005.09.016.
Messina G,Celauro E,Atterrato M T,Giordano E,Iwashita S,Dimitri P.2015.The bucentau(BCNT)protein family:A long-neglected class of essential proteins required for chro‐matin/chromosome organization and function[J].Chromo‐soma,124(2):153-162.doi:10.1007/s00412-014-0503-8.
Mu J Y,Tan H L,Zheng Q,Fu F Y,Liang Y,Zhang J,Yang X H,Wang T,Chong K,Wang X J,Zuo J R.2008.LEAFY COTYLEDON1 is a key regulator of fatty acid biosynthesis in Arabidopsis[J].Plant Physiology,148(2):1042-1054.doi:10.1104/pp.108.126342.
Ogas J,Kaufmann S,Henderson J,Somerville C.1999.PICKLE is a CHD3 chromatin-remodeling factor that regulates the transition from embryonic to vegetative development in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,96(24):13839-13844.doi:10.1073/pnas.96.24.13839.
Stone S L,Braybrook S A,Paula S L,Kwong L W,Meuser J,Pelletier J,Hsieh T F,Fischer R L,Goldberg R B,Harada J J.2008.Arabidopsis LEAFY COTYLEDON2 induces maturation traits and auxinactivity:Implications for somatic embryogenesis[J].Proceedings of the National Academy of Sciences of the United States of America,105(8):3151-3156.doi:10.1073/pnas.0712364105.
Sun L,Luk E.2017.Dual function of Swc5 in SWR remode-ling ATPase activation and histone H2A eviction[J].Nucleic Acids Research,45(17):9931-9946.doi:10.1093/nar/gkx 589.
Tramantano M,Sun L,Au C,Labuz D,Liu Z M,Chou M,Shen C,Luk E.2016.Constitutive turnover of histone H2A.Z at yeast promoters requires the preinitiation complex[J].Elife,5:e14243.doi:10.7554/eLife.14243.
Wójcikowska B,Jaskóła,K,Gasiorek P,Meus M,Nowak K,Gaj M D.2013.LEAFY COTYLEDON2(LEC2)promotes embryogenic induction in somatic tissues of Arabidopsis,via YUCCA-mediated auxin biosynthesis[J].Planta,238(3):425-440.doi:10.1007/s00425-013-1892-2.
Wu W H,Wu C H,Ladurner A,Mizuguchi G,Wei D B,Xiao H,Luk E,Ranjan A,Wu C.2009.N terminus of Swr1 binds to histone H2AZ and provides a platform for subunit assembly in the chromatin remodeling complex[J].The Journal of Biological Chemistry,284(10):6200-6207.doi:10.1074/jbc.M808830200.
Xu X P,Zhang C Y,Xu X Q,Cai R D,Guan Q X,Chen X H,Chen Y K,Zhang Z H,Xu X H,Lin Y L,Lai Z X.2023.Riboflavin mediates m6A modification targeted by miR408,promoting early somatic embryogenesis in longan[J].Plant Physiology,192(3):1799-1820.doi:10.1093/plphys/kiad 139.
Zhang H,Bishop B,Ringenberg W,Muir W M,Ogas J.2012.The CHD3 remodeler PICKLE associates with genes enriched for trimethylation of histone H3 lysine 27[J].Plant Physiology,159(1):418-432.doi:10.1104/pp.112.194878.
Zhang S Z,Liu X G,Lin YA,Xie G N,Fu F L,Liu H L,Wang J,Gao S B,Lan H,Rong T Z.2011.Characterization of a ZmSERK gene and its relationship to somatic embryogen‐esis in a maize culture[J].Plant Cell,Tissue&Organ Cul‐ture(PCTOC),105(1):29-37.doi:10.1007/s 11240-010-9834-1.
(责任编辑李洪艳)
