蓖麻RcbZIP44基因克隆及表达特性
2024-10-15徐兴源李艳肖朱梦洋朱贵爽刘鹏向殿军











摘要:【目的】克隆蓖麻bZIP转录因子基因RcbZIP4 并进行表达特性分析,为探究bZIP转录因子在蓖麻生长发育及非生物胁迫下的生物学功能提供理论参考。【方法】从蓖麻品种通蓖5号中克隆bZIP转录因子基因家族成员RcbZIP4 对其序列进行生物信息学分析,借助烟草瞬时表达系统对RcbZIP44蛋白进行亚细胞定位,通过实时荧光定量PCR检测RcbZIP44基因在不同组织及非生物胁迫下的表达模式。【结果】克隆获得的RcbZIP44基因cDNA全长612 bp,包含1个456 bp的开放阅读框(ORF),编码151个氨基酸残基,无跨膜区域和信号肽结构,为不稳定的亲水性蛋白,存在21个潜在的磷酸化位点,二级结构以α-螺旋为主,定位于细胞核中。RcbZIP44基因启动子区域含有激素响应元件(ABRE、GARE-motif、TATC-box、TGACG-motif)、胁迫响应元件(LTR、ARE、MRE)等,推测RcbZIP44基因在非生物胁迫中发挥重要作用。RcbZIP44基因在茎中的相对表达量最高,显著高于根、子叶和真叶(P<0.05),说明其具有明显的组织表达特异性。在脱落酸(ABA)、盐、干旱和低温胁迫下,RcbZIP44基因在真叶和根中表现出不同的表达模式。RcbZIP44基因对低温胁迫敏感,处理6 h时的相对表达量最高;RcbZIP44基因在ABA和干旱胁迫下呈先增后减的表达模式,在处理12 h时的相对表达量最高;在盐胁迫中RcbZIP44基因表达较为平缓。【结论】RcbZIP44基因编码的蛋白含有bZIP家族特有的bZIP-plant-GBF1结构域,其主要在茎中发挥调控作用,且该基因受ABA、盐、干旱和低温等非生物胁迫诱导表达,推测RcbZIP44基因在蓖麻生长发育及响应非生物胁迫中发挥重要调控作用。
关键词:蓖麻;bZIP44;转录因子;基因克隆;非生物胁迫;表达分析
中图分类号:S565.603.53文献标志码:A文章编号:2095-1191(2024)07-2069-11
Cloning and expression characteristics of RcbZIP44 gene in castor
XU Xing-yuan LI Yan-xiao ZHU Meng-yang ZHU Gui-shuang LIU Peng XIANG Dian-jun *
(1College of Agriculture,Inner Mongolia University for Nationalities,Tongliao,Inner Mongolia 028000,China;2Key Laboratory of Ecological Agriculture of Horqin Sandy Land,Inner Mongolia University forNationalities,Tongliao,Inner Mongolia 028000,China)
Abstract:【Objective】Cloned the castor bZIP transcription factor gene RcbZIP44 and analyzed its expression charac-teristics to provide reference for exploring the biological functions of bZIP transcription factors in castor growth and deve-lopment and under abiotic stress.【Method】The bZIP transcription factor gene family member RcbZIP44 from the castor variety Tongbi No.5 was cloned,bioinformatics analysis on its sequence was performed,the tobacco transient expression system was used to conduct subcellular localization analysis on the RcbZIP44 protein.The expression pattern of RcbZIP44 gene in different tissues and under abiotic stress was detected by real-time fluorescence quantitative PCR.【Result】The cloned full-length cDNA of the RcbZIP44 gene was 612 bp,containing a 456 bp open reading frame(ORF),encoding 151 amino acid residues.There was no transmembrane region and signal peptide structure.It was an unstable hydrophilic protein with 21 potential phosphorylation sites.The secondary structure was mainly consisted ofα-helix and was locatedin the nucleus.The promoter region of the RcbZIP44 gene contained hormone response elements(ABRE,GARE-motif,TATC-box,TGACG-motif),stress response elements(LTR,ARE,MRE),etc.It was speculated that the RcbZIP44 gene played an important role in abiotic stress.The relative expression level of RcbZIP44 gene in stems was the highest,signifi-cantly higher than that in roots,cotyledons and true leaves(P<0.05),indicating that it had obvious tissue expression speci-ficity.Under abscisic acid(ABA),salt,drought and low-temperature stresses,RcbZIP44 gene showed different expression patterns in leaves and roots.RcbZIP44 gene was sensitive to low-temperature stress,and the relative expression level was the highest when treated for 6 h.RcbZIP44 gene showed an expression pattern of increasing first and then decreasing under ABA and drought stress,and the relative expression level was the highest when treated for 12 h.In salt stress,the expression of the RcbZIP44 gene was relatively stable.【Conclusion】The protein encoded by RcbZIP44 gene contains bZIP-plant-GBF1 domain which is unique in bZIPfamily.It mainly plays a regulatory role in stems.RcbZIP44 gene is in-duced by abiotic stresses such as ABA,salt,drought and low temperature.It is speculated that RcbZIP44 gene plays an im-portant regulation role in castor growth and development and in response to abiotic stress.
Key words:castor;bZIP44;transcription factor;gene cloning;abiotic stress;expression analysis
Foundation items:National Natural Science Foundation of China(32060492);Inner Mongolia Natural Science Foundation(2022MS03057);Inner Mongolia Castor Industry Collaborative Innovation Center Development Project(MDK2023081);Inner Mongolia Universities Basic Scientific Research Project(GXKY23Z047)
0引言
【研究意义】蓖麻(Ricinus communis)作为一种经济作物,在农业、医学及航天事业上发挥着重要的作用(张树军等,2011),但随环境的恶化,其生长发育受到多种非生物胁迫(如温度、盐碱和干旱等)的影响,严重制约了蓖麻的产量和品质(萨茹拉和刘鹏,2021)。随着蓖麻全基因组测序工作的完成,使从基因层面揭示基因家族的功能成为可能。利用基因家族成员的功能特性研究其在植物中的作用机理,为培育耐逆新品种提供一定的基因资源。多项研究表明,bZIP转录因子在植物的逆境胁迫响应中发挥作用(Wang et al.,2021;Duan et al.,2022;Liu et al.,2023)。因此,开展bZIP转录因子基因克隆及表达分析,对深入研究bZIP转录因子在植物中的调控机制及培育耐逆新品种具有重要意义。【前人研究进展】bZIP转录因子的特异结构域由1个碱性氨基酸区域(BR)和1个亮氨酸(Leu)拉链区(Li etal.,2020)组成,其中碱性氨基酸区具有二聚体化作用,可通过DNA结构域上的N-x7-R/K结构识别并结合启动子区域的顺式作用元件,激活或抑制下游基因的表达,发挥调控细胞增殖分化、生长等作用(Santner and Estelle,2010;Alves et al.,2013;Tullyet al.,2014;Li,2022)。bZIP特异结合的启动子区域是以ACGT为核心序列的A-box(TACGTA)和G-box(CACGTG)及C-box(GACGTC)等顺式作用元件组成(Tsugama et al.,2012;贾利强等,2021),通过介导脱落酸(ABA)、茉莉酸甲酯(MeJA)等激素信号转导途径或影响下游基因表达来实现对植物抗性的调控(孙晓丽,2011;Jin et al.,2014)。大量研究发现,bZIP转录因子参与多种植物对非生物胁迫的应答调节,如Ying等(2012)研究发现,玉米(Zea mays)ZmbZIP72基因在拟南芥中异源表达,可明显提高植株的耐旱能力;Liu等(201 2018)研究发现,水稻(Oryza sativa L.)中OsbZIP71基因过表达可提高水稻对干旱胁迫和盐胁迫的耐受性,OsbZIP73基因过表达可增强水稻对低温的耐受性;Jiang等(2017)研究发现,苹果MdbZIP26基因通过ABA介导的信号转导途径提高植物对干旱和盐胁迫的抗性;Dröge-Laser和Weiste(2018)研究发现,AtbZIP2基因过表达可提高拟南芥对干旱胁迫的耐受能力;李健等(2023)从芒果(Mangifera indica L.)中克隆获得MibZIP46基因,并检测了其在干旱和盐胁迫下的表达情况,结果显示MibZIP46基因在芒果响应干旱和盐胁迫中发挥重要的调控作用;Wan等(2022)从苹果(Malus pumila Mill)中克隆获得MdbZIP26基因,并证实其在响应ABA、干旱及盐胁迫等非生物胁迫中发挥重要调控作用;曹丽茹等(2023)从玉米中克隆获得ZmbZIP26基因,并证实其积极响应干旱和盐等非生物胁迫,对其进行蛋白互作分析,发现ZmbZIP26蛋白能与锌指蛋白、钙依赖性蛋白及丝氨酸蛋白等协同调控玉米的生长发育过程和胁迫应答过程。【本研究切入点】目前对bZIP转录因子基因的研究主要集中在模式植物中,蓖麻的相关研究较少,目前鲜见对蓖麻bZIP转录因子基因克隆及表达分析的研究报道。【拟解决的关键问题】从蓖麻中克隆1个bZIP转录因子基因家族成员(RcbZIP44),对其序列进行生物信息学分析,借助烟草瞬时表达系统对RcbZIP44蛋白进行亚细胞定位分析,通过实时荧光定量PCR检测RcbZIP44基因在不同组织及非生物胁迫下的表达模式,旨在了解该基因的生物学特征及功能,为培育蓖麻优良抗逆品种提供一定的基因资源。
1材料与方法
1.1试验材料
供试材料为蓖麻品种通蓖5号,是以哲lmAB3为母本、哲蓖2号为父本杂交后的稳定后代,平均产量比哲蓖3号提高51.7%(李金琴等,2004)。主要试剂:2×KOD MasterMix高保真酶和DNA提取试剂盒购自北京酷来搏科技有限公司;MonScriptTM RTLLL All-in-One Mix with dsDNase购自莫纳生物科技有限公司;SanPrep Column DNAGel Extraction Kit、SanPrep Column PCR Product Purification Kit和质粒DNA小量抽提试剂盒购自生工生物工程(上海)股份有限公司;pMD18-T载体、载体连接试剂盒、限制性内切酶(Sac I和Xba I)购自日本TaKaRa公司;pCAMBIA2300-CaMV35S-GFP载体购自青岛艾迪特生物科技有限公司。所需引物均交由生工生物工程(上海)股份有限公司合成。主要仪器设备:DYY-6C型电泳仪(北京六一仪器厂)、FR980型凝胶成像系统(上海复日科技有限公司)、T100TMPCR仪(美国BIO-RAD公司)、THBC-470切胶仪(上海科器仪器设备有限公司)、LightCycler480II型荧光定量PCR仪(瑞士Rotkreuz公司)、FV1000共聚焦显微镜[奥林巴斯(中国)有限公司]。
1.2试验方法
1.2.1样品处理及采集选取籽粒饱满,大小、光泽和斑纹一致的蓖麻籽作种子。精选的种子经28℃催芽处理后将其均匀摆放在发芽盒中进行水培,等到2片子叶展开后浇灌1/2的MS营养液,待2片真叶完全展开后浇灌1/2 Hoagland营养液。4叶期时分别进行干旱(10%PEG 6000)、盐(150 mmol/L NaCl)、ABA(100μmol/L)和低温(4℃)胁迫处理,剪取0、6、12、24和36 h的根和真叶。此外,剪取未处理时植株的根、茎、子叶和真叶用于组织特异性表达分析。液氮速冻后于-80℃的冰箱中保存备用。每个处理设3次生物学重复及3次技术重复。
1.2.2总RNA的提取将蓖麻组织置于高温灭菌且预冷后的研钵内,迅速加入液氮,充分磨成粉末状。按照TransZol试剂说明书提取蓖麻总RNA。使用第一链cDNA试剂盒反转录合成第一链cDNA。反转录体系20.0μL:RNA模板5.0μL,MonScriptTM 5×RTLLL All-in-One Mix 4.0μL,MonScriptTMdsDN-ase 1.0μL,Nuclease-free水补充至20.0μL。反转录条件:37℃2 min,56℃15 min,85℃2 min。
1.2.3 RcbZIP44基因克隆参考NCBI数据库中参考序列(XP_002521521.1)序列信息,利用Primer Premier 5.0设计特异性引物RcbZIP44-F和RcbZIP44-R(表1)。以1.2.2中合成的第一链cDNA为模板进行PCR扩增。反应体系50.0μL:cDNA模板5.0μL,MonAmpTM 2×Taq Mix Pro 25.0μL,RcbZIP44-F和RcbZIP44-R引物各2.0μL,ddH2O补充至50.0μL。扩增程序:95℃预变性6 min;95℃15 s,53℃15 s,72℃10 s,进行35个循环,72℃延伸10 s。PCR产物经1%琼脂糖凝胶电泳检测、切胶回收纯化、末端加A和纯化操作后,最终将其连接至pMD18-T载体上,再将克隆产物热击转化大肠杆菌感受态细胞。挑取阳性菌液,送至生工生物工程(上海)股份有限公司进行测序。
1.2.4 RcbZIP44基因的生物信息学分析分别运用ExPASy中的ProtParam(https://web.expasy.org/prot-param/)、ProtScale(http://web.expasy.org/protscale/)和WoLF PSORT(https://wolfpsort.hgc.jp/)在线工具对蓖麻RcbZIP44蛋白的理化性质、亲/疏水性及亚细胞进行预测分析。分别使用NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)、TMHMM-2.0(http://www.cbs.dtu.dk/services/TMHMM/)和SignaIP(http://www.cbs.dtu.dk/services/SignalP/)预测RcbZIP44蛋白的磷酸化位点、跨膜螺旋结构和信号肽。分别采用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa%20_sopma.html)和SWISS-MODEL(https://www.swissmodel.expasy.org/)在线预测RcbZIP44蛋白的二级结构和三级结构,再用SAVES v6.0(https://saves.mbi.ucla.edu/)对三级结构模型进行打分。通过NCBI数据库对RcbZIP44氨基酸序列进行BLAST比对分析,并下载蓖麻(R.com-munis)、扁桃(Prunus dulcis)、葡萄(Vitis vinifera)、鹰嘴豆(Cicer arietinum)、梅(Prunus mume)、小垫柳(Salix brachista)、枣树(Ziziphus jujuba)和毛果杨(Populus trichocarpa)等作物的bZIP44蛋白序列,再利用MEGA 11.0构建系统发育进化树。
1.2.5 RcbZIP44基因启动子序列克隆及分析使用DNA提取试剂盒提取蓖麻叶片组织中的DNA,按照1.2.3中的反应体系对RcbZIP44基因上游2000 bp的启动子序列进行PCR扩增,经电泳检测及切胶回收纯化后,最后将所得到的菌液送至生工生物工程(上海)股份有限公司进行测序。测序结果对比正确后,将序列提交至PlantCARE(https://bioinfor-matics.psb.ugent.be/webtools/plantcare/html)网站上预测启动子区域中的顺式作用元件。
1.2.6 RcbZIP44蛋白亚细胞定位利用引物RcbZIP44-Y-F和RcbZIP44-Y-R(表1)进行PCR扩增,将PCR产物连接至pCAMBIA2300-CaMV35S-GFP中,从而构建重组载体pCAMBIA2300-CaMV35S-RcbZIP44-GFP。将pCAMBIA2300-CaMV35S-GFP(对照)和pCAMBIA2300-CaMV35S-RcbZIP44-GFP转化农杆菌菌株GV3101中,再将农杆菌注射到烟草叶片表皮细胞中,通过激光共聚焦显微镜,观察瞬时表达荧光蛋白的烟草叶片表皮细胞,判断RcbZIP44蛋白的亚细胞定位情况。
1.2.7实时荧光定量PCR检测依据RcbZIP44基因序列设计引物RcbZIP44-Q-F和RcbZIP44-Q-R(表1),将蓖麻Actin基因作为内参基因,以上述采集的不同组织及非生物胁迫处理样品cDNA为模板,通过实时荧光定量PCR检测RcbZIP44基因的表达情况。反应体系20.0μL:SYBR Green qPCR Master Mix 10.0μL,cDNA模板1.0μL,正、反向引物各0.5μL,ddH2O补充至20.0μL。将反应体系置于LightCy-cler480 II型荧光定量PCR仪进行实时荧光定量PCR检测。扩增程序:95℃预变性30 s;95℃5 s,60℃30 s,进行40个循环。根据2-ΔΔCt方法计算目的基因的相对表达量。
1.3统计分析
使用Excel 2016对数据进行整理分析,再采用SPSS 2.0分析样本间的差异显著性。
2结果与分析
2.1 RcbZIP44基因克隆及序列分析
由图1可知,克隆获得的片段大小约600bp,与预期结果基本一致。测序结果显示,该cDNA全长为612 bp,其中3'非编码区49bp,5'非编码区107 bp,开放阅读框(ORF)为456 bp,编码151个氨基酸残基(图2)。通过在NCBI数据库序列比对发现,该基因位于6号染色体上,且不包含内含子;该基因推导氨基酸序列与NCBI数据库中蓖麻bZIP44转录因子氨基酸序列的相似性较高,为100.00%,故将该基因命名为RcbZIP44。
2.2 RcbZIP44蛋白理化性质
ExPASy预测结果显示,RcbZIP44基因编码的蛋白分子式为C734H1173N217O243S1 相对分子质量为17.27 kD,理论等电点5.78;带负电氨基酸(Asp+Glu)数为19个,占4.3%,带正电氨基酸(Arg+Lys)数为16个,占16.2%;脂肪指数为68.64;不稳定指数为57.1 平均亲水性指数(GRAVY)为-0.71 属于不稳定的亲水性蛋白。
2.3 RcbZIP44蛋白磷酸化位点、信号肽及跨膜域预测结果
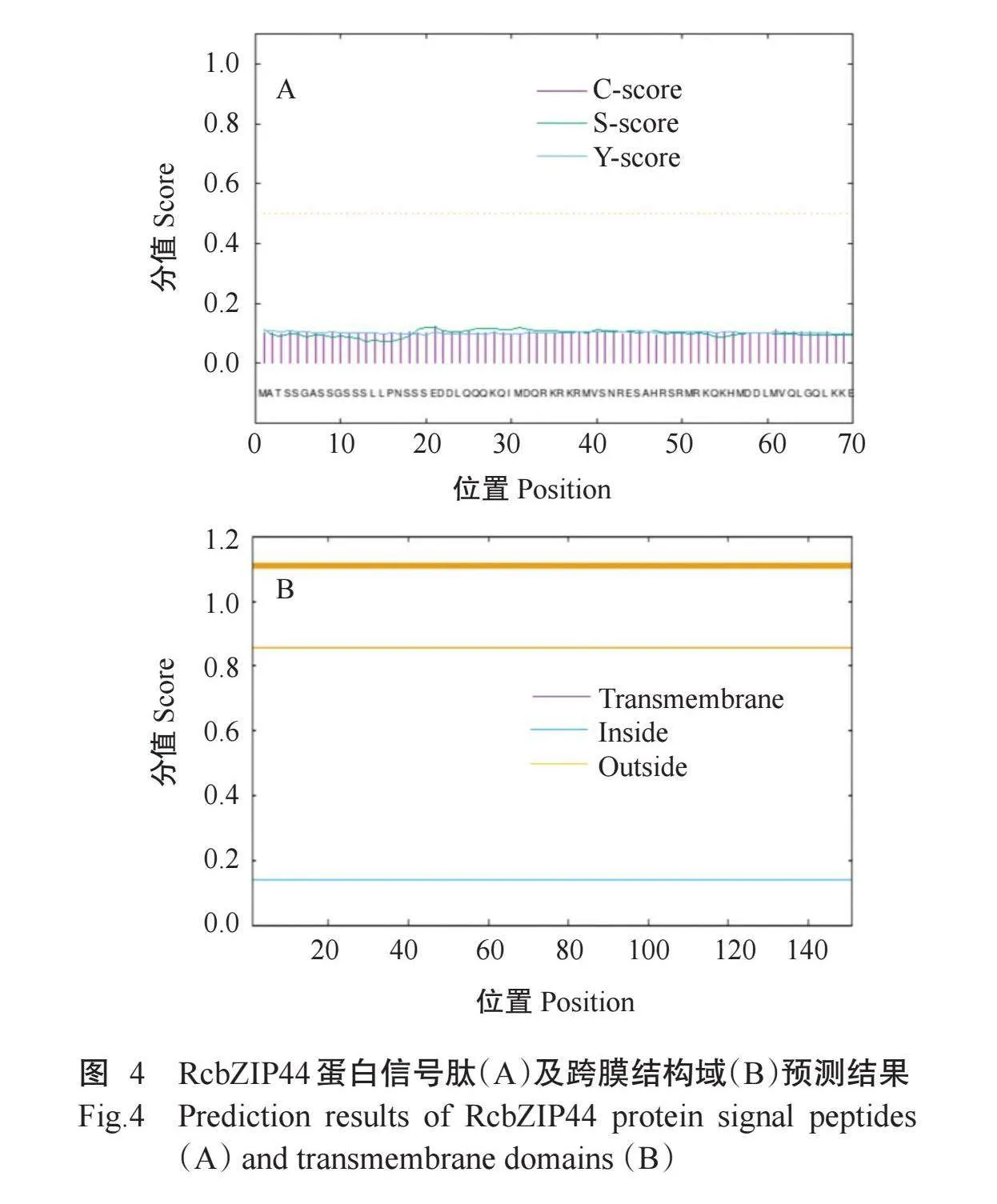
RcbZIP44蛋白的磷酸化位点预测结果(图3)显示,潜在的丝氨酸(Ser)数量最多,有18个(占11.9%);酪氨酸(Tyr)数量次之,有2个(占1.3%);苏氨酸(Thr)数量最少,有1个(占0.6%)。信号肽分析结果(图4-A)显示,RcbZIP44蛋白无信号肽。跨膜结构域分析结果(图4-B)显示,RcbZIP44蛋白不具有跨膜结构域。
2.4 RcbZIP44蛋白的二级和三级结构
二级结构预测结果(图5)显示,α-螺旋和无规则卷曲是RcbZIP44蛋白的主要结构元件,分别有100个(占66.23%)和43个(28.48%),延伸链和β-折叠分别有6个(占3.97%)和2个(占1.32%)。三级结构(图6-A)与二级结构预测结果相符,均以α-螺旋和无规则卷曲为主。利用SAVES v6.0在线工具生成RcbZIP44蛋白三级结构的拉氏图,进一步对三级结构进行检测(图6-B)。RcbZIP44蛋白三级结构的Φ角和Ψ角有60%位于最佳允许区(A、B、L)和次允许区,一致性达90%,表明RcbZIP44蛋白的三级结构预测结果合理可靠。
2.5多序列比对及系统发育分析结果
RcbZIP44氨基酸序列上传至NCBI数据库中进行BLAST比对,结果显示RcbZIP44蛋白与扁桃(P.dulcis,BBH09373.1)、葡萄(V.vinifera,RVW482 36.1)、鹰嘴豆(C.arietinum,XP_004500792.2)、梅(P.mume,XP_008236935.1)、小垫柳(S.brachista,KAB5547595.1)、枣树(Z.jujuba,XP_015889898.2)和毛果杨(P.trichocarpa,KAI5581465.1)的bZIP44氨基酸序列相似性分别为78.34%、64.86%、60.OvaWnNLQNcDvdfeOPiL0Exjp1zLjjlx1vQE5YdOjK0U=69%、59.15%、58.55%、57.14%和56.41%。多序列比对结果(图7)显示,8种作物bZIP44蛋白的N端表现出高度的保守性,尤其是在bZIP_plant_GBF1结构域的氨基酸序列一致性较高,而C端保守性较弱。由系统发育进化树(图8)可知,8种作物bZIP蛋白被划分为3个分支。RcbZIP44蛋白与小垫柳(KAB5547595.1)和毛果杨(KAI5581465.1)bZIP44同属一个进化分支(Group II),说明三者亲缘关系最近。
2.6 RcbZIP44基因启动子的克隆及序列分析
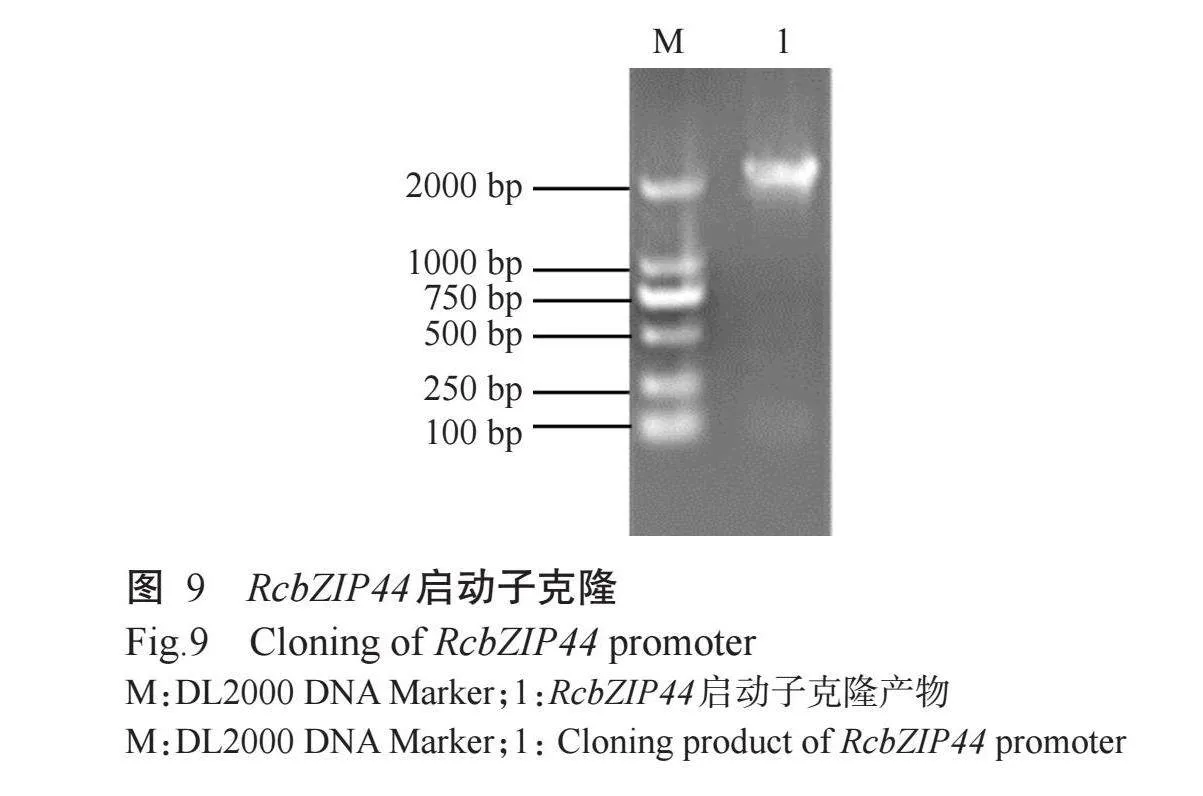
PCR扩增得到一条2kb片段(图9),与NCBI数据库中的RcbZIP44基因(XP_002521521.1)启动子相似性为100.00%。通过PlantCARE数据库分析启动子区域中的顺式作用元件,以期探究RcbZIP44基因的调控机制,结果如图10所示。RcbZIP44基因启动子共预测到197个具有功能注释的顺式作用元件,除含有TATA-box等核心元件外,还存在与光响应元件(G-box、I-box、GT1-motif)、激素响应元件(ABRE、GARE-motif、TATC-box、TGACG-motif)、胁迫响应元件(LTR、ARE、MRE)等,表明RcbZIP44基因在蓖麻的生长发育及胁迫响应等方面均发挥重要的调控作用。
2.7 RcbZIP44蛋白亚细胞定位结果
WoLF PSORT预测结果显示,RcbZIP44蛋白定位于细胞核中。借助烟草叶片瞬时表达系统对其进行验证,结果(图11)显示,绿色荧光在对照(pCAM‐BIA2300-CaMV35S-GFP)烟草叶片的细胞膜、细胞质和细胞核等均有显示,而被含pCAMBIA2300-CaMV35S-RcbZIP44-GFP的农杆菌GV3101侵染后烟草叶片表皮细胞的绿色荧光主要分布在细胞核,表明RcbZIP44蛋白定位于细胞核,与WoLF PSORT预测结果一致。RcbZIP44蛋白定位于细胞核中,推测其在细胞核中发挥重要作用,为后续研究RcbZIP44蛋白的生物学功能提供一定依据。
2.8 RcbZIP44基因表达分析结果
2.8.1组织表达特性分析利用实时荧光定量PCR检测RcbZIP44基因在蓖麻的根、茎、真叶和子叶中的表达模式,结果如图12所示。RcbZIP44基因在这些组织中均有不同程度的表达,其中,在茎中的相对表达量最高,显著高于其他组织(P<0.05,下同),其次在子叶中的相对表达量较高,显著高于根和真叶,在根和真叶中的相对表达量较低,表明RcbZIP44基因具有明显的组织表达特异性,推测其在维持蓖麻茎和子叶正常生长发育中发挥重要调控作用。
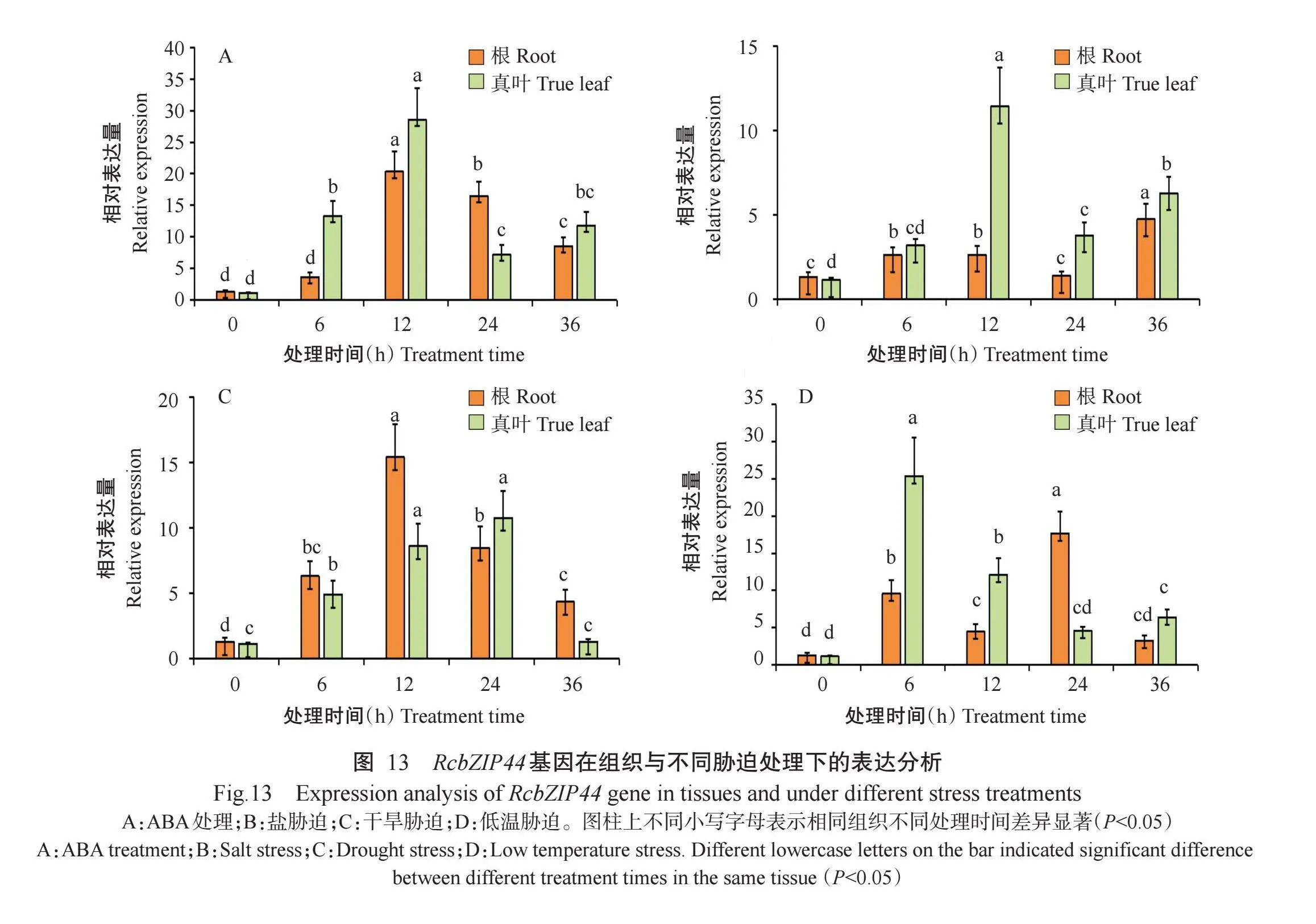
2.8.2非生物胁迫下表达模式分析利用实时荧光定量PCR检测RcbZIP44基因在ABA、盐、干旱和低温胁迫下蓖麻幼苗的真叶和根中的表达情况,结果如图13所示。在ABA、盐、干旱和低温胁迫下,RcbZIP44基因在真叶和根中表现出不同的表达模式,且RcbZIP44基因的相对表达量均高于处理0h。ABA处理12 h时RcbZIP44基因的相对表达量较处理0 h显著上调表达,且在真叶和根中均达高峰,分别是处理0h的41.8倍和11.2倍。盐胁迫后RcbZIP44基因的相对表达量整体呈上调趋势,处理12 h时RcbZIP44基因的相对表达量在真叶中达峰值,处理36 h时RcbZIP44基因的相对表达量在根中达峰值,分别是处理0h的10.1倍和3.6倍。干旱胁迫处理也能高效诱导RcbZIP44基因上调表达,在真叶和根中RcbZIP44基因的相对表达量分别在处理24和12 h时达峰值,分别是处理0h的9.5倍和11.8倍。低温胁迫处理后真叶和根中RcbZIP44基因的相对表达量分别在处理6和24h时达峰值,分别是0h的22.4倍和13.5倍,与处理0 h时相对表达量存在显著差异,说明RcbZIP44基因在蓖麻受非生物胁迫时高效表达,从而提高蓖麻对非生物胁迫的抗性。
3讨论
目前,bZIP转录因子家族成员已在蓖麻(Jin et al.,2014)、白桑(Morus alba L.)(邓璇等,2022)、艾(Artemisia argyi Lévl.et Vant)(程泊涵等,2023)、紫苏(Perilla frutescens)(黄旭升等,2023)等多个物种中被鉴定。本研究从蓖麻品种通蓖5号中克隆出1个bZIP转录因子基因RcbZIP4 并对其及编码的蛋白进行序列特征分析、亚细胞定位及表达特异性分析。研究发现,RcbZIP44蛋白的理化性质与苎麻[Boehmeria nivea(L.)Gaudich.](Huanget al.,2016)、芹菜(Apium graveolens L.)(沈迪等,2019)、白桑(邓璇等,2022)等物种中bZIP蛋白的理化性质具有一定的差异,推测是由进化差异所导致。Yang等(2019)研究发现,水稻OsbZIP60基因编码的蛋白无信号肽和跨膜域,二级结构的主要元件是“-螺旋,与本研究结果基本一致。植物bZIP转录因子基因家族可被分为多个亚家族,如Droger-Laser等(2018)将拟南芥中的bZIP划分13个亚族(A~M)。Jin等(2014)将蓖麻的49个RcbZIP蛋白分为9个亚族(A~I),其中G族中含bZIP-plant-GBF1结构域。由于RcbZIP44蛋白含bZIP-plant-GBF1结构域,故推测RcbZIP44蛋白属于G族。
研究发现,bZIP转录因子主要定位于细胞核中。Huang等(2016)、沈迪等(2019)、贾利强等(2021)将苎麻BnbZIP1、BnbZIP2、BnbZIP3、芹菜AgbZIP16及玉米ZmbZIP16基因编码蛋白均定位于细胞核。本研究通过RcbZIP44蛋白在烟草叶片中瞬时融合表达对其进行亚细胞定位,结果发现RcbZIP44蛋白定位于细胞核,与上述前人研究结果一致,表明RcbZIP44可能和大多数bZIP转录因子一样,具有核定位序列,能通过与靶基因特定区域结合来调控基因的表达(Yuetal.,2023)。
研究发现,bZIP转录因子会优先与A-box、G-box及ABRE等以ATGC为核心的顺式作用元件结合(Tsugama et al.,2012;贾利强等,2021),而这些均是典型的非生物胁迫响应元件,说明bZIP转录因子响应非生物胁迫。如苹果MdbZIP26基因通过ABA介导的信号转导途径提高植株的耐旱性和耐盐性得益于其启动子存在的ABRE核心元件(Wan et al.,2022);BsbZIP13基因启动子序列中含有干旱响应元件(MYB),过表达BsbZIP13基因的烟草较野生型烟草具有更高抗旱能力(赵光明等,2022)。本研究中,RcbZIP44基因启动子序列也含有G-box、ABRE及CAAT-box等元件,故推测RcbZIP44基因的表达受到激素和低温诱导,且RcbZIP44基因在非生物胁迫下的表达模式也印证了该推测结果,但该基因在非生物胁迫下的抵抗潜力及途径还有待深入研究。研究发现,bZIP转录因子在植物应对非生物胁迫的过程中主要通过基因的过量表达来实现,如大豆GmbZIP44基因可促进大豆叶片中脯氨酸的合成,提高大豆在低温和盐胁迫下的耐受能力(Liao et al.,2008);水稻OsbZIP88基因过表达可提高水稻对高盐和干旱的耐受能力(蒋钰东等,2020);香蕉(Musa acuminata)MabZIP53基因在低温、干旱及盐胁迫下相对表达量升高,表明MabZIP53基因在非生物胁迫中发挥重要作用(王霞等,2021)。本研究也发现,RcbZIP44基因在ABA、盐、干旱和低温胁迫下各时间点的相对表达量均高于处理0 h时,表明RcbZIP44基因积极响应非生物胁迫。后续RcbZIP44基因可作为培育蓖麻优良抗逆品种的基因资源,但其作用机理尚不明确,还有待进一步研究。
4结论
RcbZIP44基因编码的蛋白含有bZIP家族特有的bZIP-plant-GBF1结构域,其主要在茎中发挥调控作用,且该基因受ABA、盐、干旱和低温等非生物胁迫诱导表达,推测RcbZIP44基因在蓖麻生长发育及响应非生物胁迫中发挥重要作用。
参考文献(References):
曹丽茹,庞芸芸,叶飞宇,马晨晨,张新,王振华,鲁晓民.2024.玉米逆境胁迫响应基因ZmbZIP84的克隆与功能验证[J].核农学报,38(4):644-653.[Cao LR,Pang YY,Ye F Y,Ma C C,Zhang X,Wang Z H,Lu X M.2024.Cloning and functional verification of maize stress response gene ZmbZIP84[J].Journal of Nuclear Agricultural Scien-ces,38(4):644-653.]doi:10.5376/gab.cn.2011.30.0007.
程泊涵,王梦月,邬兰,高冉冉,尹青岗,师玉华,向丽.2023.艾bZIP基因家族全基因组鉴定及萜类合成调控基因筛选[J].中国中药杂志,48(19):5181-5194.[Cheng B H,Wang M Y,Wu L,Gao R R,Yin Q G,Shi Y H,Xiang L.2023.Genome-wide identification of bZIP family genes and screening of candidate AarbZIPs involved interpenoid biosynthesis in Artemisia argyi[J].China Journal of Chi-nese Materia Medica,48(19):5181-5194.]doi:10.19540/j.cnki.cjcmm.20230613.101.
邓璇,陈春兵,刘练练,邓静,李娟,查幸福.2022.白桑bZIP基因家族的全基因组鉴定及表达谱分析[J].蚕业科学,48(6):477-488.[Deng X,Chen C B,Liu L L,Deng J,Li J,Zha X F.2022.Genome-wide identification and expres-sion profile of bZIP gene family in white mulberry,Morus alba L.[J].Acta SericologicaSinica,48(6):477-488.]doi:10.13441/j.cnki.cykx.2022.06.001.
黄旭升,周雅莉,史先飞,高宇,董书言,蔡桂萍,李润植,王计平.2023.紫苏bZIP转录因子全基因组鉴定及对非生物胁迫的响应分析[J].植物生理学报,59(7):1383-1397.[Huang X S,Zhou Y L,Shi X F,Gao Y,Dong S Y,Cai G P,Li R Z,Wang J P.2023.Genome-wide characterization and abiotic stress response analysis of bZIP transcriptionfactors in Perilla frutescens[J].Plant Physiology Journal,59(7):1383-1397.]doi:10.13592/j.cnki.ppj.100454.
贾利强,吴洪梅,曾科美,龙金云,郑飞,赵秋芳,陈曙.2021.10个玉米ZmbZIP基因表达模式分析[J].福建农业学报,36(11):1255-1263.[Jia L Q,Wu H G,Zeng K M,Long J Y,Zheng F,Zhao Q F,Chen S.2021.Analysis of expression patterns of 10 maize ZmbZIP genes[J].Fujian Journal of Agricultural Sciences,36(11):1255-1263.]doi:10.19303/j.issn.1008-0384.2021.11.001.
蒋钰东,罗俊涛,何兴材,杨扬,付均,郑军,况浩池,曾正明.2020.水稻BZIP类转录因子在逆境胁迫下的作用[J].分子植物育种,18(7):2196-2201.[Jiang Y D,Luo J T,He X C,Yang Y,Fu J,Zheng J,Kuang H C,Zeng Z M.2020.The effect of the BZIP transcription factors under abiotic stress in rice[J].Molecular Plant Breeding,18(7):2196-2201.]doi:10.13271/j.mpb.018.002196.
李健,李曦,农艳丰.2023.芒果bZIP转录因子基因的克隆、亚细胞定位及表达分析[J].江苏农业科学,51(21):29-36.[Li J,Li X,NongY F.2023.Cloning,subcellular locali-zation and expression analysis of mango bZIP transcription factor gene[J].Jiangsu Agricultural Sciences,51(21):29-36.]doi:10.15889/j.issn.1002-1302.2023.21.005.
李金琴,朱国立,李靖霞,田福东,张春华,吴国林,王建伟.2004.蓖麻新品种通蓖5号的选育[J].内蒙古农业科技,(1):10-11.[Li J Q,Zhu G L,Li J X,Tian F D,Zhang C H,Wu G L,Wang J W.2004.Selection of a new castor-oil plant variety Tongbi 5[J].Inner Mongolia Agricultural Science and Technology,(1):10-11.]doi:1010.3969/j.issn.1007-0907.2004.01.008.
萨茹拉,刘鹏.2021.蓖麻适应非生物胁迫的研究进展[J].内蒙古民族大学学报(自然科学版),36(2):135-139.[Sa R L,Liu P.2021.Research progress on the adaptation of cas-tor to abiotic stress[J].Journal of Inner Mongolia Minzu University(Natural Sciences Edition),36(2):135-139.]doi:10.14045/j.cnki.15-1220.2021.02.009.
沈迪,陈龙正,陶建平,刘洁霞,冯凯,尹莲,徐志胜,熊爱生.2019.芹菜bZIP转录因子基因AgbZIP16的逆境响应分析[J].植物生理学报,55(12):1817-1826.[Shen D,Chen L Z,Tao J P,Liu J X,Feng K,Yin L,Xu Z S,Xiong A S.2019.Stress response analysis of AgbZIP16,a bZIPtran-scription factor gene,in Apium graveolens[J].Journal of Plant Physiology,55(12):1817-1826.]doi:10.13592/j.cnki.ppj.2019.0198.
孙晓丽,李勇,才华,柏锡,纪巍,季佐军,朱延明.2011.拟南芥bZIP1转录因子通过与ABRE元件结合调节ABA信号传导[J].作物学报,37(4):612-619.[Sun X L,Li Y,Cai H,Bai X,Ji W,Ji Z J,Zhu Y M.2011.Arabidopisis bZIP1 transcription factor binding to the ABRE cis-element regulates abscisic acid signal transduction[J].Acta Agro-nomicaSinica,37(4):612-619.]doi:10.3724/SP.J.1006.2011.00612.
王霞,林秋妹,贾彩红,王静毅,刘菊华,黄绵佳,从心黎,王卓.2021.香蕉MabZIP53基因的克隆和表达分析[J].分子植物育种,19(19):6302-6308.[Wang X,Lin Q M,Jia C H,Wang J Y,Liu J H,Huang M J,Cong X L,Wang Z.2021.Cloning and expression analysis of banana MabZIP53 gene[J].Molecular Plant Breeding,19(19):6302-6308.]doi:10.13271/j.mpb.019.006302.
张树军,狄建军,白靓,黄凤兰,穆莎茉莉,魏永春,张国文.2011.蓖麻饼粕的脱毒及综合开发利用[J].内蒙古民族大学学报(自然科学版),26(5):549-551.[Zhang S J,Di J J,Bai L,Huang F L,Musa M L,Wei Y C,Zhang G W.2011.Detoxification and comprehensive development and utilization of castor meal[J].Journal of Inner Mongolia Minzu University(Natural Sciences Edition),26(5):549-551.]doi:10.3969/j.issn.1671-0185.2011.05.016.
赵光明.2022.白及bZIP基因家族鉴定与BsbZIP10和BsbZIP13基因功能研究[D].西安:陕西师范大学.[Zhao G M.2022.Identification of bZIP gene family in Bletillastriata(Thunb.exA.Murray)Rchb and functional study of BsbZIP10 and BsbZIP13 genes[D].Xi’an:Shaanxi Normal University.]
Alves M S,Dadalto S P,Gonçalves A B,De Souza G B,Barros V A,Fietto L G.2013.Plant bZIP transcription factors responsive to pathogens:A review[J].International Jour-nal of Molecular Sciences,14(4):7815-7828.doi:10.3390/ijms 14047815.
Dröge-Laser W,Snoek BL,Snel B,Weiste C.2018.The Arabi-dopsisbZIP transcription factor family—An update[J].Current Opinion in Plant Biology,45:36-49.doi:10.1016/j.pbi.2018.05.001.
Dröge-Laser W,Weiste C.2018.The C/S1bZIP network:A regulatory hub orchestrating plant energy homeostasis[J].Trends in Plant Science,23(5):422-433.doi:10.1016/j.tplants.2018.02.003.
Duan L L,Mo Z J,Fan Y,Li K Y,Yang M F,Li D C,Ke Y Z,Zhang Q,Wang F Y,Fan Y,Liu R X.2022.Genome-wide identification and expression analysis of the bZIPtranscrip-tion factor family genes in response to abiotic stress in Nicotiana tabacum L[J].BMC Genomics,23(1):318.doi:10.1186/s 12864-022-08547-z.
Huang C J,Zhou J H,Jie Y C,Xing H C,Zhong Y L,Yu W L,She W,Ma Y S,Liu Z H,Zhang Y.2016.A ramie bZIP transcription factor BnbZIP2 is involved in drought,salt,and heavy metal stress response[J].DNA and Cell Bio-logy,35(12):776-786.doi:10.1089/dna.2016.3251.
Jiang J J,Ma S H,Ye N H,Jiang M,Cao J S,Zhang J H.2017.WRKY transcription factors in plant responses to stresses[J].Journal of Integrative Plant Biology,59(2):86-101.doi:10.1111/jipb.12513.
Jin Z W,Xu W,Liu A Z.2014.Genomic surveys and expres-sion analysis of bZIP gene family in castor bean(Ricinus communis L.)[J].Planta,239(2):299-312.doi:10.1007/s00425-013-1979-9.
Li H Y,Li L X,Shangguan G D,Jia C,Deng S N,Noman M,Liu Y L,Guo Y X,Han L,Zhang X M,Dong YY,Ahmad N,Du LN,Li H Y,Yang J.2020.Genome-wide identifica-tion and expression analysis of bZIP gene family in Car-thamus tinctorius L[J].Scientific Reports,10(1):15521.doi:10.1038/s41598-020-72390-z.
Li Z Y,Fu D Y,Wang X,Zeng R,Zhang X,Tian J G,Zhang S S,Yang X H,Tian F,Lai J S,Shi Y T,Yang S H.2022.The transcription factor bZIP68 negatively regulates cold tolerance in maize[J].The Plant Cell,34(8):2833-2851.doi:10.1093/plcell/koac 137.
Liao Y,Zou H F,Wei W,Hao Y J,Tian A G,Huang J,Liu Y F,Zhang J S,Chen S Y.2008.Soybean GmbZIP4 GmbZIP62 and GmbZIP78 genes function as negative regulator of ABA signaling and confer salt and freezing to-lerance in transgenic Arabidopsis[J].Planta,228(2):225-240.doi:10.1007/s00425-008-0731-3.
Liu C T,Mao B G,Ou S J,Wang W,Liu L C,Wu Y B,Chu C C,Wang X P.2014.OsbZIP7 a bZIP transcription factor,confers salinity and drought tolerance in rice[J].Plant Mo-lecular Biology,84(1-2):19-36.doi:10.1007/s 11103-013-0115-3.
Liu C T,Ou S J,Mao B G,Tang J Y,Wang W,Wang H R,Cao S Y,Schläppi M R,Zhao B R,Xiao G Y,Wang X P,Chu C C.2018.Early selection of bZIP73 facilitated adaptation of japonica rice to cold climates[J].Nature Communica-tions,9(1):3302.doi:10.1038/s41467-018-05753-w.
Liu H T,Tang X,Zhang N,Li S G,Si H J.2023.Role of bZIP transcription factors in plant salt stress[J].International Journal of Molecular Sciences,24(9):7893.doi:10.3390/ijms24097893.
Santner A,Estelle M.2010.The ubiquitin-proteasome system regulates plant hormone signaling[J].The Plant Journal,61(6):1029-1040.doi:10.1111/j.1365-313x.2010.04112.x.
Tsugama D,Liu S K,Takano T.2012.A bZIP protein,VIP is a regulator of osmosensory signaling in Arabidopsis[J].Plant Physiology,159(1):144-155.doi:10.1104/pp.112.197020.
Tully J P,Hill A E,Ahmed H M,Whitley R,Skjellum A,Mukhtar M S.2014.Expression-based network biology identifies immune-related functional modules involved in plant defense[J].BMC Genomics,15:421.doi:10.1186/1471-2164-15-421.
Wan Y,Wang Y Q,Wang F,Feng S S,Zhang L,Wang X P,Gao H.2022.Heterologous expression of the apple MdbZIP26 gene in Arabidopsis thaliana improves resis-tance to high salinity and drought stress[J].Agronomy,12(11):2624.doi:10.3390/agronomy 12112624.
Wang Q,Guo C,Li Z,Sun J,Wang D,Xu L,Li X,Guo Y.2021.Identification and analysis of bZIP family genes in potato and their potential roles in stress responses[J].Fron-tiers in Plant Science,12:637343.doi:10.3389/fpls.2021.637343.
Yang S Q,Xu K,Chen S J,Li T F,Xia H,Chen L,Liu H Y,Luo L J.2019.A stress-responsive bZIP transcription fac-tor OsbZIP62 improves drought and oxidative tolerance in rice[J].BMC Plant Biology,19(1):260.doi:10.1186/s12870-019-1872-1.
Ying S,Zhang D F,Fu J,Shi Y S,Song Y C,Wang T Y,Li Y.2012.Cloning and characterization of a maize bZIPtran-scription factor,ZmbZIP7 confers drought and salt tole-rance in transgenic Arabidopsis[J].Planta,235(2):253-266.doi:10.1007/s00425-011-1496-7.
Yu Y G,He L Y,Wu Y X.2023.Wheat WRKY transcription factor TaWRKY24 confers drought and salt tolerance in transgenic plants[J].Plant Physiology and Biochemistry,205:108137.doi:10.1016/j.plaphy.2023.108137.
Zhu M K,Meng X Q,Cai J,Li G,Dong T T,Li Z Y.2018 Basic leucine zipper transcription factor SlbZIP1 mediates salt and drought stress tolerance in tomato[J].BMC Plant Biology,18(1):83.doi:10.1186/s 12870-018-1299-0.
(责任编辑陈燕)
