利用CRISPR-Cas9技术编辑OsBADH2基因改良优质恢复系桂恢852的香味品质
2024-10-15齐金岗陈颖刘开强王小姣李林娟赵丽冰李孝琼郭嗣斌




摘要:【目的】利用CRISPR-Cas9技术编辑桂恢852的甜菜碱醛脱氢酶基因(OsBADH2),以期快速改良广西优质恢复系桂恢852的香味品质,为广西香稻新种质的创制提供亲本资源及技术参考。【方法】以广西优质非香型水稻桂恢852为材料,对其OsBADH2蛋白的序列特征、保守结构域、保守基序、系统发育进化等进行分析,再根据CRISPR-GE网站信息挑选合适的靶位点,分别构建OsBADH2基因第1、2外显子的双突载体pLM62和第7外显子的单突载体pLM63。利用CRISPR-Cas9技术和水稻遗传转化技术靶向敲除桂恢852的OsBADH2基因,获取不同类型的osbadh2突变体。以桂恢852为对照,通过咀嚼法鉴定突变体osbadh2是否具有香味。最后,通过农艺性状测定和单因素方差分析,判断OsBADH2基因突变是否影响农艺性状。【结果】OsBADH2基因序列全长为6268 bp,包含15个外显子和14个内含子,其编码区(CDS)为1512 bp,编码503个氨基酸残基,具有1个典型的Aldedh结构域(第16~485位氨基酸),属于醛脱氢酶,其蛋白序列与结构相对保守。通过OsBADH2氨基酸序列的BLAST比对分析,分别获得水稻的3个高相似性蛋白和拟南芥的4个高相似性蛋白,其中水稻OsBADH1、OsBADH2、OsALDH2B2、OsALDH2C1及拟南芥BADH1、BADH2、AL2C4均属于ALDH-SF(Aldehyde dehydrogenase superfamily)超家族成员。OsBADH2与OsBADH1为旁系同源基因,与拟南芥中BADH1和BADH2为直系同源基因。在桂恢852的遗传背景下成功获得4种突变类型且不含T-DNA的纯合突变体株系(osbadh2-1~osbadh2-4)。这4种突变类型均会使OsBADH2基因发生移码突变,导致翻译过程提前终止,破坏OsBADH2蛋白的原有结构和功能,导致4个osbadh2突变体株系的稻米产生香气。4个osbadh2突变体株系的株高、有效穗数、穗长、结实率、千粒重、长宽比与桂恢852野生型间无显著差异(P>0.05),但osbadh2-2突变体与osbadh2-4突变体的结实率存在极显著差异(P<0.01)。【结论】桂恢852的4个osbadh2突变体株系均具有香味品质,且综合农艺性状与野生型无显著差异,表明利用CRISPR-Cas9基因编辑技术能快速定向改变水稻品种的目标性状,极大缩短了育种年限。
关键词:水稻;恢复系;香味;OsBADH2;CRISPR-Cas9
中图分类号:S511.035.3文献标志码:A文章编号:2095-1191(2024)07-2058-11
Improving the aroma quality of high-quality restorer lineGuihui 852 by editing OsBADH2 gene withCRISPR-Cas9 technology
QI Jin-gang,CHEN Ying,LIU Kai-qiang,WANG Xiao-jiao,LI Lin-juan,ZHAO Li-bing,LI Xiao-qiong*,GUO Si-bin*
(Rice Research Institute,Guangxi Academy of Agricultural Sciences/Guangxi Key Laboratory of Rice Genetics andBreeding/State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources,Nanning,Guangxi 530007,China)
Abstract:【Objective】CRISPR-Cas9 technology was used to edit the betaine aldehyde dehydrogenase gene(Os-BADH2)of Guihui 85 in order to quickly improve the aroma quality of the high-quality restorer line Guihui 852 in Guangxi,and to provide parental resources and technical references for the creation of new fragrant rice germplasm in Guangxi.【Method】The sequence characteristics,conserved domains,conserved motifs and phylogenetic evolution of the OsBADH2 protein of Guihui 85 a high-quality non-fragrant rice in Guangxi,were analyzed.According to the informa-tion on the CRISPR-GE website,appropriate target sites were selected to construct the double mutation vector pLM62 for the first and second exons of the OsBADH2 gene and the single mutation vector pLM63 for the seventh exon.The Os-BADH2 gene of Guihui 852 was targetedly knocked out using CRISPR-Cas9 technology and rice genetic transformation technology to obtain different types of osbadh2 mutants.Guihui 852 was used as a control,and the chewing method was used to identify whether the mutant osbadh2 had aroma.Finally,agronomic traits were determined and one-way ANOVA was performed to determine whether the mutation of OsBADH2 gene affected agronomic traits.【Result】The full length of OsBADH2 gene sequence was 6268 bp,including 15 exons and 14 introns.Its coding region(CDS)was 1512 bp,enco-ding 503 amino acid residues.It had a typical Aldedh domain(amino acids positions 16-485),belonging to aldehyde dehy-drogenase,and its protein sequence and structure were relatively conservative.Through BLAST analysis of OsBADH2 amino acid sequence,three highly similar proteins in rice and four highly similar proteins in Arabidopsis were obtained.OsBADH OsBADH OsALDH2B OsALDH2C1 of rice,BADH BADH2 and AL2C4 of Arabidopsis thaliana all be-longed to the ALDH-SF(Aldehyde dehydrogenase superfamily)members.OsBADH2 and OsBADH1 were paralogous genes,and were orthologous genes to BADH1 and BADH2 in A.thaliana.Four homozygous mutant lines(osbadh2-1-osbadh2-4)without T-DNA were successfully obtained under the genetic background of Guihui 852.All four types of mu-tations could cause frameshift mutations in the OsBADH2 gene,resulting in premature termination of the translation pro-cess,destroying the original structure and function of the OsBADH2 protein,and causing the rice of the four osbadh2 mutant lines to produce aroma.There were no significant differences in plant height,effective panicle number,panicle length,seed setting rate,1000-grain weight,and length-to-width ratio between the four osbadh2 mutant lines and Guihui 852 wild type(P>0.05),but there was extremely significant difference in seed setting rate between the osbadh2-2 mutant and the osbadh2-4 mutant(P<0.01).【Conclusion】The four osbadh2 mutant lines of Guihui 852 all have aroma quality,and the comprehensive agronomic traits are not significantly different from those of the wild type,indicating that the CRISPR-Cas9 gene editing technology can quickly and directionally change the target traits of rice varieties,greatly shor-tening the breeding period.
Key words:rice;restorer line;aroma;OsBADH2;CRISPR-Cas9
Foundation items:Joint Fund of National Natural Science Foundation of China(U20A2031);General Project of Guangxi Natural Science Foundation(2022GXNSFAA035494);Science and Technology Development Project of Guangxi Academy of Agricultural Sciences(Guinongke 2022JM23)
0引言
【研究意义】水稻(Oryza sativa L.)是世界三大主要粮食作物之一(韩建军等,2023),传统育种目标主要聚焦于水稻产量的提升和植株抗性的增强,但随着人们生活水平的提高,水稻品种选育在追求高产高抗的同时,对稻米品质也提出更高的要求。稻米品质主要分为食味品质(香味、胶稠度、碱消值、直链淀粉含量等)和外观品质(整精米率、长宽比、垩白度等),其中香味是重要的食味品质性状之一。香米因具有独特的芳香味,在市场上颇受消费者青睐,价格明显高于普通稻米,具有较高的经济价值和市场潜力(刘广林等,2022)。传统香稻品种存在适应性差、产量低、病虫害抗性弱等缺点,利用传统杂交选育方法易引入供体亲本的劣质基因,增加育种难度(彭波等,2017),同时还要面临选育周期长、性状鉴定难等问题。CRISPR-Cas9基因编辑技术可靶向敲除1个或多个基因,实现性状快速定向改变。由于甜菜碱醛脱氢酶(BADH)基因是调控香味产生的主效基因(Bradbury et al.,2005;Chen et al.,2006;Sakthivel et al.,2009;Shao et al.,2013;潘阳阳等,2021),其可抑制水稻香味的生成或改变香味。因此,利用CRISPR-Cas9基因编辑技术对优质恢复系桂恢852进行OsBADH2基因靶向敲除和香味定向改良,以期大幅缩短优质香型恢复系的育种年限和选育成本,为杂交选育优质香稻提供亲本资源,具有重要的研究意义。【前人研究进展】我国香稻栽培历史悠久,国内有名的香稻品种包括五常稻花香米、靖西香糯等(曾宇等,2017;侯学然和王荣升,2021)。依据稻米的香气可将香稻分为爆米花型、茉莉花型、紫罗兰型、山核桃型、莴苣笋型等(胡培松等,2006),其中又以爆米花型为主。研究发现,2-乙酰-1-吡咯啉(2-AP)是稻米产生香味的关键物质,OsBADH2可通过氧化2-AP的前体物质γ-氨基丁醛(GABald)生成γ-氨基丁酸(GABA),抑制2-AP的合成与积累,造成水稻不同品种间的香味程度差异(Juwatta-nasomran et al.,2011;Kuaprasert et al.,2011;Wong-panya et al.,2011;Okpala et al.,2019)。目前已鉴定出多个OsBADH2基因的变异位点,并据此开发设计出相应的分子标记用于品种选育,如针对OsBADH2基因第2、7外显子缺失所设计InDel-E2和InDel-E7(王军等,2008);针对OsBADH2基因第4、5外显子间803 bp的碱基缺失所设计FMbadh2-E4-5(Shao et al.,2011);针对缅甸香稻OsBADH2基因第13外显子上3 bp的碱基插入所设计3In2AP(Myint et al.,2012)。曾宇等(2017)通过分子标记对179个广西香稻地方品种OsBADH2基因进行基因型鉴定,结果发现这些材料主要以InDel7和InDel4-5等位基因型为主。近年来,广西香稻选育取得丰硕成果,先后利用OsBADH2基因的第7外显子变异位点设计分子标记育成多个品种,如桂野香占(韦敏益等,2021)、那谷香(李孝琼等,2023)、桂香99(李虎等,2023)等。随着基因工程技术的发展,已有研究者通过多种手段沉默优良品种中OsBADH2基因,可在原有基础上快速获得香味性状,以增强其食味品质,如通过RNA干扰(RNAi)技术使OsBADH2基因表达下调,促进2-AP积累(Niu etal.,2008);通过基因编辑工具(TALENs)敲除OsBADH2基因,在T2代中筛选获得2-AP含量明显提高的纯合突变体(Shan et al.,2015)。CRISPR-Cas9使基因编辑技术的安全性和效率均有了大幅度的提升,先后有研究者对ZH11(邵高能等,2017)、东农425(孙慧宇等,2019)、龙粳11(徐善斌等,2020)、嘉58和秀水134(祁永斌等,2020)等水稻材料进行OsBADH2基因敲除,使其获得香味性状。【本研究切入点】目前未见利用CRISPR-Cas9基因编辑技术对优质恢复系桂恢852进行OsBADH2基因靶向敲除和香味定向改良的研究报道。【拟解决的关键问题】以广西优质非香型水稻桂恢852为材料,根据OsBADH2基因的第1、2、7外显子分别设计靶位点,利用CRISPR-Cas9技术进行定向编辑,探究不同类型的突变方式对香味生成机制的影响,以期获得OsBADH2突变且稳定遗传的无标记香型植株,为广西香稻新种质的创制提供亲本资源及技术参考。
1材料与方法
1.1试验材料
供试材料为广西优质恢复系桂恢85 由广西农业科学院水稻研究所提供。主要菌种为大肠杆菌DH5“感受态细胞和农杆菌EHA105感受态细胞,购自北京全式金生物技术有限公司。水稻基因编辑载体pHUE411E由武汉大学提供。主要试剂:普通PCR酶2×Taq Master Mix、高保真PCR酶Phanta Max Super-Fidelity DNA Polymerase和T4连接酶T4 DNALigase(Rapid)购自南京诺唯赞生物科技股份有限公司;Bsa I限制性内切酶Bsa I GMP-grade购自翌圣生物科技(上海)股份有限公司;普通DNA产物纯化试剂盒(TIANquick Midi Purification Kit)和质粒小提试剂盒(TIANprep Mini Plasmid Kit)购自天根生化科技(北京)有限公司。主要仪器设备:离心机(德国Eppendorf公司)、普通PCR仪(美国BIO-RAD公司)、电泳仪(美国BIO-RAD公司)等。
1.2 OsBADH2基因序列特征及结构分析
通过Phytozome(https://phytozome-next.jgi.doe.gov/)数据库获得OsBADH2基因全长序列、编码区(CDS)及其编码的氨基酸序列。通过SMART(https://smart.embl.de/)数据库预测OsBADH2蛋白的结构域。借助GSDS网站(https://gsds.gao-lab.org/)对OsBADH2基因结构及其编码蛋白结构进行可视化处理。通过Phytozome数据库BLAST搜索水稻和拟南芥中与OsBADH2氨基酸序列相似性较高的序列,再利用DNAMAN 6.0进行氨基酸序列比对及系统发育进化树构建。通过MEM进行保守基序及保守结构域分析,借助TBtools完成可视化(Chen et al.,2023)。
1.3基因编辑载体构建
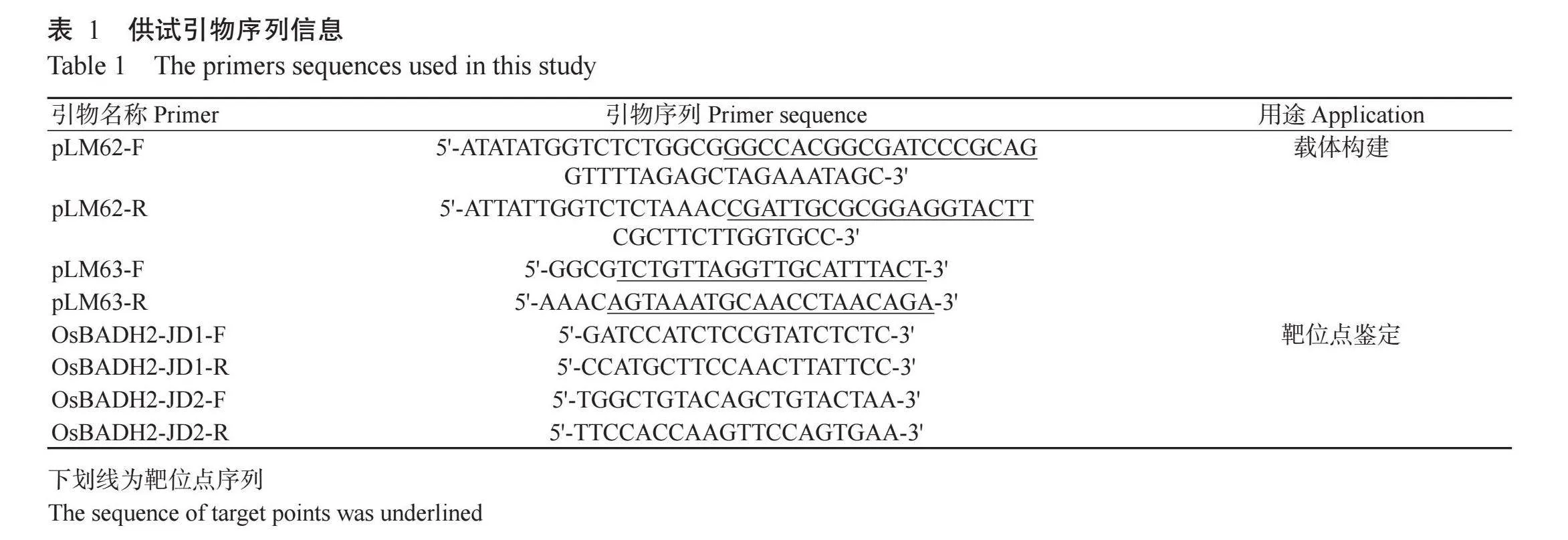
借助华南农业大学刘耀光院士课题组开发的CRISPR-GE网站(http://skl.scau.edu.cn/)分别在OsBADH2基因的第1、2、7外显子处设计靶位点(表1)。PCR扩增启动子—靶位点—gRNA表达盒,利用Bsa I和T4 DNA ligase通过“边切边连”的方式将启动子—靶位点—gRNA表达盒连接至pHUE411E载体上,获得双突载体pLM62和单突载体pLM63(图1)。
1.4基因编辑方式分析
将双突载体pLM62和单突载体pLM63分别转化农杆菌EHA105感受态细胞中,挑取阳性菌株送至武汉伯远生物科技有限公司,委托其完成桂恢852的遗传转化试验。取转基因阳性eA71rK5INaypZYIIa2/dkQ==苗部分叶片组织,利用CTAB法提取其总DNA。选取OsBADH2基因靶位点前后适当位置设计其引物序列,通过PCR扩增靶位点前后序列,并送生工生物工程(上海)股份有限公司进行测序。借助CRISPR-GE网站分析测序结果,明确基因编辑方式。
1.5香味性状鉴定
以桂恢852为对照,请3名专业人员通过咀嚼法对无T-DNA插入的T3代纯合突变体进行成熟籽粒香味性状鉴定。每位测试人员分发5袋试验组盲样和1袋对照组样品,每袋样品包含10粒糙米,其中5袋盲样分别为4个突变株系osbadh2-1~osbadh2-4和桂恢852eg(试验组中的桂恢85 用于判断专业人员鉴定结果是否准确可靠)。若10粒种子均被鉴定为非香型,则说明该株系种子不具备香气,若连续5粒种子均被鉴定为香型,则认为该株系种子具备香气。若鉴定结果不一致或专业人员未能鉴别出桂恢852eg,则再重新请3名专业人员进行补充鉴定。
1.6统计分析
以桂恢852为对照,每个株系各取5个单株作为生物学重复,分别记录株高、有效穗数、穗长、结实率、千粒重和长宽比,所有数据由平均值±标准差表示;利用SPSS 20.0进行单因素方差分析(Bonferroni检验),明确各组分间差异性;借助GraphPad Prism进行数据可视化。
2结果与分析
2.1 OsBADH2序列特征及结构分析
通过Phytozome数据库获得OsBADH2基因序列全长(6268 bp)及其CDS序列(1512 bp),经分析发现该基因全长序列包含15个外显子和14个内含子,其CDS序列编码503个氨基酸残基(图2-A和图2-B)。从Phytozome数据库上获得OsBADH2氨基酸序列,经SMART分析发现,OsBADH2蛋白具有1个典型的Aldedh结构域(位于第16~485位氨基酸)(图2-B),属于醛脱氢酶。
在Phytozome数据库上对OsBADH2氨基酸序列进行BLAST比对分析,获得水稻的3个高相似性蛋白OsBADH1(LOC_Os04g39020)、OsALDH2B2(LOC_Os06g39230)、OsALDH2C1(LOC_Os01g408 70)及拟南芥的4个高相似性蛋白BADH1(At1g749 20)、BADH2(At3g48170)、AL2C4(At3g24503)和AL2B4(At3g48000)。利用DNAMAN 6.0对这些蛋白进行氨基酸序列比对,结果发现这些蛋白序列保守性较高(图2-C)。对这8个蛋白进行保守结构域分析,结果发现OsBADH1、OsBADH2及拟南芥BADH1和BADH2均具有相同的PLN02467结构域,与含PLN02766结构域的OsALDH2C1和拟南芥AL2C 以及含ALDH-SF(Aldehyde dehydrogenasesuperfamily)结构域的OsALDH2B2属于同一超家族,与含PLN02466结构域的拟南芥AL2B4蛋白不属于同一家族(图2-D),推测OsBADH1、OsBADH2蛋白及拟南芥BADH1和BADH2蛋白的亲缘关系更近。通过保守基序分析发现,8个蛋白中均含有Motif 1、Motif 2、Motif 3、Motif 4、Motif 5、Motif 6和Motif 9,仅OsBADH1、OsBADH2及拟南芥BADH1和BADH2蛋白具有10个Motif(Motif 1~Motif 10)(图2-E),进一步证实这4个蛋白亲缘关系较近。基于这8个蛋白的氨基酸序列构建系统发育进化树,可推测OsBADH2与OsBADH1为旁系同源基因,与拟南芥BADH1和BADH2为直系同源基因,说明四者在进化上确实具有同源性(图2-F)。
2.2构建优质恢复系桂恢852的osbadh2突变体
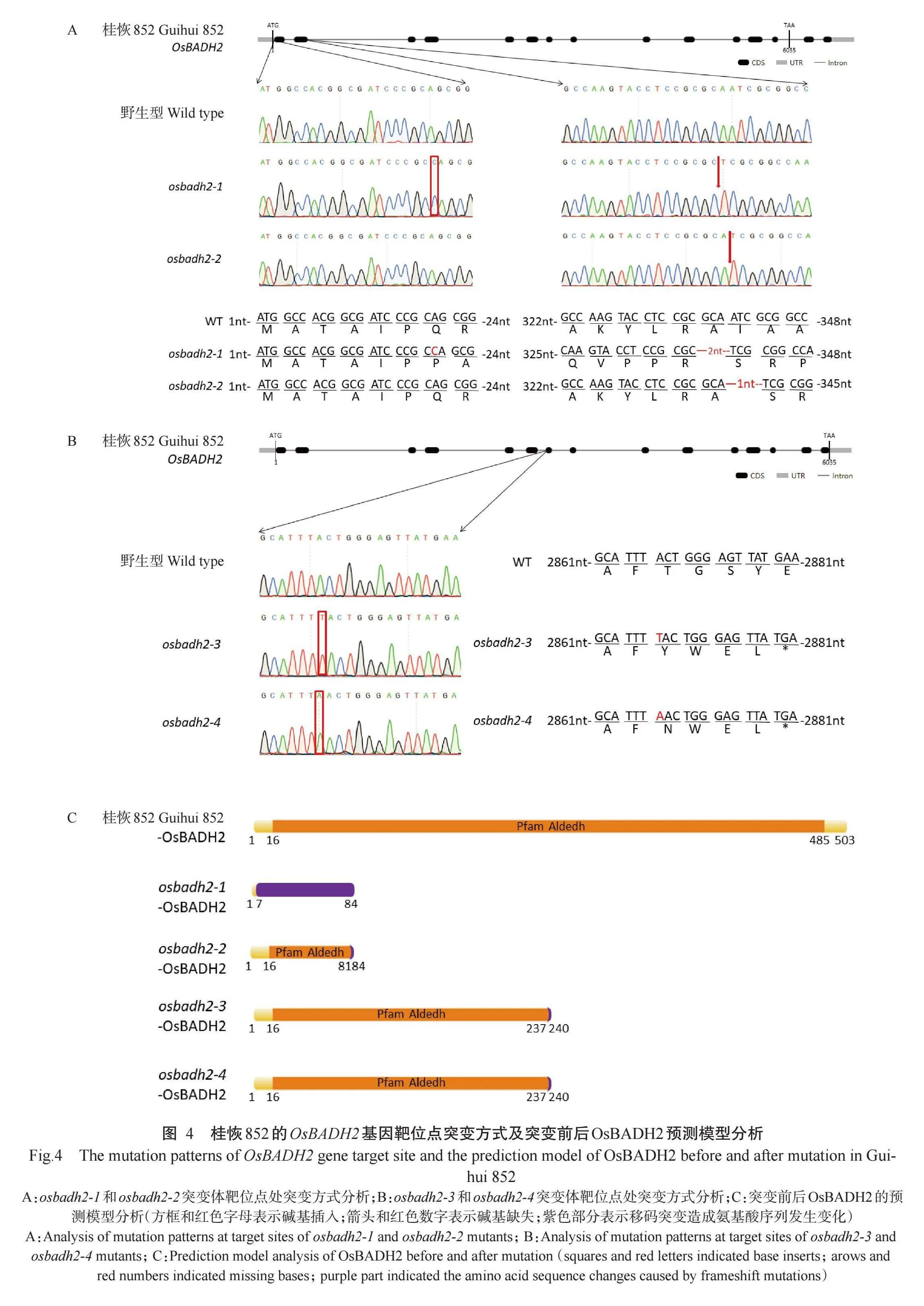
桂恢852第1、2、7外显子的测序结果显示,OsBADH2基因序列与参考基因组(日本晴)相同,未见有常见香型稻在第2、7外显子的突变(图3-A和图3-B)。为改良桂恢852的食味品质,使其具有香味,分别构建针对第1、2外显子的双突载体pLM62和针对第7外显子的单突载体pLM63。利用CRISPR-Cas9技术和水稻遗传转化技术成功获得osbadh2突变体的T0代杂合阳性植株。将T0代杂合阳性植株种植于转基因温网室,利用水稻自花授粉引起基因分离的特性进行选育,最终筛选获得4种不同突变类型且不含T-DNA的T3代纯合突变体株系,命名为osbadh2-1~osbadh2-4。
测序结果显示,osbadh2-1突变体株系在第1外显子的靶位点处发生1个碱基的插入(+C),同时在第2外显子的靶位点处发生2个碱基的缺失(-AA),最终造成OsBADH2基因整体发生1个碱基的缺失(图4-A)。osbadh2-2突变体株系在第1外显子处未发生突变,在第2外显子的靶位点处发生1个碱基的缺失(-A)(图4-A)。osbadh2-3和osbadh2-4突变体株系均在第7外显子的靶位点处发生1个碱基的插入(+T、+A)(图4-B)。对基因突变后翻译的氨基酸序列进行预测分析,结果发现,与桂恢852野生型相比,上述4种突变类型均会使OsBADH2基因发生移码突变,导致翻译过程提前终止(图4-C)。
2.3 osbadh2突变体的香味性状鉴定结果
为探究4个突变体是否具有香气,采用咀嚼法对其香味性状进行鉴定,结果显示,4个突变体均为香稻品系,对照组桂恢852与试验组桂恢852eg均被鉴定为非香稻品种(表2),表明4种突变类型造成的移码突变均能破坏OsBADH2在香味调控通路中的作用,靶向敲除桂恢852的OsBADH2基因能为其增添香味。
由图4可知,虽然osbadh2-1、osbadh2-2、osbadh2-3和osbadh2-4突变体的靶位点突变方式存在差异,且突变后翻译的氨基酸序列也有不同,但均破坏了OsBADH2的原有蛋白结构,表明其功能发挥依赖于其蛋白结构的完整性或蛋白C端的部分位点。
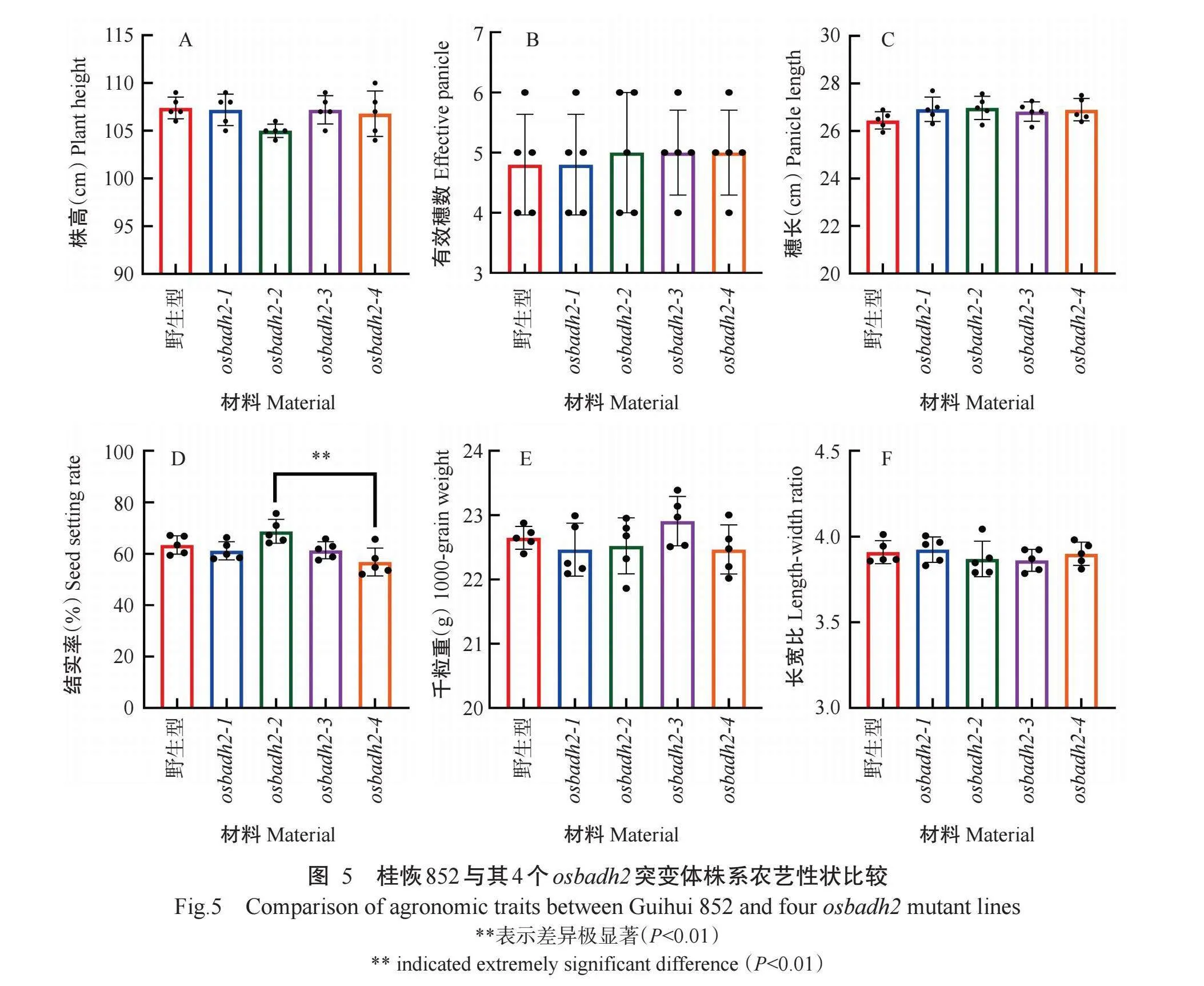
2.4 osbadh2突变体的农艺性状分析结果
为探究OsBADH2突变对水稻综合农艺性状的影响,将桂恢852与其4个osbadh2突变体株系种植于转基因温网室,观察并统计株高、有效穗数、穗长、结实率、千粒重、长宽比等重要农艺性状。单因素方差分析结果显示,与桂恢852野生型相比,4个osbadh2突变体在株高、有效穗数、穗长、结实率、千粒重和长宽比均无显著差异(P>0.05,下同)(图5-A~图5-F),表明OsBADH2基因突变对水稻综合农艺性状无明显影响,暗示OsBADH2为增加香味性状的优质候选基因,可用于改良桂恢852的食味品质。4个突变体株系的组间比较结果显示,osbadh2-2突变体与osbadh2-4突变体的结实率存在极显著差异(P<0.01)(图5-D)。考虑到osbadh2-2突变体与osbadh2-3突变体间的结实率无显著差异,osbadh2-4突变体与osbadh2-3突变体之间仅存在1个碱基的差异,综合分析推测是由于温室内温度过高,各突变系摆放位置存在差异等环境因素所致,而非突变位点不同所引起。
3讨论
3.1构建osbadh1/2双突变体以增强桂恢852香味品质的可行性分析
本研究发现,OsBADH1与OsBADH2为旁系同源蛋白,二者具有相同的结构域PLN02467和保守基序。结合前人研究结果表明,OsBADH1在水稻逆境响应中发挥作用(Tang et al.,2014;Lapuz et al.,2019;Min et al.,2021),与负责调控稻米香味的OsBADH2不同。OsBADH1和OsBADH2重测序结果也证明,在水稻进化过程中,OsBADH2被驯化,而OsBADH1未被选择(He etal.,2015)。但有研究表明,OsBADH1在其他物种中的同源蛋白与香味调控有关,如Monkhan等(2021)研究发现,高粱品种Ambemohor的香味与BADH1有关;Xie等(2024)通过基因编辑技术构建了大豆gmbadh1、gmbadh2和gmbadh1/2共3种类型的功能缺失型突变体,结果发现野生型和gmbadh1突变体均未产生香味,gmbadh2突变体有较淡的稻花香味,双突变体gmbadh1/2的种子和叶片均有浓郁的稻花香味。因此,通过构建水稻双突变体osbadh1/2有可能选育出比突变体osbadh2香味更浓郁的品种,但仍需考虑到OsBADH1基因的逆境响应功能,即OsBADH1基因突变可能造成优良品种的抗性退化。
3.2 OsBADH2的香味调控通路和功能位点
本研究通过构建4种不同类型的osbadh2突变体,使OsBADH2基因的第1、2、7外显子发生移码突变,导致翻译蛋白发生结构缺陷,均可在不影响桂恢852综合农艺性状的情况下限制OsBADH2在香味调控通路中的作用,使稻米产生香气,与祁永斌等(2020)、韦敏益等(2021)、李虎等(2023)、李孝琼等(2023)的研究结果一致。这些研究结果均暗示OsBADH2蛋白的结构完整性对其功能发挥具有很大影响。此外,保守基序分析结果显示,OsBADH2上存在多个保守基序,osbadh2-3突变体和osbadh2-4突变体在第7外显子发生突变并不会影响OsBADH2蛋白在N端的保守基序,推测OsBADH2蛋白在香味调控通路中的功能位点主要在C端而非N端。后续可通过酵母双杂交文库筛选等方式寻找OsBADH2的互作蛋白,明晰其调控通路,为香稻制种提供理论参考。同时通过构建OsBADH2基因全长及不同截断方式的载体,再进行酵母双杂交试验、免疫共沉淀(Co-IP)试验等,深入探究OsBADH2的功能是依赖于其结构的完整性还是某些潜在的功能位点。
3.3环境因素与突变类型对突变体2-AP含量的影响
本研究发现,osbadh2-2突变体与osbadh2-4突变体间的结实率存在极显著差异,但osbadh2-2突变体与osbadh2-3突变体间的结实率无显著差异,osbadh2-4突变体和osbadh2-3突变体之间仅存在1个碱基的差异,综合分析推测是由于温室内温度过高,各突变系摆放位置存在差异等环境因素所致,而非突变位点不同所引起,表明田间栽培和试验研究过程中均应注意各类环境因素可能对作物部分农艺性状产生的影响。结合桂恢852的结实率较本课题前期区域试验的统计结果也有一定程度的降低,进一步证明了环境因素对部分农艺性状存在一定的影响力。相关研究表明,外源施用脯氨酸、茉莉酸甲酯和微量元素(锰、锌等),以及光照、温度等环境因素改变均会对稻米中2-AP含量产生影响(Li et al.,2016;Luo et al.,2019;Luo et al.,2020;Imran et al.,2023;Zhang et al.,2023)。虽然采用咀嚼法可判断不同突变类型的稻米是否具有香气,但难以进行量化分析,目前可通过气相色谱仪检测2-AP含量(邵高能等,2017;祁永斌等,2020),因此,后续可考虑利用气相色谱仪对桂恢852和4个osbadh2突变体株系的2-AP含量进行准确检测,分析不同环境因素及不同突变类型对稻米中2-AP含量的影响,尽可能找出平衡产量与食味品质的最优解,将改良效果最优化。
4结论
将CRISPR-Cas9技术结合水稻遗传转化技术靶向敲除广西优质恢复系桂恢852的OsBADH2基因,在桂恢852的遗传背景下成功获得4种突变类型且可稳定遗传的osbadh2突变体株系。4个osbadh2突变体株系的稻米均具有香气,且在综合农艺性状方面与野生型无显著差异,表明利用CRISPR-Cas9基因编辑技术能快速定向改变水稻品种的目标性状,极大缩短了育种年限。
参考文献(References):
韩建军,侯婧祎,郭志涛,郭妍妍,杨雅冰,张梦琪.2023.复杂网络视角下的世界主粮贸易格局与趋势分析[J].河南农业大学学报,57(2):342-351.[Han J J,Hou J Y,Guo Z T,Guo Y Y,Yang Y B,Zhang M Q.2023.Analysis of world staple grain trade pattern and trend from the perspec-tive of complex network[J].Journal of Henan Agricultural University,57(2):342-351.]doi:10.16445/j.cnki.1000-2340.20221121.002.
侯学然,王荣升.2021.五常市特色水稻品种的历史与现状研究——从松93-8到稻花香2号[J].中国种业,(3):16-18.[Hou X R,Wang R S.2021.Study on the history and cur-rent situation of distinctive rice varieties in Wuchang City—From Song 93-8 to Daohuaxiang 2[J].China Seed Indus-try,(3):16-18.]doi:10.19462/j.cnki.1671-895x.2021.03.005.
胡培松,唐绍清,顾海华,王晓焰.2006.水稻香味的遗传研究与育种利用[J].中国稻米,(6):1-5.[Hu P S,Tang S Q,Gu H H,Wang X Y.2006.Genetic research and breeding utilization of rice aroma[J].China Rice,(6):1-5.]
李虎,刘广林,吴子帅,罗群昌,陈传华,朱其南.2023.利用分子标记辅助选育优质香稻新品种‘桂香99’[J].分子植物育种,21(2):510-516.[Li H,Liu G L,Wu Z S,Luo Q C,Chen C H,Zhu Q N.2023.Breeding of a new high qua-lity fragrant rice variety‘Guixiang99’by molecular marker-assisted selection[J].Molecular Plant Breeding,21(2):510-516.]doi:10.13271/j.mpb.021.000510.
李孝琼,韦宇,陈炜坚,刘开强,王小姣,李林娟,郭嗣斌,陈颖.2023.水稻香味基因OsBadh2分子标记的开发及优质香稻新品种‘那谷香’的选育[J/OL].分子植物育种.https://kns.cnki.net/kcms2/detail/46.1068.S.20230529.0919.006.html.[Li X Q,Wei Y,Chen W J,Liu K Q,Wang X J,Li L J,Guo S B,Chen Y.2023.Development of molecular marker for the rice aroma gene OsBadh2 and breeding of a new high-quality aroma rice‘Naguxiang’[J/OL].Molecu-lar Plant Breeding.https://kns.cnki.net/kcms2/detail/46.1068.S.20230529.0919.006.html.]
刘广林,李虎,吴子帅,罗群昌,李秋雯,朱其南,陈传华.2022.9个广西常规香稻品种香味及香味基因变异类型分析[J].中国稻米,28(6):54-58.[Liu G L,Li H,Wu Z S,Luo Q C,Li Q W,Zhu Q N,Chen C H.2022.Analysis of fragrance and fragrance gene variation types of 9 con-ventional fragrant rice varieties in Guangxi[J].China Rice,28(6):54-58.]doi:10.3969/j.issn.1006-8082.2022.06.011.
潘阳阳,陈宜波,王重荣,李宏,黄道强,周德贵,王志东,赵雷,龚蓉,周少川.2021.γ-氨基丁酸和2-乙酰-1-吡咯啉代谢通路在水稻籽粒发育过程中的变化分析[J].中国水稻科学,35(2):121-129.[Pan YY,Chen Y B,Wang Z R,Li H,Huang D Q,Zhou D G,Wang Z D,Zhao L,Gong R,Zhou S C.2021.Metabolism ofγ-aminobutyrate and 2-ace-tyl-1-pyrroline analyses at various grain developmental stages in rice(Oryza sativa L.)[J].Chinese Journal of Rice Science,35(2):121-129.]doi:10.16819/j.1001-7216.2021.0805.
彭波,孙艳芳,陈报阳,孙瑞萌,孔冬艳,庞瑞华,李先文,宋晓华,李慧龙,李金涛,周棋赢,柳琳,段斌,宋世枝.2017.水稻香味基因及其在育种中的应用研究进展[J].植物学报,52(6):797-807.[Peng B,Sun Y F,Chen B Y,Sun R M,Kong D Y,Pang R H,Li X W,Song X H,Li H L,Li J T,Zhou Q Y,Liu L,Duan B,Song S Z.2017.Research progress of fragrance gene and its application in rice bree-ding[J].Chinese Bulletin of Botany,52(6):797-807.]doi:10.11983/CBB16197.
祁永斌,张礼霞,王林友,宋建,王建军.2020.利用CRISPR/Cas9技术编辑水稻香味基因Badh2[J].中国农业科学,53(8):1501-1509.[Qi Y B,Zhang L X,Wang L Y,Song J,Wang J J.2020.CRISPR/Cas9 targeted editing for the fragrant gene Badh2 in rice[J].Scientia Agricultura Sinica,53(8):1501-1509.]doi:10.3864/j.issn.0578-1752.2020.08.001.
邵高能,谢黎虹,焦桂爱,魏祥进,圣忠华,唐绍清,胡培松.2017.利用CRISPR/CAS9技术编辑水稻香味基因Badh2[J].中国水稻科学,31(2):216-222.[Shao G N,Xie LH,Jiao G A,Wei X J,Sheng Z H,Tang S Q,Hu P S.2017.CRISPR/CAS9-mediated editing of the fragrant gene Badh2 in rice[J].Chinese Journal of Rice Science,31(2):216-222.]doi:10.16819/j.1001-7216.2017.6098.zUIT47PLXP4h+FKGXxzglVPe7E6G7UnubXd5cDPQmfY=
孙慧宇,宋佳,王敬国,刘化龙,孙健,莫天宇,徐善斌,郑洪亮,邹德堂.2019.利用CRISPR/Cas9技术编辑Badh2基因改良粳稻香味[J].华北农学报,34(4):1-8.[Sun H Y,Song J,Wang J G,Liu H L,Sun J,Mo T Y,Xu S B,Zheng H L,Zou D T.2019.Editing Badh2 gene to improve thefragrance of japonica rice by CRISPR/CAS9 technology[J].Acta AgriculturaeBoreali-Sinica,34(4):1-8.]doi:10.7668/hbnxb.201751503.
王军,杨杰,陈志德,仲维功.2008.水稻香米基因标记的开发与应用[J].分子植物育种,6(6):1209-1212.[Wang J,Yang J,Chen Z D,Zhong W G.2008.Development and application of fragrance gene markers in rice[J].Molecu-lar Plant Breeding,6(6):1209-1212.]
韦敏益,黄大辉,张月雄,马增凤,罗同平,秦钢,刘驰,李振经.2021.分子标记辅助选育香型优质稻新品种‘桂野香占’[J].分子植物育种,22(13):4275-4282.[Wei M Y,Huang D H,Zhang Y X,Ma Z F,Luo T P,Qin G,Liu C,Li Z J.2021.Breeding of a new high quality fragrant rice variety‘Guiyexiangzhan’by molecular marker-assisted selection[J].Molecular Plant Breeding,22(13):4275-4282.]doi:10.13271/j.mpb.022.004275.
徐善斌,郑洪亮,刘利锋,卜庆云,李秀峰,邹德堂.2020.利用CRISPR/Cas9技术高效创制长粒香型水稻[J].中国水稻科学,34(5):406-412.[Xu S B,Zheng H L,Liu L F,Bu Q Y,Li X F,Zou D T.2020.Improvement of grain shapeand fragrance by using CRISPR/Cas9 system[J].Chinese Journal of Rice Science,34(5):406-412.]doi:10.16819/j.1001-7216.2020.0104.
曾宇,夏秀忠,农保选,张宗琼,杨行海,邓国富,刘开强,黄志,李丹婷.2017.广西特色香稻地方品种香味及其香味基因型的鉴定[J].南方农业学报,48(9):1548-1553.[Zeng Y,Xia X Z,Nong B X,Zhang Z Q,Yang X H,Deng G F,Liu K Q,Huang Z,Li D T.2017.Identification of aroma and aroma genotype in local specific fragrant rice varieties from Guangxi[J].Journal of Southern Agricul-ture,48(9):1548-1553.]doi:10.3969/j.issn.2095-1191.2017.09.02.
Bradbury L M T,Fitzgerald T L,Henry R J,Jin Q S,Waters D L E.2005.The gene for fragrance in rice[J].Plant Biotech-nology Journal,3(3):363-370.doi:10.1111/j.1467-7652.2005.00131.x.
Chen C J,Wu Y,Li J W,Wang X,Zeng Z H,Xu J,Liu Y L,Feng J T,Chen H,He Y H,Xia R.2023.TBtools-II:A“one for all,all for one”bioinformatics platform for bio-logical big-data mining[J].Molecular Plant,16(11):1733-1742.doi:10.1016/j.molp.2023.09.010.
Chen S H,Wu J,Yang Y,Shi W W,Xu M L.2006.The fgr gene responsible for rice fragrance was restricted within 69 kb[J].Plant Science,171(4):505-514.doi:10.1016/j.plantsci.2006.05.013.
He Q,Yu J,Kim T S,Cho Y H,Lee Y S,Park Y J.2015.Rese-quencing reveals different domestication rate for BADH1 and BADH2 in rice(Oryza sativa)[J].PLoS One,10(8):e134801.doi:10.1371/journal.pone.0134801.
Imran M,Shafiq S,Ashraf U,Qi J Y,Mo Z W,Tang X R.2023.Biosynthesis of 2-acetyl-1-pyrroline in fragrant rice:Recent insights into agro-management,environmental fac-tors,and functional genomics[J].Journal of Agricultural and Food Chemistry,71(10):4201-4215.doi:10.1021/acs.jafc.2c07934.
Juwattanasomran R,Somta P,Chankaew S,Shimizu T,Wong-pornchai S,Kaga A,Srinives P.2011.A SNP in GmBADH2 gene associates with fragrance in vegetable soybean varie-ty“Kaori”and SNAP marker development for the fra-grance[J].Theoretical and Applied Genetics,122(3):533-541.doi:10.1007/s00122-010-1467-6.
Kuaprasert B,Silprasit K,Horata N,Khunrae P,Wongpanya R,Boonyalai N,Vanavichit A,Choowongkomon K.2011.Purification,crystallization and preliminary X-ray analysis of recombinant betaine aldehyde dehydrogenase 2(OsBADH2),a protein involved in jasmine aroma,from Thai fragrant rice(Oryza sativa L.)[J].Acta Crystallo-graphica.Section F Structural Biology and Crystallization Communications,67(Pt 10):1221-1223.doi:10.1107/S17 44309111030971.
Lapuz R R,Javier S,Aquino J D,Undan J R.2019.Gene expression and sequence analysis of BADH1 gene in CLSU aromatic rice(Oryza sativa L.)accessions sub-jected to drought and saline condition[J].Journal of Nutri-tional Science and Vitaminology,65(S):S196-S199.doi:10.3177/jnsv.65.S196.
Li M J,Ashraf U,Tian H,Mo Z W,Pan S G,Anjum SA,Duan M Y,Tang X R.2016.Manganese-induced regulations in growth,yield formation,quality characters,rice aroma and enzyme involved in 2-acetyl-1-pyrroline biosynthesis in fragrant rice[J].Plant Physiology Biochemistry,103:167-175.doi:10.1016/j.plaphy.2016.03.009.
Luo H W,Du B,He L X,He J,Hu L,Pan S G,Tang X R.2019.Exogenous application of zinc(Zn)at the heading stage regulates 2-acetyl-1-pyrroline(2-AP)biosynthesis in different fragrant rice genotypes[J].Scientific Reports,9(1):19513.doi:10.1038/s41598-019-56159-7.
Luo H W,Zhang T T,Zheng A X,He L X,Lai R F,Liu J H,Xing P P,Tang X R.2020.Exogenous proline induces regulation in 2-acetyl-1-pyrroline(2-AP)biosynthesis and quality characters in fragrant rice(Oryza sativa L.)[J].Scientific Reports,10(1):13971.doi:10.1038/s41598-020-70984-1.
Min M H,Maung T Z,Cao Y,Phitaktansakul R,Lee G S,Chu S H,Kim K W,Park Y J.2021.Haplotype analysis of BADH1 by next-generation sequencing reveals association with salt tolerance in rice during domestication[J].Interna-tional Journal of Molecular Sciences,22(14):7578.doi:10.3390/ijms22147578.
Monkhan T,Chen X,Somta P.2021.BADH1 is associated with fragrance in sorghum(Sorghum bicolor(L.)Moench)cul-tivar‘Ambemohor’[J].Journal of Genetics,100:3.doi:10.1007/s 12041-020-01256-0.
Myint K M,Arikit S,Wanchana S,Yoshihashi T,Choowongko-mon K,Vanavichit A.2012.A PCR-based marker for a locus conferring the aroma in Myanmar rice(Oryza sativa L.)[J].Theoretical and Applied Genetics,125(5):887-896.doi:10.1007/s00122-012-1880-0.
Niu X L,Tang W,Huang W Z,Ren G J,Wang Q L,Luo D,Xiao Y Y,Yang S M,Wang F,Lu B R,Gao F Y,Lu T G,Liu Y S.2008.RNAi-directed downregulation of OsBADH2 results in aroma(2-acetyl-1-pyrroline)produc-tion in rice(Oryza sativa L.)[J].BMC Plant Biology,8:100.doi:10.1186/1471-2229-8-100.
Okpala N E,Mo Z W,Duan M Y,Tang X R.2019.The gene-tics and biosynthesis of 2-acetyl-1-pyrroline in fragrant rice[J].Plant Physiology and Biochemistry,135:272-276.doi:10.1016/j.plaphy.2018.12.012.
Sakthivel K,Sundaram R M,Rani S N,Balachandran S M,Neeraja C N.2009.Genetic and molecular basis of fra-grance in rice[J].Biotechnology Advances,27(4):468-473.doi:10.1016/j.biotechadv.2009.04.001.
Shan Q W,Zhang Y,Chen K L,Zhang K,Gao C X.2015.Crea-tion of fragrant rice by targeted knockout of the OsBADH2 gene using TALEN technology[J].Plant Biotechnology Journal,13(6):791-800.doi:10.1111/pbi.12312.
Shao G N,Tang A,Tang S Q,Luo J,Jiao GA,Wu J L,Hu P S.2011.A new deletion mutation of fragrant gene and the development of three molecular markers for fragrance in rice[J].Plant Breeding,Jl2LXQNnRxmnHc5mTfB8ZQ==130(2):172-176.doi:10.1111/j.1439-0523.2009.01764.x.
Shao G N,Tang S Q,Chen M L,Wei X J,He J W,Luo J,JiaoG A,Hu Y C,Xie L H,Hu P S.2013.Haplotype variationat Badh the gene determining fragrance in rice[J].Geno-mics,101(2):157-162.doi:10.1016/j.ygeno.2012.11.010.Tang W,Sun J Q,Liu J,Liu F F,Yan J,Gou X J,Lu B R,LiuY S.2014.RNAi-directed downregulation of betaine alde-hyde dehydrogenase 1(OsBADH1)results in decreasedstress tolerance and increased oxidative markers without affecting glycine betaine biosynthesis in rice(Oryza sativa)[J].Plant Molecular Biology,86(4-5):443-454.doi:10.1007/s 11103-014-0239-0.
Wongpanya R,Boonyalai N,Thammachuchourat N,Horata N,Arikit S,Myint K M,Vanavichit A,Choowongkomon K.2011.Biochemical and enzymatic study of rice BADH wild-type and mutants:An insight into fragrance in rice[J].The Protein Journal,30(8):529-538.doi:10.1007/s10930-011-9358-5.
Xie H T,Song M L,Cao X S,Niu Q F,Zhu J H,Li S S,Wang X,Niu X M,Zhu J K.2024.Breeding exceptionally fra-grant soybeans for soy milk with strong aroma[J].Journal of Integrative Plant Biology,66(4):642-644.doi:10.1111/jipb.13631.
Zhang Y X,Ren Y,Yang D Y,Liu H D,Zhang Y S,Wang X J,Bai F J,Cheng S R.2023.Foliar methyl jasmonate(MeJA)application increased 2-acetyl-1-pyrroline(2-AP)content and modulated antioxidant attributes and yield for-mation in fragrant rice[J].Journal of Plant Physiology,282:153946.doi:10.1016/j.jplph.2023.153946.
(责任编辑陈燕)
