不同方法提取的山茱萸多糖品质特征
2024-10-15石云鑫杨家潘诗琴曾诚郭荣荣李晓蝶宋旭琴杨剑宋亚




摘要:【目的】研究不同提取方法对山茱萸多糖品质特征的影响,为山茱萸多糖的深加工及其开发利用提供参考依据。【方法】分别以热水提取法、微波辅助提取法、超声波辅助提取法、酸提取法、碱提取法和复合酶提取法等6种方法提取山茱萸多糖,比较不同提取方法对山茱萸多糖的提取率、总糖含量、抗氧化能力、理化性质和结构表征的影响。【结果】不同提取方法所得的山茱萸多糖品质特征具有差异性。其中,碱提取法提取的山茱萸多糖提取率(15.13%)、总糖含量(93.43%)、铁离子还原能力(1.31 mmol/g),以及多糖中的C=O和C-H含量均高于其他方法;微波辅助提取法提取的山茱萸多糖吸油性(19.00 mL/g)和泡沫稳定性(41.67%)均高于其他方法;复合酶提取法提取的山茱萸多糖体外胆固醇吸附能力(621.80 mg/g)最强,且对1,1-二苯基-2-三硝基苯肼(DPPH)自由基的平均清除率(60.06%)明显高于其他方法;而热水提取法提取的山茱萸多糖质量浓度为0.2 mg/mL时,其对2,2-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)自由基清除率(61.20%)明显高于其他方法;超声辅助提取法提取的山茱萸多糖起泡性(17.00%)显著高于其他方法(P<0.05)。傅里叶变换红外光谱显示,不同方法提取的山茱萸多糖中官能团含量不同;扫描电镜分析结果显示,热水提取法和微波辅助提取法提取的山茱萸多糖表面光滑平整,结构排列紧密,超声波辅助提取法和复合酶提取法提取的山茱萸多糖分子间排斥力强;X射线衍射分析结果显示,碱提取法提取的山茱萸多糖在32º和45º时有明显且强烈的吸收峰,而热水提取法、微波辅助提取法、超声波辅助提取法、酸提取法和复合酶提取法提取到的山茱萸多糖有相似结构;热稳定分析中,碱提取法提取的山茱萸多糖热稳定性高于其他方法,在800℃时质量损失率为50.92%。【结论】不同方法提取的山茱萸多糖结构、抗氧化活性和理化性质各不相同,但不同方法对其热力学特征影响较小,呈相似的变化趋势。可根据不同方法提取的山茱萸多糖特点进行开发利用。
关键词:山茱萸;多糖;提取方法;品质特征
中图分类号:S853.75文献标志码:A文章编号:2095-1191(2024)07-2031-13
Quality characteristics of Cornus officinalis Sieb.et Zucc.polysaccharides extracted by different methods
SHI Yun-xin YANG Jia PAN Shi-qin ZENG Cheng GUO Rong-rong LI Xiao-die SONG Xu-qin YANG Jian 4*,SONG Ya
(1College of Animal Science,Guizhou University,Guiyang,Guizhou 550025,China;2Department of Food Engineeringand Science,Moutai College,Zunyi,Guizhou 564507,China;3Guizhou Key Laboratory of Animal Epidemics and Ve-terinary Public Health,Guiyang,Guizhou 550025,China;4Key Laboratory of Animal Genetics,Breeding andRepro-duction in the Plateau Mountainous Region,Ministry of Education,Guiyang,Guizhou 550025,China)
Abstract:【Objective】The effects of different extraction methods on the quality characteristics of Cornus officinalis Sieb.et Zucc.polysaccharides were studied to provide reference for the deep processing and development and utilizationofC.officinalis polysaccharides.【Method】Six methods were used to extract C.officinalis polysaccharides,including hot water extraction,microwave-assisted extraction,ultrasonic-assisted extraction,acid extraction,alkaline extraction and composite enzyme extraction,and the effects of the different extraction methods on the yields of C.officinalispolysaccha-rides,the contents of total sugars,antioxidant capacity,physicochemical properties,and structural characterization of C.officinalis polysaccharides were compared.【Result】The quality characteristics of C.officinalis polysaccharides obtained by different extraction methods were different.The extraction rate(15.13%)total sugar content(93.43%),ferric ion re-ducing ability(1.31 mmol/g),and C=O and C-H contents in polysaccharides obtained by alkaline extraction method were higher than those obtained by other methods;the oil absorption(19.00 mL/g)and foam stability(41.67%)of C.officina-lis polysaccharides extracted by microwave-assisted extraction were higher than those obtained by other methods;the cho-lesterol adsorption capacity(621.80 mg/g)of the polysaccharides extracted by composite enzyme extraction method was the strongest,and the scavenging rate of 1,1-diphenyl-2-trinitrophenylhydrazine(DPPH)radical(60.06%)was greatly higher than that of the other methods;when the mass concentration of C.officinalis polysaccharide extracted by hot water extraction was 0.2 mg/mL,the scavenging rate of 2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt(ABTS)free radical(61.20%)was greatly higher than that of other methods.The foaming ability of polysaccharides extracted by ultrasonic-assisted extraction(17.00%)was significantly higher than that of other methods(P<0.05).In addition,Fourier transform infrared spectroscopy showed that the contents of functional groups in C.officinalispolysac-charides extracted by different methods were different;scanning electron microscopy analysis showed that the surface of C.officinalis polysaccharides extracted by hot water extraction and microwave-assisted extraction were smooth and flat,and the structure of the extracted polysaccharides was tightly aligned;C.officinalis polysaccharides by ultrasonic-assisted extraction and composite enzyme extraction had a strong intermolecular repulsive force;X-ray diffraction suggested that there were obvious and strong absorption peaks at 32ºand 45ºfor C.officinalis polysaccharides extracted by alkaline ex-traction method,while those extracted by hot water extraction method,microwave-assisted extraction method,ultrasonic-assisted extraction method,acid extraction method and composite enzyme extraction method had a similar structure;in the thermal stability analysis,the thermal stability of C.officinalispolysaccharides extracted by alkali extraction method was higher than that of other methods,and the mass loss was about 50.2%at 800℃.【Conclusion】The structure,antioxi-dant activity and physicochemical properties of C.officinalis polysaccharides extracted by various methods are different,but different methods have slight effect on their thermodynamic characteristics,showing a similar trend.It can be deve-loped and applied according to the characteristics of polysaccharides extracted by different methods.
Key words:Cornus officinalis Sieb.et Zucc.;polysaccharides;extraction method;quality characteristics
Foundation items:National Natural Science Foundation of China(32202854);Guizhou Basic Research Plan(Natu-ral Science)Project(QKHJC-ZK〔2023〕Yiban 451);Joint Science and Technology Research and Development Project of Zunyi Science and Technology Bureau and Maotai College(Zunshikehe HZ〔2021〕308);Research Start-up Fund Pro-ject of High-level Talents in Maotai University(mygccrc〔2022〕091)
0引言
【研究意义】山茱萸(Cornus officinalis Sieb.et Zucc.)是我国临床常用的滋补中药材之一,在限定使用范围和用量内可作为药食两用之物(国家卫生健康委员会和国家市场监督管理总局,2023)。山茱萸含有萜类、苷类、糖类、酯类、有机酸和单宁酸等多种成分(张晓文等,2020;冯飞艳和行冰玉,2023;王威等,2024),其中多糖是其主要生物活性成分之一,具有增强免疫力、降血糖血脂、抗氧化、抗炎等功效(唐敏,2023)。近年来,多糖日益被人们所重视,成为研究热点之一。因此,探究不同提取方法对山茱萸多糖提取率、总糖含量、抗氧化能力、理化性质及结构表征的影响,对山茱萸多糖的生物活性和应用品质研究,及其深加工开发利用均具有重要意义。【前人研究进展】多糖常用的提取方法有超声波辅助提取法(王如涛等,2013)、复合酶提取法(曹楠楠,2015)、微波辅助提取法(张燕等,2015)、碱提取法(孟楠等,2017)、热水提取法(李瑶佳,2019)和酸提取法(Peng et al.,2023)。采用碱提取法得到的山茱萸多糖具有较强的抗油脂氧化和清除自由基能力,是一种天然的抗氧化剂(李平等,2003)。复合酶提取法具有操作简便、提取率高、低成本等优点,其作用条件温和,有益于促进植物多糖的溶出;程俊文等(2010)利用响应面法优化复合酶法提取山茱萸多糖工艺,确定最佳提取工艺:由纤维素酶2.0%、果胶酶2.0%和中性蛋白酶1.5%组成复合酶,浸提时间69 min,浸提温度50℃,pH 3.8。微波辅助提取法具有污染小、低消耗、提取率高等优点;胡园园等(2011)采用微波辅助提取法提取山茱萸多糖,并利用响应面法进行工艺优化,确定最佳提取条件,为工业化生产山茱萸多糖提供参考依据。热水提取法是提取多糖最常用的方法,该方法提取到的山茱萸粗多糖对1,1-二苯基-2-三硝基苯肼(DPPH)自由基有一定的清除能力,可作为天然抗氧化剂的良好来源(张培全等,2019)。酸提取法提取到的植物多糖化学成分及特性因pH而异,适当的酸浓度会促进植物细胞壁的水解,从而促进多糖的提取,但强酸会导致多糖部分水解,影响其提取率(Bai etal.,2020)。超声波辅助提取山茱萸多糖工艺研究中,与无超声波辅助相比,超声波辅助提取能有效提高山茱萸多糖的提取率,且双频组合超声波的提取效果最佳(姚瑞祺等,2022)。【本研究切入点】已有采用不同方法提取山茱萸多糖的相关研究,但同时比较多种提取方法获得的山茱萸多糖的提取率、理化性质及抗氧化活性差异鲜见报道,且目前对于山茱萸多糖化学结构的研究尚不全面和深入。【拟解决的关键问题】采用6种方法提取山茱萸多糖,探究不同提取方法对山茱萸多糖提取率和多糖中总糖含量的影响,并对其理化性质、抗氧化能力和结构表征进行差异分析,为山茱萸多糖的深加工及其开发利用提供参考依据。
1材料与方法
1.1试验材料
山茱萸果肉购自岷县和泰中药材有限公司,经干燥后在粉碎机中粉碎,过80目筛后密封干燥保存备用,使用前用石油醚进行脱脂处理。无水乙醇、冰醋酸、盐酸、硫酸、氢氧化钠、硫酸铁铵、过硫酸钾、正丁醇、无水醋酸钠、2,4,6-三(2-吡啶基)三嗪(TPTZ)、抗坏血酸(Vc)、DPPH、2,2-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)和三氯甲烷均为分析纯,购自国药集团化学试剂有限公司;苯酚购自成都金山化学试剂有限公司。
主要仪器设备:DK-S24电热恒温水浴锅(上海森信实验仪器有限公司);J-800B粉碎机(永康市招风耳工贸有限公司);16-0362真空冷冻干燥机(临海市永昊真空设备有限公司);H1650离心机(湘仪离心机仪器有限公司);RE-52AA旋转蒸发仪、SHZ-III循环水真空泵(上海亚荣生化仪器厂);SB-4200DT超声清洗机(宁波新芝生物科技股份有限公司);DNM-9606酶标仪(北京普朗新技术有限公司);FJ高速均质机(上海沪析实业有限公司);DHG-9013A电热鼓风干燥箱(上海一恒科学仪器有限公司);247258 pH计(上海日岛科学仪器有限公司);FA2204N精密电子天平(上海菁海仪器有限公司);P70F23P-G5微波炉(广东格兰仕微波生活电器制造有限公司)。
1.2山茱萸多糖提取
1.2.1热水提取法参照刘宇等(2023)的方法,准确称取30.0 g干燥山茱萸果肉粉末置于提取容器中,按料液比1∶30加入900 mL去离子水,在70℃水浴中提取120min,冷却至室温,过滤除去滤液,即得山茱萸多糖浸提液;浸提液在60℃下旋转蒸发减压浓缩,浓缩液加入4倍体积的无水乙醇,醇沉过夜,于4000r/min下离心10min,弃上清液得山茱萸多糖沉淀,沉淀物经真空冷冻干燥后即得山茱萸粗多糖(DP-A)。
1.2.2微波辅助提取法参照李豪等(2011)的方法,准确称取30.0 g干燥山茱萸果肉粉末置于提取容器中,按料液比1∶30加入900 mL去离子水,放入微波炉中,350 W下加热6 min后,在70℃水浴中提取120min;萃取后过滤去除残留物,蒸发浓缩滤液,再加入浓缩液4倍体积的无水乙醇,静置过夜,于4000 r/min下离心10min,弃上清液得山茱萸多糖沉淀,真空冷冻干燥后即得山茱萸粗多糖(DP-B)。
1.2.3超声波辅助提取法参照雷呈和李斐(2013)的方法,准确称取30.0 g干燥山茱萸果肉粉末置于提取容器中,按料液比1∶30加入900 mL去离子水,超声波处理40 min后,在70℃水浴中提取120 min,过滤滤渣即得山茱萸多糖提取液;减压蒸发浓缩提取物后,向浓缩液中加入4倍体积的无水乙醇,静置过夜,于4000r/min下离心10min,弃上清液并保留沉淀物,经冷冻干燥后即得山茱萸粗多糖(DP-C)。
1.2.4酸提取法参照李亚平和周鸿立(2020)的方法,准确称取30.0 g干燥山茱萸果肉粉末置于提取容器中,按料液比1∶30加入900 mL 0.06 mol/L盐酸溶液,在70℃水浴中提取2h,过滤残渣,提取液加入氢氧化钠溶液调节pH为中性;减压蒸发浓缩提取物后,向浓缩液中加入4倍体积的无水乙醇,静置过夜,于4000r/min下离心10min,弃上清液,沉淀经真空冻干即得山茱萸粗多糖(DP-D)。
1.2.5碱提取法参照何嘉琦等(2022)的方法,准确称取30.0 g干燥山茱萸果肉粉末置于提取容器中,按料液比1∶30加入900 mL 0.2 mol/L氢氧化钠溶液,在70℃水浴中提取120min,然后抽滤除去滤渣,用盐酸溶液将提取液pH调至中性;减压蒸发浓缩提取液,向浓缩液中加入4倍体积的无水乙醇,静置过夜,于4000 r/min下离心10 min,弃上清液收集沉淀,真空冷冻干燥即得山茱萸粗多糖(DP-E)。
1.2.6复合酶提取法参照徐丽梅和陈炼红(2022)的方法,准确称取30.0 g干燥山茱萸果肉粉末置于提取容器中,按料液比1∶30加入900 mL去离子水,再加入5%复合酶(木瓜蛋白酶∶纤维素酶=1∶3),在70℃水浴中提取120 min,反应完成后,立即在100℃水浴中灭活10 min,抽滤得到滤液,减压浓缩,浓缩液中加入4倍体积的无水乙醇,静置过夜,于4000 r/min下离心10 min,弃上清液,沉淀经真空冷冻干燥后即得山茱萸粗多糖(DP-F)。
1.3山茱萸多糖提取率计算及总糖含量测定
6种提取方法得到的山茱萸多糖提取率由以下公式计算:
提取率(%)=干燥后多糖质量/原料质量×100
6种提取方法得到的山茱萸多糖中总糖含量采用苯酚—硫酸法进行测定,以无水葡萄糖为标准品。将1.0 mL 5%苯酚、5.0 mL浓硫酸分别加入到葡萄糖标准溶液和山茱萸多糖溶液中,混匀,在490 nm波长处测吸光度,按以下公式计算总糖含量:
总糖含量(%)=多糖质量浓度×稀释体积/多糖
质量×100
1.4山茱萸多糖理化性质测定
1.4.1吸油性参照黄雪松等(2009)的方法,稍作修改,测定山茱萸多糖吸油性。准确称取0.100 g山茱萸多糖置于离心管中,加入5.0 mL植物油,振荡混匀,待植物油完全浸透多糖后,以3000 r/min离心10 min,离心后测定游离的植物油体积。
吸油性(mL/g)=(5-V)/m
式中,V为离心后游离的植物油体积(mL),m为样品质量(g)。
1.4.2起泡性参照刘洋等(2020)的方法,稍作修改,测定山茱萸多糖起泡性。将不同方法提取的山茱萸多糖0.300 g溶于100 mL蒸馏水中,测定各溶液的初始体积V0,然后用高速均质机在室温下搅拌1 min,迅速将溶液转移到量筒中,测定溶液和泡沫总体积V。
起泡性(%)=(V-V0)/V0×100
1.4.3泡沫稳定性分别在5、10、15、20和25 min记录各溶液的泡沫体积,并根据泡沫体积的变化比较山茱萸多糖泡沫稳定性。
泡沫稳定性(%)=Vt/V0×100
式中,Vt为t时剩余泡沫体积,V0为初始泡沫体积。
1.4.4体外胆固醇吸附能力山茱萸多糖体外胆固醇吸附能力测定参照刘明研等(2016)的方法,稍作修改。分别准确称取山茱萸多糖试样0.100 g,用去离子水定容至25 mL容量瓶中,分别取0.5 mL于6支干净离心管中(试样浓度为4 mg/mL),依次加入2.5 mg/mL的胆固醇无水乙醇溶液0、0.5、1.0、1.5、2.0和2.5 mL,每管用无水乙醇补至总体积3.0 mL,于37℃水浴振荡100 min,然后4000 r/min离心15 min,取上清液2.0 mL置于15 mL离心管中,加入3.0 mL去离子水、0.7 g氯化钠和10.0 mL石油醚,在漩涡振荡器上振荡2 min,静置萃取1 h,取萃取液2.0 mL,加入4.0 mL冰乙酸和2.0 mL铁矾显色液,混匀,静止放置15min,在564nm波长处测吸光度,计算剩余胆固醇质量和吸附量。
被吸附胆固醇质量(mg)=加入胆固醇质量-剩余胆固醇质量
吸附量(mg/g)=被吸附胆固醇质量/多糖试样质量1.5山茱萸多糖抗氧化能力测定
1.5.1 DPPH自由基清除能力参照王娜等(2023)的方法,稍作修改,测定山茱萸多糖清除DPPH自由基的能力。取0.2 mmol/L DPPH溶液150μL,分别加入到50μL不同质量浓度(0.025~0.5 mg/mL)的6种多糖(DP-A、DP-B、DP-C、DP-D、DP-E和DP-F)溶液中,以Vc为阳性对照,蒸馏水为空白对照,每个浓度梯度做3次平行试验。室温下暗处反应30min后,在517 nm波长处测定吸光度,根据公式计算DPPH自由基清除率。
DPPH自由基清除率(%)=(A0-A1)/A0×100
式中,A1为样品溶液在混合溶液中反应后的吸光度,A0为蒸馏水代替样品溶液反应后的吸光度。
1.5.2 ABTS自由基清除能力参照陈红惠和牛念拉姆(2020)的方法,稍作修改,测定山茱萸多糖清除ABTS自由基的能力。取150μL的ABTS工作液,分别加入到50μL不同质量浓度(0.025~0.5 mg/mL)的6种多糖(DP-A、DP-B、DP-C、DP-D、DP-E和DP-F)溶液中,以蒸馏水为空白对照,每个浓度梯度做3次平行试验。室温下暗处反应30min后,在734nm波长处测定吸光度,根据公式计算ABTS自由基清除率。
ABTS自由基清除率(%)=(A0-A1)/A0×100
式中,A1为样品溶液在反应体系中反应后的吸光度,A0为蒸馏水代替样品溶液在反应体系中反应后的吸光度。
1.5.3铁离子还原能力参照鞠念衡等(2023)的方法,稍作修改,测定山茱萸多糖的铁离子还原能力。用蒸馏水配制0.3 mol/L醋酸盐缓冲液和20 mmol/L FeCl3溶液,用40 mmol/L盐酸配制10mmol/L TPTZ溶液,将醋酸盐缓冲液、FeCl3溶液和TPTZ溶液按10∶1∶1的比例混合,配制成FRAP工作液(现配现用)。在96孔板中取不同质量浓度梯度的FeSO4溶液各50μL,分别加入150μL FRAP工作液,混匀后于37℃反应10min后,在593nm波长处测定吸光度。以FeSO4质量浓度为横坐标、吸光度为纵坐标,绘制标准曲线。将各样品液代替FeSO4溶液重复以上操作,得到的吸光度代入标准曲线,用FeSO4当量表示样品对铁离子的还原力。
1.6不同方法提取的山茱萸多糖结构表征测定
1.6.1傅里叶变换红外光谱分析参照马立军等(2012)的方法,采用傅里叶变换红外光谱对山茱萸多糖的分子结构进行分析。分别称取少量不同方法提取的山茱萸多糖置于干燥的玛瑙研钵中,在红外灯照射下加入适量溴化钾,研磨均匀后压片。用傅里叶红外光谱仪在500~4000 cm-1进行扫描,初步分析多糖的官能团。
1.6.2扫描电镜分析参照刘阿娟等(2013)的方法,稍作修改,对山茱萸多糖进行扫描电镜分析。取少量不同方法提取的山茱萸多糖样品,平铺于导电胶上固定,放置于样品台,然后用真空喷镀仪进行喷金处理,使用TESCAN MIRA-S6123扫描电子显微镜在不同放大倍数下观察样品的外部形态。在5 kV的加速电压下观察样品表面形貌。
1.6.3 X射线衍射分析使用X射线衍射仪测定不同方法提取的山茱萸多糖样品的结晶特性(尹艳和高文宏,2014)。测试时用Cu-Ka射线源(波长0.15 nm),电压40 kV,电流40 mA;角度5°~80°(2θ),角度梯度0.02°。
1.6.4热稳定分析参照张曼等(2020)的方法,对山茱萸多糖样品进行热重分析(TGA)和差示扫描量热分析(DSC)。称取18.11 mg的多糖样品置于样品托盘中,使用氮气和经净化、干燥处理的空气作为试验载气,流速80 mL/min,温度从室温以10℃/min的速度升至500℃。
1.7统计分析
试验均重复3次,结果以平均值±标准差表示。采用SPSS 27.0的单因素方差分析(One-way ANOVA)处理数据,Duncan’s多重比较法检验组间差异显著性,以GraphPad Prism 9.5制图。
2结果与分析
2.1不同提取方法对山茱萸多糖提取率和总糖含量的影响
如表1所示,采用不同方法提取山茱萸多糖,其提取率有所差异。6种方法的山茱萸多糖提取率由高到低排序为DP-E>DP-C>DP-B>DP-D>DP-F>DP-A,其中采用碱提取法提取的多糖(DP-E)提取率显著高于其他方法提取的多糖(P<0.05,下同),是采用热水提取法提取多糖(DP-A)提取率的2.7倍。
此外,6种方法提取的山茱萸多糖中总糖含量也有所不同,DP-E的总糖含量最高(93.43%),显著高于其他方法提取的多糖,而采用酸提取法提取的山茱萸多糖(DP-D)的总糖含量(37.49%)显著低于其他方法提取的多糖。
2.2不同提取方法对山茱萸多糖理化性质的影响
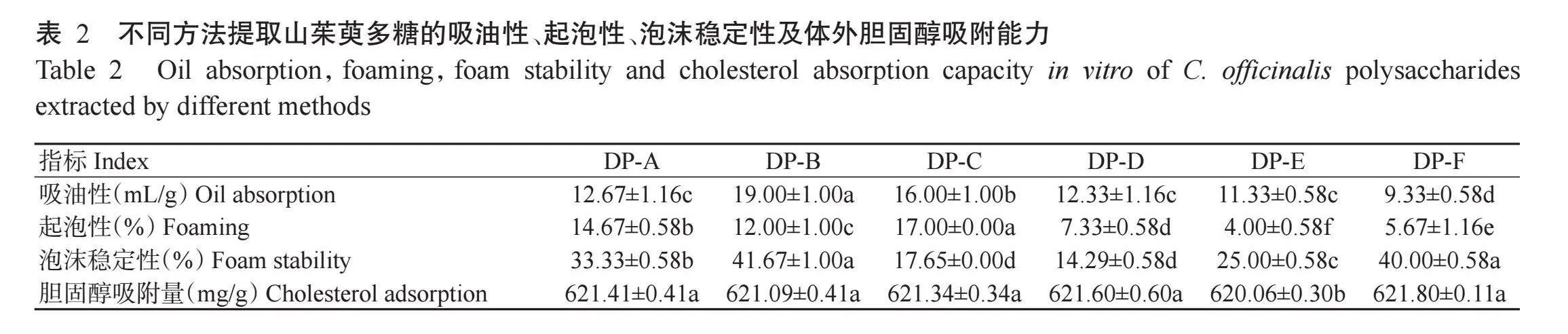
由表2可知,采用微波辅助提取法提取的山茱萸多糖(DP-B)的吸油性(19.00 mL/g)显著高于其他方法提取的多糖,其他方法提取的山茱萸多糖吸油性由高到低排序为DP-C>DP-A>DP-D>DP-E>DP-F。不同方法提取的山茱萸多糖起泡性有所差异,DP-E的起泡性(4.00%)显著低于其他方法提取的多糖,而采用超声波辅助提取法提取的多糖(DP-C)起泡性最强(17.00%),其他4种方法提取的多糖起泡性强弱依次为DP-A>DP-B>DP-D>DP-F,各种方法提取的山茱萸多糖起泡性之间均存在显著差异。不同方法提取的山茱萸多糖泡沫体积随时间的推移逐渐减少,在前5 min减少速度最快,20 min后有少量泡沫存在,计算10 min时剩余泡沫体积,比较不同方法提取的山茱萸多糖泡沫稳定性。由表2可知,DP-D的泡沫稳定性最低(14.29%),而DP-B的泡沫稳定性最高(41.67%),是DP-D的2.9倍。
由表2还可知,不同方法提取的山茱萸多糖体外胆固醇吸附量在620.06~621.80 mg/g,表明6种提取方法得到的山茱萸多糖体外胆固醇吸附能力相近。其中,采用复合酶提取法提取的山茱萸多糖(DP-F)的体外胆固醇吸附能力最高,而DP-E的体外胆固醇吸附能力显著低于其他5种方法,其他5种方法之间差异不显著。
2.3不同提取方法对山茱萸多糖抗氧化能力的影响
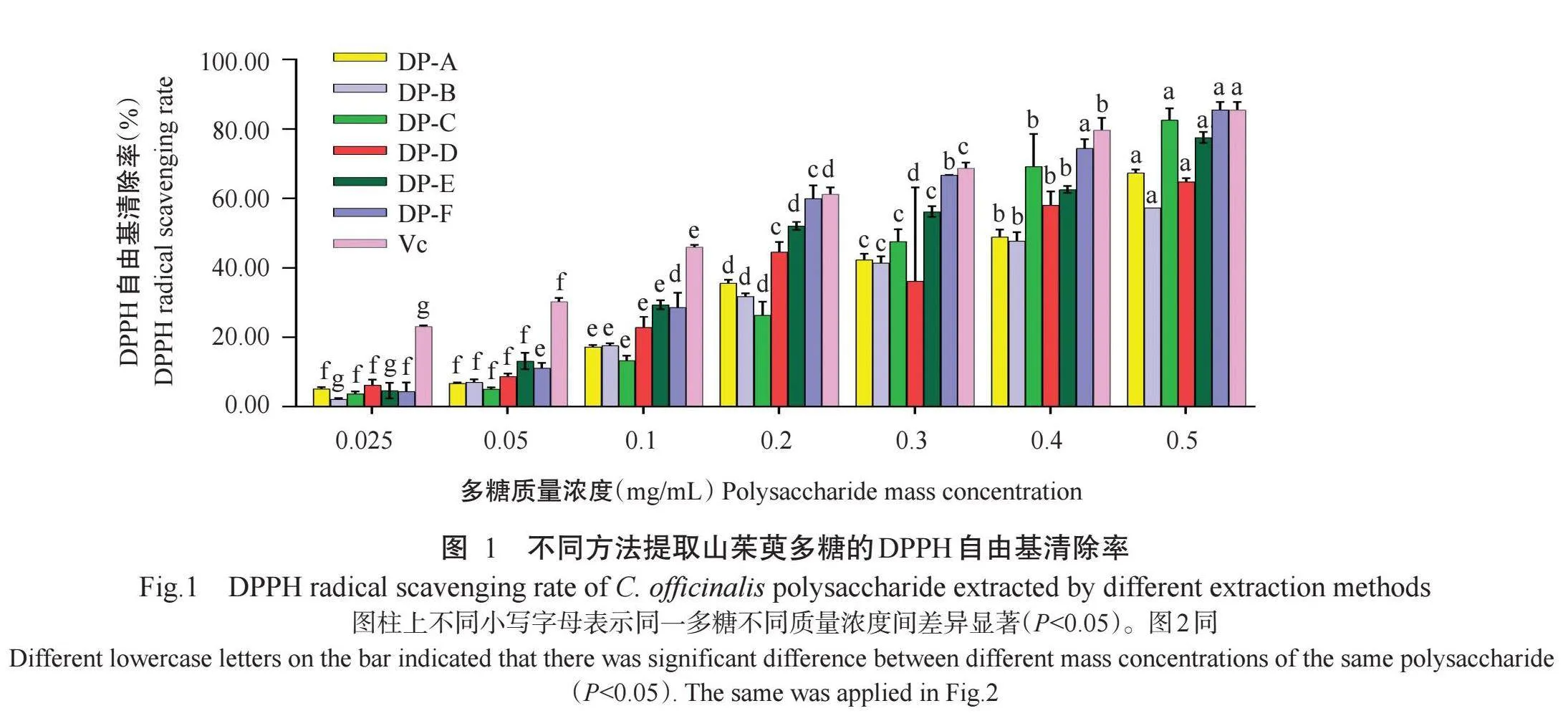
不同方法提取的山茱萸多糖和阳性对照Vc对DPPH自由基清除结果如图1所示。6种方法提取的山茱萸多糖在质量浓度0.025~0.5 mg/mL均具有较强的清除DPPH自由基能力,且清除能力均表现为浓度依赖性。当质量浓度为0.5 mg/mL时,6种方法得到的山茱萸多糖(DP-A、DP-B、DP-C、DP-D、DP-E和DP-F)溶液对DPPH自由基的清除率分别为67.47%、57.40%、82.63%、64.87%、77.57%和85.57%,均达50.00%以上,且DP-F对DPPH自由基的清除率与Vc相同。但6种方法提取的山茱萸多糖中,仅有DP-F对DPPH自由基的平均清除率(60.06%)高于Vc(56.38%),其余多糖(DP-A、DP-B、DP-C、DP-D和DP-E)平均清除率分别为35.51%、31.73%、26.30%、44.54%和52.11%。
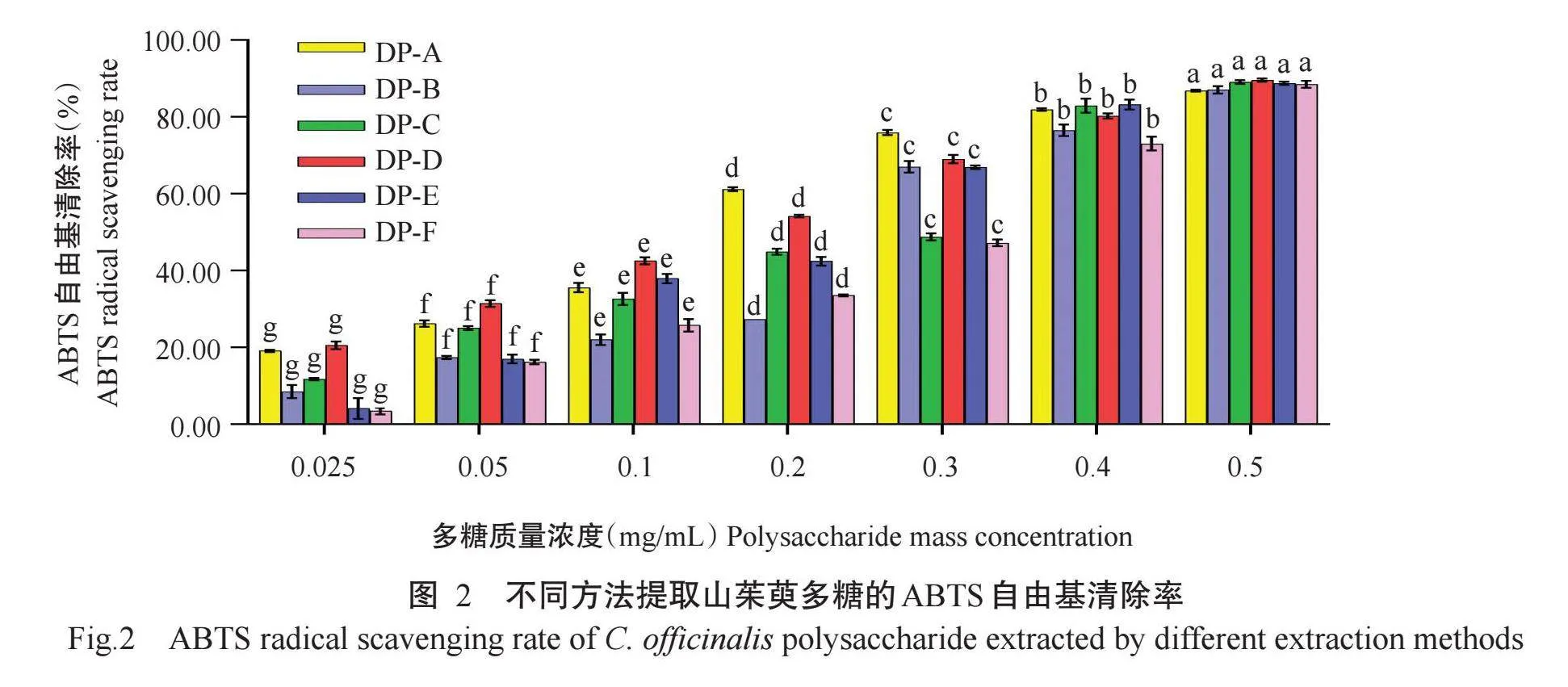
如图2所示,6种方法提取的山茱萸多糖均具有清除ABTS自由基的能力。在质量浓度0.025~0.5 mg/mL范围内,ABTS自由基清除能力呈浓度依赖性。当质量浓度为0.2 mg/mL时,DP-A和DP-D对ABTS自由基清除率分别为61.20%和54.22%,此浓度下清除率已达50.00%以上;其他4种方法提取的多糖(DP-B、DP-C、DP-E和DP-F)对ABTS自由基的清除能力能达到50.00%以上的浓度分别为0.3 mg/mL(67.06%)、0.4 mg/mL(82.94%)、0.3 mg/mL(66.93%)和0.4 mg/mL(73.06%)。当质量浓度为0.5 mg/mL时,6种方法得到的山茱萸多糖(DP-A、DP-B、DP-C、DP-D、DP-E和DP-F)溶液对ABTS自由基清除率分别为86.89%、87.09%、89.13%、89.59%、88.80%和88.54%,在此浓度下,6种多糖的清除效果相近。
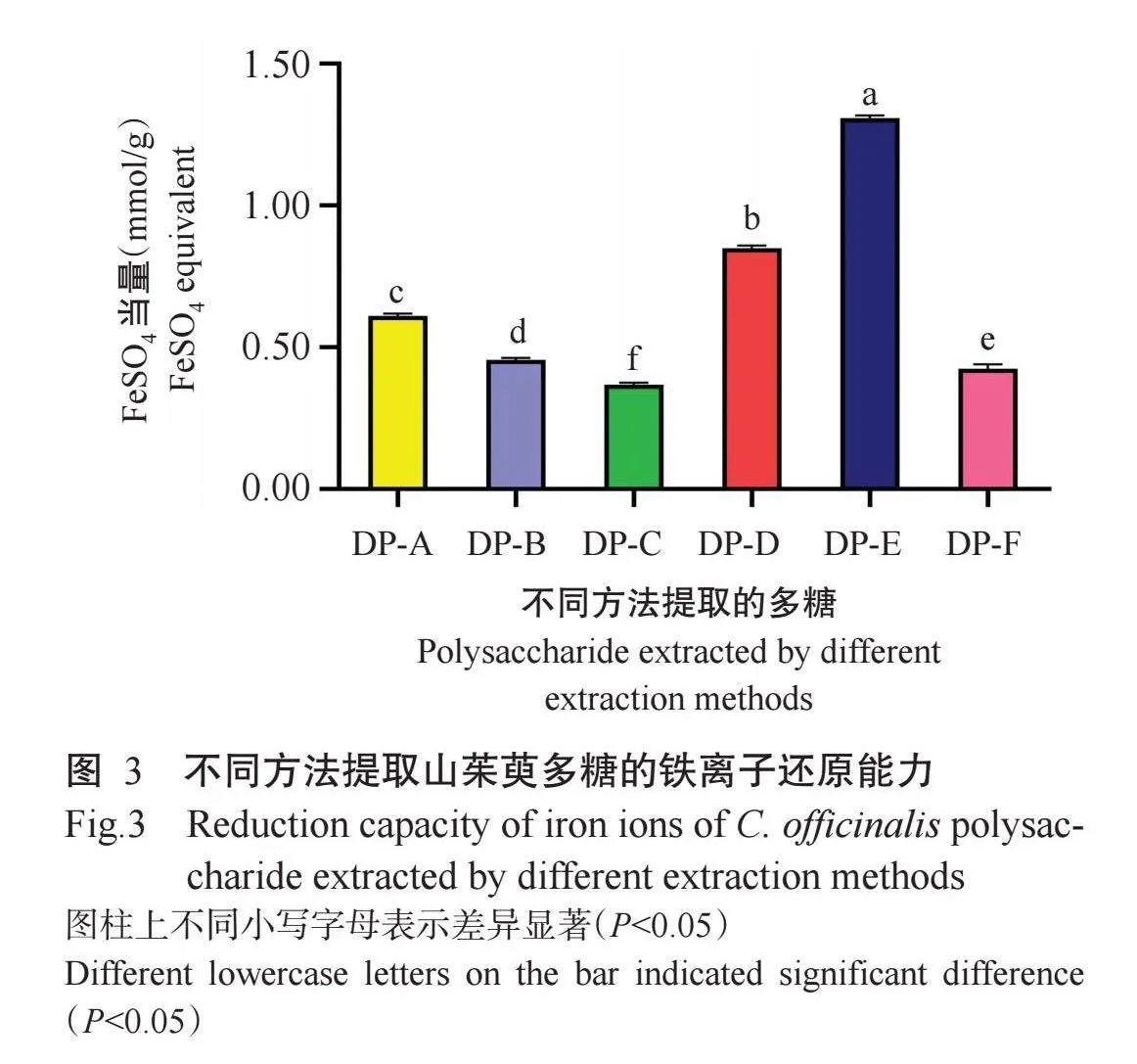
如图3所示,不同方法提取的山茱萸多糖均对铁离子有还原作用,其中DP-E的还原能力(1.31 mmol/g)显著高于其他方法提取的多糖,其他5种方法提取的多糖铁离子还原能力排序为DP-D(0.85 mmol/g)>DP-A(0.61 mmol/L)>DP-B(0.46 mmol/g)>DP-F(0.42 mmol/g)>DP-C(0.37 mmol/g)。
2.4不同方法提取的山茱萸多糖结构表征分析结果
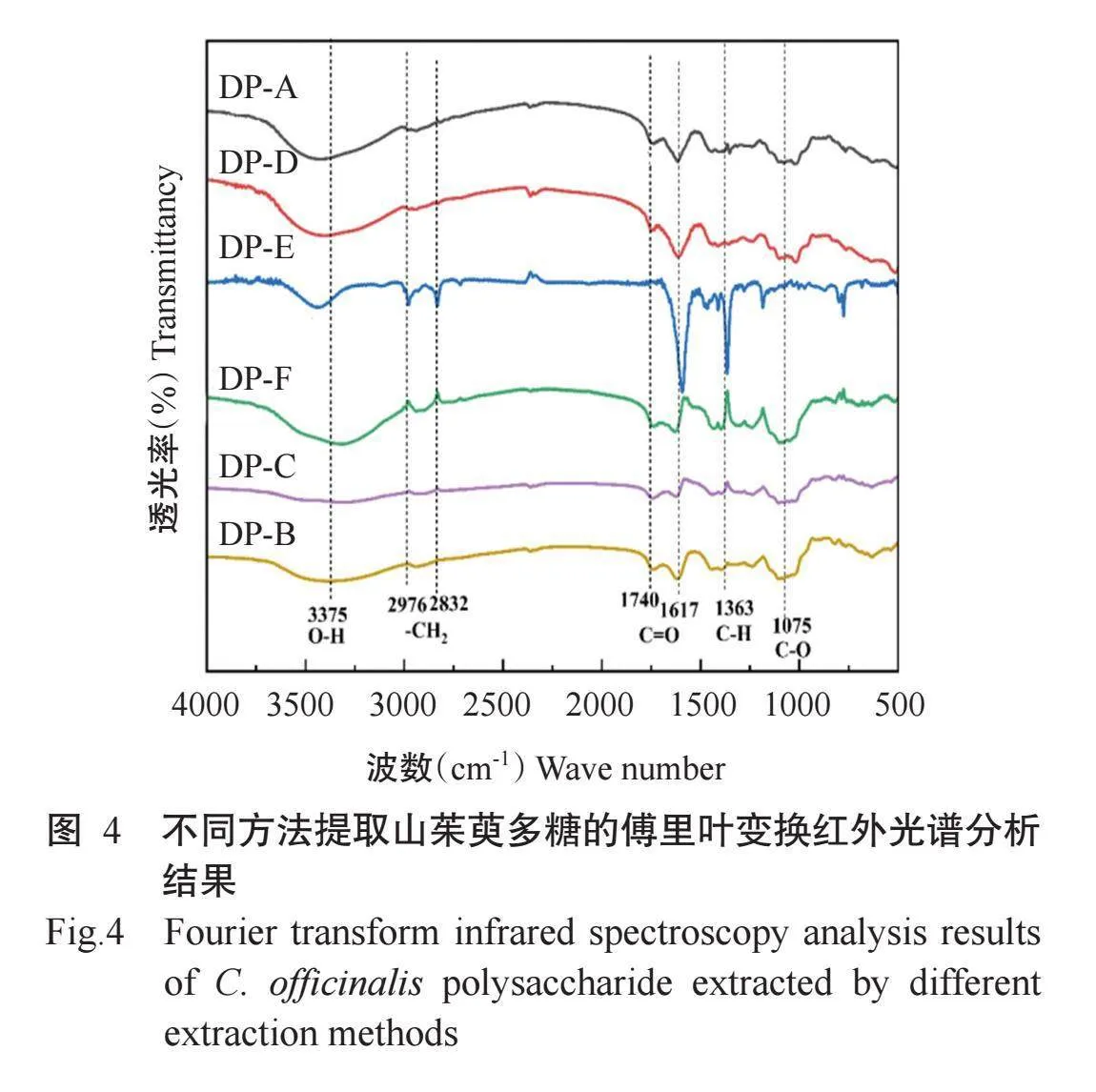
2.4.1傅里叶变换红外光谱分析结果不同方法提取的山茱萸多糖的傅里叶变换红外光谱如图4所示。由图可知,在3375 cm-1处有O-H伸缩振动形成的宽峰,其中DP-E在此处波动强于其他方法提取的多糖,由此推出DP-E中O-H含量高于其他方法提取的多糖。在2976和2832 cm-1处有-CH2伸缩振动形成的吸收峰,DP-E和DP-F波动较强,其余方法提取的多糖波动较弱。在1740和1617 cm-1处有C=O伸缩振动引起的吸收峰,其中DP-E的C=O峰强度增加特别明显,说明其内部含有大量羰基。在1363 cm-1有C-H形成的吸收峰,且DP-E的峰强度依旧大于其他方法提取的多糖。DP-E的C-O伸缩振动形成的吸收峰于1075 cm-1处出现,其余5种方法在此处波动强度无明显差异。总体而言,通过分析山茱萸多糖的红外光谱图,可大致确定不同方法提取的山茱萸多糖中官能团种类和数量。其中,采用碱提取法提取的山茱萸多糖中C=O和C-H含量明显高于其他方法提取的多糖。
2.4.2扫描电镜分析结果采用扫描电镜对不同方法提取得到的山茱萸多糖表面形貌形态特征进行检测,结果如图5所示。在放大倍数为5000时,DP-A和DP-B的表面光滑平整,深入扫描(放大倍数为20000)发现微小孔洞,但结构排列紧密,说明其分子间的吸引力较强,排斥力较弱,未完全降低多糖的相互作用力和分子交联度,故DP-A和DP-B的提取率均不高;DP-C和DP-F的表面粗糙,且深入扫描时多糖结构呈絮状堆叠,整体蓬松多孔,由此说明超声波辅助提取法和复合酶提取法提取的山茱萸多糖分子间排斥力强;DP-D的结构紧密,但有微小异物存在,可能是提取过程中产生的盐类结晶;而DP-E的结构不及DP-B的紧密,表面孔隙较大且不规则。
2.4.3 X射线衍射分析结果图6为不同方法提取的山茱萸多糖X射线衍射结果,在2θ的扫描区间为5º~80º,从图中可看出DP-A、DP-B、DP-C和DP-F的X射线衍射曲线大致相同,均在20。时出现吸收峰,DP-D在大致22。时出现吸收峰;热水提取法、微波辅助提取法、超声波辅助提取法、复合酶提取法和酸提取法提取的山茱萸多糖出现的吸收峰强度基本一致,说明这5种方法提取的山茱萸多糖具有相似的局部有序结构。而碱提取法提取的多糖(DP-E)在32。和45。时出现较强烈的吸收峰。
2.4.4热稳定分析结果由图7可知,不同方法提取的山茱萸多糖第1阶段(0~200℃)的质量损失分别为DF-A:30~124.55℃(质量损失率4.00%)、DF-B:30~114.80℃(质量损失率3.50%)、DF-C:30~124.55℃(质量损失率4.00%)、DF-D:30~179.27℃(质量损失率9.00%)、DF-E:30~154.99℃(质量损失率6.00%)、DF-F:30~122.67℃(质量损失率5.00%)。此阶段主要与少量结合水和吸附水的蒸发有关。第1阶段结束至500℃区间内不同方法提取的山茱萸多糖质量急速减少,说明该阶段多糖的化学键被破坏,多糖配合物分解,产生的气体逸散。在800℃时,DP-E残留最多,占起始质量的49.08%(即质量损失率为50.92%),其余5种方法获得的多糖质量损失率均在60.00%~70.00%。
DSC曲线与TGA曲线分析结果基本一致,不同方法提取的山茱萸多糖在30~200℃范围内吸热蒸发水分,在200~500℃范围内大量化学键断裂放热(图8)。
3讨论
多糖是广泛存在于植物、动物和微生物中的天然大分子化合物,具有多种生物学功能,学者们一直对其药理作用与理化性质进行探索和研究。提取多糖的方法一般有热水提取法、微波辅助提取法、超声波辅助提取法、酸提取法、碱提取法和复合酶提取法。其中,热水提取法具有简单易操作、高效环保的优点,仍是目前运用较多的提取方法,但提取率相对较低、提取到的多糖易降解(刘蕴恒,2022)。微波辅助提取法高效、快捷,能有效保护多糖的生物活性,但需考虑设备成本、安全性、物料等要求,且并非所有多糖均适用该方法(刘梦培等,2024)。超声波辅助提取法具有提取时间短、效率高、成本低、在低温下进行能减少有效成分损失等优势,但超声波时间过长会造成多糖链断裂,影响其结构(Huang et al.,2023)。pH对多糖提取率、结构等影响较大,酸提取法得到的多糖化学稳定性较强,但pH过高会引起酸降解及糖苷键的断裂,从而降低多糖提取率;碱提取法得到的多糖提取率和总糖含量较高,但碱浓度过高会促进多糖水解(Genget al.,2024)。复合酶提取法具有操作简便、条件温和、高效等优点,但花费成本较高、对原料质量要求高,且酶易失活(刘蕴恒,2022)。
本研究采用上述6种方法提取山茱萸多糖,并对各多糖样品的提取率、总糖含量、理化性质、抗氧化性及结构表征进行测定和探讨,结果表明不同方法提取到的山茱萸多糖多个测定指标存在明显差异。
3.1提取方法对山茱萸多糖提取率和总糖含量的影响
用碱提取时,碱液通过破坏纤维素和半纤维素之间的氢键,使不溶性多糖可从细胞壁中分离出来,并转化为可溶性多糖,从而提高其提取率(Li etal.,2023);据报道,使用氢氧化钠的碱提取法是获得淀粉提取率和纯度较高的一种方法(Wang and Cope-land,2012)。因淀粉也属于多糖中的一类,本研究中碱提取法得到的山茱萸多糖的提取率和总糖含量均最高,说明多糖在适当浓度的碱介质中能明显提高其提取率,与Wang和Copeland(2012)、Li等(2023)的研究结果一致。
在适当温度范围内,多糖提取率与温度呈正相关,但随着温度持续升高,高温会破坏多糖结构,氢键断裂,最终其组成发生变化(Chen et al.,2015)。虽然热水提取法具有操作简易、应用范围广且环保等优点,但温度会显著影响多糖提取率,本研究中热水提取法所得山茱萸多糖提取率最低,可能是不佳的温度条件使多糖内部的分子发生降解。
有研究表明,多糖提取率随盐酸浓度的升高而改变,一定范围内有利于多糖溶出,酸度过高会破坏多糖结构,使多糖提取率降低(李亚平和周鸿立,2020)。此外,强酸溶液会破坏多糖中起连接作用的糖苷键,导致部分不耐酸的多糖结构被破坏,从而降低多6fe66ddcf1a4c58f9378c0a1ac60296f糖含量(丁慧敏,2021)。本研究中,酸提取法得到的山茱萸多糖中总糖含量仅为37.49%,可能是盐酸浓度过高破坏了山茱萸多糖的分子结构,故山茱萸多糖的提取须在较温和的pH条件下进行,可考虑降低盐酸浓度。
3.2提取方法对山茱萸多糖理化性质的影响
多糖由许多交织的支链相互缠绕组成不同的网状结构,对油相的截留作用不同,同时糖蛋白的疏水基团也赋予多糖吸油特性(魏瑞芝等,2016)。刘洋等(2020)研究表明,吸油性较好的多糖可应用在食品中,因其表面会形成水合层保持水分,在保湿方面有较大潜能。微波辅助提取法具有耗时短、能较好保留其生物活性等优点,本研究中该方法得到的山茱萸多糖吸油性最强,且显著高于其他方法,这种差异可能是由于不同提取方法获得的多糖结构不同,其在油相中交织的网状结构也有所不同。
泡沫由连续的水相和扩散的气相所组成,溶液中高浓度的氢离子和氢氧根离子不利于多糖泡沫的形成,当用于泡沫类食品时,最好在中性环境中使用(刘蕴恒,2022)。超声波能破坏起连接作用的糖苷键,使多糖解体成许多小分子,从而形成黏度较低的结构(Chen et al.,2021;陈妍妍,2023)。多糖浓度会直接影响气泡的形成,当浓度升高,内部形成的凝胶网状结构可能会降低气体和液体之间的表面张力,从而引发气泡形成;糖蛋白浓度的增加会导致其黏度和气液表面保护膜强度增加,使泡沫更加稳定。多糖胶体增加了整个气—液相的黏度,进一步降低气泡间的排液速率,从而发挥较好的泡沫稳定作用(陈玉峰等,2022)。本研究中碱提取法得到的山茱萸多糖起泡性最低,可能是存在的氢氧根离子影响了泡沫形成;而超声波辅助提取法得到的山茱萸多糖起泡性最高,原因除了该方法的多糖提取是在中性环境中进行外,其黏度较低也是重要因素。而泡沫稳定性存在差异的原因可能是由于不同方法提取的山茱萸多糖的侧链长度、分子链舒展度及总糖含量不同导致。
多糖在中性条件下对胆固醇的吸附能力强于强酸强碱环境(辛松林等,2020)。本研究中碱提取法获得的山茱萸多糖对体外胆固醇吸附能力相对较弱,原因可能是由于该方法提取到的山茱萸多糖中有碱性物质残留,而碱性环境不利于吸附胆固醇。
3.3提取方法对山茱萸多糖抗氧化能力的影响
研究表明,通过破坏多糖与蛋白等杂质的连接键,使多糖结构中更多的活性基团暴露出来,从而可提升多糖的抗氧化能力(王荣琨等,2020)。多糖各组分清除ABTS自由基的能力均呈量效关系,随多糖浓度的上升而增强(王智荣等,2016)。体外抗氧化试验具有操作简便、费用低廉、高通量获得数据、耗时短等优点,近年来成为学者们的研究热点,其中化合物的还原能力可作为评价抗氧化活性的重要指标(刘贵阁等,2023)。山茱萸多糖的抗氧化能力在不同评价体系中有所不同,提取方法和干燥过程均会影响多糖的物理和化学性质、结构和构象,如多糖中小分子量的组分、含糖量等,导致其抗氧化活性存在很大差异(Genget al.,2024)。
本研究中,在合适的质量浓度下,随着多糖质量浓度的增加,不同提取方法得到的山茱萸多糖清除DPPH自由基和ABTS自由基的能力不断增强,与前人研究结果(王智荣等,2016;王荣琨等,2020)一致。检测Fe3+被溶液中还原物质还原为Fe2+的能力,可用于评估多糖的抗氧化活性。本研究结果表明,碱提取法得到的山茱萸多糖具有较强的铁还原能力,可能是由于经碱液提取的多糖分子量降低并去除了其中部分杂质,多糖得到纯化,总糖含量增加,使得抗氧化活性提高。总体而言,抗氧化能力存在差异的原因可能是由于不同方法提取山茱萸多糖的纯度、分子量、结构组成、糖苷键连接方式不尽相同。
3.4提取方法对山茱萸多糖结构表征的影响
傅里叶变换红外光谱较传统的红外光谱具有灵敏度更高、速度更快等优点,是表征多糖有机基团的一种更有效的方法。研究发现,用不同方法提取的多糖基团的吸收峰位置几乎相同,表明在提取多糖的过程中未产生新的官能团(高铭等,2022)。本研究中,6种提取方法得到的山茱萸多糖结构峰位置大致相同,说明多糖的主要官能团并未随提取方法的不同而发生变化,与前人研究结果(高铭等,2022)一致。
研究表明,在扫描电子显微镜下由热水提取法得到的桑葚多糖分子排列紧密、含量高,推测可能是热水提取可促进细胞壁的降解和碎裂,进而促进多糖释放(Huang et al.,2023)。超声波辅助提取法具有简易、高效等优势,其原理是超声波产生的振动可破坏植物细胞壁,促进目标化合物从细胞中释放出来;研究发现该方法提取到的多糖空腔较多,且表面粗糙(Ji etal.,2018)。提取条件会影响多糖内部结构,造成松散、零碎等结构现象出现(陈瑞荣等,2019)。本研究中热水提取法得到的多糖排列较紧密,但提取率及总糖含量较低,与前人研究结果(Huanget al.,2023)不一致,推测可能是不适的温度条件造成其多糖结构受破坏,说明提取条件的差异对不同植物材料有不同的影响;本研究中,超声波辅助提取法得到的多糖排斥力较强,造成整体蓬松多孔的现象;碱提取法较微波辅助提取法得到的多糖结构更疏松,可能是提取过程中碱性溶液破坏了部分分子结构所致。
X射线衍射是分析生物大分子空间构象的有力工具,在多糖研究中常用于检测其对称性和螺旋参数等(杨德强等,2023)。本研究中碱提取法提取的山茱萸多糖在32º和45º时有明显且强烈的吸收峰,说明该方法提取的山茱萸多糖组分内可能有氢氧化钠固体残留。
TGA和DSC用于研究多糖的热力学性质。第1阶段的质量损失主要是由于多糖物理吸附的水分损失,第2阶段的质量损失主要是多糖小分子的挥发性热分解,第3阶段的质量损失主要是由于多糖分子的热分解(宋丽丽等,2020)。热稳定性上的差异可能与提取方法以及多糖的组成和结构有关,同时,提取方法也对多糖的表面形态有影响,可能由于多糖的物理性质(多糖含量、黏度等)造成(Huang et al.,2023)。本研究6种提取方法得到的山茱萸多糖在热力学曲线上表现出相似的趋势,但略有不同,最后500~800℃多糖质量损失趋势稍平缓,说明此时多糖的大部分结构已固定,少部分热稳定性较强的多糖残留在其中。
4结论
不同方法提取的山茱萸多糖结构、抗氧化活性和理化性质各不相同,但不同方法对其热力学特征影响较小,呈相似的变化趋势。可根据不同方法提取的山茱萸多糖特点进行开发利用。
参考文献(References):
曹楠楠.2015.苦豆子多糖的制备及基本结构特征[D].上海:上海交通大学.[Cao N N.2015.Studies on extraction,fractionation and structural characterization of polysaccha-rides from Sophora alopecuroidesL.seeds[D].Shanghai:Shanghai Jiao Tong University.]
陈红惠,牛念拉姆.2020.底圩茶多糖的超声波辅助提取及其抗氧化活性[J].食品工业科技,41(21):179-184.[Chen H H,Niu N L M.2020.Ultrasonic extraction and antioxidant activity of polysaccharide from Dixu tea[J].Science and Technology of Food Industry,41(21):179-184.]doi:10.13386/j.issn 1002-0306.2020040275.
陈瑞荣,平兆华,陈骏佳,李亚军,曾建,李浩洋,梁磊.2019.灵芝栽培菌丝多糖的提取优化、表征和生物活性分析[J].食品科技,44(9):204-208.[Chen R R,Ping Z H,Chen J J,Li Y J,Zeng J,Li H Y,Liang L.2019.Extrac-tion optimization,characterization and bioactivity analysis of polysaccharide from cultivated mycelium of spent Ganoderma substrate[J].Food Science and Technology,44(9):204-208.]doi:10.13684/j.cnki.spkj.2019.09.037.
陈妍妍.2023.植物基咖啡起泡乳的研制[D].无锡:江南大学.[Chen Y Y.2023.Research and development of plant-based coffee foaming milk[D].Wuxi:Jiangnan University.]doi:10.27169/d.cnki.gwqgu.2023.002408.
陈玉峰,巫丽君,严红云,孙怡,高肖静,刘书来,丁玉庭,周绪霞.2022.食品体系中泡沫的稳定性及其影响因素研究进展[J].食品科学,43(21):386-395.[Chen Y F,Wu L J,Yan H Y,Sun Y,Gao X J,Liu S L,Ding Y T,Zhou X X.2022.Progress in research on foam stability and the factors influencing it in the food system[J].Food Science,43(21):386-395.]doi:10.7506/spkx 1002-6630-20211028-308.
程俊文,贺亮,吴学谦,付立忠,胡传久,吴庆其,李海波,魏海龙.2010.复合酶法提取山茱萸多糖的工艺条件优化[J].中国林副特产,(3):1-4.[Cheng J W,He L,Wu X Q,Fu L Z,Hu C J,Wu Q Q,Li H B,Wei H L.2010.Optimization of extracting technique of polysaccharidefrom Fructus corni with compound enzymes[J].Forest By-Product and Speciality in China,(3):1-4.]doi:10.13268/j.cnki.fbsic.2010.03.052.
丁慧敏.2021.红须腹菌多糖提取、修饰、结构表征及免疫活性研究[D].南京:南京师范大学.[Ding H M.2021.Extraction,modification,structural characterization,and immune activity study of polysaccharides from Rhizo-pogonrubescens(Tul.)Tul[D].Nanjing:Nanjing Normal University.]doi:10.27245/d.cnki.gnjsu.2021.000424.
冯飞艳,行冰玉.2023.山茱萸中主要活性成分含量测定方法研究进展[J].化工管理,(18):58-62.[Feng F Y,Xing B Y.2023.Research progress on the determination methods of main chemical components in cornus[J].Chemical Ma-nagement,(18):58-62.]doi:10.19900/j.cnki.ISSN1008-4800.2023.18.016.
高铭,陈瑞战,吴静,白春龙,孙惠,李冬雪,吴文静.2022.提取工艺对柠檬多糖得率及理化特征的影响[J].长春师范大学学报,41(10):88-96.[Gao M,Chen R Z,Wu J,Bai C L,Sun H,Li D X,Wu W J.2022.Effects of extraction process on the yield and physicochemical characteristics of lemon polysaccharides[J].Journal of Changchun Normal University,41(10):88-96.]doi:10.3969/j.issn.1008-178X.2022.10.014.
国家卫生健康委员会,国家市场监督管理总局.2023.关于党参等9种新增按照传统既是食品又是中药材的物质公告[EB/OL].(2023-11-17)[2024-02-25].http://www.nhc.gov.cn/sps/s7892/202311/f0d6ef3033b54333a882e3d009ff49bf.shtml.[National Health Commission,State Administrationfor Market Regulation.2023.Announcement on 9 newly added substances,including Codonopsispilosula,that aretraditionally both food and traditional Chinese medicinal materials[EB/OL].(2023-11-17)[2024-02-25].http://www.nhc.gov.cn/sps/s7892/202311/f0d6ef3033b54333a882e3d0 09ff49bf.shtml.]
何嘉琦,胡懿化,张武霞,鲁静武,赵晋忠,李鹏.2022.茯苓碱提多糖的免疫活性及作用机制[J].食品科技,47(8):167-173.[He J Q,HuY H,Zhang W X,Lu J W,Zhao J Z,Li P.2022.Immunoregulatory activities and mechanisms of alkali-extracted polysaccharides from Poria cocos(Schw.)Wolf[J].Food Science and Technology,47(8):167-173.]doi:10.13684/j.cnki.spkj.2022.08.043.
胡园园,方淑玲,杨虎清,吴峰华.2011.微波辅助提取山茱萸多糖工艺优化[J].食品与机械,27(5):93-95.[Hu Y Y,Fang S L,Yang H Q,Wu F H.2011.Optimization of tech-nology for microwave-assisted extraction of polysaccha-rides from Fructus corni[J].Food&Machinery,27(5):93-95.]doi:10.3969/j.issn.1003-5788.2011.05.023.
黄雪松,李颖思,石思迷.2009.大蒜多糖功能性质的研究[J].现代食品科技,25(6):588-591.[Huang X S,Li Y S,Shi S M.2009.Study of functions and properties of garlic polysaccharide[J].Modern Food Science and Technology,25(6):588-591.]doi:10.3969/j.issn.1673-9078.2009.06.003.
鞠念衡,刘爽,韩之一,李双双,赵前程,李莹.2023.纳豆菌发酵海参制备的多糖抗氧化活性分析[J].渔业研究,45(2):163-168.[Ju N H,Liu S,Han Z Y,Li S S,Zhao Q C,Li Y.2023.Analysis of antioxidant activity of polysaccha-ride from sea cucumber and fermented sea cucumber by Bacillus natto[J].Journal of Fisheries Research,45(2):163-168.]doi:10.14012/j.cnki.fjsc.2023.02.008.
雷呈,李斐.2013.超声波辅助提取山茱萸多糖的实验研究[J].天然产物研究与开发,25(7):990-994.[Lei C,Li F.2013.Ultrasonic assisted extraction of polysaccharidefrom Cornus officinalis Sieb.et Zucc[J].Natural Product Research and Development,25(7):990-994.]doi:10.16333/j.1001-6880.2013.07.011.
李豪,车振明,谷燕,刘燕,吴永军,黄维,陈荣华.2011.微波辅助提取山茱萸多糖的工艺优化[J].安徽农业科学,39(26):15998-16000.[Li H,Che Z M,GuY,Liu Y,Wu Y J,Huang W,Chen R H.2011.Optimization of the microwave-assisted extraction process of polysaccharides from Fruc-tuscorni[J].Journal of Anhui Agricultural Sciences,39(26):15998-16000.]doi:10.13989/j.cnki.0517-6611.2011.26.194.
李平,王艳辉,马润宇.2003.碱提山茱萸多糖的理化性质及抗氧化活性研究[J].中草药,34(11):973-976.[Li P,Wang Y H,Ma R Y.2003.Study on physiochemical characteris-tic and antioxidation activity of polysaccharide extracted with sodium hydroxide from fruit of Cornus officinalis[J].Chinese Traditional and Herbal Drugs,34(11):973-976.]doi:10.3321/j.issn:0253-2670.2003.11.005.
李亚平,周鸿立.2020.玉米须多糖酸提取工艺及其抗氧化活性的研究[J].粮食与油脂,33(8):86-90.[Li Y P,Zhou H L.2020.Acidic extraction and antioxidant activity of polysaccharides from corn silk[J].Cereals&Oils,33(8):86-90.]doi:10.3969/j.issn.1008-9578.2020.08.024.
李瑶佳.2019.植物多糖提取方法研究进展[J].现代农业科技,(1):222-223.[Li Y J.2019.Research progress on extraction methods of plant polysaccharides[J].Modern Agricultural Science and Technology,(1):222-223.]doi:10.3969/j.issn.1007-5739.2019.01.127.
刘阿娟,张静,张化朋,张鹏,梁涛.2013.虎奶菇菌核多糖SHNP的分离纯化及形貌观测[J].农产品加工(学刊),(18):66-69.[Liu A J,Zhang J,Zhang H P,Zhang P,Liang T.2013.Purification and atomic force microscope observation of SHNP from the mushroomsclerotia of Pleu-rotus tuber-regium[J].Academic Periodical of Farm Pro-ducts Processing,(18):66-69.]doi:10.3969/jissn.1671-9646(X).2013.09.049.
刘贵阁,钟耀广,陈冰洁,王晓,张怡,乔勇进.2023.不同醇沉米糠多糖的体外抗氧化和降血糖活性研究[J].保鲜与加工,23(3):29-36.[Liu G G,Zhong Y G,Chen B J,Wang X,Zhang Y,Qiao Y J.2023.Antioxidant and hypoglyce-mic activities in vitro of rice bran polysaccharides with dif-ferent ethanol precipitation treatment[J].Storage and Pro-cess,23(3):29-36.]doi:10.3969/j.issn.1009-6221.2023.03.005.
刘梦培,王嵘,李格,张李兵,纵伟,黄琳.2024.杜仲叶多糖的提取、结构及抗氧化活性研究[J].河南农业大学学报,58(1):132-140.[Liu M P,Wang R,Li G,Zhang L B,Zong W,Huang L.2024.Study on extraction,structure and antio-xidant activity of polysaccharides from Eucommia ulmoi-des leaves[J].Journal of Henan Agricultural University,58(1):132-140.]doi:10.16445/j.cnki.1000-2340.20230919.001.
刘明研,余丽访,杨芬,刘品华.2016.小黑药水溶性成分吸附胆酸盐、胆固醇的研究[J].曲靖师范学院学报,35(6):37-41.[Liu M Y,Yu L Y,Yang F,Liu P H.2016.Study on the adsorption of bile salts and cholesterol by water soluble constituents from Saniculaastrantiifolia[J].Jour-nal of Qujing Normal University,35(6):37-41.]doi:10.3969/j.issn.1009-8879.2016.06.008.
刘洋,张汆,周圣伟,陈志宏,何晓伟,赵维萍.2020.芡果皮和假种皮中多糖的分离提取及其功能性质[J].滁州学院学报,22(2):10-14.[Liu Y,Zhang C,Zhou S W,Chen Z H,He X W,Zhao W P.2020.Extraction and functional pro-perties of polysaccharides in the Euryale ferox fruit peel and aril[J].Journal of Chuzhou University,22(2):10-14.]doi:10.3969/j.issn.1673-1794.2020.02.004.
刘宇,戴沅霖,马越,董淑君,张斌,郑振佳.2023.金银花粗多糖提取工艺优化及其抗氧化活性评价[J].食品工业科技,44(7):188-196.[Liu Y,Dai Y L,Ma Y,Dong S J,Zhang B,Zheng Z J.2023.Extraction process optimiza-tion and antioxidant activity evaluation of crude polysac-charides from Lonicera japonica[J].Science and Techno-logy of Food Industry,44(7):188-196.]doi:10.13386/j.issn 1002-0306.2022060232.
刘蕴恒.2022.岩豆多糖的提取工艺优化、结构表征及功能特性研究[D].雅安:四川农业大学.[Liu Y H.2022.Opti-mization of extraction process,structural characterization and functional characteristics of polysaccharide from seeds of Millettiadielsiana Harms[D].Ya’an:Sichuan Agricul-tural University.]doi:10.27345/d.cnki.gsnyu.2022.000571.
马立军,刘振权,雒鹰,廖丽华,李继平,刘冰.2012.强化杨木单板的傅立叶红外光谱分析[J].吉林林业科技,41(3):23-27.[Ma L J,Liu Z Q,Luo Y,Liao L H,Li J P,Liu B.2012.Analysis of fourier transform infrared spectroscopy on enhanced poplar veneer[J].Journal of Jilin Forestry Science and Technology,41(3):23-27.]doi:10.16115/j.cnki.issn.1005-7129.2012.03.001.
孟楠,樊振江,高雪丽.2017.纤维素酶法提取黄秋葵多糖的工艺优化[J].食品工程,(4):14-17.[Meng N,Fan Z J,Gao X L.2017.Study on okra polysaccharide extraction pro-cess by cellulase[J].Food Engineering,(4):14-17.]doi:10.3969/j.issn.1673-6044.2017.04.005.
宋丽丽,闻格,霍姗浩,胡晓龙,彭惠.2020.小黄姜多糖的分离纯化76wWPdpqDEHtqbS/6SLGIs2uCv3cYqMjOmoZSzCUjzE=及其结构特征及抗氧化活性研究[J].食品与发酵工业,46(12):73-79.[Song L L,Wen G,Huo S H,Hu X L,Peng H.2020.Isolation,purification,structural charac-terization and antioxidant activity of polysaccharide from Zingiber officinale Roscoe[J].Food and Fermentation In-dustries,46(12):73-79.]doi:10.13995/j.cnki.11-1802/ts.023519.
唐敏.2023.油茶多糖的提取优化、理化特性及其抗氧化活性研究[D].雅安:四川农业大学.[Tang M.2023.Extrac-tion optimization,physicochemical properties and antioxi-dant activity of polysaccharides from Camellia oleifera[D].Ya’an:Sichuan Agricultural University.]doi:10.27345/d.cnki.gsnyu.2023.000473.
王娜,刘玉叶,刘美玲,刘孟军,赵智慧.2023.响应面优化金丝小枣碱提多糖工艺及其抗氧化活性研究[J].食品工业科技,44(7):163-169.[Wang N,Liu Y Y,Liu M L,Liu M J,Zhao Z H.2023.Optimization of alkali extraction pro-cess of‘Jinsixiaozao’polysaccharide by response surface methodology and its antioxidant activity[J].Science and Technology of Food Industry,44(7):163-169.]doi:10.13386/j.issn 1002-0306.2022060026.
王荣琨,王钦,罗欣,孙达锋,蒋建新,朱莉伟.2020.不同提取方法对竹荪多糖提取率及抗氧化性影响[J].中国食用菌,39(3):24-28.[Wang R K,Wang Q,Luo X,Sun D F,Jiang J X,Zhu L W.2020.Effects of different extraction methods on the extraction rate and antioxidant properties of Dictyophoraindusiata polysaccharide[J].Edible Fungi of China,39(3):24-28.]doi:10.13629/j.cnki.53-1054.2020.03.007.
王如涛,吴绵斌,林建平,杨立荣.2013.植物多糖分离提取技术的研究进展[J].中国生物工程杂志,33(7):118-123.[Wang R T,Wu M B,Lin J P,Yang L R.2013.Recent advances in extraction and isolation of plant polysaccha-rides[J].China Biotechnology,33(7):118-123.]doi:10.13523/j.cb.20130718.
王威,甘啸阳,许惠琴,朱逸晖,束安梅,富莹雪,喻斌,吕高虹.2024.山茱萸新苷对糖尿病肾病模型小鼠的保护作用及机制[J].中国药房,35(4):395-400.[Wang W,Gan X Y,Xu H Q,Zhu Y H,Shu A M,Fu Y X,Yu B,LüG H.2024.The protective effect and mechanism of cornuside on diabetic nephropathy model mice[J].China Pharmacy,35(4):395-400.]doi:10.6039/j.issn.1001-0408.2024.04.03.
王智荣,崔春,林宗毅,黄俊伟.2016.海带多糖及其纯化组分的胆酸盐吸附能力及抗氧化活性[J].食品科学,37(1):22-27.[Wang Z R,Cui C,Lin Z Y,Huang J W.2016.Bilesalt adsorption capacity and antioxidant activity of polysac-charide extract from Laminaria japonica and its fraction[J].Food Science,37(1):22-27.]doi:10.7506/spkx 1002-6630-201601005.
魏瑞芝,奥文芳,李克超,王承明.2016.花生蛋白多糖的功能性质研究[J].食品科技,41(5):202-207.[Wei R Z,Ao W F,Li K C,Wang C M.2016.Functional properties of peanut proteoglycan[J].Food Science and Technology,41(5):202-207.]doi:10.13684/j.cnki.spkj.2016.05.038.
辛松林,舒娟,韦章琳,徐培,黄韬睿,张海豹.2020.川秋葵微粉体外降血脂作用及对小鼠肠道菌群的影响[J].江苏农业科学,48(16):228-235.[Xin S L,Shu J,Wei Z L,Xu P,Huang T R,Zhang H B.2020.In vitro hypolipidemic effect of Sichuan okra micropowder and its influence on intestinal flora of mice[J].Jiangsu Agricultural Sciences,48(16):228-235.]doi:10.15889/j.issn.1002-1302.2020.16.045.
徐丽梅,陈炼红.2022.响应面复合酶法提取紫薯多糖及抗氧化活性研究[J].中国调味品,47(4):190-197.[Xu L M,Chen L H.2022.Study on extraction of polysaccharides from purple sweet potato by response surface and com-pound enzymatic methods and the antioxidant activity[J].China Condiment,47(4):190-197.]doi:10.3969/j.issn.1000-9973.2022.04.037.
杨德强,魏名卓,杨欣荣,李冀,杨春娟.2023.多糖的高级结构鉴定分析的研究进展[J].化学工程师,37(5):68-71.[Yang D Q,Wei M Z,Yang X R,Li J,Yang C J.2023.Research progress of identification and analysis methodsfor advanced structure of polysaccharides[J].Chemical Engineer,37(5):68-71.]doi:10.16247/j.cnki.23-1171/tq.20230568.
姚瑞祺,胡家栋,王锋,周博.2022.多频超声波辅助提取山茱萸多糖工艺研究[J].湖北农业科学,61(16):155-158.[Yao R Q,Hu J D,Wang F,Zhou B.2022.Research on extraction of polysaccharides from Macrocarpiumoffcina-lis by multi-frequency ultrasonic[J].Hubei Agricultural Sciences,61(16):155-158.]doi:10.14088/j.cnki.issn0439-8114.2022.16.030.
尹艳,高文宏.2014.两种水溶性大豆多糖的X-射线衍射分析[J].食品研究与开发,35(6):1-2.[Yin Y,Gao W H.2014.Study on analyzing X-ray diffraction patterns of two kinds of soluble soybean polysaccharides[J].Food Research and Development,35(6):1-2.]doi:10.3969/j.issn.1005-6521.2014.06.001.
张曼,张宇,徐少博,赵宏,王宇亮,赵芷萌,孟繁玲.2020.平贝母多糖铁配合物的合成、结构特征及抗氧化活性[J].食品科学,41(6):36-42.[Zhang M,Zhang Y,Xu S B,Zhao H,Wang Y L,Zhao Z M,Meng F L.2020.Prepara-tion,structural characteristics and antioxidant activity of polysaccharide-iron complex from Fritillaria ussuriensis[J].Food Science,41(6):36-42.]doi:10.7506/spkx 1002-6630-20190410-123.
张培全,胡继藤,张超.2019.山茱萸提取物清除DPPH·自由基作用的研究[J].海峡药学,31(2):32-35.[Zhang P Q,Hu J T,Zhang C.2019.Study on scavenge DPPH·activi-ties of the extractives from Cornus officinalis[J].Strait Pharmaceutical Journal,31(2):32-35.]doi:10.3969/j.issn.1006-3765.2019.02.010.
张晓文,柳美娟,王珍珍,宋珂.2020.山茱萸多糖的提取分离及药理活性研究进展[J].西北药学杂志,35(3):470-475.[Zhang X W,Liu M J,Wang Z Z,Song K.2020.Research progress on extraction,isolation and pharmaco-logical activity of Fructus corni polysaccharide[J].North-west Pharmaceutical Journal,35(3):470-475.]doi:10.3969/j.issn.1004-2407.2020.03.034.
张燕,张树淼,王飞,王璐,刘梦杰,梁英.2015.近年来植物多糖提取方法研究进展[J].农产品加工,(11):65-68.[Zhang
Y,Zhang S M,Wang F,Wang L,Liu M J,Liang Y.2015.Review on extraction methods of plant polysaccharide of these years[J].Farm Products Processing,(11):65-68.]doi:10.3969/jissn.1671-9646(X).2015.06.021.
Bai L L,Zhu P L,Wang W B,Wang M C.2020.The influence of extraction pH on the chemical compositions,macromo-lecular characteristics,and rheological properties of poly-saccharide:The case of okra polysaccharide[J].Food Hy-drocolloids,102:105586.doi:10.1016/j.foodhyd.2019.10 5586.
Chen C,You L J,Abbasi A M,Fu X,Liu R H.2015.Optimiza-tion for ultrasound extraction of polysaccharides from mul-berry fruits with antioxidant and hyperglycemic activity in vitro[J].Carbohydrate Polymers,130:122-132.doi:10.1016/j.carbpol.2015.05.003.
Chen H Y,Zeng J S,Wang B,Cheng Z,Xu J,Gao W H,Chen K F.2021.Structural characterization and antioxidant activities of Bletilla striata polysaccharide extracted by dif-ferent methods[J].Carbohydrate Polymers,266:118149.doi:10.1016/j.carbpol.2021.118149.
Geng X R,Guo D D,Wu B,Wang W X,Zhang D F,Hou S T,Bau T,Lei J Y,Xu L J,Cheng Y F,Feng C P,Meng J L,Qian H,Chang M C.2024.Effects of different extraction methods on the physico-chemical characteristics and bio-logical activities of polysaccharides from Clitocybe squa-mulosa[J].International Journal of Biological Macromo-lecules,259:129234.doi:10.1016/j.ijbiomac.2024.129234.
Huang Y Y,Xie W,Tang T,Chen H G,Zhou X.2023.Struc-tural characteristics,antioxidant and hypoglycemic activi-ties of polysaccharides from Mori Fructus based on diffe-rent extraction methods[J].Frontiers in Nutrition,10:1125831.doi:10.3389/fnut.2023.1125831.
Ji X L,Peng Q,Yuan Y P,Liu F,Wang M.2018.Extraction and physicochemical properties of polysaccharides from Ziziphus jujuba cv.Muzao by ultrasound-assisted aqueous two-phase extraction[J].International Journal of Biologi-cal Macromolecules,108:541-549.doi:10.1016/j.ijbiomac.2017.12.042.
Li Q Y,Dou Z M,Duan Q F,Chen C,Liu R H,Jiang Y M,Yang B,Fu X.2023.A comparison study on structure-function relationship of polysaccharides obtained from sea buckthorn berries using different methods:Antioxidant and bile acid-binding capacity[J].Food Science and Human Wellness,13(1):494-505.doi:10.26599/FSHW.2022.925 0043.
Peng Z C,Tian S R,Li H L,Zhu L P,Zhao Z M,Zheng G D,Wen Q Y,Tian H R,Yang D P.2023.Extraction,cha-racterization,and antioxidant properties of cell wall poly-saccharides from the pericarp of Citrus reticulata cv.Chachiensis[J].Food Hydrocolloids,136:1-12.doi:10.1016/J.FOODHYD.2022.108237.
Wang S J,Copeland L.2012.Effect of alkali treatment on struc-ture and function of pea starch granules[J].Food Chemis-try,135(3):1635-1642.doi:10.1016/j.foodchem.2012.06.003.
(责任编辑罗丽)
