海巴戟果实多糖的体外抗肿瘤活性研究
2024-10-15王璇袁海华敖新宇金璨王灿范睿吴田






摘要:【目的】明确海巴戟果实多糖的抗肿瘤活性,为深入研究海巴戟果实多糖生物活性及其开发利用提供科学依据。【方法】采用噻唑蓝比色(MTT)法检测海巴戟果实粗多糖和纯化多糖对人正常结肠上皮细胞的毒性,并鉴定多糖对人结肠癌细胞SW620和HCT-116、宫颈癌细胞Hela、肝癌细胞QGY-7703增殖生长的影响,通过统计癌细胞的凋亡和坏死频率评估纯化多糖的体外抗肿瘤效果。【结果】海巴戟果实多糖无毒,较低浓度(62.5~125μg/mL)的粗多糖或较高浓度(125~2000μg/mL)的纯化多糖对人正常结肠上皮细胞增殖有促进作用。海巴戟果实多糖对宫颈癌细胞Hela的抑制作用较强,粗多糖和纯化多糖均在125~2000μg/mL浓度范围内显著抑制宫颈癌细胞Hela的增殖生长(P<0.05,下同),粗多糖和纯化多糖对宫颈癌细胞Hela的半抑制浓度(IC50)分别为542.80和1546.00μg/mL。海巴戟果实多糖对结肠癌细胞HCT-116的增殖生长也有较强抑制作用,但对肝癌细胞QGY-7703的增殖无明显抑制作用。海巴戟果实粗多糖浓度为1000μg/mL时对结肠癌细胞HCT-116和宫颈癌细胞Hela的抑制作用最强,细胞增殖率分别为78.11%和81.85%;纯化多糖浓度为2000μg/mL时对结肠癌细胞HCT-116和宫颈癌细胞Hela的抑制作用最强,细胞增殖率分别为57.05%和68.64%;纯化多糖对癌细胞生长的抑制能力整体上高于粗多糖。纯化多糖对结肠癌细胞HCT-116和宫颈癌细胞Hela的凋亡及坏死频率均有显著影响,且2种癌细胞的坏死频率均随纯化多糖浓度的增加而升高,于2000μg/mL浓度时达峰值,坏死频率分别为2.83%和6.75%。【结论】海巴戟果实多糖具有良好的抗肿瘤活性,纯化多糖比粗多糖的抗肿瘤活性更强。
关键词:海巴戟;粗多糖;纯化多糖;抗肿瘤活性
中图分类号:S567.190.99文献标志码:A文章编号:2095-1191(2024)07-1971-10
Antitumor activity in vitro of polysaccharide from MorindacitrifoliaL.fruit
WANG Xuan YUAN Hai-hua AO Xin-yu3,JIN Can WANG Can FAN Rui WU Tian1*
(1College of Landscape Architecture and Horticulture Sciences,Southwest Forestry University,Kunming,Yunnan65022 China;2Key Laboratory of Bamboo and Rattan Science&Technology,International Center for Bambooand Rattan,National Forestry and Grassland Administration,Beijing 10010 China;3College of Humanities andLaw,Southwest Forestry University,Kunming,Yunnan 65022 China;4Spice and Beverage Research Institute,Chinese Academy of Tropical Agricultural Sciences,Wanning,Hainan 571533,China)
Abstract:【Objective】To clarify the antitumor activity of polysaccharides from the MorindacitrifoliaL.fruit,and to provide reference basis for the in-depth study of polysaccharide biological activity in M.citrifolia fruit and its develop-ment and application.【Method】The cytotoxicity of crude and purified polysaccharides of M.citrifolia fruit on normal co-lon epithelial cells was detected by thiazole blue colorimetry(MTT)assay.Then,the effects of polysaccharides on the pro-liferation and growth of human colon cancer cells SW620 and HCT-116,cervical cancer cell Hela and liver cancer cell QGY-7703 were evaluated,and the antitumor activity in vitro of purified polysaccharide was assessed by the frequenciesof apoptosis and necrosis of cancer cells.【Result】The polysaccharides of M.citrifolia fruit were non-toxic,and crude polysaccharide at low concentrations(62.5-125μg/mL)or purified polysaccharide at high concentrations(125-2000μg/mL)had promoting effect on the proliferation of human normal colon epithelial cells.Polysaccharide from M.citrifolia fruit showed the strongest inhibitory effect on cervical cancer cell Hela,with both crude and purified polysaccharide signifi-cantly inhibiting the growth of cervical cancer cell Hela at the concentration range of 125-2000μg/mL(P<0.05,the same below),with semi-inhibitory concentration(IC50)of 542.80 and 1546.00μg/mL.The polysaccharide of M.citrifolia fruit also had strong inhibitory effect on the proliferation and growth of colon cancer cell HCT-116,but had no obvious inhibi-tory effect on the proliferation of liver cancer cell QGY-7703.At a concentration of 1000μg/mL,the crude polysaccharide of M.citrifolia fruit had the strongest inhibitory effect on colon cancer cells HCT-116 and cervical cancer cells Hela,the cell proliferation rates were 78.11%and 81.85%respectively.The purified polysaccharide at a concentration of 2000μg/mL showed the strongest inhibitory effect on colon cancer cells HCT-116 and cervical cancer cells Hela,with cell prolifera-tion rates of 57.05%and 68.64%.The growth inhibitory ability of purified polysaccharide on cancer cells was higher than that of crude polysaccharide.The purified polysaccharide had significant effect on the apoptosis and necrosis frequency of colon cancer cell HCT-116 and cervical cancer cell Hela,and the necrosis frequency of the both cancer cells increased with the increase of purified polysaccharide concentration,reaching a peak value at 2000μg/mL,with the necrosis fre-quency of 2.83%and 6.75%.【Conclusion】The polysaccharide from M.citrifolia fruit has good activity of antitumor,and the purified polysaccharide shows much stronger antitumor activity than the crude polysaccharides.
Key words:Morindacitrifolia L.;crude polysaccharide;purified polysaccharide;antitumor activity
Foundation items:Species Variety Resource Protection Project of Ministry of Agriculture and Rural Affairs(2023NWB050);Promotion Project Supported by National Forestry and Grassland Administration(〔2019〕27)
0引言
【研究意义】海巴戟(Morindacitrifolia L.)又称为诺丽,生长于热带丛林中,是茜草科巴戟天属的一种集观赏、药用、食用价值为一体的多功能园林植物,含有较丰富的多糖及其他营养成分(Jin et al.,2019)。海巴戟主要分布于南太平洋诸岛至亚洲中南半岛等地区,在我国台湾、海南、云南等地均有栽培(陈鸿洁等,2018)。海巴戟果实、叶片、枝干等部位均可入药,其中果实是药用成分的主要来源,具有较大的开发价值,具有抗氧化、抑菌、抗炎症、抗肿瘤和免疫调节等生物活性(Sun et al.,2021)。海巴戟体内含有大量的天然生物活性成分,其中多糖是海巴戟的主要功能成分之一(杨焱等,2017)。多糖的生物活性与其化学结构、组成成分及分子量等有关,是重要的生物大分子,参与多种生命活动,具有抗衰老(Yang et al.,2019)、降血糖(史天洁等,2020)、抗炎(Zhao et al.,2020a)、抗氧化(Zhao et al.,2020b;陈淑芳等,2021)及抗肿瘤(Wu et al.,2023)等多种药理活性。近年来,以细胞异常增殖为显著特征的癌症发病率急剧上升。据报道,我国癌症发病率显著高于全球平均水平,造成了全球性癌症负担(Zheng et al.,2022)。因此,探究海巴戟果实多糖的抗肿瘤生物活性对天然植物活性成分的开发利用具有重大意义,也可为利用海巴戟果实多糖开发新型抗肿瘤药物提供理论依据。【前人研究进展】植物多糖因具备生物相容性、生物降解性、可化学修饰、低毒高效等优势已成为近年来国内外抗肿瘤领域的研究热点。相关研究证实,从白及(Bletillastriata)块茎中分离纯化的多糖BSP-1含有糖醛酸,主要由甘露糖和葡萄糖构成,能抑制肝癌细胞的增殖(陈思思等,2019);黄芩(Scutellariabaicalensis)多糖有抗肿瘤生物活性,具有开发为抗肿瘤药物的潜在价值(边亮等,2020;李平等,2021);以甘露糖、葡萄糖和半乳糖等吡喃糖为单糖构型的生姜纯化多糖UGP1是一种β型酸性糖,对结肠癌细胞有显著的抗肿瘤活性,可通过调控p53、caspase-3和Bax/Bcl-2依赖性途径诱导细胞凋亡及调节免疫系统活性来抑制人结肠癌细胞的增殖生长(Liao et al.,2020;Qian et al.,2023);从石斛(Dendrobium wardianum)茎中提取纯化的多糖DWPP-Is具有典型的β吡喃型结构,主要由甘露糖和葡萄糖组成,还存在少量的半乳糖等,具有开发为预防肺癌功能性药物的潜力(Ye etal.,2021)。多糖是海巴戟果实中含量较高的活性成分之一。据报道,海巴戟果实多糖能促进肠黏膜和紧密连接蛋白的表达,从而改善炎症性肠病小鼠的临床诊断(Jin et al.,2019)。海巴戟果实多糖还可以抑制白细胞向炎症部位的迁移并减少炎症损伤,在预防癌症方面具有较大潜力(Sousa et al.,2018)。研究人员在评估海巴戟多糖成分与阿霉素(DOX)联合化疗效力期间发现,海巴戟富含多糖的部分可能通过细胞毒性T淋巴细胞激活诱导免疫调节作用,表明海巴戟多糖可用作癌症DOX化疗的佐剂(Sasmito et al.,2015)。【本研究切入点】前人对海巴戟的研究大多集中于干扰病变细胞DNA与蛋白质合成、与其他抗癌药物联合作用或通过诱导细胞自身免疫调节而间接影响癌细胞增殖生长等方面,而关于海巴戟果实多糖是否具有直接抑制肿瘤细胞增殖作用的研究鲜有报道。【拟解决的关键问题】通过水提醇沉法提取海巴戟果实多糖,设置体外抗肿瘤试验模型,采用噻唑蓝比色(MTT)法鉴定海巴戟果实多糖的细胞毒性及抗肿瘤生物活性,通过观察癌细胞形态变化并统计目标肿瘤细胞凋亡和坏死数量来评估其抗肿瘤能力,为深入研究海巴戟果实多糖的生物活性及其开发利用提供科学依据。
1材料与方法
1.1试验材料
供试的成熟海巴戟果实采集于云南省玉溪市元江县海巴戟种植基地。将成熟海巴戟果实洗净切片后,置于60℃干燥箱中烘干至恒重,用粉碎机粉碎成果粉后经100目过筛并置于60℃干燥器中保存备用。供试人正常结肠上皮细胞CCD-841-CoN、结肠癌细胞SW620和HCT-116、宫颈癌细胞Hela、肝癌细胞QGY-7703等均为标准细胞株,由云南师范大学生命科学学院环境基因组实验室惠赠。
主要试剂:L-谷氨酰胺(L-Glu)、0.25%胰蛋白酶-EDAT溶液、胎牛血清(FBS)、RPMI-1640培养基(RPMI)、青霉素/链霉素溶液、磷酸缓冲盐溶液(PBS)均购自美国Gibco公司。二甲基亚砜(DMSO)购自北京兰杰柯科技有限公司。细胞松弛素B(CB)购自美国Sigma公司。MTT粉末、吉姆萨粉末均购自北京索莱宝科技有限公司。试验用水均为双蒸水。
主要仪器设备:MCO-15AC CO2恒温培养箱(日本Sanyo公司)、AB204-S电子天平(美国Mettler Toledo公司)、SpectraMax®iD3酶标仪(美国Molecu-lar Devices公司)、22R离心机(美国Beckman公司)、HH·WZ1恒温水浴锅(北京市长风仪器仪表公司)、SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司)、SCIENTZ-ⅡD超声波细胞破碎仪(宁波新芝生物科技股份有限公司)、SIM-F140制冰机(日本Sanyo公司)、TD3细胞涂片离心机(上海卢湘仪离心机仪器有限公司)。
1.2试验方法
1.2.1海巴戟果实多糖的粗提取及纯化海巴戟果实多糖的粗提取及纯化参照袁海华等(2020)、Wang等(2021)的方法。称取干燥的海巴戟果粉,经水提醇沉、Sevage法除蛋白后获得海巴戟果实粗多糖(MCPs)样品;粗多糖样品经AB-8树脂脱色、DEAE Sepharose Fast Flow凝胶纯化后洗脱得到海巴戟果实纯化多糖(MCPs-W)样品,贮存备用。
1.2.2多糖储备液配制遵循现配现用原则,配制多糖储备液。分别称取400 mg粗多糖和纯化多糖,并分别溶于双蒸水中,振荡混匀后定容至10 mL,经0.22μm无菌过滤器过滤后配制成浓度为40 mg/mL的多糖储备液。
1.2.3细胞传代培养将贮藏于液氮深冷箱(无锡爱思科仪器有限公司)中的供试细胞取出,置于37℃水浴锅中解冻复苏,参照胡建燃等(2019)的方法,用含有10%胎牛血清的RPMI-1640培养基(100 U/mL青霉素/链霉素、300 mg/L L-Glu)对细胞株进行培养,置于5%CO2条件的培养箱中,培养温度为37℃。细胞贴壁生长,待汇合率达75%~90%时,用胰蛋白酶-EDTA消化液将细胞消化下来,收集细胞用于后续试验。
1.2.4细胞活性测定受试物干预处理:分别取40 mg/mL粗多糖和纯化多糖储备液与RPMI-1640培养基混合至终浓度为0、62.5、125、250、500、1000和2000μg/mL,其中0μg/mL为对照组,然后按每孔3000~5000个细胞接种到96孔板中,每组设3个复孔,轻拍去除气泡并混匀。
MTT法测定细胞活性:海巴戟果实多糖处理细胞48 h后,参照李尚泉等(2021)的方法并略作修改进行MTT反应。弃去孔中原有培养基,避光将新鲜培养基与10μL MTT(5 mg/mL)混匀后加入各孔,在原有条件下继续培养4 h后进行显色反应。弃掉原有培养基,每孔加100μL DMSO,在37℃、5%CO2条件下反应10 min后避光振荡10 min,至结晶物充分溶解。然后在490 nm波长下测定OD值,计算细胞增殖率,细胞增殖率(%)=测定组OD值/对照组OD值×100,利用GraphPad Prism 9.0通过细胞抑制率分析相应多糖对细胞的半抑制浓度(IC50)。
1.2.5肿瘤细胞的凋亡和坏死频率统计药物处理:根据1.2.4细胞活性测定结果,选择海巴戟果实多糖抑制作用较强的细胞接种到24孔细胞培养板中,每孔1×105个/细胞,在37℃、5%CO2条件下培养,直至细胞完全贴壁后,再用移液枪量取细胞培养板中每孔的剩余体积,用0、125、500和2000μg/mL纯化多糖对应地将每个浓度的孔体积增加至800μL,其中0μg/mL为对照组。处理结束后置于37℃、5%CO2条件下培养48h。
CB处理:将600 mg/mL的CB储备液稀释至60 mg/mL,制成CB工作液备用。弃掉24孔细胞培养板中的培养基,然后每孔中加入60μL CB工作液和740μL培养基,振荡细胞培养板将其混匀,在37℃、5%CO2条件下继续培养24h。
染色制片及计数:弃掉CB处理后细胞培养板中的培养基,并用PBS清洗,每孔中加入100μL胰蛋白酶-EDTA进行细胞消化,然后加入100μL培养基终止消化,吹悬。将各浓度的细胞悬液转移到对应的EP管中,根据各孔细胞数量,制作细胞爬片,40倍镜下观察细胞形态,随机选取5个视野,每个视野计数400个细胞,分别计数其中细胞凋亡和坏死数目并计算细胞凋亡坏死频率。
1.3统计分析
采用SPSS 23.0对试验数据进行统计分析,采用Duncan’s法进行组间多重比较检验差异显著性,所有试验平行测定4次。
2结果与分析
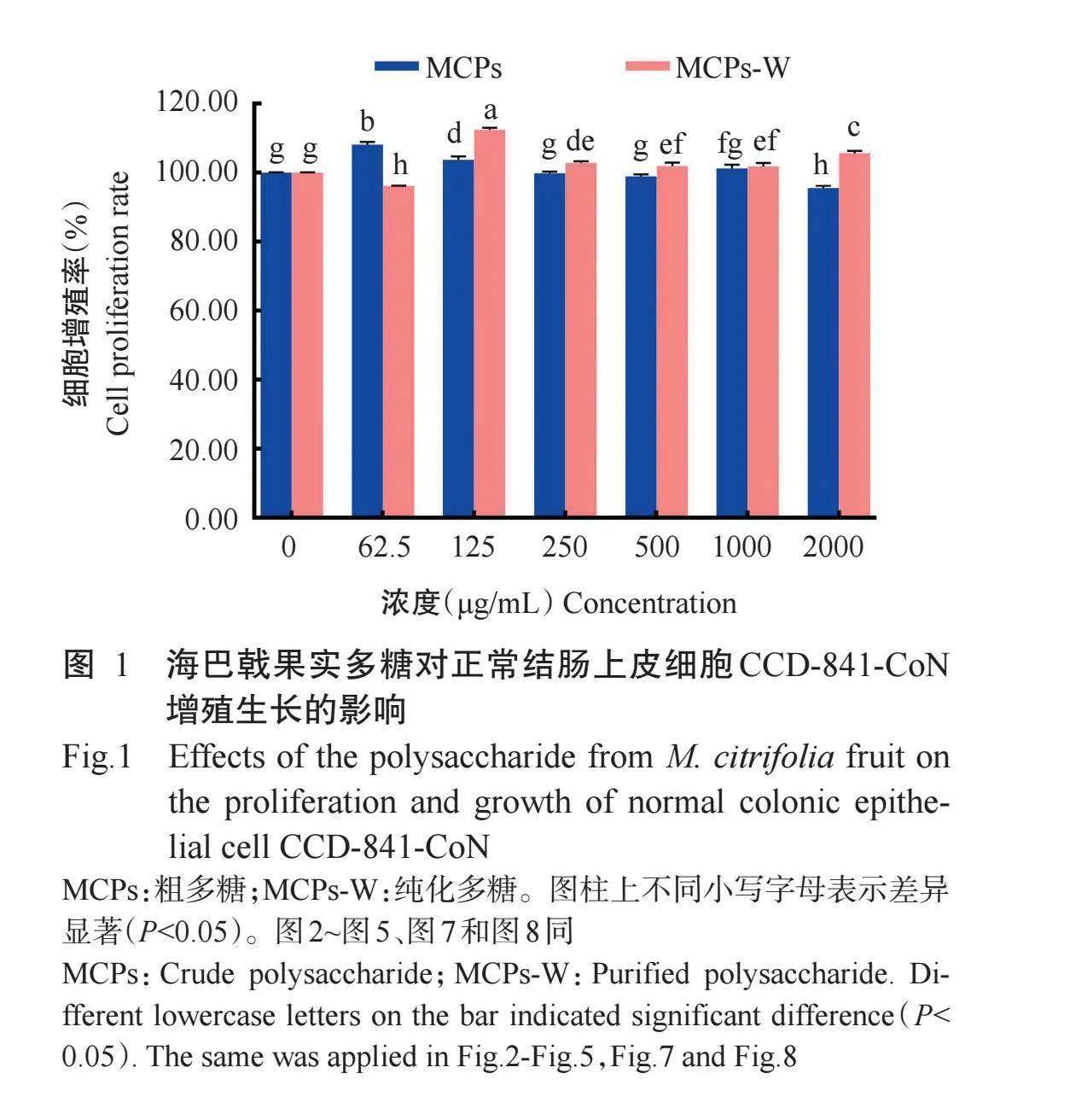
2.1海巴戟果实多糖对正常结肠上皮细胞CCD-841-CoN增殖生长的影响
利用不同浓度的海巴戟果实粗多糖和纯化多糖处理正常结肠上皮细胞CCD-841-CoN 48 h后,经MTT试验测定其对细胞增殖生长的影响。由图1可知,从细胞增殖率来看,海巴戟果实纯化多糖促进正常结肠上皮细胞增殖的能力比粗多糖强,粗多糖浓度为62.5μg/mL、纯化多糖浓度为125μg/mL时,正常结肠上皮细胞的增殖率较高,分别达108.16%和112.47%。当海巴戟果实粗多糖浓度在250~1000μg/mL时,正常结肠上皮细胞增殖率与对照组差异不显著(P>0.05,下同);当浓度升高至2000μg/mL时,细胞增殖率显著低于对照组(P<0.05,下同),暗示着高浓度粗多糖对细胞产生了一定的毒害。当海巴戟果实纯化多糖浓度在62.5μg/mL时,正常结肠上皮细胞增殖率显著低于对照组,即较低浓度的纯化多糖对细胞增殖无利,而当浓度为125~2000μg/mL时,细胞增殖率均显著高于对照组。由此可见,海巴戟果实多糖具有无毒的优势,较低浓度(62.5~125μg/mL)的海巴戟果实粗多糖或较高浓度(125~2000μg/mL)的纯化多糖可促进正常结肠上皮细胞增殖。
2.2海巴戟果实多糖对结肠癌细胞SW620增殖生长的影响
利用不同浓度的海巴戟果实粗多糖和纯化多糖处理结肠癌细胞SW620 48h后,经MTT试验测定其对细胞增殖生长的影响。由图2可看出,不同浓度的海巴戟果实粗多糖和纯化多糖均显著抑制结肠癌细胞SW620的增殖生长。海巴戟果实粗多糖浓度为62.5μg/mL时对结肠癌细胞SW620增殖的抑制作用最强,此时细胞增殖率为83.49%,IC50为122.60μg/mL;结肠癌细胞SW620的增殖率随着海巴戟果实纯化多糖浓度的增加呈波动降低趋势,当纯化多糖浓度为2000μg/mL时,细胞增殖率最低,为72.11%,与对照组差异显著;纯化多糖浓度为125和500μg/mL时的细胞增殖率无显著差异;纯化多糖的IC50为1118.00μg/mL。由此可知,海巴戟果实多糖对结肠癌细胞SW620的增殖生长表现出一定的抑制作用。
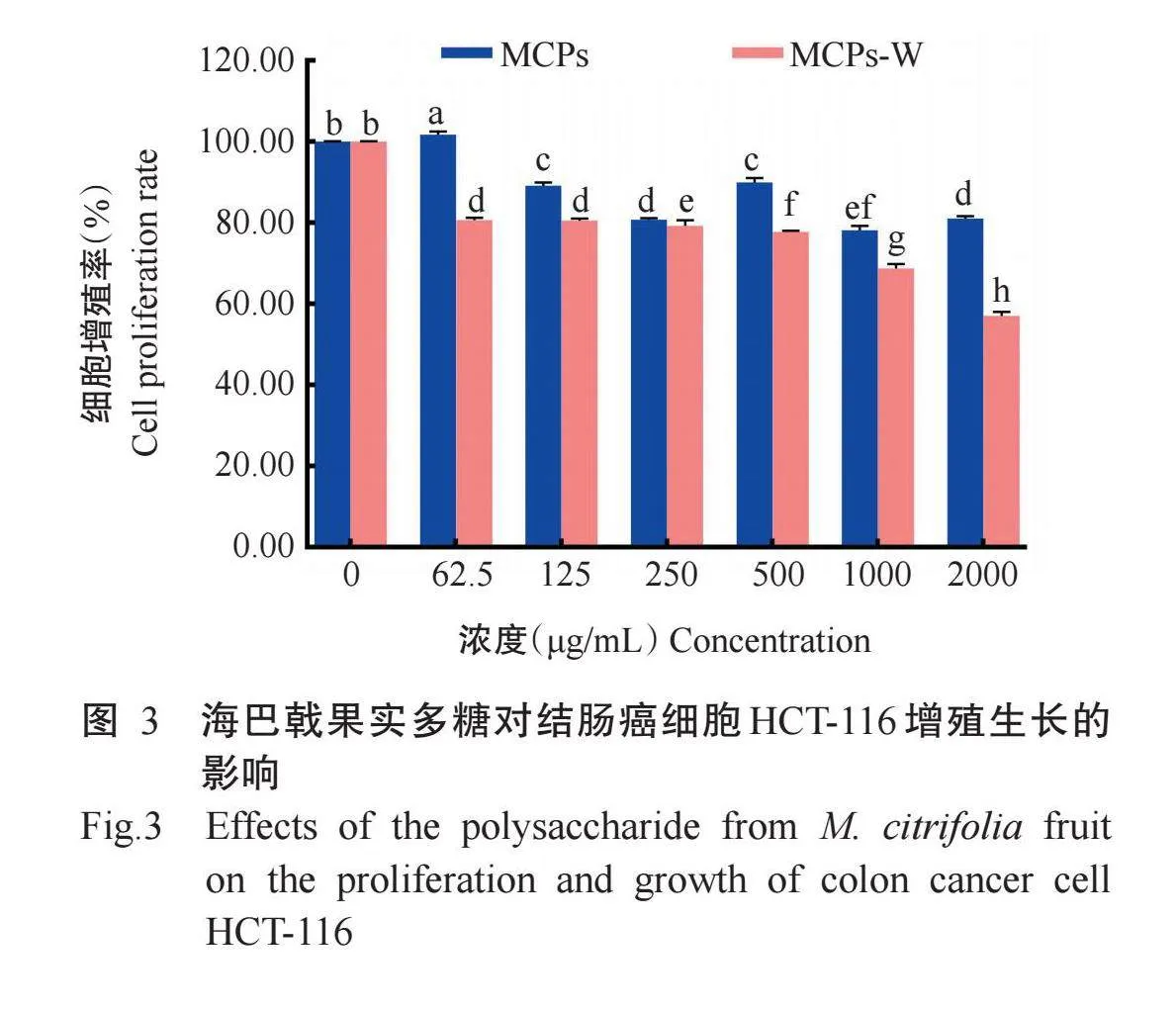
2.3海巴戟果实多糖对结肠癌细胞HCT-116增殖生长的影响
利用不同浓度的海巴戟果实粗多糖和纯化多糖处理结肠癌细胞HCT-116 48 h后,经MTT试验测定其对细胞增殖生长的影响。由图3可看出,不同浓度海巴戟果实纯化多糖均显著抑制结肠癌细胞HCT-116的增殖生长,且对细胞的抑制作用具有明显的剂量依赖性,细胞增殖率随着纯化多糖浓度的增大而降低,纯化多糖浓度为2000μg/mL时的细胞增殖率最低,为57.05%,其IC50为1172.00μg/mL;海巴戟果实粗多糖浓度为125~2000μg/mL时对结肠癌细胞HCT-116的增殖也具有显著抑制作用,浓度为1000μg/mL时的细胞增殖率最低,为78.11%,粗多糖的IC50为2.18μg/mL,但海巴戟果实纯化多糖抑制结肠癌细胞HCT-116增殖的能力始终强于粗多糖。相对于结肠癌细胞SW620,海巴戟果实纯化多糖对结肠癌细胞HCT-116的增殖生长表现出更好的抑制作用。
2.4海巴戟果实多糖对宫颈癌细胞Hela增殖生长的影响
利用不同浓度的海巴戟果实粗多糖和纯化多糖处理宫颈癌细胞Hela 48h后,经MTT试验测定其对细胞增殖生长的影响。由图4可看出,不同浓度海巴戟果实纯化多糖均显著抑制细胞的增殖生长,当浓度处于125~2000μg/mL时,宫颈癌细胞Hela的增殖率随纯化多糖浓度的增加而降低,呈明显的剂量依赖性,浓度为2000μg/mL时细胞增殖率最低,为68.64%,其IC50为1546.00μg/mL。海巴戟果实粗多糖浓度在125~2000μg/mL时对宫颈癌细胞Hela的增殖生长有显著抑制作用,浓度为1000μg/mL时抑制作用最强,细胞增殖率最低,为81.85%,其IC50为542.80μg/mL,但125~500μg/mL范围内细胞增殖率无明显差异;海巴戟果实纯化多糖对宫颈癌细胞Hela生长的抑制作用强于粗多糖。由此可知,海巴戟果实纯化多糖对宫颈癌细胞Hela的增殖具有较强的抑制作用。
2.5海巴戟果实多糖对肝癌细胞QGY-7703增殖生长的影响
利用不同浓度的海巴戟果实粗多糖和纯化多糖处理肝癌细胞QGY-7703 48 h后,经MTT试验测定其对细胞增殖生长的影响。由图5可看出,不同浓度海巴戟果实粗多糖和纯化多糖的细胞增殖率与对照组均无显著差异。粗多糖和纯化多糖的浓度为500μg/mL时细胞增殖率最低,分别为98.99%和99.30%;2种多糖的IC50分别为110.40和1599.00μg/mL。由此可知,海巴戟果实多糖对肝癌细胞QGY-7703的增殖生长无明显的抑制作用。
2.6海巴戟果实纯化多糖对宫颈癌细胞Hela和结肠癌细胞HCT-116凋亡和坏死频率的影响
根据细胞活性测定结果可知,海巴戟果实纯化多糖对结肠癌细胞HCT-116和宫颈癌细胞Hela有较强的抑制作用,因此选取这2种细胞进行细胞凋亡和坏死频率分析。图6为经浓度2000μg/mL的海巴戟果实纯化多糖处理后的宫颈癌细胞Hela和结肠癌细胞HCT-116的细胞形态,其中A图为40倍镜下观察的细胞全视野图,B图为部分截取图。正常的肿瘤细胞紧密贴壁生长且形态规则(图6-A1、6-B1、6-A4、6-B4);凋亡细胞形态明显变形,细胞皱缩成团且出现核固缩现象(图6-A2、6-B2、6-A5、6-B5);而坏死细胞形态变得不完整,结构全面溶解且细胞肿胀(图6-A3、6-B3、6-A6、6-B6)。
参照图6细胞形态变化统计2种肿瘤细胞的凋亡及坏死频率。由图7可看出,细胞的坏死频率随着海巴戟果实纯化多糖浓度的增加而上升,且与对照组差异显著,当纯化多糖浓度为2000μg/mL时,宫颈癌细胞Hela坏死频率最高,为6.75%;且此时细胞的凋亡频率也最高,与对照组差异显著。由此可知,海巴戟果实纯化多糖对宫颈癌细胞Hela的凋亡和坏死频率均有显著影响,暗示着海巴戟果实纯化多糖通过调节细胞凋亡和坏死来抑制宫颈癌细胞Hela的增殖。
由图8可看出,随着海巴戟果实纯化多糖浓度的增加,细胞坏死频率逐渐升高且呈一定的剂量依赖性,当纯化多糖浓度为2000μg/mL时,结肠癌细胞HCT-116的坏死频率最高,为2.83%;当浓度处于125~2000μg/mL时,细胞的凋亡频率也均较对照组显著升高。由此可知,海巴戟果实纯化多糖对结肠癌细胞HCT-116产生了明显的抑制作用,从而导致细胞凋亡和坏死频率显著升高,暗示着海巴戟果实纯化多糖通过调节细胞凋亡和坏死来抑制结肠癌细胞HCT-116的增殖。
3讨论
多糖是海巴戟果实中的重要活性成分,本研究以宫颈癌细胞、结肠癌细胞、肝癌细胞作为体外抗肿瘤试验模型,MTT法分别检测海巴戟果实粗多糖和纯化多糖对癌细胞增殖的抑制作用,发现海巴戟果实粗多糖和纯化多糖均可降低宫颈癌和结肠癌细胞的增殖率,具有抗肿瘤活性,且纯化多糖较粗多糖对癌细胞的抑制作用更强;但同时也发现,各浓度海巴戟果实粗多糖和纯化多糖对肝癌细胞QGY-7703的增殖均无显著影响。肝癌细胞增殖被抑制的作用机制主要包括阻滞肝癌细胞的细胞周期、干扰肝癌细胞DNA与蛋白质合成、调控凋亡信号通路诱导肝癌细胞凋亡等(Ren etal.,2019;Wang et al.,2019),因此,推测海巴戟果实多糖不能引起该肝癌细胞株的一系列反应,从而无法直接抑制其增殖生长。此外,植物多糖抑制肝癌细胞作用机制除上述几种外,还有调节免疫系统增强机体免疫力方式(Monmai et al.,2018)。有研究表明,海巴戟果实中的多糖具有免疫调节作用,能调节乙型肝炎大鼠细胞因子水平,对机体免疫系统的调节有积极作用(Yudhawan et al.,2020),进而推测海巴戟果实多糖有可能通过调节机体免疫力来达到抗肿瘤的效果。
植物多糖成分结构复杂且多样,多糖的化学组分及结构在很大程度上决定多糖的生物活性。而多糖中单糖组分、连接方式等结构差异可能导致不同的生物活性功能。杏鲍菇(Pleurotus eryngii)多糖主要由葡萄糖组成,其他种类单糖含量较少,以1,3-葡萄糖和1,6-葡萄糖为主要连接方式,能显著抑制人胃癌细胞的增殖,具有一定的抗肿瘤活性(郑恒光等,2019)。从紫苏(Perilla frutescens)中提取纯化的多糖是一种主要由鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和半乳糖醛酸组成的典型吡喃型多糖,仅由一条主链进行连接,可能通过阻断细胞周期S期抑制小鼠腹水肝癌细胞增殖并降低线粒体膜电位(Dinget al.,2022)。本研究中粗提取出的海巴戟果实粗多糖为复合物质,其纯度较低,包含一部分酚类、蛋白质、无机盐等物质,而经纯化后获得的纯化多糖重均相对分子量为5213 Da,其单糖主要由甘露糖、葡萄糖和半乳糖构成,而葡萄糖和半乳糖占总糖构成的80%以上;对其结构特征进行分析后发现,海巴戟果实纯化多糖为典型的β型吡喃环糖,含有糖醛酸,属于水溶性酸性糖,并以→4)-吡喃葡萄糖-(1→和非还原末端的吡喃葡萄糖为主链且存在其他分支结构(袁海华等,2020;王青芬等,2023)。本研究证明海巴戟果实纯化多糖能显著抑制宫颈癌和结肠癌细胞的增殖生长,表现出良好的体外抗肿瘤生物活性。今后将对海巴戟果实纯化多糖抑制癌细胞增殖的作用机制进行深入研究,为海巴戟果实多糖在抗肿瘤领域的应用提供理论依据。
诸多研究表明,植物多糖对肿瘤细胞进行抑制时通常存在剂量效应。如黄芩多糖终浓度从0.16 mg/mL增大至2.50 mg/mL时,对胃癌细胞的抑制率逐渐升高,表现出剂量依赖性(李平等,2021);纯化后的杨桑黄孔菌(Sanghuangporusvaninii)多糖会促进结肠癌细胞对细胞毒性T淋巴细胞的敏感性,具有不同程度的抗肿瘤活性,表现出良好的剂量关系,在结直肠癌治疗方面具有良好的潜力(Quetal.,2023);板栗(Castanea mollissima Blume)种仁多糖对8种人肿瘤细胞的增殖均有不同程度的抑制作用,且抑制作用随着浓度的升高而增强,体现出明显的量效关系(何俊平等,2020)。本研究中,海巴戟果实纯化多糖在0~2000μg/mL的剂量范围内,对宫颈癌细胞Hela及结肠癌细胞HCT-116的增殖有不同程度的抑制作用,纯化多糖浓度为125μg/mL时细胞增殖率较高,之后随纯化多糖浓度升高,细胞增殖率不断降低,浓度为2000μg/mL时细胞增殖率降至最低值,呈明显的剂量效应。不同植物多糖的抗肿瘤活性存在差异,且适当浓度的植物多糖才会对肿瘤细胞产生良好的抑制效果,因此选择合适剂量的植物多糖对肿瘤细胞进行处理显得尤为重要。
诱导肿瘤细胞凋亡、坏死被普遍认为是植物多糖抗肿瘤的主要作用途径(Lin etal.,2022)。前人研究发现,黄芩多糖能激活调控胃癌细胞凋亡的关键蛋白酶caspase-3的表达,诱导胃癌细胞凋亡(李平等,2021),而黄精多糖通过调控caspases-3、caspases-7等细胞凋亡信号途径中相关基因的表达,从而导致DNA裂解促进宫颈癌细胞凋亡(Li etal.,2020)。本研究发现,海巴戟果实纯化多糖促进了结肠癌细胞和宫颈癌细胞的凋亡和坏死,表明海巴戟果实纯化多糖能有效抑制肿瘤细胞的增殖,其抑制肿瘤细胞的作用可能与细胞凋亡、坏死机制有关。推测海巴戟果实纯化多糖可能通过调控细胞凋亡关键基因的表达水平,导致DNA裂解,诱导细胞凋亡从而发挥其抑癌作用。目前,海巴戟果实多糖调控细胞凋亡更深层次的分子机制还有待探究,后续将对关键信号分子网络深入研究,以揭示海巴戟果实纯化多糖抑制肿瘤细胞增殖生长的重要分子机制。
4结论
本研究采用MTT法观察海巴戟果实多糖对3种肿瘤细胞的抑制作用,观察细胞状态并统计细胞的凋亡和坏死数量,从而评估海巴戟果实多糖的体外抗肿瘤效果,证实海巴戟果实多糖具有无毒的优势,一定浓度范围内可促进人正常结肠上皮细胞的增殖,且具有良好的抗肿瘤活性,其中纯化多糖能显著抑制结肠癌和宫颈癌细胞的增殖生长,比粗多糖的抗肿瘤活性更强。
参考文献(References):
边亮,陈华国,周欣.2020.植物多糖的抗肿瘤活性研究进展[J].食品科学,41(7):275-282.[Bian L,Chen H G,Zhou X.2020.Recent advances in understanding the antitumor activity of polysaccharides from plants[J].Food Science,41(7):275-282.]doi:10.7506/spkx 1002-6630-20190330-392.
陈鸿洁,钱云,只佳增,王树明.2018.海巴戟在云南河口的适应性表现[J].热带农业科学,38(6):31-33.[Chen H J,Qian Y,Zhi J Z,Wang S M.2018.The adaptive perfor-mance of Morindacitrifolia in Hekou,Yunnan[J].Chinese Journal of Tropical Agriculture,38(6):31-33.]doi:10.12008/j.issn.1009-2196.2018.06.007.
陈淑芳,黎庆涛,黄凯,邬智高,张文清,张良军.2021.篱栏网多糖的提取工艺优化及抗氧化活性[J].应用化工,50(11):3031-3035.[Chen S F,Li Q T,Huang K,Wu Z G,Zhang W Q,Zhang L J.2021.Optimization of extraction process of polysaccharide from Merremia hederacea andits antioxidant activity[J].Applied Chemical Industry,50(11):3031-3035.]doi:10.16581/j.cnki.issn 1671-3206.20 210820.001.
陈思思,吴蓓,谭婷,谢赛赛,杨世林,冯育林,温泉.2019.白及多糖BSP-1的分离纯化、结构表征及抗肿瘤活性研究[J].中草药,50(8):1921-1926.[Chen S S,Wu B,Tian T,Xie S S,Yang S L,Feng Y L,Wen Q.2019.Isolation,puri-fication and structural characterization of Bletilla striatapolysaccharides and its antitumor activity[J].Chinese Tra-ditional and Herbal Drugs,50(8):1921-1926.]doi:10.7501/j.issn.0253-2670.2019.08.022.
何俊平,李晓菁,孟迪,宋磊肖,杨越冬,牛奎.2020.板栗种仁多糖的提取纯化及体外抗肿瘤活性筛选[J].食品工业科技,41(22):134-149.[He J P,Li X J,Meng D,Song L X,Yang Y D,Niu K.2020.Extraction,purification and in vitro antitumor screening of polysaccharides from chestnut kernel[J].Science and Technology of Food Industry,41(22):134-149.]doi:10.13386/j.issn 1002-0306.2020020113.
胡建燃,李平,铁军,金山.2019.紫丁香花精油的抗氧化和抗肿瘤活性研究[J].生物技术通报,35(12):16-23.[Hu J R,Li P,Tie J,Jin S.2019.Study on antioxidant and anti-tumor activity of essential oil from flowers of Syringa oblata[J].Biotechnology Bulletin,35(12):16-23.]doi:10.13560/j.cnki.biotech.bull.1985.2019-0144.
李平,胡建燃,史宝忠,赵晶磊.2021.黄芩多糖的提取及其抗氧化和抗肿瘤活性研究[J].生物技术通报,37(4):155-163.[Li P,Hu J R,Shi B Z,Zhao J L.2021.Extraction of Scutellariabaicalensis polysaccharides and its antioxidant and antitumor activities[J].Biotechnology Bulletin,37(4):155-163.]doi:10.13560/j.cnki.biotech.bull.1985.2020-0764.
李尚泉,陈佳,何秀苗.2021.高产胞外多糖海洋芽孢杆菌分离鉴定及其多糖抗肿瘤活性分析[J].南方农业学报,52(11):3166-3173.[Li S Q,Chen J,He X M.2021.Isola-tion and identification of an extracellular polysaccharide high-producing marine Bacillus and the study on its anti-tumor activity[J].Journal of Southern Agriculture,52(11):3166-3173.]doi:10.3969/j.issn.2095-1191.2021.11.029.
史天洁,范媛媛,左绍远,王钰.2020.植物多糖抗肿瘤与降血糖作用研究进展[J].实用医药杂志,37(1):85-88.[Shi T J,Fan Y Y,Zou S Y,Wang Y.2020.Research progress on antitumor and hypoglycemic activity of plant polysaccha-rides[J].Practical Journal of Medicine&Pharmacy,37(1):85-88.]doi:10.14172/j.issn 1671-4008.2020.01.027.
王青芬,敖新宇,宫树森,刘琅,刀梅,吴田.2023.海巴戟果实多糖的结构特征及体外抗氧化活性研究[J].林产化学与工业,43(6):81-88.[Wang Q F,Ao X Y,Gong S S,Liu L,Dao M,Wu T.2023.Structural characteristics and anti-oxidant activity of polysaccharide from Morindacitrifolia fruit in vitro[J].Chemistry and Industry of Forest Products,43(6):81-88.]doi:10.3969/j.issn.0253-2417.2023.06.011.
杨焱,杨朴丽,徐荣,徐通.2017.不同诺丽种质外观性状与营养成分的分析及评价[J].热带作物学报,38(1):53-58.[Yang Y,Yang P L,Xu R,Xu T.2017.The analysis and evaluation of appearance character and nutritive content in different MorindaCiturifoliaL.germplasms[J].Chinese Journal of Tropical Crops,38(1):53-58.]doi:10.3969/j.issn.1000-2561.2017.01.010.
袁海华,吴田,敖新宇.2020.诺丽果多糖的提取工艺优化及组成分析[J].中药材,43(6):1441-1444.[Yuan H H,Wu T,Ao X Y.2020.Optimization of extraction technology and the composition analysis of Morindacitrifolia fruit polysaccharides[J].Journal of Chinese Medicinal Mate-rials,43(6):1441-1444.]doi:10.13863/j.issn 1001-4454.2020.06.030.
郑恒光,沈恒胜,杨道富,翁敏劼,陈君琛.2019.杏鲍菇菇头多糖的结构鉴定及生物活性评价[J].食品科学,40(22):7-13.[Zheng H G,Shen H S,Yang D F,Weng M J,Chen J C.2019.Structural characterization and antitumor activi-ty of crude polysaccharide extracted from the stalk residue of Pleurotus eryngii[J].Food Science,40(22):7-13.]doi:10.7506/spkx 1002-6630-20181126-292.
Ding S Y,Yan Z Q,Liu H P,Chen P,Shi S Y,Chang M L.2022.Structural characterization and antitumor activity of a polysaccharide extracted from Perilla frutescens var.fru-tescens[J].Industrial Crops and Products,187(S1):115334.doi:10.1016/j.indcrop.2022.115334.
Jin M Y,Wang Y X,Yang X B,Yin H,Nie S P,Wu X Y.2019.Structure characterization of a polysaccharide extracted from noni(Morindacitrifolia L.)and its protective effect against DSS-induced bowel disease in mice[J].Food Hy-drocolloids,90:189-197.doi:10.1016/j.foodhyd.2018.11.049.
Li L,Thakur K,Cao YY,Liao B Y,Zhang J G,Wei Z J.2020.Anticancerous potential of polysaccharides sequentially extracted from Polygonatumcyrtonema Hua in human cer-vical cancer Hela cells[J].International Journal of Biologi-cal Macromolecules,148:843-850.doi:10.1016/j.ijbiomac.2020.01.223.
Liao D W,Cheng C,Liu J P,Zhao LY,Huang D C,Chen G T.2020.Characterization and antitumor activities of polysac-charides obtained from ginger(Zingiber officinale)by dif-ferent extraction methods[J].International Journal of Bio-logical Macromolecules,152:894-903.doi:10.1016/j.ijbio-mac.2020.02.325.
Lin C J,Liu S T,Yang R C,Wang L H,Tsai C C,Chen T W,Huang S M.2022.Anticancer effects of Taraxacum via cell cycle arrest,necrosis,apoptosis,and endoplasmic reticulum stress[J].The American Journal of Chinese Me-dicine,50(2):569-587.doi:10.1142/S0192415X22500227.
Monmai C,Park S H,You S G,Park W J.2018.Immu-noenhancement effect of polysaccharide extracted from Stichopus japonicus on cyclophosphamide-induced immu-nosuppression mice[J].Food Science and Biotechnology,27(2):565-573.doi:10.1007/s 10068-017-0248-2.
Qian Y F,Shi C Y,Cheng C,Liao D W,Liu J P,Chen G T.2023.Ginger polysaccharide UGP1 suppressed human colon cancer growth via p53,Bax/Bcl- caspase-3 path-ways and immunomodulation[J].Food Science and Human Wellness,12(2):467-476.doi:10.1016/j.fshw.2022.07.048.
QuY D,Yang H X,Li S Y,Li L Z,Wang D.2023.The involve-ment of Th1 cell differentiation in the anti-tumor effect of purified polysaccharide from Sanghuangporusvaninii in colorectal cancer via multi-omics analysis[J].International Journal of Biological Macromolecules,237:123927.doi:10.1016/j.ijbiomac.2023.123927.
Ren F,Li J,Yuan X,Wang Y L,Wu K X,Kang L X,Luo YY,Zhang H M,Yuan Z Q.2019.Dandelion polysaccharides exert anticancer effect on hepatocellular carcinoma by inhibiting PI3K/AKT/mTOR pathway and enhancing im-mune response[J].Journal of Functional Foods,55:263-274.doi:10.1016/j.jff.2019.02.034.
Sasmito E,Hertiani T,NovlitaRenggani T,Jaya Laksana B.2015.Polysaccharide-rich fraction of noni fruit(Morindacitrifolia L.)as doxorubicin co-chemotherapy:Evaluation of catalase,macrophages,and TCD8+lymphocytes[J].Scientia Pharmaceutica,83(3):479-488.doi:10.3797/sci-pharm.1510-01.
Sousa S G,Oliveira LA,de Aguiar Magalhães D,de Brito T V,Batista J A,Pereira C M C,de Souza Costa M,Mazulo J C R,de Carvalho Filgueiras M,Vasconselos D F P,da Silva DA,Barros F C N,Sombra V G,Freitas A L P,de Paula R C M,de Andrade Feitosa J P,Dos Reis Barbosa A L.2018.Chemical structure and anti-inflammatory effect of poly-saccharide extracted from MorindacitrifoliaLinn.(Noni)[J].Carbohydrate Polymers,197:505-523.doi:10.1016/j.carbpol.2018.06.042.
Sun B Q,Jing R X,Wang Z S,Tian L,Mao F F,Liu Y.2021.Diversity and community structure of endophytic Bacillus with antagonistic and antioxidant activity in the fruits of Xisha Wild Noni(Morindacitrifolia L.)[J].Microbial Pathogenesis,158:105065.doi:10.1016/j.micpath.2021.105065.
Wang Q F,Yang F,Jia D D,Wu T.2021.Polysaccharides and polyphenol in dried Morindacitrifolia fruit tea after diffe-rent processing conditions:Optimization analysis using response surface methodology[J].PeerJ,9:e11507.doi:10.7717/peerj.11507.
Wang Y,Wang S X,Song R Z,Cai J J,Xu J J,Tang X Z,Li N Y.2019.Ginger polysaccharides induced cell cycle arrest and apoptosis in human hepatocellular carcinoma HepG2 cells[J].International Journal of Biological Macromole-cules,123:81-90.doi:10.1016/j.ijbiomac.2018.10.169.
Wu YR,Wang Q,Liu H P,Niu LL,Li MY,Jia Q.2023.Ahete-ropolysaccharide from Rhodiola rosea L.:Preparation,purification and anti-tumor activities in H22-bearing mice[J].Food Science and Human Wellness,12(2):536-545.doi:10.1016/J.FSHW.2022.07.056.
Yang H,Hua J L,Wang C.2019.Anti-oxidation and anti-aging activity of polysaccharide from Malus micromalusmakino fruit wine[J].International Journal of Biological Macro-molecules,121:1203-1212.doi:10.1016/j.ijbiomac.2018.10.096.
Ye G Y,Li J,Zhang J H,Liu H L,Ye Q S,Wang Z H.2021.Structural characterization and antitumor activity of a poly-saccharide from Dendrobium wardianum[J].CarbohydratePolymers,269:118253.doi:10.1016/j.carbpol.2021.118253.Yudhawan I,Ediati S,Puspitasari I.2020.Immunomodulatoryeffect of standardized polysaccharide fraction syrup fromnoni fruit(Morindacitrifolia)on cytokines level(IL-2and IFN-y)and its histological evaluation in rats vacci-nated with hepatitis-B[J].Research Journal of Pharmacy and Technology,13(2):882-888.doi:10.5958/0974-360X.2020.00167.5.
Zhao L,Li M Y,Sun K C,Su S A,Geng T T,Sun H.2020a.Hippophae rhamnoides polysaccharides protect IPEC-J2 cells from LPS-induced inflammation apoptosis and bar-rier dysfunction in vitro via inhibiting TLR4/NF-κB signa-ling pathway[J].International Journal of Biological Macro-molecules,155(15):1202-1215.doi:10.1016/j.ijbiomac.2019.11.088.
Zhao S J,Han Z M,Yang L M,Hong B,Zhu H.2020b.Extrac-tion,characterization and antioxidant activity evaluation of polysaccharides from Smilacina japonica[J].International Journal of Biological Macromolecules,151:576-583.doi:10.1016/j.ijbiomac.2020.02.015.
Zheng R S,Zhang S W,Zeng H M,Wang S M,Sun K X,Chen R,Li L,Wei W Q,He J.2022.Cancer incidence and mor-tality in China,2016[J].Journal of the National Cancer Center,2(1):1-9.doi:10.1016/j.jncc.2022.02.002.
(责任编辑王晖)
