sLAG-3、PGR联合Hp抗体检测对早期胃癌的诊断价值
2024-10-08李慧娟




【摘要】 目的:研究可溶性淋巴细胞活化基因-3(soluble lymphocyte activation gene-3,sLAG-3)、胃蛋白酶原Ⅰ(PGⅠ)/胃蛋白酶原Ⅱ(PGⅡ)比值(PGR)联合幽门螺杆菌(helicobacter pylori,Hp)抗体分型检测对早期胃癌的诊断价值。方法:选择2020年1月—2023年6月于赣州市肿瘤医院就诊的120例早期胃癌患者作为研究组,选择同期于本院就诊的癌前病变患者72例作为对照组,进行回顾性分析。比较两组sLAG-3、PGR及Hp抗体检测情况,并采用受试者操作特征(ROC)曲线分析上述三项指标单独及其联合诊断对早期胃癌的诊断价值。同时,比较不同Hp抗体检测结果的癌前病变、早期胃癌患者的sLAG-3、PGR。结果:研究组sLAG-3高于对照组,PGR显著低于对照组(P<0.05);研究组CagA-128kD、VacA-110kD、VacA-90kD、UreA及UreB阳性率均显著高于对照组(P<0.05)。Hp抗体阳性患者的sLAG-3显著高于Hp抗体阴性患者,PGR低于Hp抗体阴性患者,差异均有统计学意义(P<0.05)。由ROC曲线得知,sLAG-3的敏感度为55.00%,特异度为76.39%,截断值为256.37 ng/mL;PGR的敏感度为70.00%,特异度为86.11%,截断值为2.32;Hp抗体的敏感度为77.50%,特异度为63.89%;联合诊断的敏感度为85.00%,特异度为79.17%。结论:sLAG-3、PGR单独诊断早期胃癌时具有较高的特异度,Hp抗体具有较高的敏感度,上述指标联合诊断早期胃癌的效能最高。
【关键词】 可溶性淋巴细胞活化基因-3 胃蛋白酶原Ⅰ 胃蛋白酶原Ⅱ 幽门螺杆菌 早期胃癌
Diagnostic Value of sLAG-3, PGR Combined with Hp Antibody Detection on Early Gastric Cancer/LI Huijuan. //Medical Innovation of China, 2024, 21(26): 173-177
[Abstract] Objective: To study the diagnostic value of soluble lymphocyte activation gene-3 (sLAG-3), pepsinogen Ⅰ (PGⅠ)/pepsinogen Ⅱ (PGⅡ) ratio (PGR) combined with helicobacter pylori (Hp) antibody typing detection on early gastric cancer. Method: A total of 120 patients with early gastric cancer treated in Ganzhou Cancer Hospital from January 2020 to June 2023 were selected as the study group, and 72 patients with precancerous lesions treated in our hospital during the same period were selected as the control group for retrospective analysis. The detection of sLAG-3, PGR and Hp antibody were compared between the two groups, and the value of single and combined diagnosis of these three parameters in the diagnosis of early gastric cancer were analyzed by receiver operating characteristic (ROC) curve. At the same time, sLAG-3 and PGR of precancerous lesions and early gastric cancer patients with different Hp antibody detection results were compared. Result: sLAG-3 in the study group was higher than that in the control group, and PGR was significantly lower than that in the control group (P<0.05). The positive rates of CagA-128kD, VacA-110kD, VacA-90kD, UreA and UreB in study group were significantly higher than those in control group (P<0.05). sLAG-3 of Hp antibody positive patients were significantly higher than those of Hp antibody negative patients, and PGR was lower than that of Hp antibody negative patients, the differences were statistically significant (P<0.05). ROC curve shows that the sensitivity, specificity and cut-off value of sLAG-3 were 55.00%, 76.39% and 256.37 ng/mL, respectively, the sensitivity, specificity and cut-off value of PGR were 70.00%, 86.11% and 2.32, respectively, the sensitivity and specificity of Hp antibody were 77.50% and 63.89%, respectively, the sensitivity and specificity of combined diagnosis were 85.00% and 79.17%, respectively. Conclusion: sLAG-3 and PGR have high specificity in the diagnosis of early gastric cancer alone, and Hp antibody has high sensitivity, the combination of the above indexes has the highest efficiency in the diagnosis of early gastric cancer.
[Key words] Soluble lymphocyte activation gene-3 Pepsinogen Ⅰ Pepsinogen Ⅱ Helicobacter pylori Early gastric cancer
First-author's address: Department of Pathology, Ganzhou Cancer Hospital, Ganzhou 341000, China
doi:10.3969/j.issn.1674-4985.2024.26.039
胃癌的发病率及死亡率均位居世界恶性肿瘤前列,早期胃癌临床表现缺乏特异度,导致临床上对于早期胃癌的诊断较为困难,多数患者在确诊胃癌时已为癌症进展期,加大了患者治疗和预后的困难程度,对患者的生存质量产生不利影响,因此,寻找早期胃癌诊断指标是十分有必要的[1-2]。可溶性淋巴细胞活化基因-3(soluble lymphocyte activation gene-3,sLAG-3)是近年来发现的消化道恶性肿瘤标志物,相关研究已证实sLAG-3在组织中的表达与多种消化道恶性肿瘤的病理进程有一定相关性[3]。胃蛋白酶原Ⅰ(PGⅠ)和胃蛋白酶原Ⅱ(PGⅡ)是反映胃黏膜状态的主要指标,与胃癌的发展密切相关,而幽门螺杆菌(Helicobacter pylori,Hp)是胃癌发展的重要影响因素[4-5]。为提高临床上对于早期胃癌的诊断效率,本文将分析sLAG-3、PGR联合Hp抗体检测对早期胃癌的诊断价值,并做如下报道。
1 资料与方法
1.1 一般资料
选择2020年1月—2023年6月于赣州市肿瘤医院就诊的120例早期胃癌患者作为研究组,选择同期于本院就诊的癌前病变患者72例作为对照组,进行回顾性分析。纳入标准:(1)研究组符合早期胃癌诊断[6];(2)对照组符合胃癌前病变诊断[7];(3)临床资料完整无丢失。排除标准:(1)合并其他部位恶性肿瘤或肿瘤发生转移;(2)既往存在胃部手术史;(3)既往存在Hp治疗史;(4)合并血液性疾病。本研究经赣州市肿瘤医院医学伦理委员会批准。
1.2 方法
采集患者晨起静脉血3 mL,静置后在4 000 r/min转速下充分离心,取上层清液保存待测,采取放射免疫法测定sLAG-3、PGⅠ及PGⅡ水平,并计算PGⅠ/PGⅡ比值(PGR)。活检获取患者病变部位组织样本,固定后进行切片、抗体标记及染色等处理,采用免疫印迹法对标本进行Hp抗体分型(珠海市银科医学工程股份有限公司)检测,操作步骤严格按照使用说明进行。
1.3 观察指标及判定标准
比较两组患者血清sLAG-3和PGR及Hp抗体分型情况。CagA-128kD、VacA-110kD和VacA-90kD中的任何一项表达为阳性或弱阳性即表示为Ⅰ型或弱Ⅰ型;UreA或UreB为阳性或弱阳性则表示为Ⅱ型或弱Ⅱ型,若上述指标表达均为阴性则表示为Hp抗体阴性。分别对比两组Hp抗体阳性与Hp抗体阴性患者血清sLAG-3和PGR水平差异。
1.4 统计学处理
采用软件SPSS 20.0对本文所有数据进行处理分析。计数资料用率(%)表示,组间比较采用字2检验;计量资料以(x±s)表示,组间比较采用独立样本t检验;采用软件MedCalc 18.0,通过受试者操作特征(ROC)曲线分析各指标对早期胃癌的诊断效能。P<0.05表示差异有统计学意义。
2 结果
2.1 两组基线资料比较
两组患者的基线资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
2.2 两组sLAG-3及PGR比较
研究组患者sLAG-3高于对照组,PGR显著低于对照组,差异均有统计学意义(P<0.05),见表2。
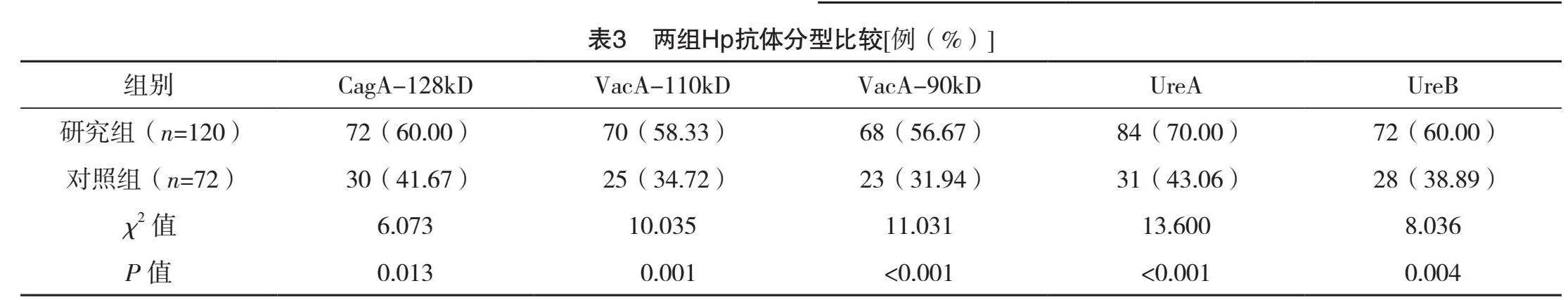
2.3 两组Hp抗体分型比较
研究组患者Hp抗体阳性、阴性例数分别为88、32例,对照组患者分别为41、31例,研究组Hp抗体阳性率高于对照组(73.33% vs 56.94%),差异有统计学意义(字2=5.483,P=0.019)。研究组患者CagA-128kD、VacA-110kD、VacA-90kD、UreA及UreB阳性率均显著高于对照组,差异有统计学意义(P<0.05),见表3。
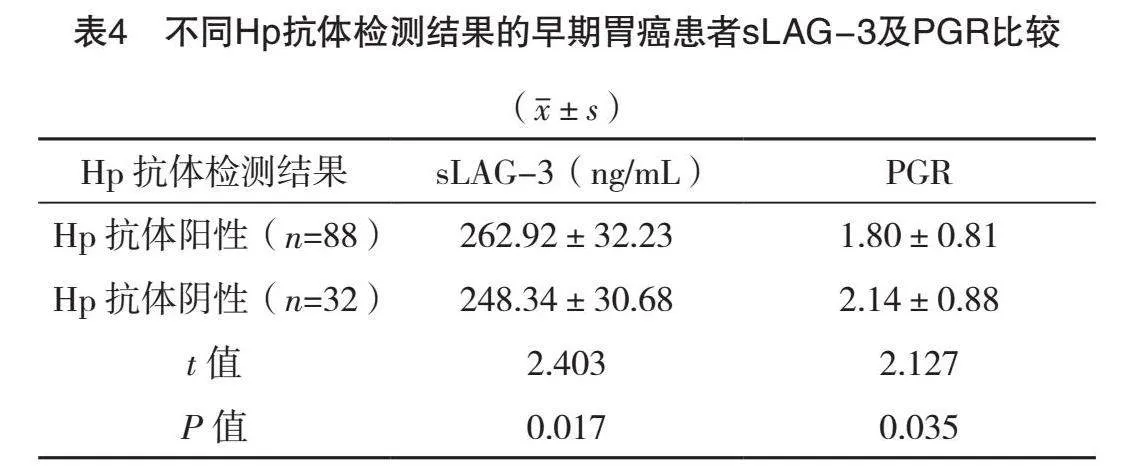
2.4 不同Hp抗体检测结果的早期胃癌患者sLAG-3及PGR比较
Hp抗体阳性早期胃癌患者的sLAG-3显著高于Hp抗体阴性早期胃癌患者,PGR低于Hp抗体阴性早期胃癌患者,差异均有统计学意义(P<0.05),见表4。
2.5 不同Hp抗体检测结果的癌前病变患者sLAG-3及PGR比较
Hp抗体阳性癌前病变患者的sLAG-3显著高于Hp抗体阴性癌前病变患者,PGR低于Hp抗体阴性癌前病变患者,差异均有统计学意义(P<0.05),见表5。
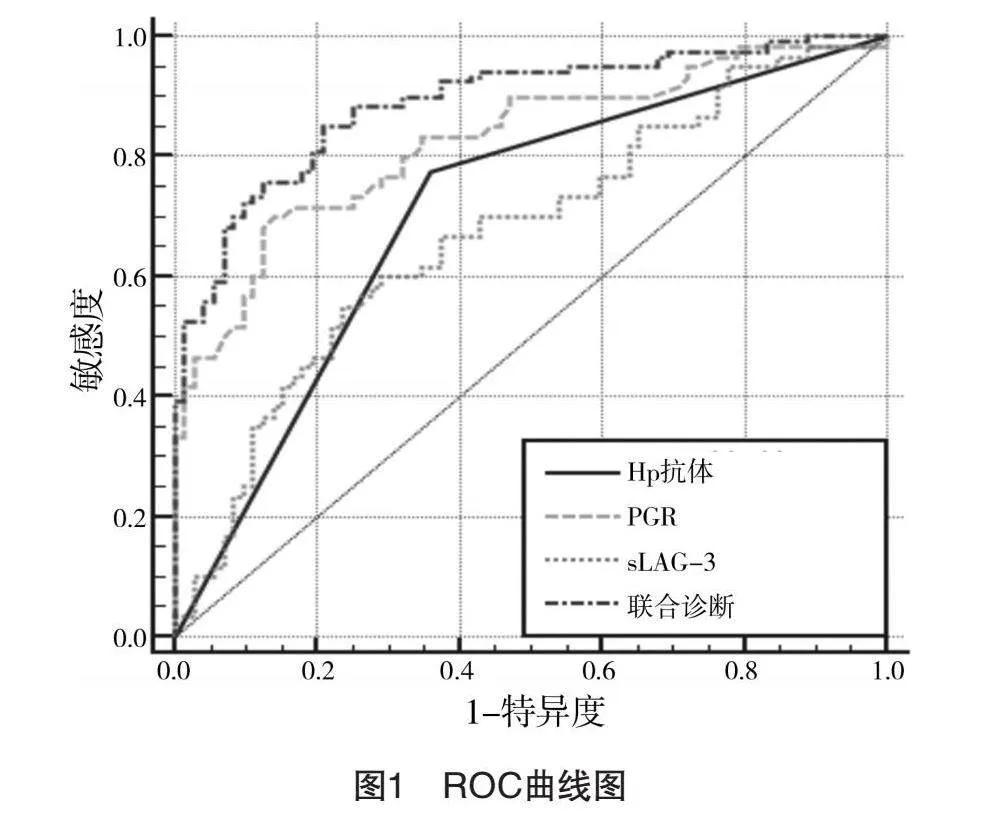
2.6 诊断效能分析
由ROC曲线得知,sLAG-3的敏感度为55.00%,特异度为76.39%,截断值为256.37 ng/mL;PGR的敏感度为70.00%,特异度为86.11%,截断值为2.32;Hp抗体的敏感度为77.50%,特异度为63.89%;联合诊断的敏感度为85.00%,特异度为79.17%。见图1、表6。
3 讨论
胃癌可由环境、遗传、生活习惯等多种因素引起,随着疾病的进展,患者的生存质量也随之下降,为提高胃癌患者的存活率,延长其生存期,临床上对于早期胃癌的诊断十分重视[8]。淋巴细胞活化基因3(lymphocyte activation gene-3,LAG-3)是免疫球蛋白超家族的一种跨膜糖蛋白,具有免疫调节功能,sLAG-3是LAG-3的可溶性形式,能与主要组织相容性复合体Ⅱ(major histocompatibility complex Ⅱ,MHCⅡ)相互作用,抑制CD4+ T细胞活化,有助于肿瘤细胞逃避凋亡[9-10],因此,当发生胃癌后,患者体内的sLAG-3表达水平会上升,进入血液循环后被检测出的概率增加。PGⅠ主要由胃底腺的主细胞、颈黏液细胞释放,PGⅡ主要由全胃黏膜层腺体细胞表达,主要反映胃黏膜腺体及细胞数量,在胃癌的发生发展过程中起到重要作用,临床上PGR异常一般提示胃黏膜发生损伤、胃部发生病变等[11-12]。
本次研究结果显示,研究组和Hp抗体阳性患者的sLAG-3均显著高于对照组和Hp抗体阴性患者,PGR均低于对照组和Hp抗体阴性患者。分析其原因:(1)sLAG-3在抗原特异度CD8+ T细胞的产生及增殖过程中起到重要需用,并可促使CD8+ T细胞的转化,此类免疫细胞因具有细胞毒性,能诱导其他细胞凋亡,当患者机体内发生癌变时,体内sLAG-3表达水平会显著上升,负向调控T细胞的增殖、激活和稳态,从而促进肿瘤细胞增殖[13];(2)当患者胃部发生癌变时,患者胃底腺颈黏液细胞及主细胞受到损伤,使PGⅠ和PGⅡ的分泌受到抑制,从而导致PGR下降[14]。
相关研究已经证实,Hp持续感染是胃癌发生的重要原因[15]。本次研究观察到,研究组患者的CagA-128kD、VacA-110kD、VacA-90kD、UreA及UreB阳性率均显著高于对照组,此结果表示,早期胃癌患者Hp感染率显著高于癌前病变患者,究其原因:(1)CagA阳性表达主要与急性胃黏膜病变、消化性溃疡和胃癌有关,因此,当CagA阳性表达时,患者发生胃癌的概率更大[16];(2)VacA可抑制T细胞的活化和增殖,是导致宿主长期慢性感染的原因之一,且VacA可改变内皮细胞功能、线粒体膜通透性,抑制壁细胞分泌胃酸的能力,引起多种免疫细胞的功能改变,因此,当患者体内VacA表达阳性时,患者发生胃癌的可能性更大[17-18];(3)Ure可通过水解酶产生氨和二氧化碳以升高胃内pH值,改变胃部酸性环境,并通过多种机制调节宿主的免疫反应,促进中性粒细胞和单核细胞的趋化性,促进细胞凋亡,增强促炎细胞因子的释放,导致患者发生胃癌的可能性增加[19-20]。
本次研究由ROC曲线可知,sLAG-3的敏感度为55.00%,特异度为76.39%,截断值为256.37 ng/mL;PGR的敏感度为70.00%,特异度为86.11%,截断值为2.32;Hp抗体的敏感度为77.50%,特异度为63.89%;联合诊断的敏感度为85.00%,特异度为79.17%。究其原因:癌细胞基因可破坏机体内的正常胃壁组织结构,导致sLAG-3在血清中的水平上升,PGR下降,Hp抗体阳性率增加,这使得联合诊断的敏感度增高。由此可见,上述指标联合诊断的结果可作为临床早期胃癌诊断的参考指标之一。
综上所述,sLAG-3在诊断早期胃癌时,具有较高的特异度,而Hp抗体、PGR具有较高的敏感度,当上述指标进行联合诊断时,诊断效能更佳。
参考文献
[1]谢世林,朴大勋.早期胃癌保留功能胃切除术的现状[J].中国现代普通外科进展,2023,26(1):77-80.
[2]张朋悦,朱振,许婷婷,等.不同胃癌筛查方案在早期胃癌诊断中的应用价值[J].安徽医科大学学报,2023,58(3):510-514.
[3]王荣荣,张轶伟.血清幽门螺杆菌抗体和可溶性淋巴细胞活化基因-3表达水平对早期胃癌的诊断价值[J].中华生物医学工程杂志,2022,28(1):80-82.
[4]于艳,李红.血清胃蛋白酶原在早期胃癌和进展期胃癌中的变化特点[J].中华保健医学杂志,2023,25(4):395-398.
[5]黎杨浩,徐海平,徐细明.幽门螺杆菌对胃癌患者微小核糖核酸-146、人类表皮生长因子受体2表达影响研究[J].创伤与急危重病医学,2021,9(1):37-40.
[6]北京市科委重大项目《早期胃癌治疗规范研究》专家组.早期胃癌内镜下规范化切除的专家共识意见(2018,北京)[J].中华消化内镜杂志,2019,36(6):381-392.
[7]国家消化系疾病临床医学研究中心(上海),国家消化道早癌防治中心联盟,中华医学会消化病学分会幽门螺杆菌学组,等.中国胃黏膜癌前状态和癌前病变的处理策略专家共识(2020年)[J].中华消化杂志,2020,40(11):731-741.
[8] SELVAN T G,GOLLAPALLI P,KUMAR S H S,et al.Early diagnostic and prognostic biomarkers for gastric cancer: systems-level molecular basis of subsequent alterations in gastric mucosa from chronic atrophic gastritis to gastric cancer[J].J Genet Eng Biotechnol,2023,21(1):86.
[9] MIMURA K,KUA L F,XIAO J F, et al.Combined inhibition of PD-1/PD-L1, Lag-3, and Tim-3 axes augments antitumor immunity in gastric cancer-T cell coculture models[J].Gastric Cancer,2021,24(3):611-623.
[10] LI N,JILISIHAN B,WANG W,et al.Soluble LAG3 acts as a potential prognostic marker of gastric cancer and its positive correlation with CD8+ T cell frequency and secretion of IL-12 and INF-γ in peripheral blood[J].Cancer Biomark,2018,23(3):341-351.
[11] LIN Z,BIAN H,CHEN C,et al.Application of serum pepsinogen and carbohydrate antigen 72-4 (CA72-4) combined with gastrin-17 (G-17) detection in the screening, diagnosis, and evaluation of early gastric cancer[J].J Gastrointest Oncol,2021,12(3):1042-1048.
[12] HAO S,SHOU M,MA J,et al.Correlation analysis of serum pepsinogen, interleukin, and TNF-α with Hp infection in patients with gastric cancer: a randomized parallel controlled clinical study[J].Comput Math Methods Med,2022,2022:9277847.
[13] CHEN N,LIU Y,GUO Y,et al.Lymphocyte activation gene 3 negatively regulates the function of intrahepatic hepatitis C virus-specific CD8+ T cells[J].J Gastroenterol Hepatol,2015,30(12):1788-1795.
[14] DONDOV G,AMARBAYASGALAN D,BATSAIKHAN B,et al.Diagnostic performances of pepsinogens and gastrin-17 for atrophic gastritis and gastric cancer in Mongolian subjects[J/OL].PLoS One,2022,17(10):e0274938.https://pubmed.ncbi.nlm.nih.gov/36251649/.
[15]王识宇,袁德成,顾芳,等.幽门螺旋杆菌感染对胃癌的影响研究[J].中国临床实用医学,2017,8(2):42-47.
[16] FREIRE DE MELO F,MARQUES H S,ROCHA PINHEIRO S L,et al.Influence of helicobacter pylori oncoprotein CagA in gastric cancer: a critical-reflective analysis[J].World J Clin Oncol,2022,13(11):866-879.
[17] SULTAN A M,SHENOUDA R,SULTAN A M, et al.The relation between host TLR9-1486T/C, rs187084 gene polymorphisms and helicobacter pylori cagA, sodB, hsp60, and vacA virulence genes among gastric cancer patients[J].Pol J Microbiol,2022,71(1):35-42.
[18]肖蓉,陶双芬,陈思宇,等.幽门螺杆菌参与胃癌侵袭转移的研究进展[J].上海交通大学学报(医学版),2023,43(4):495-499.
[19] PERRAIS M,ROUSSEAUX C,DUCOUROUBLE M P,et al.
Helicobacter pylori urease and flagellin alter mucin gene expression in human gastric cancer cells[J].Gastric Cancer,2014,17(2):235-246.
[20]何媛,赵晶,林泳.血清幽门螺杆菌抗体分型与胃部疾病的关系研究[J].中国全科医学,2019,22(36):4424-4428.
(收稿日期:2024-02-02) (本文编辑:陈韵)
