2023年7—10月江西省妇幼保健院儿童社区获得性肺炎电子支气管镜下肺泡灌洗液的病原学分析
2024-10-08李婕吴海霞许文霖


【摘要】 目的:分析社区获得性肺炎(community-acquired pneumonia,CAP)住院患儿病原菌检出情况。方法:回顾性分析江西省妇幼保健院2023年7—10月72例CAP患儿的临床资料,对患儿行电子支气管镜肺泡灌洗术,并采集肺泡灌洗液行靶向二代测序(targeted next-generation sequencing,tNGS),记录病原菌检出情况,并分析不同性别、年龄、影像学结果及临床症状的病原菌分布情况。结果:72例CAP患儿检出病原菌115株,其中以肺炎支原体(耐药型)检出率(51.30%)最高,其次为肺炎链球菌(11.30%)。不同性别患儿病原菌检出情况比较,差异均无统计学意义(P>0.05)。婴幼儿期以病毒感染为主,检出率为42.86%,而学龄期与学龄前期以肺炎支原体(耐药型)感染为主,检出率为64.52%、55.36%。不同年龄段支原体及病毒感染比较,差异均有统计学意义(P<0.05)。影像学检查结果包括肺实变、双肺炎症、右肺炎症、左肺炎症、胸腔积液,均以肺炎支原体(耐药型)检出率最高,检出率依次为51.92%、50.00%、45.71%、63.16%、40.00%。咳嗽、发热患儿肺炎支原体(耐药型)检出率最高,检出率依次为51.75%、56.70%,咳痰患儿肺炎支原体(耐药型)和肺炎链球菌检出率最高,均为37.50%,气喘患儿鼻病毒A型检出率最高,检出率为50.00%。结论:本院72例CAP患儿的肺泡灌洗液标本检查结果中,肺炎支原体(耐药性)检出率最高,其次为肺炎链球菌。病原菌感染与年龄有密切关系,婴幼儿期以病毒感染为主,学龄期与学龄前期以肺炎支原体(耐药型)感染为主。
【关键词】 社区获得性肺炎 电子支气管镜 肺泡灌洗液 病原学
Etiological Analysis of Alveolar Lavage Fluid under Electronic Bronchoscope in Children with Community-acquired Pneumonia in Jiangxi Maternal and Child Health Hospital from July to October 2023/LI Jie, WU Haixia, XU Wenlin. //Medical Innovation of China, 2024, 21(26): -173
[Abstract] Objective: To analyze the detection of pathogenic bacteria in hospitalized children with community-acquired pneumonia (CAP). Method: Clinical data of 72 children with CAP from July to October 2023 in Jiangxi Maternal and Child Health Hospital were retrospectively analyzed. Electronic bronchoscopic alveolar lavage was performed on the children, and the alveolar lavage fluid was collected for targeted next-generation sequencing (tNGS). The detection of pathogenic bacteria was recorded, and the distribution of pathogenic bacteria with different gender, age, imaging results and clinical symptoms were analyzed. Result: 115 strains of pathogenic bacteria were detected in 72 children with CAP, among which Mycoplasma pneumoniae (drug-resistant type) had the highest detection rate (51.30%), followed by Streptococcus pneumoniae (11.30%). There were no statistically significant differences in the detection of pathogenic bacteria in children of different genders (P>0.05). Virus infection was predominant in infantile period, the detection rate was 42.86%. Mycoplasma pneumoniae (drug-resistant type) infection were predominant in school stage and preschool stage, the detection rate were 64.52% and 55.36%, respectively. There were significant differences in Mycoplasma and virus infection among different age groups (P<0.05). The imaging results included pulmonary consolidation, double pneumonia, right lung inflammation, left pneumonia and pleural effusion, and the detection rate of Mycoplasma pneumoniae (drug-resistant type) were the highest, with the detection rates of 51.92%, 50.00%, 45.71%, 63.16% and 40.00%, respectively. The detection rate of Mycoplasma pneumoniae (drug-resistant type) were the highest in children with cough and fever, and the detection rates were 51.75% and 56.70%, respectively. The detection rates of Mycoplasma pneumoniae (drug-resistant type type) and Streptococcal pneumoniae were the highest in children with expectoration, both of which were 37.50%. The detection rate of rhinovirus type in children with asthma was the highest, and the detection rate was 50.00%. Conclusion: In the alveolar lavage fluid samples of 72 children with CAP in our hospital, the detection rate of Mycoplasma pneumoniae (drug-resistant type type) is the highest, followed by Streptococcal pneumoniae. The pathogenic bacteria infection is closely related to age, virus infection is predominant in infantile period, Mycoplasma pneumoniae (drug-resistant type) infection are predominant in school stage and preschool stage.
[Key words] Community-acquired pneumonia Electronic bronchoscope Alveolar lavage fluid Etiology
First-author's address: Department of Pediatrics, Jiangxi Maternal and Child Health Hospital, Nanchang 330000, China
doi:10.3969/j.issn.1674-4985.2024.26.038
肺炎是经世界卫生组织公认的导致儿童死亡的常见原因,因为儿童年龄较小,加之合并先天性疾病、营养不良、抵抗力低下等因素,极易受到病毒、细菌、肺炎支原体等病原菌的影响,进而引发社区获得性肺炎(community-acquired pneumonia,CAP),不仅对患儿肺部健康造成不良影响,也会增加家庭及社会压力,因此CAP儿童一直以来都是江西省妇幼保健院儿科医生关注的重点对象[1]。随着我国医疗技术的不断进步,儿童CAP病原菌的检测及疫苗注入也逐渐有了新的认识,临床通常以痰培养作为检测病原菌的首选方式[2],但病原菌污染的可能性较大,故痰培养诊断有一定的局限性[3]。为此,有学者提出采用电子支气管镜联合肺泡灌洗进行诊治,首先能保留电子支气管镜的治疗作用,可在支气管镜直视下对呼吸道分泌物进行有效清除,提高患者通气功能,其次,还能直接取材进行检测,从而准确反映出肺炎病原学特点[4-5]。鉴于此,本研究通过回顾性收集本院72例CAP患儿的基本资料,经电子支气管镜检查并取肺泡灌洗液统计病原菌检出情况及临床特点,以期为临床治疗CAP患儿提供合理的抗菌药物方案,改善患儿预后。现将结果报道如下。
1 资料与方法
1.1 一般资料
收集本院2023年7—10月收治的72例CAP患儿的临床资料进行回顾性研究。(1)纳入标准:①入院时病程≤7 d;②符合儿童CAP相关标准[6];③行电子支气管镜肺泡灌洗术。(2)排除标准:①中途退出研究;②合并免疫性疾病;③严重心肺功能障碍;④凝血功能障碍。男37例,女35例;年龄2个月9天~12岁。本研究经本院医学伦理委员会批准。
1.2 方法
对患儿实施电子支气管镜肺泡灌洗术,具体如下:术前禁食禁水6 h,实施喉罩通气全麻,经喉罩进纤维支气管镜,逐步进入各级支气管,采用手持注射器或壁式负压吸引器反复灌洗,留取一定量的灌洗液送检(一般采集中段,即第2管样本送检),由专业人员对标本进行靶向二代测序(targeted next-generation sequencing,tNGS)[7],记录病原菌检出情况,并根据性别、年龄收集数据,针对不同病原菌分析其性别分布及年龄分布,记录不同临床特点。常见的病原菌:肺炎支原体(MP)、肺炎链球菌(S.pneumoniae)、流感嗜血杆菌(H.influenzae)、鲍曼不动杆菌(A.baumanii)、肺炎克雷伯菌(K.pneumoniae)、金黄色葡萄球菌(S.aureus)、卡他莫拉菌(M.catarrhalis)、伊氏肺孢子菌(P.jiroveci)、新型冠状病毒(SARS-CoV-2)、人博卡病毒1型(HBoV1)、人副流感病毒3型(HPIV3)、鼻病毒A型(RV-A)、鼻病毒B型(RV-B)、WU多瘤病毒(WUPyV)、人呼吸道合胞病毒A型(RSV-A)、人呼吸道合胞病毒B型(RSV-B)、柯萨奇病毒A6型(CV-A6)、人冠状病毒OC43(HCoV-OCck3Mlgd3ewQvxaCTBeY/JQ==43)、巨细胞病毒(CMV)、人偏肺病毒(hMPV)、人腺病毒3型(HAdV-3)。
1.3 统计学处理
数据利用统计学软件SPSS 22.0处理。计量资料用(x±s)表示,计数数据用率(%)表示,用字2检验。以P<0.05为差异有统计学意义。
2 结果
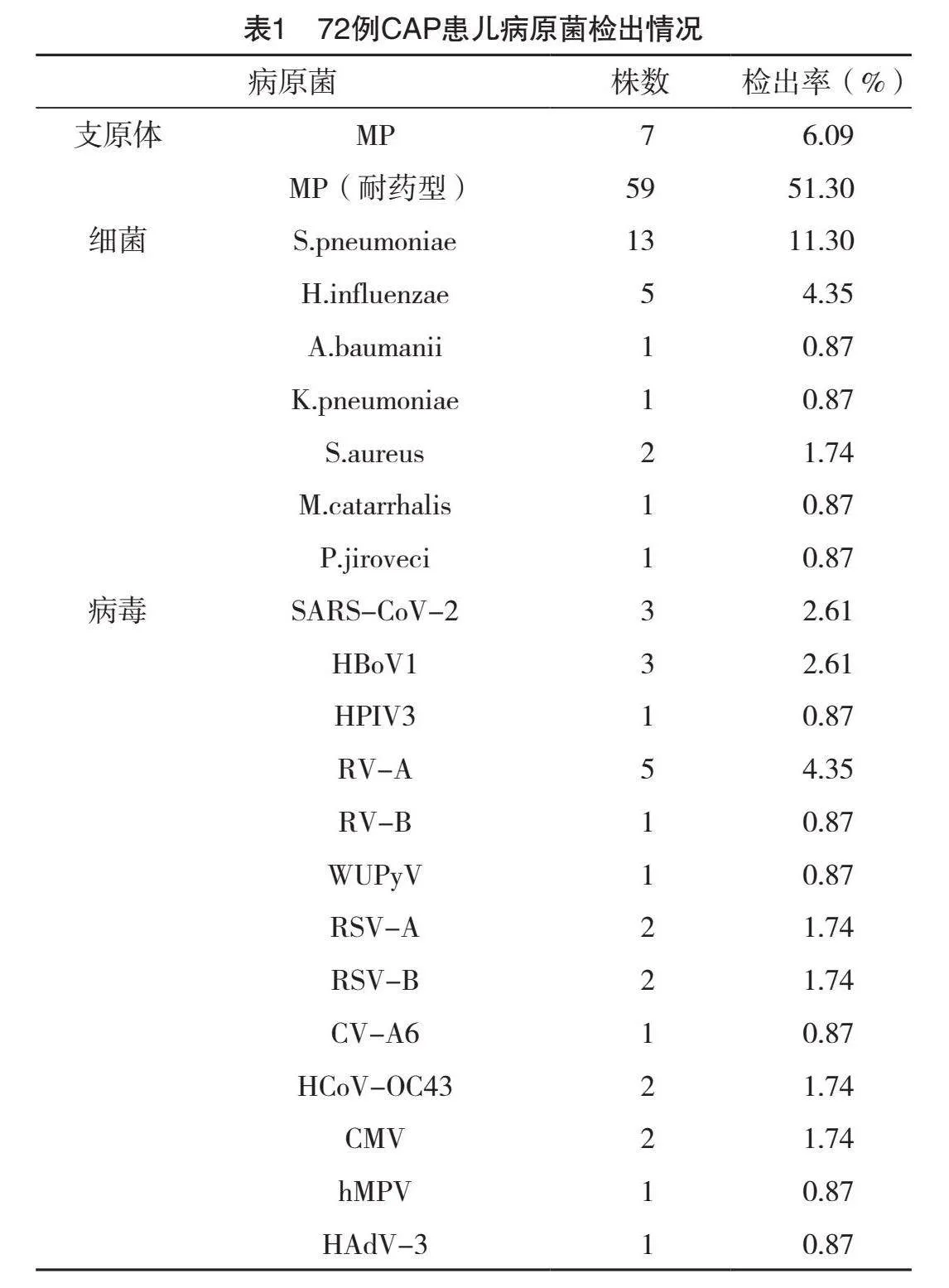
2.1 72例CAP患儿病原菌检出情况
72例患儿对电子支气管镜收集的肺泡灌洗液进行检测后,共检出病原菌115株,其中以MP(耐药型)检出率(51.30%)最高,其次为S.pneumoniae(11.30%),见表1。
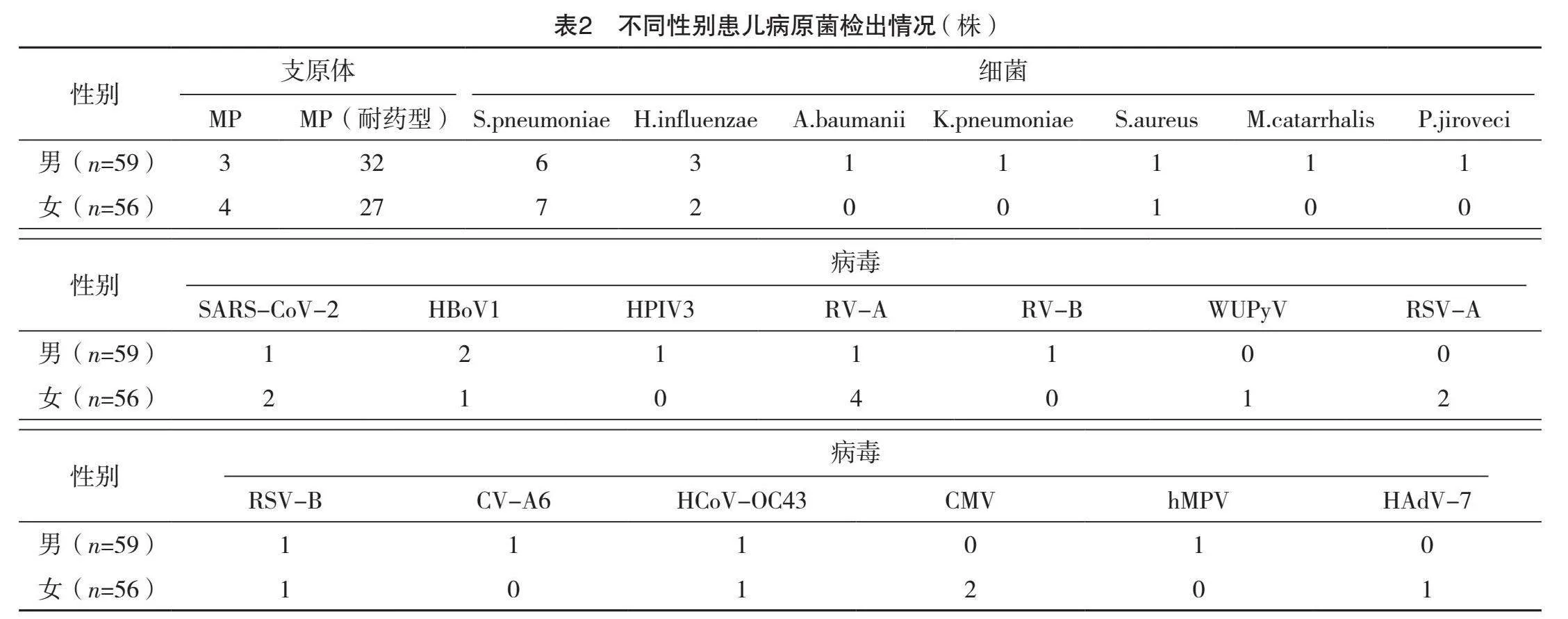
2.2 不同性别患儿病原菌检出情况
男童37例,共检出59株病原菌,包括35株支原体、14株细菌、10株病毒;女童35例,共检出56株病原菌,包括31株支原体、10株细菌、15株病毒。不同性别患儿病原菌检出情况比较,差异均无统计学意义(字2=0.185、0.695、1.989,P=0.667、0.404、0.158),见表2。
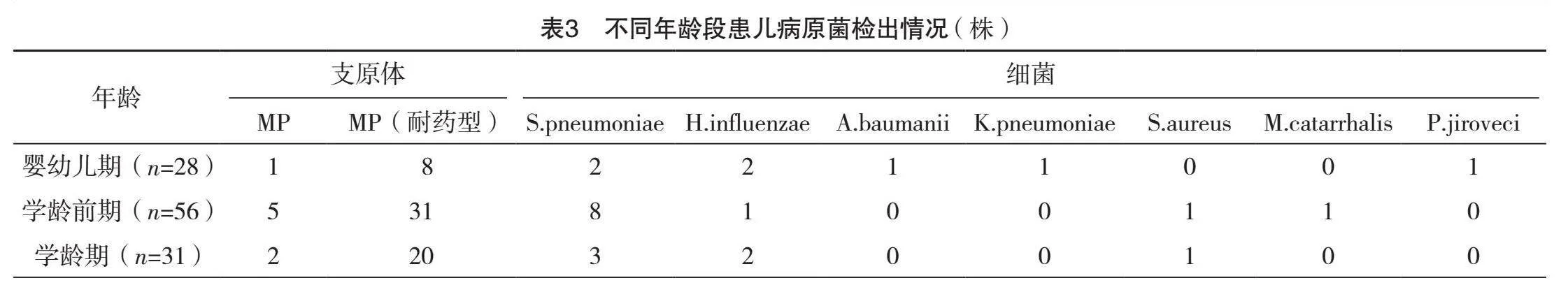
2.3 不同年龄段(婴幼儿期、学龄前期、学龄期)患儿病原菌检出情况
婴幼儿期(出生后到3周岁)15例,共检出28株病原菌;学龄前期(3周岁后至6周岁)36例,共检出56株病原菌;学龄期(7周岁至12周岁)21例,共检出31株病原菌。学龄期、学龄前期以MP(耐药型)感染为主,检出率为64.52%(20/31)、55.36%(31/56),婴幼儿期以病毒感染为主,检出率为42.86%(12/28)。不同年龄段支原体及病毒感染比较,差异均有统计学意义(字2=10.749、9.820,P=0.004、0.007)。见表3。
2.4 不同影像学检查结果病原菌检出情况
影像学检查结果包括肺实变、双肺炎症、右肺炎症、左肺炎症、胸腔积液,均以MP(耐药型)检出率最高,检出率依次为51.92%(54/104)、50.00%(21/42)、45.71%(16/35)、63.16%(12/19)、40.00%(2/5),见表4。
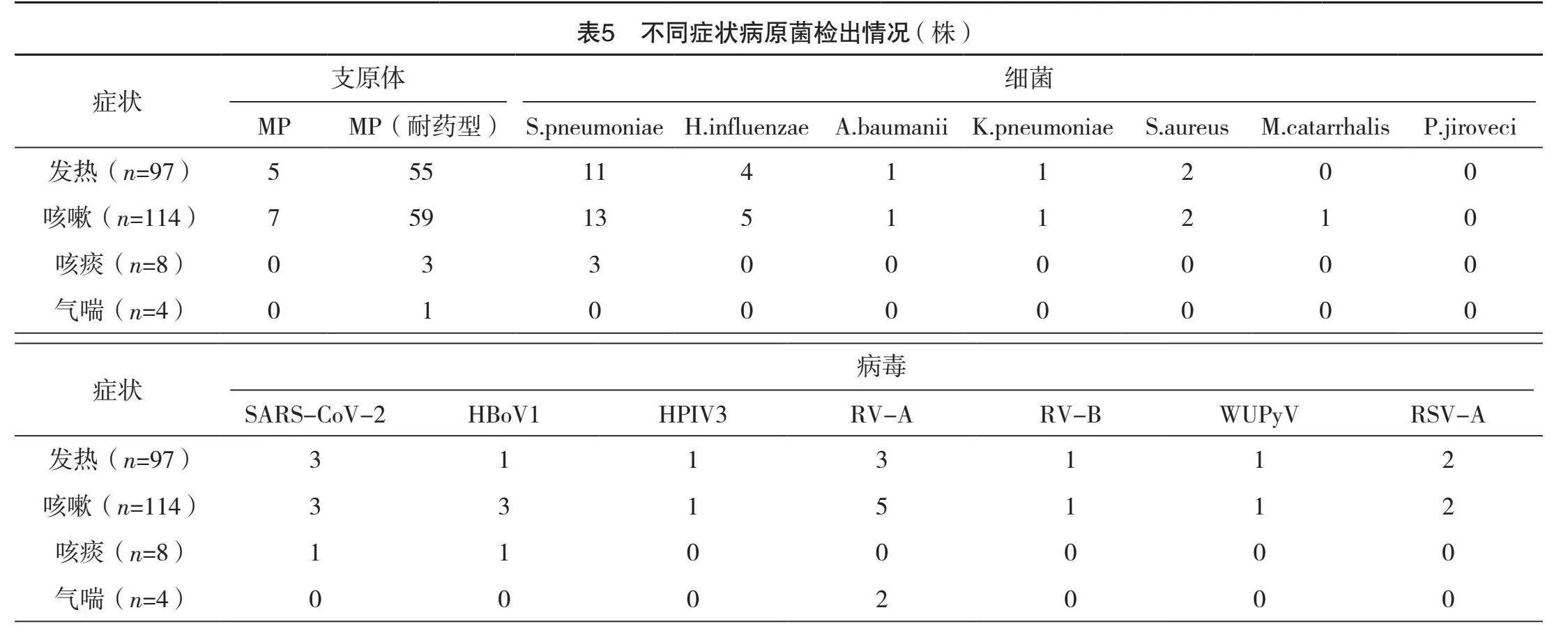
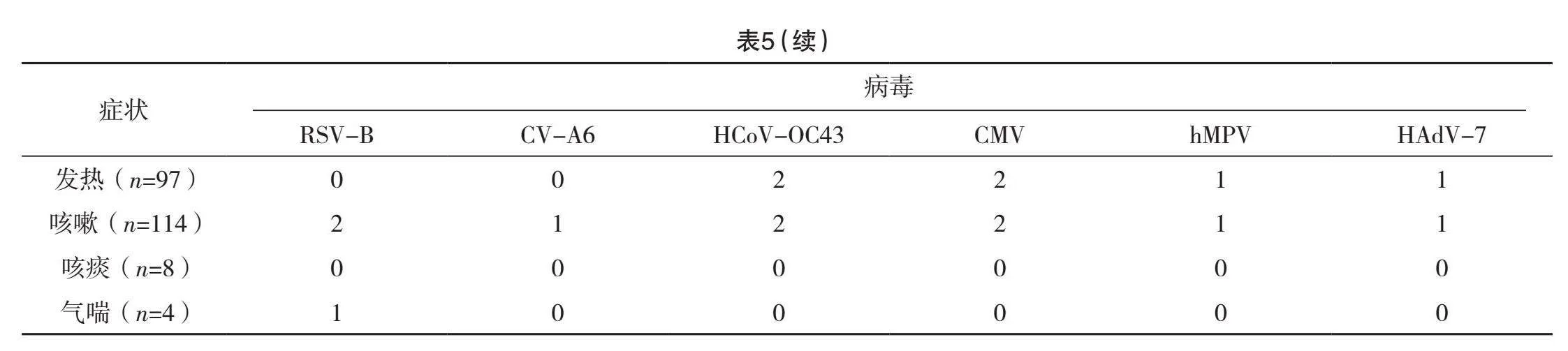
2.5 不同症状病原菌检出情况
咳嗽、发热患儿MP(耐药型)检出率最高,检出率依次为51.75%(59/114)、56.70%(55/97),咳痰患儿MP(耐药型)和S.pneumoniae检出率最高,均为37.50%(3/8),气喘患儿RV-A检出率最高,检出率为50.00%(2/4),见表5。
3 讨论
3.1 CAP患儿病原菌检出情况
CAP作为小儿常见疾病之一,也是导致小儿住院及死亡的主要原因,虽然大多数CAP患儿发热、咳嗽、咳痰等症状较轻,但也有部分患儿会出现积液、肺坏死、休克等严重并发症[8]。据以往数据报道,引发儿童CAP的病原菌种类复杂多样,其中MP是导致学龄期和青少年发病的常见病原菌[9],但不同年龄、季节及区域患儿的病原菌分布存在差异,且会随着时间推移及环境改变而发生变化,增加临床防治困难度[10-11]。电子支气管镜获取肺泡灌洗液来代替鼻咽分泌物样本,是临床近年来尝试的新型取样方法,与常规鼻咽拭子方法相比,其在检测病原菌上准确度更高[12-13]。
本研究发现72例CAP患儿共检出病原菌115株,其中以MP(耐药型)检出率(51.30%)最高,其次为S.pneumoniae(11.30%);不同性别患儿病原菌检出情况相比,差异无统计学意义;婴幼儿期以病毒感染为主,检出率为42.86%,而学龄期与学龄前期以MP(耐药型)感染为主,检出率为64.52%、55.36%。无完整细胞结构,既不是细菌也不是病毒,但其能黏附于气道独立生存,通过自身反应向气道释放毒素,久之可累及支气管、肺泡和肺间质,进而引发肺炎[14-15]。S.pneumoniae是革兰阳性菌,是寄居于上呼吸道的有毒株,其所带荚膜与溶血素是主要致病因素,能导致肺组织实变,同时也是临床公认的引起CAP的重要病原菌[16-17]。H.influenzae是典型的革兰阴性菌,菌株荚膜是主要毒性因子,而其作为机会性感染细菌,只有受到病毒感染或人体免疫系统降低的情况下,才会释放其毒性,损伤呼吸道[18]。RV在1956年被发现,认为其是引发呼吸道感染的病原菌之一,潜伏期短,一旦被感染,极易出现咽痛、喷嚏、喘息等鼻咽部症状[19]。CMV具有潜伏特性,肺是其主要感染受累器官[20]。另外,HBoV、HPIV、WUPyV、RSV检出率较低,猜测可能与年龄有关。
3.2 不同病原菌临床特点
本研究影像学检查结果包括肺实变、双肺炎症、右肺炎症、左肺炎症、胸腔积液,MP(耐药型)检出率均最高,依次为51.92%、50.00%、45.71%、63.16%、40.00%,表明CAP患儿以MP(耐药型)感染为主。MP进入支气管逐渐侵袭肺部,可波及肺间质与肺泡,局部免疫应答及炎症反应加剧,使得支气管黏膜充血、肿胀、分泌物增多,加上小儿肺脏本身气体交换面积小,病原微生物及炎性产物排除受阻;此外,炎性介质释放致使支气管痉挛,影像学多表现为局灶性或弥漫性渗出,或呈实变。咳嗽、发热患儿检出率最高的仍是MP(耐药型),依次为51.75%、56.70%。进一步分析还可发现病毒感染更易导致患儿出现发热、咳嗽等症状。
综上所述,2023年7—10月本院CAP患儿检出的最常见病原菌为MP(耐药型),且不同临床症状及影像学检查结果患儿的MP(耐药型)检出率均较高,并猜测感染病原菌情况与年龄分布有着密切关系。但本研究也存在不足之处,本研究仅对部分住院患儿进行病原学检测,样本量有限,研究结果可能会存在偏倚。
参考文献
[1]张丽娜,曹玲.儿童社区获得性肺炎的病原学研究进展及现状[J].中国医刊,2023,58(8):824-829.
[2]张树敬,陈祝俊,张菁,等.2017-2020年某肿瘤医院肿瘤患者血流感染病原菌及其耐药性[J].中华医院感染学杂志,2022,32(6):846-851.
[3]陈海波,阳辉.肺泡灌洗术与纤支镜在慢阻肺合并肺不张中的临床研究[J].黑龙江医药,2023,36(5):1014-1017.
[4]王玉娇.纤支镜肺泡灌洗治疗多重耐药菌肺部感染的研究进展[J].现代医药卫生,2021,37(6):974-978.
[5]耿海峰,王华伟,朱雪萍.纤维支气管镜检查和治疗在0~3月龄婴儿的应用[J].江苏医药,2020,46(10):988-991.
[6]贾红娥,薛红红.肺超声评分联合血清锌对儿童社区获得性肺炎预后判断的价值[J].广东医学,2023,44(1):9-12.
[7]小巴桑,张艳艳,史丹丹,等.基于下呼吸道标本靶向宏基因组测序技术评估西藏高原地区社区获得性肺炎的病原学分布特征[J].西藏科技,2022(10):42-48.
[8]张青,庄承.儿童耐大环内酯类支原体肺炎中西医治疗进展[J].辽宁中医药大学学报,2021,23(2):172-176.
[9]叶显梓,朱利华.儿童社区获得性肺炎的流行病学及常见病原学研究进展[J/OL].临床医药文献电子杂志,2021,8(17):32-34.https://d.wanfangdata.com.cn/periodical/gwyx-ekx200305001.
[10]韩晗,郑绪阳,俞珍惜,等.2018年—2020年杭州市第一人民医院儿科社区获得性肺炎病原菌分布及药敏分析[J].浙江中西医结合杂志,2021,31(2):168-172.
[11]刘丽,夏明月,刘灵,等.儿童社区获得性肺炎发病特点及导致重症的高危因素分析[J].川北医学院学报,2022,37(12):1596-1599,1603.
[12]王沛文,于少飞.儿童支气管异物临床特征分析[J].内蒙古医学杂志,2022,54(8):982-984,987.
[13]李正康,张鑫强,叶龙,等.儿科重症监护室住院患者感染病原菌分布及药敏分析[J].中国实验诊断学,2022,26(2):159-162.
[14]胡韶华,陈黎,赵梦,等.上海地区儿童肺炎支原体感染流行病学特征分析[J].检验医学,2023,38(1):14-17.
[15]谢俊杰,张健芳,苏金娣,等.肺炎支原体肺炎患儿肺炎支原体基因分型及对大环内酯类抗生素耐药基因突变的分析[J].中国小儿急救医学,2023,30(9):660-664.
[16]李亭,邓文君,张景锋,等.幼儿园儿童年龄与肺炎链球菌疫苗覆盖率间的剂量-反应关系[J].中国当代儿科杂志,2023,25(10):1059-1065.
[17]麦文慧,尹飞飞,卓珠琳,等.海口市儿童肺炎患者呼吸道标本流感嗜血杆菌的耐药性与分子流行病学特征[J].中国感染控制杂志,2022,21(12):1193-1199.
[18]蓝振章.100例儿童流感嗜血杆菌相关社区获得性肺炎的回顾性分析[J].口岸卫生控制,2023,28(3):59-62.
[19]蔡晓莹,林广裕,林创兴,等.2019至2020年粤东地区儿童呼吸道合胞病毒与鼻病毒检测情况及临床特点分析[J].中国小儿急救医学,2023,30(7):515-519.
[20]秦霞,姚娟.纤维支气管镜肺泡灌洗对巨细胞病毒肺炎患儿的疗效影响[J].河北医学,2021,27(9):1482-1486.
(收稿日期:2024-01-30) (本文编辑:陈韵)
