蜘蛛丝:一种神奇的天然生物纤维材料
2024-09-30何文倩刘遵峰

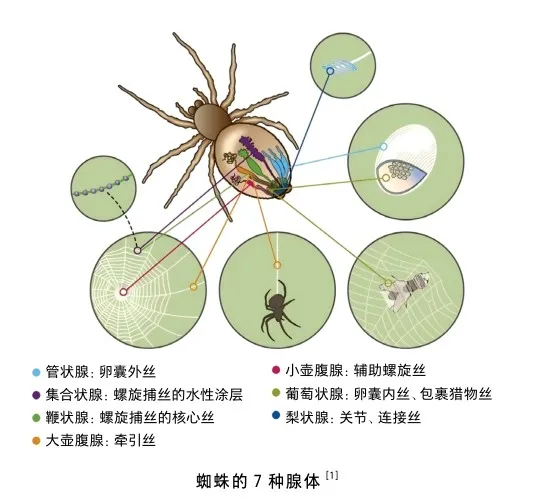
蜘蛛属于节肢动物门,是一种全球广泛分布的动物,其起源可以追溯至远古时代,大约4亿年前的泥盆纪时期。截至最新的统计数据,世界上已发现超过42 750种类型的蜘蛛,大多数的蜘蛛至少含有7种丝腺,即大壶状腺、小壶状腺、葡萄状腺、柱状或管状腺、鞭状或冠状腺、梨状腺和集合腺[1]。不同的丝腺可以分泌出不同物理性质的丝,具有不同的功能。例如,由大壶腹状腺分泌的牵引丝,又叫框丝,具有优异的机械性能,可以用于建网、捕食、逃避捕食者等;由集合状腺分泌的连接丝具有很高的黏性,可以用于连接、黏附等。
蛛丝蛋白初级结构
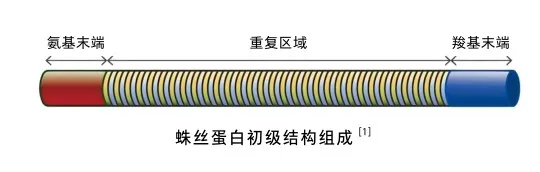
蜘蛛丝主要由一种或多种蜘蛛蛋白组成,这些蛋白质往往很大(每个单体可达350千道尔顿)。尽管蜘蛛丝性质不同,但所有蜘蛛蛋白都有一个共同的初级结构模式,中间为一个由重复模块单元组成的大核心,两侧是非重复结构域。非重复末端结构域具有折叠的球形结构,由100~140个氨基酸组成。这种末端结构域对于蛛丝腺中蛛丝蛋白的储存和纺丝管中纤维的形成至关重要。重复核心序列由模块单元组成,每个单元包含40~200个氨基酸,这些模块单元在核心域内大约重复100次。在大壶状腺、小壶状腺和鞭毛状丝中,模块单元主要由(Ala)4-14、(GlyAla)n、GlyGlyX和GlyProGlyXX序列组成,其中X代表可变氨基酸。一般来说,这些序列的子集、顺序和数量对纤维的机械性能至关重要。
由大壶状腺分泌的蜘蛛牵引丝,其拉伸强度为0.88~1.6吉帕,韧性为136~350 兆焦每立方米,是被研究的最多、最深入的蜘蛛丝之一。这种牵引丝主要由两种大壶状腺蛛丝蛋白MaSp1和MaSp2构成,是一种嵌段共聚物。MaSp1的单个模块单元通常包括一个聚丙氨酸块和几个GGX基序,在MaSp2模块中,GGX基序被GPGXX基序取代,显著增加了MaSp2的脯氨酸含量。这些基序的重复交替组成了牵引丝的核心结构域,末端则是由小的非重复氨基和羧基结构域构成[2]。
蜘蛛纺丝过程
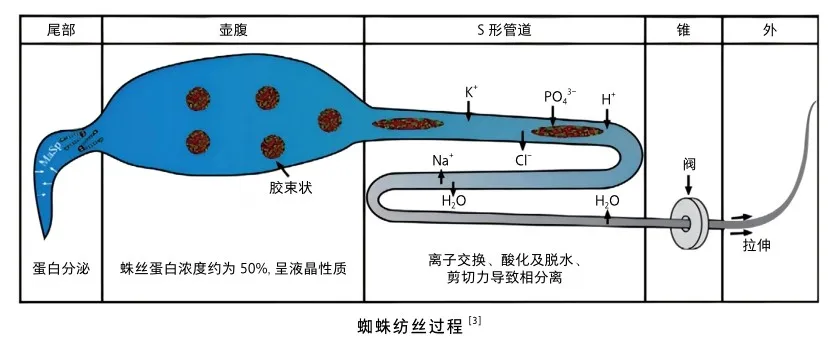
蜘蛛的纺丝过程可分为4个部分[3]。第一部分在尾部,由专属细胞分泌蛛丝蛋白;第二部分在壶腹/囊中,蛛丝蛋白被储存起来,与壶腹中的其他化合物混合形成纤维的皮肤层。在壶腹中,蛛丝蛋白的浓度可以达到50%(质量分数),在这个浓度下,大多数蛋白倾向于不可逆的聚集。为了防止这种非特异性聚集,蛛丝蛋白借助其两亲性的性质形成胶束状结构。另外,非重复末端结构域也支持这种超分子组装体的形成。这种具有向列液晶相性质的蛛丝蛋白称为纺丝液。在第三部分,蛛丝蛋白流经S-形轨道,随着轨道逐渐变窄,剪切力增加,液晶性蛛丝蛋白形成β-折叠晶区。在纺丝过程的最后一部分,纤维从喷丝口拉出,剪切力进一步提高,导致蛛丝蛋白产生一些结构变化,特别是在末端结构域,上皮细胞将水排出去导致蛛丝蛋白和溶剂发生相分离,疏水区域被暴露,这些末端结构域的变化造成胶束状结构核心区域的重新排列,与剪切力一起支持蛛丝蛋白组装。另外,除了剪切力的影响外,在S-形轨道发生的化学变化也会影响蛛丝蛋白结构变化。Na+、Cl-和K+、PO43-的交换导致羧基末端非重复结构域中疏水区域的暴露;将pH从7降低到6,氨基末端结构域二聚化,可充当物理交联点交联蛛丝蛋白结构。
在纤维离开喷丝口之前,会通过一个“阀门”,一个在内部破裂后帮助重新启动纺丝过程的器官。通过对管道进行前后加捻,以此将破裂的纤维移动到打开的阀门中。一旦纤维从喷丝口中喷出去,蜘蛛将会进一步拉伸纤维导致纤维进一步水分蒸发和分子有序排列。这种复杂精细的纺丝过程产生了一种强而韧的蜘蛛丝。
蜘蛛牵引丝多级结构
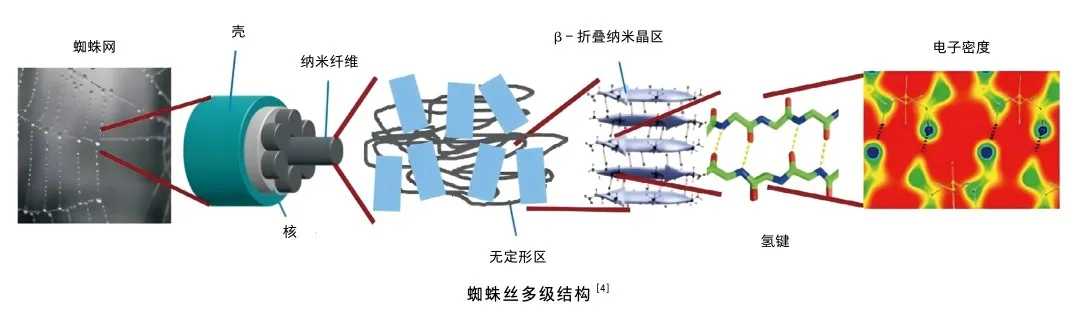
蜘蛛牵引丝具有一种多级结构,对蛛丝切片并免疫染色,然后通过透射电子显微镜观察到MaSp1和MaSp2蛋白在蛛丝横截面上异质分布,呈现一种“核壳结构”[4]。即外壳主要由MaSp1蛋白组成,表现为高模量和低延展性;内核则是由MaSp1和MaSp2蛋白混合构成,表现为低模量和高延展性。这种刚柔并济的核壳结构是蜘蛛牵引丝兼具优异强度和韧性的重要原因之一。另外,科学家借助原子力显微镜在蜘蛛丝表面观察到了螺旋扭曲的纳米纤维结构,这些纳米纤维沿着蜘蛛丝长度方向有序排列[5];将蛛丝放在去离子水中进行超声分解,可以得到直径10纳米的纳米纤维,单根纳米纤维的断裂强度约为120纳牛。曾有研究者通过有限元模拟证实了这种螺旋的纳米纤维结构在高剪切变形下可以发生滑动,放大形变,提高能量耗散,增大蛛丝的韧性;而分子链在纳米纤维中的有序排列,可以提高纤维的强度[6]。
在分子水平上,富含丙氨酸的基序形成了β-折叠晶区,富含甘氨酸的基序形成了β-转折、β-螺旋、α-螺旋和无定型基质,纳米尺度的β-折叠晶区嵌在由β-转折、β-螺旋l、α-螺旋以及随机线圈组成的无定形基质中形成交联网络,影响纤维的机械性能。β-折叠晶区沿纤维轴向排列,充当交联网络的节点,提高蛛丝变形过程中的强度,而α-螺旋以及随机线圈在拉伸过程中伸展,促进纤维的延展性。β-折叠晶区由蛛丝蛋白多肽链通过氢键自组装形成,其尺寸对纤维的力学性能影响巨大。研究人员通过一系列分子动力学模拟,揭示了尺寸限制在几纳米内的β-折叠晶区,能够更有效地利用氢键的均匀剪切变形和耗散分子黏滑变形,使纤维具有更高的硬度、强度和韧性[7]。由上述内容可知,蜘蛛牵引丝展现了一种多级结构,包括核壳结构、螺旋纳米纤维结构以及β-折叠晶区交联等,这些结构是蛛丝具有优异性能的重要原因。
人造蛛丝制备
虽然天然蜘蛛丝具有十分优异的性能,如高强度、良好的柔韧性和弹性,以及良好的生物相容性和生物可降解性等,但是由于蜘蛛同类相食的特性,不能大量养殖,因此,人造蛛丝的制备就显得尤为重要。基于重组蛛丝蛋白制备人造蛛丝是一种有效的方式[8]。
2015年,有研究小组小组采用十字园蛛丝蛋白3(ADF3),在大肠杆菌中表达重组蛛丝蛋白。将冻干的重组蛛丝蛋白溶解并透析作为纺丝液进行纺丝,得到的人造蛛丝纤维拉伸强度为370兆帕,韧性为183兆焦每立方米;2017年,该团队又设计了一种短的主壶腹腺蛛丝蛋白,该蛋白融合了角织蛛末端结构域和圆织蛛核心结构域,所制备的人造蛛丝纤维拉伸强度为282兆帕,韧性为144兆焦每立方米。
另外,科学家们发现重组蛛丝浓度和分子量也会影响人造蛛丝纤维的力学性能。重组蛛丝蛋白分子量越高,所制得的人造蛛丝纤维力学强度越高,由分子量为284.9千道尔顿的重组蛛丝蛋白制备得到的人造蛛丝纤维拉伸强度可以达到508兆帕,杨氏模量达到21吉帕。
一般来说,重组蛛丝蛋白的浓度很难达到天然蛛丝蛋白的浓度(50%)。有研究团队设计了一种嵌合重组蛛丝蛋白,由来自Euprosthenops australis MaSp1可溶的氨基末端结构域和来自大腹园蛛MiSp可溶的羧基末端结构域组成,这种嵌合重组蛛丝蛋白浓度高达50%,纺出的纤维拉伸强度为162兆帕,韧性为45兆焦每立方米。与纯蛛丝蛋白纤维相比,多组分复合纤维有望具有更高的机械性能和稳定性。另有研究团队将蜘蛛牵引丝蛋白和丝素蛋白复合,制备的纤维韧性达到116兆焦每立方米。此外,将MaSp1靶向整合到家蚕丝腺中,显著改善了蚕丝纤维的力学性能,尤其是拉伸性能,所得到的纤维断裂强度为371.5兆帕,断裂应变为32.2%。而其他学者将蛛丝蛋白基因插入丝素蛋白重链或轻链的内含子中,由此产生的纤维拉伸强度高达1.2吉帕。
除了基于重组蛋白制备人造蛛丝外,科学家们通过模仿蜘蛛丝的多级结构如交联结构、螺旋的纳米纤维结构以及核壳结构等,已经开发出了很多性能优异的人造纤维[9]。
结 语
蜘蛛丝作为一种天然生物蛋白纤维,具有高强、高韧、轻质柔性以及生物相容性、可降解等特点,在生物医学、军事工业、材料科学等领域具有广泛的应用。通过对蜘蛛丝结构和性能的深入研究,可以推动人们对新型功能纤维材料的仿生结构设计,创造出更多性能优异、功能多样的纤维材料。
[1]Rising A, Johansson J. Toward spinning artificial spider silk. Nature Chemical Biology, 2015, 11: 309–315.
[2]Yarger J L, Cherry B R, van der Vaart A. Uncovering the structurefunction relationship in spider silk. Nature Reviews Materials, 2018, 3(3): 8000.
[3]Eisoldt L, Smith A, Scheibel T. Decoding the secrets of spider silk . Materials Today, 2011, 14(3): 80-86.
[4]Sponner A, Vater W, Monajembashi S, et al. Composition and hierarchical organisation of a spider silk. Plos One, 2007, 2(10): e998.
[5]Xu G, Gong L, Yang Z, et al. What makes spider silk fibers so strong? From molecular-crystallite network to hierarchical network structures. Soft Matter, 2014, 10(13): 2116-2123.
[6]Wang Q, Schniepp H C. Strength of recluse spider’s silk originates from nanofibrils. ACS Macro Letters, 2018, 7(11): 1364-1370.
[7]Keten S, Xu Z, Ihle B, et al. Nanoconfinement controls stiffness, strength and mechanical toughness of β-sheet crystals in silk. Nature Materials, 2010, 9(4): 359-367.
[8]Li J, Li S, Huang J, et al. Spider silk-inspired artificial fibers. Advanced Science, 2022, 9(5): 2103965.
[9]Liu S, Cui Z, Liu Z, Zhao W, Zhou X. Research progress on spiderinspired tough fibers. Chinese Journal of Chemistry. 2023, 3401.
关键词:蜘蛛丝 多级结构 纺丝 纤维 人造蛛丝 ■
