蛋白尿与估算肾小球滤过率联合对糖尿病患者新发心血管疾病的影响
2024-08-18陶杰张欣欣李跃军张明桑大森

摘要:目的 观察估算肾小球滤过率(estimated glomerular filtration rate, eGFR)和尿微量白蛋白与肌酐比值(urine albumin-to-creatinine ratio, uACR)评估肾功能的一致性,探讨二者联合对糖尿病患者新发心脑血管疾病(cardia-cerebrovascular disease, CVD)(包括心力衰竭、心肌梗死、脑卒中)的影响。方法 选择参加开滦第5次或第6次健康体检且进行尿微量白蛋白及尿肌酐、血肌酐检测的8 791例2型糖尿病(type 2 diabetes mellitus, T2DM)患者为研究对象。依据基线uACR和eGFR水平分组:正常组(uACR<3 mg/mmol且eGFR≥90 mL·min-1·1.73 m-2)、单纯eGFR下降组(uACR<3 mg/mmol且eGFR<90 mL·min-1·1.73 m-2)、单纯uACR升高组(uACR≥3 mg/mmol且eGFR≥90 mL·min-1·1.73 m-2)和uACR升高合并eGFR下降组(uACR≥3 mg/mmol且eGFR<90 mL·min-1·1.73 m-2)。观察eGFR和uACR评估的肾功能是否一致。采用多因素Cox回归模型分析uACR和eGFR联合分组对CVD发病风险的影响。结果 (1)研究对象基线年龄为(60.97±9.99)岁,男性占79.05%,中位uACR为1.68(0.81,4.60)mg/mmol,平均eGFR为(92.14±16.52) mL·min-1·1.73 m-2,uACR升高与eGFR下降不一致者占43.59%。(2)中位随访时间为3.83年,共发生CVD事件694例 (7.89%),4组总CVD事件的发病密度分别为12.96/1 000人年、19.04/1 000人年、25.65/1 000人年和46.87/1 000人年。(3)与正常组相比,单纯eGFR下降组、单纯uACR升高组和uACR升高合并eGFR下降组新发总CVD事件的风险分别升高1.06(95%CI 0.73~1.55)倍、1.99(95%CI 1.41~2.80)倍和3.00(95%CI 2.12~4.25)倍。结论 eGFR下降和uACR升高所评估的肾功能不一致现象较为常见,二者对CVD发病的影响存在联合作用。
关键词:心血管疾病 ;尿微量白蛋白与尿肌酐比值;估算肾小球滤过率;2型糖尿病
DOI:10.3969/j.issn.1674490X.2024.03.005
中图分类号:R54"""" 文献标志码:A"""" 文章编号:1674490X(2024)03003109
The combined effect of albuminuria and eGFR on cardiovascular disease in population with" diabetes mellitus
TAO Jie, ZHANG Xinxin, LI Yuejun, ZHANG Ming, SANG Dasen
(Department of Cardiology, Baoding NO.1 Central Hospital, Baoding 071000, China)
Abstract: Objective To investigate whether the renal function assessed by estimated glomerular filtration rate (eGFR) and urinealbumin-to-creatinine rate (uACR) is consistent and explore the effect of the combination of the two on new-onset Cardia-cerebrovascular disease (CVD) in population with type 2 diabetes mellitus(T2DM). Methods We included 8 791 participants with T2DM but no CVD who were assessed with uACR and eGFR between 2014 and 2016. The participants were divided into four groups based on their baseline uACR and eGFR: normal(uACRlt;3 mg/mmol and eGFR≥90 mL·min-1·1.73 m-2), simple eGFR decreaed(uACRlt;3 mg/mmol and eGFRlt;90 mL·min-1·1.73 m-2), simple uACR increased(uACR≥3 mg/mmol and eGFR≥90 mL·min-1·1.73 m-2), uACR increased and eGFR decreaed(uACR≥3 mg/mmol and eGFRlt;90 mL·min-1·1.73 m-2). The relationship between uACR and eGFR and new-onset CVD was studied using Cox proportional hazard models. Results" There were 79.05% males in all participants with an average age of 60.97 years old. Their median uACR was 1.68(0.81, 4.60)mg/mmol and mean of eGFR was (92.14±16.52) mL·min-1·1.73 m-2),increased uACR and decreased eGFR were inconsistent in 43.59%. 694 new-onset CVD cases (7.89%) were recorded after a median follow-up of 3.83 years. The incidence of CVD in all four groups was 12.96/1 000 preson-years,19.04/1 000 preson-years, 25.65/1 000 preson-years and 46.87/1 000 preson-years, respectively. When compared with normal, multivariable-adjustted hazard ratios of CVD were 1.06(95%CI 0.73~1.55), 1.99(95%CI 1.41~2.80)and 3.00(95%CI 2.12~4.25)in simple eGFR decreaed group, simple uACR increased group, uACR increased and eGFR decreaed group, respectively. Conclusion Inconsistencies in renal function assessed by decreased eGFR and increased uACR are common, there is a joint effect of the two methods on the prediction of new CVD.
Key words: cardiovascular disease; urine albumin-to-creatinine ratio; estimated glomerular filtration rate; type 2 diabetes
随着人口老龄化和生活方式的改变,慢性病已经逐渐成为影响人类健康和生活质量的突出问题,尤其是糖尿病和心脑血管疾病(cardia-cerebrovascular disease,CVD)。1980年全国流行病学资料显示,糖尿病患病率为0.67%,而2015—2017年数据显示,中国18岁及以上糖尿病患病率高达11.2%[1-2]。糖尿病患者是CVD的高危人群,而CVD又是糖尿病患者致死和致残的主要原因[1,3]。因此,筛查出糖尿病患者中的CVD高危人群,早期开展针对性防治措施非常重要。传统的糖尿病患者CVD发病危险因素主要包括增龄、男性、估算肾小球滤过率(estimated glomerular filtration rate, eGFR)以及合并高血压、冠心病等[4]。近年来,很多研究证实尿微量白蛋白与尿肌酐比值(urine albumin-to-creatinine ratio, uACR)是糖尿病肾损伤和微血管病变的敏感指标,蛋白尿(uACR≥300 mg/g)与CVD的发生、发展和预后显著相关[5-7]。而eGFR和uACR均为反映肾功能的敏感指标和CVD的独立影响因素,那么,在糖尿病患者中,uACR和eGFR联合对新发CVD的影响又如何?为此,本研究旨在利用开滦研究 (注册号ChiCTR-TNC-11001489)资料分析2型糖尿病(type 2 diabetes mellitus, T2DM)患者uACR和eGFR联合对新发CVD的影响。
1 资料与方法
1.1 研究对象
选择参加开滦第5次、第6次体检且进行尿微量白蛋白、尿肌酐、血肌酐检测的T2DM患者为研究对象。本研究通过开滦总医院伦理委员会批准(2018ZX10715005)。
入选标准:(1)参加2014年度或 2016年度健康体检;(2)符合T2DM诊断标准(参考以往研究[3]);(3)uACR、血肌酐、年龄、性别等主要研究资料完整;(4)同意参加本研究并签署知情同意书。
排除标准:(1)体检前已有心力衰竭、心肌梗死、脑卒中病史;(2)患有心脏瓣膜病及先天性心脏病。
1.2 资料的收集
1.2.1 基线资料的收集
通过问卷调查获得观察对象的年龄、性别、患病情况、服用药物情况。身高、体质量、血压的测量以及相关生化指标的测定方法及标准参考以往研究[8]。
1.2.2 随访
以参加体检时间为随访起点,以新发CVD事件或死亡时间为随访终点,发生2次及以上事件者取第一次发生的事件及时间,未发生CVD事件和死亡者,末次随访时间为2020年12月31日。每年由经过培训的医务人员查阅开滦集团上述11家医院及市医保定点医院的疾病诊断记录,记录终点事件的发生情况,所有诊断均由专业医师根据住院病历进行确认。
1.3 实验室检查
研究对象体检当日早晨抽取5 mL空腹静脉血用于生化指标检测,统一应用日立7600自动化生化分析仪检测。同时留取中段晨尿。尿液检查应用尿液分析仪(N-600, 中国长春迪瑞)检测,血肌酐采用肌氨酸氧化酶法测定,尿肌酐采用Jaffes kinetic法测定,尿微量白蛋白采用比浊法(DAKO kit, Denmark)检测。
1.4 相关概念界定
(1)体质量指数:计算公式为体质量/身高2(kg/m2)。(2)吸烟:近1年平均每天至少吸1支烟以及戒烟不足1年者。(3)发病密度:以每1 000人年发病率表示,计算公式为每1 000人年发病率=发生结局的人数/总的人年数* 1 000‰。
1.5 研究对象分组
eGFR计算采用CKD-EPI公式[9]。uACR计算公式=尿微量白蛋白/尿肌酐(mg/mmol)。uACR≥3 mg/mmol为微量白蛋白尿[10]。依据基线时的uACR及eGFR值将研究对象分为4组:正常组为uACR<3 mg/mmol且eGFR≥90 mL·min-1·1.73 m-2;单纯eGFR下降组为uACR<3 mg/mmol且eGFR<90 mL·min-1·1.73 m-2;单纯uACR升高组为uACR≥3 mg/mmol且eGFR≥90 mL·min-1·1.73 m-2;uACR升高合并eGFR下降组为uACR≥3 mg/mmol且eGFR<90 mL·min-1·1.73 m-2。
1.6 统计学分析
应用SAS 9.4统计软件进行分析。正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,并进行两两比较,方差齐用LSD检验,方差不齐则用Dunnetts T3检验。非正态分布计量资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis秩和检验。计数资料用频数和百分比表示,组间比较用卡方检验。用Cochran-Armitage 趋势检验比较CVD事件发病密度的组间差异。采用多因素Cox回归模型分析不同uACR和eGFR分组对新发CVD事件的影响。Plt;0.05为差异有统计学意义(双侧检验)。
2 结果
参加开滦第5次和/或第6次体检并进行尿微量白蛋白与尿肌酐检测,且满足T2DM诊断标准的分别为1 820例和8 827例,参加2次体检均者(1005例)以参加第5次体检为基线,共9 642例进入研究队列,排除尿微量白蛋白及尿肌酐、血肌酐等主要研究资料不完整者210例,排除体检前有CVD病史者641例,最终纳入统计分析8 791例。
2.1 研究对象基线资料
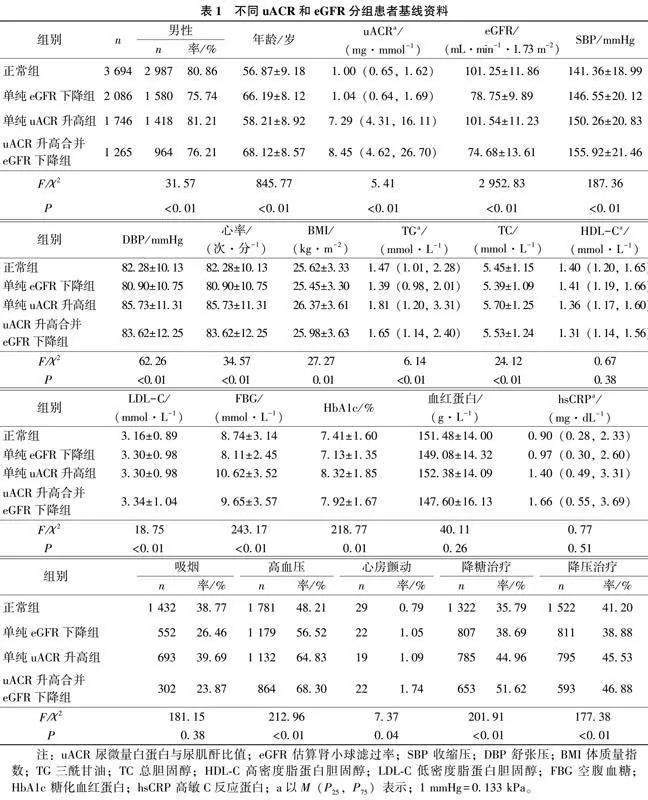
研究对象基线时平均年龄为(60.97±9.99)岁;其中男性6 949例(79.05%),女性1 842例(20.95%),中位uACR为1.68(0.81,4.60)mg/mmol,平均eGFR为(92.14±16.52 )mL/(min·1.73 m2)。其中,3 351例(42.47 %)eGFR下降,3 011例(34.25 %)uACR升高。uACR升高与eGFR下降“不匹配”者占43.59 %。见表1。
2.2 uACR和eGFR分组CVD事件发病情况
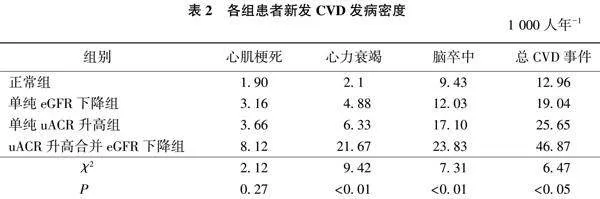
中位随访时间为3.83(3.36,4.22)年,其间共发生总CVD事件694例 (7.89%),其中心肌梗死113例(1.29%)、心力衰竭206例(2.34%)、脑卒中444例(5.05%)。发生全因死亡633例(7.20%)。总研究对象中心肌梗死发病密度为3.64/1 000人年,心力衰竭发病密度为6.15/1 000人年,脑卒中发病密度为13.46/1 000人年,总CVD事件发病密度为21.27/1 000人年。在不同uACR和eGFR分组中,心力衰竭、脑卒中和总CVD事件发病密度均随着uACR升高和eGFR下降而升高,发病密度最高均出现在uACR升高合并eGFR下降组(趋势P均lt;0.05)。见表2。
2.3 新发CVD事件的影响因素分析
2.3.1 新发CVD事件的单因素Cox分析
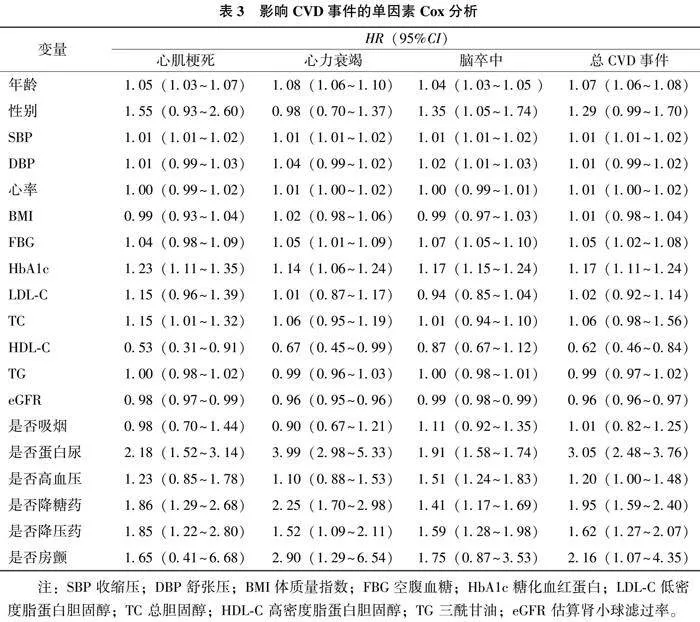
分别以心肌梗死、心力衰竭、脑卒中和总CVD事件为因变量,以年龄、性别、SBP、DBP、心率、BMI等为自变量行单因素Cox回归分析,结果显示,年龄、SBP、HbA1c、TC、HDLC、eGFR、 是否蛋白尿、是否降糖药、是否降压药对心肌梗死有统计学意义;年龄、SBP、心率、HDLC、是否降糖药、是否降压药、是否房颤对心力衰竭有统计学意义;性别、年龄、SBP、心率、HbA1c、是否高血压、是否降糖药、是否降压药对于脑卒中有统计学意义;年龄、SBP、心率、TC、HbA1c、是否降糖药、是否降压药对总CVD事件有统计学意义。见表3。
2.3.2 Cox回归分析
分别以是否发生心肌梗死、心力衰竭、脑卒中及总CVD事件为因变量,以uACR联合eGFR分组为自变量,模型1校正各事件单因素回归分析中有统计学意义的变量,模型1显示,在控制相关协变量后,uACR升高合并eGFR下降组发生CVD风险是正常组的3倍(95%CI 2.12~4.25),发生心肌梗死的风险是正常组的2.22倍(95%CI 1.22~4.04),发生心力衰竭的风险是正常组的5.73倍(95%CI 3.52~9.33),发生脑卒中的风险是正常组的1.44倍(95%CI 1.06~1.97)。见表4。
3 讨论
本研究在对一大型前瞻性队列中8 791例T2DM患者进行平均3.83年的随访后得出,uACR升高与eGFR下降均是CVD事件发病独立危险因素,且二者对CVD发病的影响具有联合促进作用。在该类患者中,uACR升高与eGFR下降所评估的肾功能“不一致”现象并不少见。
uACR升高与eGFR下降均是早期肾损伤的敏感指标,尤其是在T2DM患者中,uACR与eGFR同时被推荐用于T2DM患者早期肾功能的评估[3],研究已经证实二者均是CVD事件发生、发展和预后的独立预测因素[11-13]。因此,美国心脏病学会建议T2DM患者应常规检测尿微量白蛋白和计算eGFR以评估CVD风险。而既往研究多倾向于单独分析二者对CVD的影响,少有二者联合研究。Nowak等[10]曾在一般人群中发现与eGFR和uACR均正常组相比,新发心力衰竭风险最高出现在微量白蛋白尿合并eGFR 15~30 mL·min-1·1.73 m-2组(HR 1.77~12.62,Plt;0.05)。SPRINT研究[14]在无糖尿病的CVD高危患者(eGFRlt;60 mL·min-1·1.73 m-2者占28.4%,uACRgt;300 mg/g者占2.8%)中发现,心力衰竭和CVD死亡的风险随着eGFR下降和uACR升高而升高,单纯uACR升高组事件风险(HR 2.75~4.67,均Plt;0.01)高于单纯eGFR下降组(HR 1.83,Plt;0.01),风险值最高出现在eGFR最低合并uACR最高组(HR 7.16,Plt;0.01)。
在本研究中,近半数(43.59%)T2DM患者uACR和eGFR所评估的肾功能“不一致”,在校正相关影响因素后,单纯uACR升高组和单纯eGFR下降组新发总CVD事件的风险分别增加1.99倍和1.06倍,但后者无统计学意义。与正常组相比,uACR升高合并eGFR下降组总CVD事件发病风险最高(HR 3.00),且心肌梗死、心力衰竭和脑卒中结果均与上述趋势类似,但在心肌梗死事件中,仅uACR升高合并eGFR下降组风险增加有统计学意义。
目前,关于uACR与脑卒中发病风险的研究结论尚不一致。一项Meta分析显示,uACR升高与出血性脑卒中和缺血性脑卒中风险增加均有关,uACR可以作为非高血压非糖尿病患者脑卒中发病的预测因子,而在糖尿病亚组和高血压亚组中uACR升高与脑卒中高发病风险无统计学意义[15]。而在本研究的T2DM患者中,由于出血性脑卒中事件数量较少,故与缺血性脑卒中合并为脑卒中进行分析,结果显示单纯eGFR下降组脑卒中风险未见增加,而单纯uACR升高和uACR升高合并eGFR下降组脑卒中的发病风险均升高,分别是正常组的1.41倍和1.44倍。
这些结果支持uACR升高和eGFR下降所评估的肾功能损害可能代表不同的病理生理过程。eGFR代表肾小球的滤过功能,被认为是评价肾功能的金标准,肾血流量减少、肾小球有效滤过压降低和肾小球滤过膜通透性增加均可以导致eGFR下降,导致血管容量负荷过重和肾素-血管紧张素-醛固酮系统过度激活,进一步介导高血压的发生和血管重构可能是eGFR下降与CVD发病风险升高的主要共同机制[16]。其次,肾功能受损导致的凝血/纤溶系统异常、炎症和血脂代谢异常、贫血等是影响心功能和血管病变的重要原因[17-19]。此外,eGFR下降是动脉硬化的独立危险因素,这也是CVD发病风险升高的原因[20]。尿微量白蛋白是肾小球电荷屏障损伤的标志性蛋白,蛋白尿可能是涉及全身小血管和大血管广泛性血管壁病变的生物标志物。微量白蛋白尿增加,血管内皮功能障碍和低度慢性炎症相互关联,共同启动T2DM患者动脉粥样硬化病程[21]。也有研究证实,蛋白尿与高同型半胱氨酸血症、凝血功能障碍、炎症因子升高和氧化应激增强有关[22-24]。eGFR的变化可能是由于真实肾小球滤过率的变化或者血清肌酐浓度的变化,但在血压恒定时,蛋白尿的变化主要反映肾小球血流动力学变化和肾脏结构损伤。
本研究的优势:本研究队列稳定、样本量大、结局终点事件准确,且首次在以社区为基础的T2DM患者中观察uACR和eGFR评估肾功能的分布情况,并依据uACR和eGFR联合分组分析二者对糖尿病患者发生CVD事件的影响。本研究不足:首先,本研究随访时间可能相对较短,部分CVD事件不能完全暴露;其次,由于本研究中出血性脑卒中事件较少,故将出血性和缺血性脑卒中合并为脑卒中进行分析。
参考文献:
[1]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2020年版)[J].国际内分泌代谢杂志, 2021, 41(5): 482-548. DOI: 10.3760/cma.j.cn121383-20210825-08063.
[2]LI Y Z, TENG D, SHI X G, et al. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: national cross sectional study[J]. BMJ, 2020, 369: m997. DOI: 10.1136/bmj.m997.
[3]ASSOCIATION A D. Standards of medical care in diabetes: 2010[J]. Diabetes Care, 2010, 33(Suppl 1): S11-S61. DOI: 10.2337/dc10-S011.
[4]PYLYPCHUK R, WELLS S, KERR A, et al. Cardiovascular risk prediction in type 2 diabetes before and after widespread screening: a derivation and validation study[J]. Lancet, 2021, 397(10291): 2264-2274. DOI: 10.1016/S0140-6736(21)00572-9.
[5]ARNLV J, EVANS J C, MEIGS J B, et al. Low-grade albuminuria and incidence of cardiovascular disease events in nonhypertensive and nondiabetic individuals: the Framingham Heart Study[J]. Circulation, 2005, 112(7): 969-975. DOI: 10.1161/CIRCULATIONAHA.105.538132.
[6]TAO J, SANG D S, ZHANG X X, et al. An elevated urinary albumin-to-creatinine ratio increases the risk of incident cardia-cerebrovascular disease in individuals with type 2 diabetes[J]. Diabetol Metab Syndr, 2024, 16(1): 30. DOI: 10.1186/s13098-024-01256-5.
[7]SCIRICA B M, MOSENZON O, BHATT D L, et al. Cardiovascular outcomes according to urinary albumin and kidney disease in patients with type 2 diabetes at high cardiovascular risk: observations from the SAVOR-TIMI 53 trial[J]. JAMA Cardiol, 2018, 3(2): 155-163. DOI: 10.1001/jamacardio.2017.4228.
[8]WU S L, HUANG Z R, YANG X C, et al. Prevalence of ideal cardiovascular health and its relationship with the 4-year cardiovascular events in a northern Chinese industrial city[J]. Circ Cardiovasc Qual Outcomes, 2012, 5(4): 487-493. DOI: 10.1161/CIRCOUTCOMES.111.963694.
[9]LEVEY A S, STEVENS L A, SCHMID C H, et al. A new equation to estimate glomerular filtration rate[J]. Ann Intern Med, 2009, 150(9): 604-612. DOI: 10.7326/0003-4819-150-9-200905050-00006.
[10]NOWAK C, RNLV J. Kidney disease biomarkers improve heart failure risk prediction in the general population[J]. Circ Heart Fail, 2020, 13(8): e006904. DOI: 10.1161/circheartfailure.120.006904.
[11]ORLANDI P F, XIE D W, YANG W, et al. Slope of kidney function and its association with longitudinal mortality and cardiovascular disease among individuals with CKD[J]. J Am Soc Nephrol, 2020, 31(12): 2912-2923. DOI: 10.1681/ASN.2020040476.
[12]LEES J S, WELSH C E, CELIS-MORALES C A, et al. Glomerular filtration rate by differing measures, albuminuria and prediction of cardiovascular disease, mortality and end-stage kidney disease[J]. Nat Med, 2019, 25(11): 1753-1760. DOI: 10.1038/s41591-019-0627-8.
[13]MATSUSHITA K, CORESH J, SANG Y Y, et al. Estimated glomerular filtration rate and albuminuria for prediction of cardiovascular outcomes: a collaborative meta-analysis of individual participant data[J]. Lancet Diabetes Endocrinol, 2015, 3(7): 514-525. DOI: 10.1016/S2213-8587(15)00040-6.
[14]VADUGANATHAN M, PAREEK M, KRISTENSEN A M D, et al. Prevention of heart failure events with intensive versus standard blood pressure lowering across the spectrum of kidney function and albuminuria: a SPRINT substudy[J]. Eur J Heart Fail, 2021, 23(3): 384-392. DOI: 10.1002/ejhf.1971.
[15]LI M, CHENG A C, SUN J K, et al. The role of urinary albumin-to-creatinine ratio as a biomarker to predict stroke: a meta-analysis and systemic review[J]. Brain Circ, 2021, 7(3): 139-146. DOI: 10.4103/bc.bc_64_20.
[16]MIRABITO COLAFELLA K M, BOVE D M, DANSER A H J. The renin-angiotensin-aldosterone system and its therapeutic targets[J]. Exp Eye Res, 2019, 186: 107680. DOI: 10.1016/j.exer.2019.05.020.
[17]HE J, SHLIPAK M, ANDERSON A, et al. Risk factors for heart failure in patients with chronic kidney disease: the CRIC (chronic renal insufficiency cohort) study[J]. J Am Heart Assoc, 2017, 6(5): e005336. DOI: 10.1161/JAHA.116.005336.
[18]ZHANG H, SHI S, ZHAO X J, et al. Association between the lipid profile and renal dysfunction in the heart failure patients[J]. Kidney Blood Press Res, 2019, 44(1): 52-61. DOI: 10.1159/000498834.
[19]MCCLELLAN W M, FLANDERS W D, LANGSTON R D, et al. Anemia and renal insufficiency are independent risk factors for death among patients with congestive heart failure admitted to community hospitals: a population-based study[J]. J Am Soc Nephrol, 2002, 13(7): 1928-1936. DOI: 10.1097/01.asn.0000018409.45834.fa.
[20]HEIN A M, SCIALLA J J, SUN J L, et al. Estimated glomerular filtration rate variability in patients with heart failure and chronic kidney disease[J]. J Card Fail, 2021, 27(11): 1175-1184. DOI: 10.1016/j.cardfail.2021.04.016.
[21]那娜,江洪. 尿白蛋白与尿肌酐比值在2型糖尿病治疗中的研究进展[J].中华临床医师杂志(电子版), 2015, 9(21): 3969-3972. DOI: 10.3877/cma.j.issn.1674-0785.2015.21.028.
[22]TOYODA K. The cerebro-renal interaction in stroke neurology[J]. Neurology, 2012, 78(24): 1898-1899. DOI: 10.1212/WNL.0b013e318259e29f.
[23]BARZILAY J I, PETERSON D, CUSHMAN M, et al. The relationship of cardiovascular risk factors to microalbuminuria in older adults with or without diabetes mellitus or hypertension: the cardiovascular health study[J]. Am J Kidney Dis, 2004, 44(1): 25-34. DOI: 10.1053/j.ajkd.2004.03.022.
[24]DE ZEEUW D, PARVING H H, HENNING R H. Microalbuminuria as an early marker for cardiovascular disease[J]. J Am Soc Nephrol, 2006, 17(8): 2100-2105. DOI: 10.1681/asn.2006050517.
(责任编辑:高艳华)
本文引用:陶杰,张欣欣,李跃军,等.蛋白尿与估算肾小球滤过率联合对糖尿病患者新发心血管疾病的影响[J].医学研究与教育,2024,41(3):3139.DOI:10.3969/j.issn.1674490X.2024.03.005.
基金项目:保定市科学技术研究与发展计划项目(2241ZF249)
第一作者:陶杰 ( 1987—) ,女,河北唐山人,主治医师,硕士,主要从事心血管疾病诊治。E-mail: 529942140@qq.com
通信作者:桑大森 ( 1985—) ,男,河北保定人,副主任医师,博士,硕士生导师,主要从事心血管疾病诊治。E-mail: drtaoj@126.com