早期主动脉硬化风险筛查模型的构建及验证研究
2024-08-07周镇森黄岩程思为张小玉张晓雨孙婷杨先军谢晖马祖长


【摘要】 背景 在心血管风险评估领域,主动脉僵硬度被认为是关键的预测指标,颈股脉搏波传导速度(cfPWV)被认为是无创评估主动脉硬化风险的金标准。由于技术难度等挑战,我国cfPWV检测尚未广泛开展。目的 本研究旨在开发并验证一种基于心血管危险因素的早期主动脉硬化风险筛查模型,以期替代cfPWV复杂的测量过程,减少对传统测量方法的依赖。方法 选取2023年5—11月在安徽医科大学第一附属医院体检中心招募的878名受试者作为研究对象,按照8∶2的比例进行随机抽样分为建模组(n=703)和验证组(n=175)。收集患者一般资料、实验室检查结果及cfPWV。依据cfPWV检查结果和相关指南,将建模组受试者分为无主动脉硬化风险(n=503)和有主动脉硬化风险(n=200)。采用多因素Logistic回归分析并筛选变量,建立列线图评估模型。绘制模型预测主动脉硬化发生风险的受试者工作特征曲线(ROC曲线),以ROC曲线下面积(AUC)、Hosmer-Lemeshow检验评估模型的区分度和校准度,采用Delong检验比较各模型的AUC,采用决策曲线分析(DCA)评估模型临床实用性,并采用Bootstrap法重复采样1 000次对模型进行内部验证。结果 建模组有主动脉硬化风险者年龄、BMI、收缩压(SBP)、舒张压(DBP)、平均动脉压(MAP)、尿素、空腹血糖(FBG)、低密度脂蛋白胆固醇(LDL-C)、三酰甘油(TG)、总胆固醇(TC)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、血红蛋白(Hb)、饮酒、血脂异常、糖尿病比例高于无主动脉硬化风险者,肾小球滤过率(GFR)、血小板计数(PLT)低于无主动脉硬化风险者(P<0.05)。多因素Logistic回归分析结果显示年龄(OR=1.112,95%CI=1.082~1.143)、MAP(OR=1.146,95%CI=1.107~1.188)、Hb(OR=1.026,95%CI=1.004~1.049)和FBG(OR=1.353,95%CI=1.076~1.701)是主动脉硬化的独立影响因素(P<0.05)。纳入多因素Logistic回归分析结果差异有统计学意义的指标(年龄、MAP、Hb、FBG)构建预测模型Ⅰ,同时分别纳入吸烟、性别、血脂异常构建模型Ⅱ、模型Ⅲ、模型Ⅳ,绘制模型Ⅰ~模型Ⅳ的ROC曲线,模型Ⅰ~模型Ⅳ的AUC分别为0.941(95%CI=0.923~0.964,P<0.05)、0.941(95%CI=0.922~0.962,P<0.05)、0.941(95%CI=0.922~0.963,P<0.05)、0.939(95%CI=0.919~0.962,P<0.05);Delong检验结果示,模型Ⅰ、模型Ⅱ、模型Ⅲ、模型Ⅳ的AUC比较,差异无统计学意义(P>0.05)。根据多因素Logistic回归分析结果,以年龄、MAP、FBG、Hb为预测因子构建列线图模型,预测模型训练集的AUC为0.941(95%CI=0.920~0.962),灵敏度为0.832,特异度为0.917。验证集的AUC为0.961(95%CI=0.914~1.000),灵敏度为0.872,特异度为0.964。DCA结果显示使用主动脉硬化早期筛查模型可以使受试者在临床中获益。结论 本研究基于年龄、MAP、Hb和FBG 4个简易指标,建立了早期主动脉硬化风险筛查模型,提供了便捷、高效的早期血管功能筛查的方法。
【关键词】 动脉硬化;主动脉僵硬度;颈股脉搏波传导速度;预测模型;早期筛查
【中图分类号】 R 543.5 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2024.0032
Construction and Validation of a Screening Model for Early Atherosclerosis Risk in the Aorta
ZHOU Zhensen1,2,HUANG Yan2,CHENG Siwei3,ZHANG Xiaoyu2,ZHANG Xiaoyu4,SUN Ting1,YANG Xianjun2,XIE Hui1,MA Zuchang2,3*
1.Department of Nursing,Bengbu Medical University,Bengbu 233030,China
2.Hefei Institutes of Physical Science,Chinese Academy of Sciences,Hefei 230031,China
3.University of Science and Technology of China,Hefei 230026,China
4.Health Management Center,the First Affiliated Hospital of Anhui Medical University,Hefei 230022,China
*Corresponding author:MA Zuchang,Researcher;E-mail:zuchangma_zcm@163.com
【Abstract】 Background In the field of cardiovascular risk assessment,aortic stiffness is considered a key predictive indicator,and carotid-femoral pulse wave velocity(cfPWV)is recognized as the gold standard for non-invasive assessment of atherosclerotic risk in the aorta. Due to challenges such as technical difficulty,cfPWV testing has not been widely implemented in China. Objective This study aimed to develop and validate a screening model for early atherosclerotic risk in the aorta based on cardiovascular risk factors,with the intention of replacing the complex measurement process of cfPWV and reducing reliance on traditional measurement methods. Methods A total of 878 participants recruited from the Health Checkup Center of the First Affiliated Hospital of Anhui Medical University between May and November 2023 were selected as research subjects,randomly divided into a model-building group(n=703)and a validation group(n=175)in an 8∶2 ratio. Patient general information,laboratory test results,and cfPWV were collected. Based on the cfPWV examination results and relevant guidelines,participants in the model-building group were divided into those without atherosclerotic risk in the aorta(n=503)and those with atherosclerotic risk in the aorta(n=200). Multifactorial Logistic regression analysis was used to screen variables and establish a nomogram assessment model. The receiver operating characteristic curve(ROC curve)for predicting the risk of atherosclerosis in the aorta was plotted for the model,and the model's discriminative ability and calibration were assessed using the area under the ROC curve(AUC)and the Hosmer-Lemeshow test,respectively. The Delong test was used to compare the AUCs of different models,and decision curve analysis(DCA)was used to assess the clinical utility of the model. Internal validation of the model was performed using the bootstrap method with 1 000 resampling iterations. Results Participants with atherosclerotic risk in the model-building group were older,had higher BMI,systolic blood pressure(SBP),diastolic blood pressure(DBP),mean arterial pressure(MAP),urea,fasting blood glucose(FBG),low-density lipoprotein cholesterol(LDL-C),triglycerides(TG),total cholesterol(TC),alanine aminotransferase(ALT),aspartate aminotransferase(AST),hemoglobin(Hb),and a higher proportion of alcohol consumption,dyslipidemia,and diabetes than those without atherosclerotic risk in the aorta. The glomerular filtration rate(GFR)and platelet count(PLT)were lower in those with atherosclerotic risk(P<0.05). Multifactorial Logistic regression analysis showed that age(OR=1.112,95%CI=1.082-1.143),MAP(OR=1.146,95%CI=1.107-1.188),Hb(OR=1.026,95%CI=1.004-1.049),and FBG(OR=1.353,95%CI=1.076-1.701)were independent risk factors for atherosclerosis in the aorta(P<0.05). A predictive modelⅠ was constructed using statistically significant indicators from the multifactorial logistic regression analysis(age,MAP,Hb,FBG),and models Ⅱ,Ⅲ,and Ⅳ were constructed by additionally including smoking,gender,and dyslipidemia,respectively. The AUCs for models Ⅰ to Ⅳ were 0.941(95%CI=0.923-0.964,P<0.05),0.941(95%CI=0.922-0.962,P<0.05),0.941(95%CI=0.922-0.963,P<0.05),and 0.939(95%CI=0.919-0.962,P<0.05),respectively. The Delong test showed no statistically significant difference in AUCs among models Ⅰ,Ⅱ,Ⅲ,and Ⅳ(P>0.05). A nomogram model was constructed using age,MAP,FBG,and Hb as predictive factors,with an AUC of 0.941(95%CI=0.920-0.962)for the training set,sensitivity of 0.832,and specificity of 0.917. The AUC for the validation set was 0.961(95%CI=0.914-1.000),with sensitivity of 0.872 and specificity of 0.964. DCA results indicated that the use of the early atherosclerosis screening model could benefit participants in clinical practice. Conclusion Based on four simple indexes of age,mean arterial pressure,hemoglobin and fasting blood glucose,a screening model for early aortic sclerosis risk was established,which provides a convenient and efficient method for early vascular function screening.
【Key words】 Arteriosclerosis;Aortic stiffness;Carotid-femoral pulse wave velocity;Prediction model;Early screening
随着中国人口老龄化加速以及不健康生活方式的影响,心血管疾病(cardiovascular disease,CVD)在中国人群中的患病率和死亡率不断上升。《中国心血管健康与疾病报告2022概要》[1]表明,CVD已经成为威胁居民身体健康的首要疾病。据统计,我国目前约有3.3亿人患有CVD,每5例死亡病例中就有2例死于CVD,形势严峻。
在心血管风险评估领域,主动脉僵硬度被认为是关键的预测指标[2]。动脉僵硬度增加会导致收缩压(SBP)升高,引起左心室后负荷压力增加。同时,舒张压(DBP)降低,导致血液灌注不足,引起心肌缺血[3-4]。目前无创筛查主动脉硬化的主要方法包括彩色超声、CT扫描和核磁共振等影像学技术。这些方法侧重于血管结构的筛查,而颈股脉搏波传导速度(carotid-femoral pulse wave velocity,cfPWV)检测更注重血管功能的评估。cfPWV被认为是无创评估主动脉硬化风险的金标准[5],在各种脉搏波速度测量中,cfPWV与CVD之间的相关性最显著[6]。由于血管功能性的改变通常先于结构性的改变。因此,cfPWV的测量对于反映早期血管功能至关重要。
目前,测量cfPWV仍然面临一些挑战:检测设备昂贵;需要专业人员操作,在测量股动脉时可能会涉及隐私等问题。为解决这些问题,本研究成功构建了早期主动脉硬化风险筛查模型,有效地替代了cfPWV复杂的测量过程,通过该模型,居民可以自主监测主动脉硬化风险水平,并有针对性地采取预防和管理措施。
1 对象与方法
1.1 研究对象
选取2023年5—11月在安徽医科大学第一附属医院体检中心招募的878名受试者作为研究对象。纳入标准:(1)年龄≥18岁;(2)意识清醒,具有良好的中文书写及阅读交流能力;(3)具有良好的依从性,自愿参加。排除标准:(1)患有精神疾病;(2)患有严重的心脑血管、肝肾等疾病;(3)严重周围动脉闭塞性病变累及左、右侧颈动脉、上肢动脉、髂动脉、股动脉等无法完成cfPWV检测者;(4)频发性期前收缩、心房颤动等导致检测过程中无法获得规律的窦性节律者;(5)急性疼痛、严重痛苦感或焦躁者;(6)身体或情感上不安或不合作者;(7)以任何原因拒绝参与者;(8)研究者认定有其他不合格条件,包括孕妇,测量部位无法触及动脉脉搏者等。根据Logistic回归样本量估计的因变量事件数法(events per variable,EPV)计算样本量。为保证回归分析结果的稳健,EPV应为10~20[7]。前期100例预调查发现主动脉硬化检出率为30%,假设EPV=10,由于本研究共纳入研究因素21个,因此所需阳性事件的例数为21×10=210例,共需样本量210÷30%=700例。根据风险预测模型外部验证的样本量一般为建模组样本量1/4~1/2的原则[8],验证组样本量应为175~350例。本研究共纳入878例样本,按照8∶2的比例进行随机抽样,其中建模组703例,验证组175例。
本研究遵照赫尔辛基宣言,并获得中科院合肥物质研究院科技伦理委员会批准(YXLL-2023-46),受试者均同意参加本次研究并签署知情同意书。
1.2 方法
1.2.1 一般资料收集:测量前受试者禁食8 h,并且测量前3 h内停止摄入咖啡因或吸烟。由2名经过规范训练的操作者在每天上午固定时间测量,控制环境温度为(25±2)℃。收集年龄、性别、身高、体质量、高血压、糖尿病、用药史、SBP、DBP、吸烟史(吸烟定义为调查前30 d有吸烟行为,并且≥1支/d[9])、饮酒史(饮酒定义为调查前30 d有饮酒行为,至少1次/周[10])等。采用OMORON M6设备记录卧位时右侧肱动脉血压,每次间隔至少1 min,进行3次测量,取每位受试者连续3次SBP和DBP测量的平均值,计算平均动脉压(mean arterial pressure,MAP),MAP=(SBP+2×DBP)/3。
1.2.2 实验室检查指标的收集:受试者空腹8 h后,于次日清晨抽取肘静脉血,测定总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、三酰甘油(triglyceride,TG)、空腹血糖(fasting blood glucose,FBG)、肾小球滤过率(glomerular filtration rate,GFR)、尿素、尿酸(uric acid,UA)、血红蛋白(hemoglobin,Hb)、丙氨酸氨基转移酶(glutamic-pyruvic transaminase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、血小板计数(platelet,PLT)、肌酐水平。根据《中国血脂管理指南(2023年)》[11]将血脂异常定义为TC≥5.2 mmol/L;LDL-C≥3.4 mmol/L;HDL-C≤1.0 mmol/L或TG≥1.7 mmol/L。
1.2.3 cfPWV检测:本研究采用Sphygmocor XCEL设备,受试者仰卧位休息10 min后,定位每位受试者右侧颈动脉和股动脉最强跳动的脉搏点[2]进行cfPWV测量。在测量过程中,受试者不得说话和睡觉。使用卷尺测量颈动脉与股动脉搏动最明显处之间的距离(m)作为实测距离,并将信息录入分析系统。颈、股动脉之间距离=实测距离(m)×0.8,以校正测量误差[2]。系统采集10个稳定波形后,计算cfPWV。cfPWV(m/s)=L×0.8/Δt,其中L为颈股动脉之间的距离(m),Δt为脉搏波传导的时间(s)[12],取两次测量后的平均值。如果两次计算的cfPWV差值>0.5 m/s,则进行第3次测量取中值。
1.2.4 受试者分组:根据欧洲专家共识[2],本研究采用10 m/s作为cfPWV的截断值,将受试者分为无主动脉硬化风险和有主动脉硬化风险,其中建模组共703名成员,200例存在主动脉硬化风险。验证组共175名成员,40例存在主动脉硬化风险。
1.3 统计学方法
采用R 4.1.0和SPSS 26.0统计学软件进行数据分析。符合正态分布的计量资料以(x-±s)表示,两组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-Whitney U检验;计数资料以例(%)表示,组间比较采用χ2检验。采用多因素Logistic回归分析并筛选变量,采用R 3.6.1软件包联合rms程序包建立列线图评估模型。绘制受试者工作特征曲线(ROC曲线),以ROC曲线下面积(AUC)、Hosmer-Lemeshow检验评估模型的区分度和校准度,采用Delong检验比较各模型的AUC,采用决策曲线分析(decision curve analysis,DCA)评估模型临床实用性,并采用Bootstrap法重复采样1 000次对模型进行内部验证。以P<0.05为差异有统计学意义。
2 结果
2.1 建模组临床基线资料比较
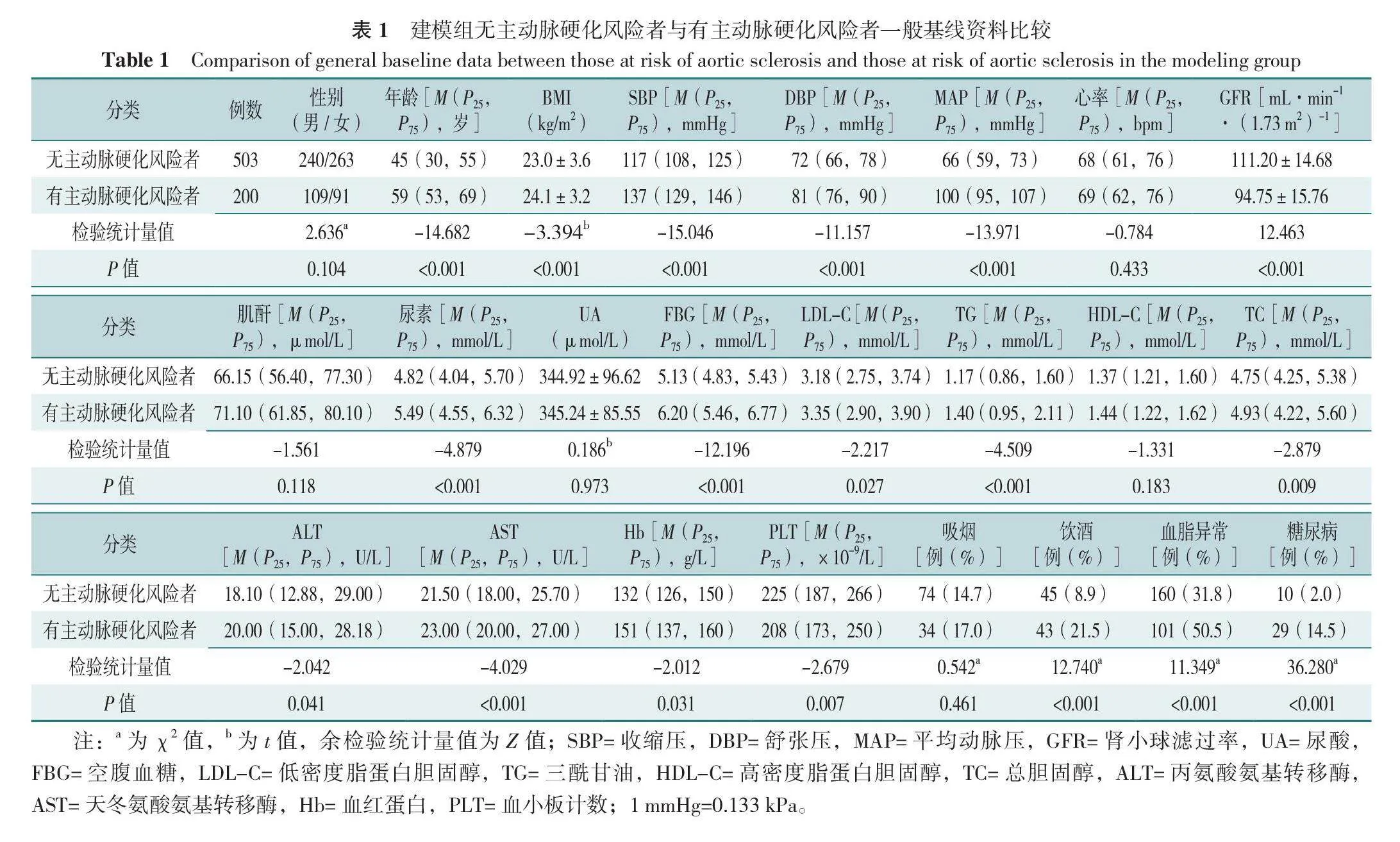
建模组共703名受试者,其中男349名,女354名;年龄18~91岁,中位年龄51(30,61)岁。有主动脉硬化风险者年龄、BMI、SBP、DBP、MAP、尿素、FBG、LDL-C、TG、TC、ALT、AST、Hb、饮酒、血脂异常、糖尿病比例高于无主动脉硬化风险者,GFR、PLT低于无主动脉硬化风险者,差异有统计学意义(P<0.05);两组性别、心率、肌酐、UA、HDL-C、吸烟比例比较,差异无统计学意义(P>0.05),见表1。
2.2 主动脉硬化影响因素的单因素及多因素Logistic回归分析
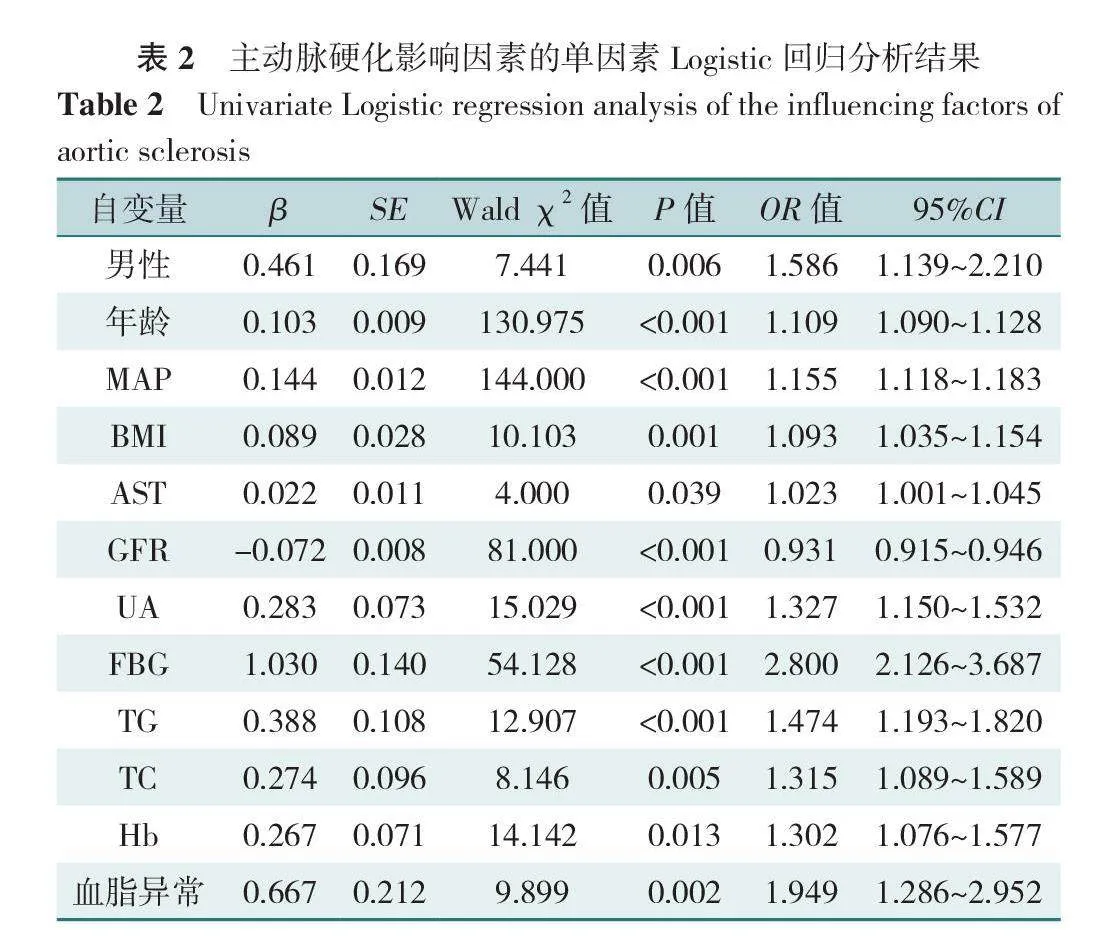
以是否发生主动脉硬化(赋值:否=0,是=1)为因变量,以性别(赋值:女=0,男=1)、血脂异常(赋值:否=0,是=1)、年龄、MAP、BMI、AST、GFR、UA、FBG、TG、TC、Hb(赋值均为实测值)为自变量进行单因素Logistic回归分析,结果显示性别、年龄、MAP、BMI、AST、GFR、UA、FBG、TG、TC、Hb、血脂异常为主动脉硬化的影响因素(P<0.05)。进一步将单因素分析差异有统计学意义的结果纳入多因素Logistic回归分析(赋值同上),结果显示年龄(OR=1.112,95%CI=1.082~1.143)、MAP(OR=1.146,95%CI=1.107~1.188)、Hb(OR=1.026,95%CI=1.004~1.049)和FBG(OR=1.353,95%CI=1.076~1.701)是主动脉硬化的独立影响因素(P<0.05),见表2、3。
2.3 主动脉硬化预测模型的性能评价
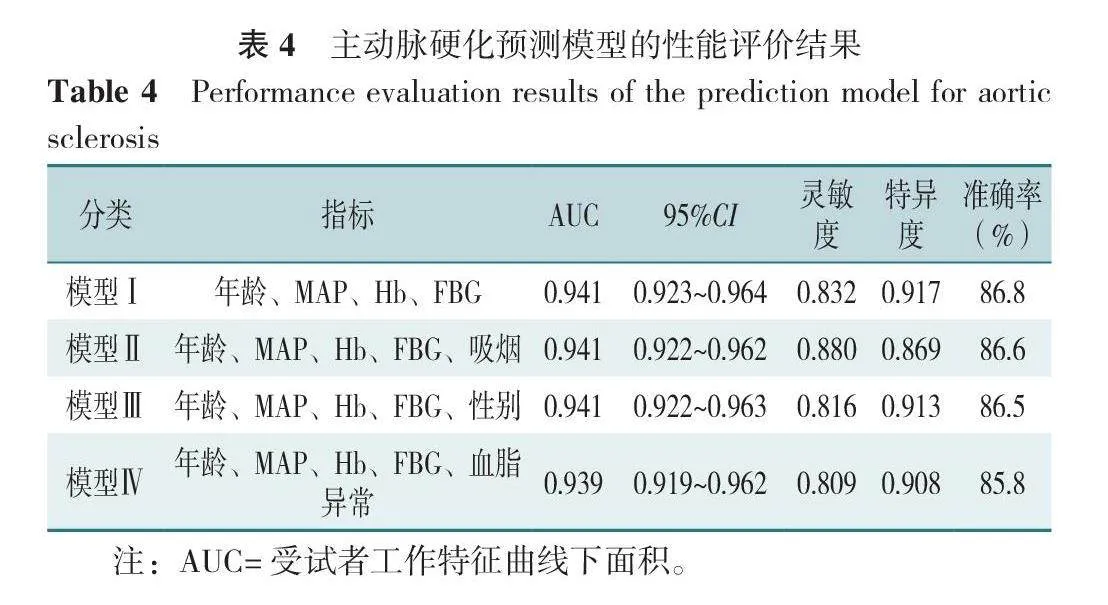
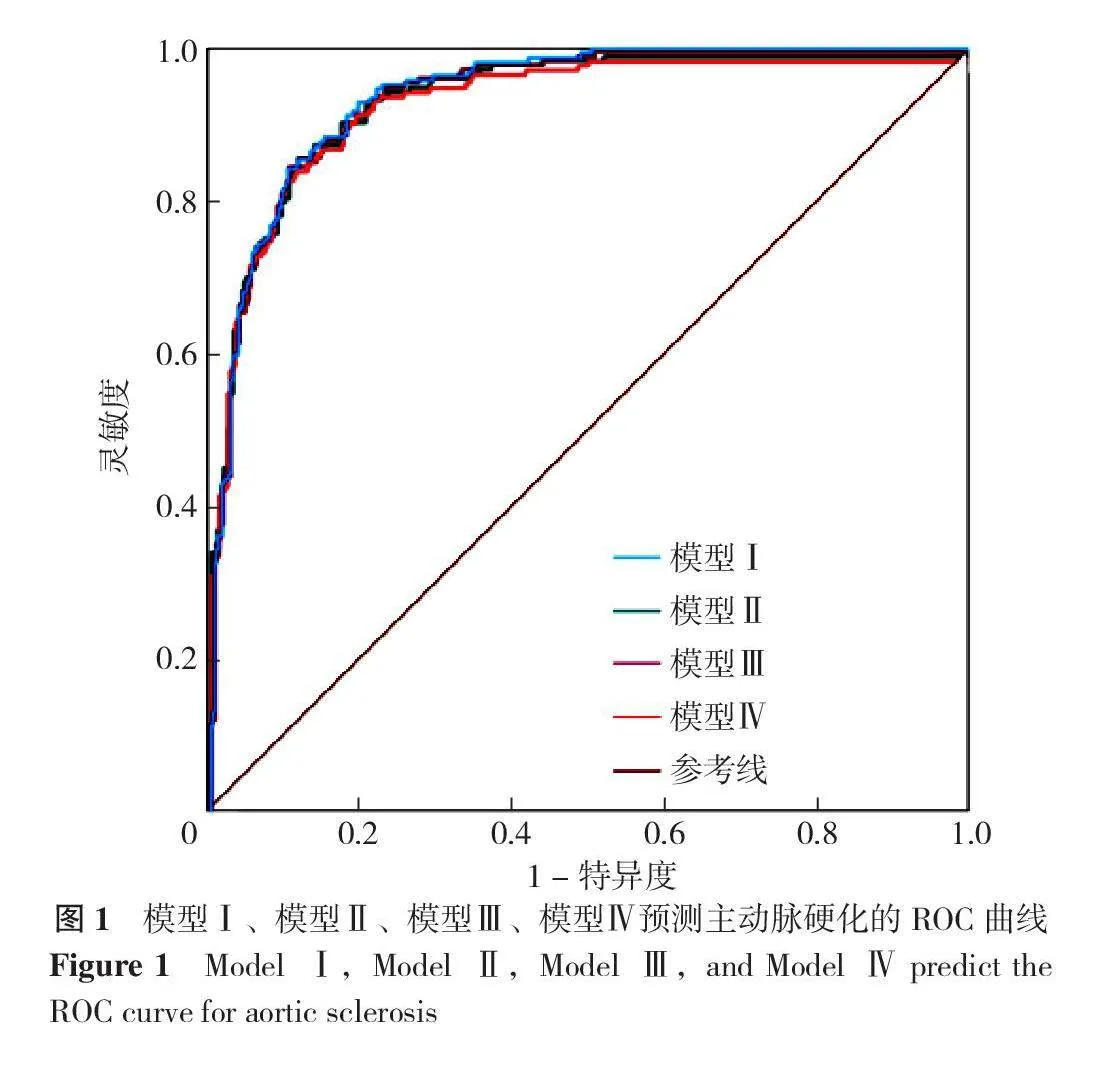
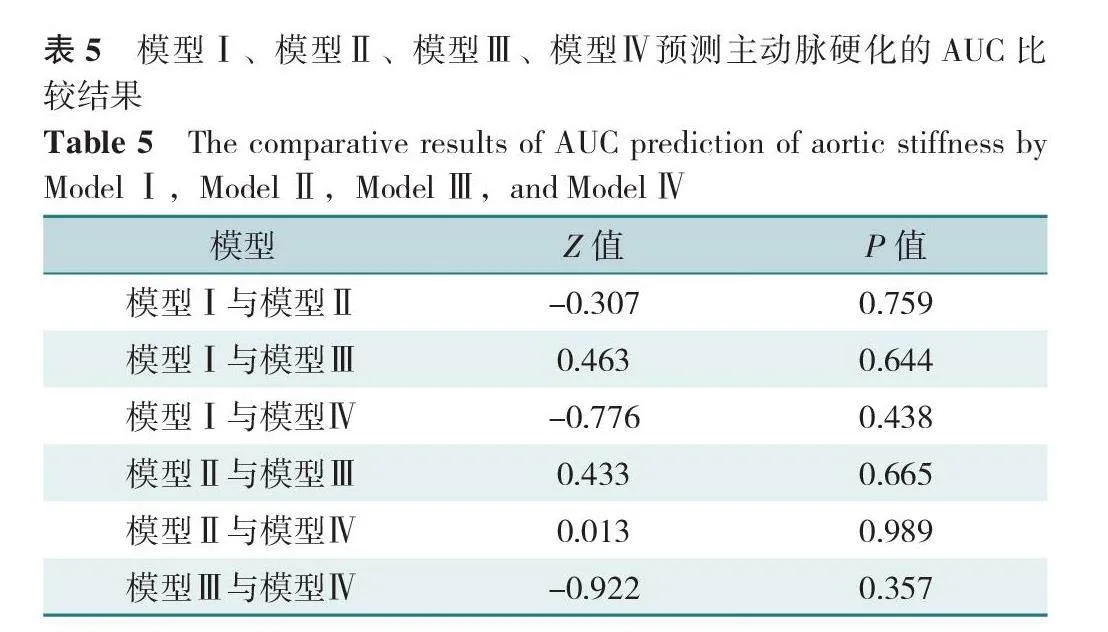
纳入多因素Logistic回归分析结果差异有统计学意义的指标(年龄、MAP、Hb、FBG)构建预测主动脉硬化的预测模型Ⅰ,同时根据临床经验分别纳入吸烟、性别、血脂异常构建模型Ⅱ、模型Ⅲ、模型Ⅳ,绘制模型Ⅰ~模型Ⅳ的ROC曲线,模型Ⅰ~模型Ⅳ的AUC分别为0.941(95%CI=0.923~0.964,P<0.05)、0.941(95%CI=0.922~0.962,P<0.05)、0.941(95%CI=0.922~0.963,P<0.05)、0.939(95%CI=0.919~0.962,P<0.05);Delong检验结果示,模型Ⅰ、模型Ⅱ、模型Ⅲ、模型Ⅳ的AUC比较,差异无统计学意义(P>0.05),见图1、表4、表5。
2.4 列线图模型的构建
根据多因素Logistic回归分析结果,以年龄、MAP、FBG、Hb为预测因子构建列线图模型,见图2。通过将相应预测因子的得分相加得出总分,对应的概率即为主动脉硬化发生的概率。
2.5 模型的内部验证和外部验证
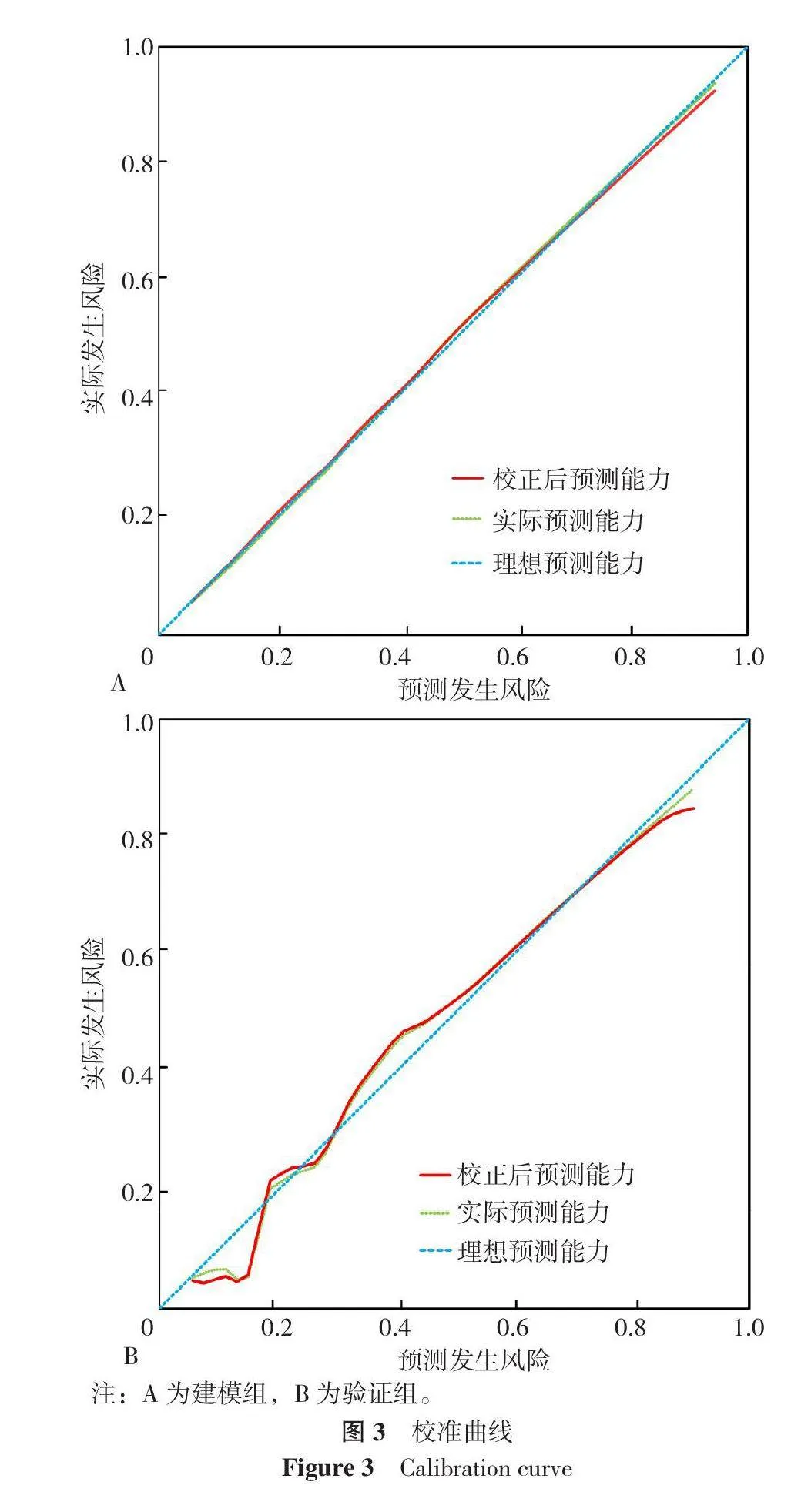
内部验证:采用Bootstrap法进行内部验证,对建模组进行1 000次重复抽样后,计算得到的C-index为0.939,表明模型具有良好的区分度,准确率为86.8%。Hosmer-Lemeshow检验结果为χ2=14.500(P=0.070),预测模型曲线和参考线重合度较好,提示模型的校准度良好。绘制ROC曲线,AUC为0.941(95%CI=0.920~0.962),灵敏度为0.832,特异度为0.917,约登指数为0.267,见图3A。
外部验证:验证组模型中C-index为0.922,校准图显示实际曲线与理想曲线吻合良好。AUC为0.961(95%CI=0.914~1.000),灵敏度为0.872,特异度为0.964,预测准确率为93.9%。Hosmer-Lemeshow检验χ2=1.547(P=0.992),见图3B。
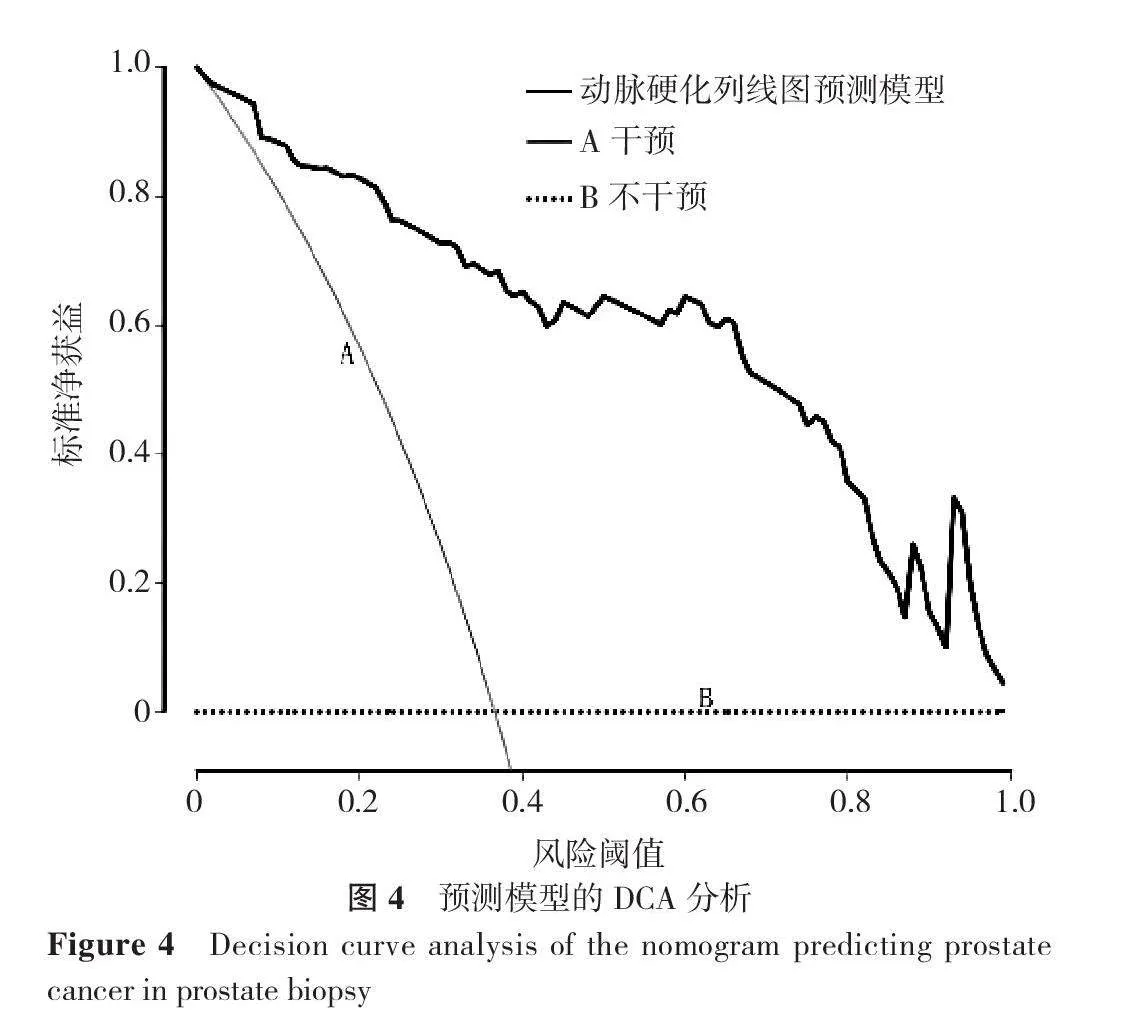
DCA曲线中A线假设对所有受试者采取主动脉硬化风险干预方案,净获益是斜率为负值的反斜线;B线假设受试者均不采取干预方案,净获益为0。使用主动脉硬化早期筛查模型可以使受试者在临床中获益,见图4。
3 讨论
3.1 研究结果及意义
本研究通过综合分析建模组703名受试者的数据,揭示了主动脉硬化与多种生理指标之间的显著关联,为心血管疾病的早期识别和预防提供了重要的科学依据。研究结果表明,主动脉硬化组在年龄、BMI、心率、SBP、DBP、MAP、尿素、FBG、TG、TC、AST、PLT、饮酒比例、血脂异常比例和糖尿病比例等方面均显著高于正常组,而GFR水平显著低于正常组。这些发现不仅加深了对主动脉硬化病理机制的认识,而且为主动脉硬化的临床诊断提供了新的生物标志物。此外,回归分析结果显示,年龄、MAP、Hb和FBG是主动脉硬化的独立预测因子。基于上述危险因素,构建的早期主动脉硬化风险筛查模型能够精确地识别早期血管功能异常的个体,为心血管疾病的预防和管理提供了一种简单高效的评估工具,有望在临床实践中发挥重要作用。
3.2 主动脉硬化相关危险因素分析
Logistic回归分析显示年龄增长、MAP升高是主动脉硬化的独立危险因素,年龄的增长与主动脉硬化的风险呈正相关,会导致血管壁逐渐失去弹性,发生内膜的变化以及脂质斑块的积累[13]。因此,随着年龄的增加,个体主动脉硬化风险逐渐增加。高血压在主动脉硬化过程中同样发挥着关键作用,高血压会增加血管壁的压力,导致内膜受损,从而使动脉壁对脂蛋白的通透性增加,加快胆固醇斑块的形成[14]。目前高血压的定义是基于SBP和DBP的水平,研究指出[15]亚洲人高血压长期卒中风险应通过SBP和DBP一起评估,或通过MAP进行评估。刘倩等[16]发现在非高血压人群中,基线MAP和10年随访期间MAP升高是影响动脉硬化进展的重要因素。BENETOS等[17]发现MAP越高,动脉的扩张性越低(r=-0.36,P<0.01)。
本研究发现,Hb升高是主动脉硬化独立危险因素,与ZHANG等[18]和LIANG等[19]研究结果一致。Hb主要通过影响血液黏度,以及外周小动脉的口径影响外周血管阻力[20]。Hb水平的升高与脉搏波速度的增加可能由以下机制解释:(1)Hb水平的升高与血压升高有关,而持续升高的血压会加速动脉粥样硬化。(2)Hb会导致胰岛素抵抗,胰岛素抵抗与动脉硬化有关[21]。(3)血红素氧合酶1(HO-1)是降解Hb的诱导限速酶,具有血管舒张作用。当体内Hb过多时,大量的游离Hb释放到血液中,导致氧化应激,激活HO-1的降解作用。当HO-1减少时,无法在高血压中调节血管内皮生长因子,减轻氧化应激和炎症[22-23]。
FBG是主动脉硬化重要危险因素之一,是一种廉价且方便的糖代谢测量方法,高血糖与冠状动脉疾病的发生和严重程度密切相关。研究表明高血糖可诱导心血管细胞中线粒体活性氧的过量产生,过量的活性氧可通过激活多种途径促进动脉粥样硬化[24],此外,高血糖可能通过诱导内皮细胞功能障碍、减少一氧化氮的生物可用性、促进血管收缩或促使凝血状态,并增强核因子κB的表达,从而加速动脉粥样硬化的发展[25]。一项为期5年的关于中国社区人群的前瞻性研究中发现,FBG升高是cfPWV增加的独立影响因素[26],本研究结果与之一致。
吸烟和血脂异常被广泛认为是心血管疾病的危险因素。研究发现香烟中的尼古丁不仅会通过刺激活性氧的产生激活NOD样受体热蛋白结构域相关蛋白3炎症体,导致内皮细胞焦亡,同时也会引起脂肪组织异常,从而加速动脉粥样硬化的进展[27-28]。血脂异常是指血浆TC和/或TG水平增高,或是HDL-C水平降低。这种血脂水平的失衡会导致血液中的脂质更易沉积于血管壁内膜,形成粥样斑块[29]。吸烟和血脂异常会导致动脉硬化似乎是合理的,但CECELJA等[30]开展了一项元分析,纳入了65项研究,结果显示仅有个别研究报道了吸烟、TC、LDL-C、HDL-C与cfPWV之间存在显著独立相关性。本研究也发现,在考虑了其他潜在的混杂因素后,吸烟和血脂异常并不是主动脉硬化的独立危险因素,该发现与VLACHOPOULOS等[31]的研究结果一致。可能是因为cfPWV是评价血管早期功能的指标,在动脉粥样硬化的早期阶段,这些风险因素可能对动脉壁的硬度影响不大。但随着病情进展,特别是出现钙化斑块时,可能会增加动脉僵硬度。
3.3 早期主动脉硬化风险筛查模型的建立
列线图建模方法是一种强大且可解释性较强的统计工具,适用于二分类问题,能够预测某一临床事件发生的概率[32]。在模型构建过程中,通过Logistic回归分析筛选出对主动脉硬化风险具有显著影响的因素,包括年龄、MAP、Hb和FBG。通过给予这些因素相应的评分,计算影响因素的总分,获得相应的风险预测值。该模型经验证能够有效筛查早期血管功能异常人群。外部验证C-index为0.922,AUC>0.9,提示该模型区分度较好[33]。校准图显示两曲线重合度较好,Hosmer-Lemeshow检验表明预测结果与观察结果间存在较好的一致性。此外,外部验证的准确率为93.9%,进一步表明预测结果与观察结果的准确度较高。在模型性能评价方面,在仅考虑年龄、MAP、Hb和FBG 4个指标时,模型的AUC、特异度和准确率均优于其他考虑了血脂异常、吸烟和性别的模型,因此血脂异常、吸烟和性别未被纳入最终模型。
4 小结
本研究成功构建了一个以年龄、MAP、Hb和FBG为预测因子的早期主动脉硬化风险筛查模型,该模型在识别早期血管异常人群方面表现出高效性和准确性,为社区居民提供了一种便捷且高效的筛查工具。然而,本研究采用的是横断面研究设计,无法推断出变量间的因果关系或时间顺序。此外,本研究未考虑其他潜在风险因素,例如遗传倾向、环境暴露或个人生活方式等,这些均可能对主动脉硬化的发展产生显著影响。鉴于主动脉硬化是一个动态发展的病理过程,未来的研究应当通过长期随访的方式,纳入遗传、环境和生活方式等多维度因素,以实现对主动脉硬化风险更全面的评估。
作者贡献:周镇森进行研究设计、数据分析、撰写论文;周镇森、黄岩、张晓雨负责数据收集;程思为负责数据校对和录入;张小玉、孙婷、杨先军、谢晖负责文章审校;马祖长负责最终版本修订,对论文整体负责。
本文无利益冲突。
参考文献
中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2022概要[J]. 中国循环杂志,2023,38(6):583-612. DOI:10.3969/j.issn.1000-3614.2023.06.001.
VAN BORTEL L M,LAURENT S,BOUTOUYRIE P,et al. Expert consensus document on the measurement of aortic stiffness in daily practice using carotid-femoral pulse wave velocity[J]. J Hypertens,2012,30(3):445-448. DOI:10.1097/HJH.0b013e32834fa8b0.
BENETOS A,WAEBER B,IZZO J,et al. Influence of age,risk factors,and cardiovascular and renal disease on arterial stiffness:clinical applications[J]. Am J Hypertens,2002,15(12):1101-1108. DOI:10.1016/s0895-7061(02)03029-7.
LIANG Y L,TEEDE H,KOTSOPOULOS D,et al. Non-invasive measurements of arterial structure and function:repeatability,interrelationships and trial sample size[J]. Clin Sci,1998,95(6):669-679. DOI:10.1042/cs0950669.
LAURENT S,COCKCROFT J,VAN BORTEL L,et al. Expert consensus document on arterial stiffness:methodological issues and clinical applications[J]. Eur Heart J,2006,27(21):2588-2605. DOI:10.1093/eurheartj/ehl254.
KIM E D,BALLEW S H,TANAKA H,et al. Short-term prognostic impact of arterial stiffness in older ozecR3yqxfZCqOWsQmrnpkdT59sRzO8JVtWETL3egN8=adults without prevalent cardiovascular disease[J]. Hypertension,2019,74(6):1373-1382. DOI:10.1161/HYPERTENSIONAHA.119.13496.
COURVOISIER D S,COMBESCURE C,AGORITSAS T,et al. Performance of logistic regression modeling:beyond the number of events per variable,the role of data structure[J]. J Clin Epidemiol,2011,64(9):993-1000. DOI:10.1016/j.jclinepi.2010.11.012.
TAKUMA Y,SHOTA I,MIYATAKE H,et al. Nomograms to predict the disease-free survival and overall survival after radiofrequency ablation for hepatocellular carcinoma[J]. Intern Med,2018,57(4):457-468. DOI:10.2169/internalmedicine.9064-17.
MCCLAVE A K,MCKNIGHT-EILY L R,DAVIS S P,et al. Smoking characteristics of adults with selected lifetime mental illnesses:results from the 2007 National Health Interview Survey[J]. Am J Public Health,2010,100(12):2464-2472. DOI:10.2105/AJPH.2009.188136.
徐文超,覃玉,苏健,等. 江苏省≥35岁社区居民饮酒与肥胖对糖尿病患病交互作用[J]. 中国公共卫生,2020,36(12):1776-1779. DOI:10.11847/zgggws1123881.
王增武,刘静,李建军,等. 中国血脂管理指南(2023年)[J]. 中国循环杂志,2023,38(3):237-271.
Reference Values For Arterial Stiffness' Collaboration. Determinants of pulse wave velocity in healthy people and in the presence of cardiovascular risk factors:'establishing normal and reference values'[J]. Eur Heart J,2010,31(19):2338-2350. DOI:10.1093/eurheartj/ehq165.
CECELJA M,CHOWIENCZYK P. Role of arterial stiffness in cardiovascular disease[J]. JRSM Cardiovasc Dis,2012,1(4):cvd.2012.012016. DOI:10.1258/cvd.2012.012016.
RAFIEIAN-KOPAEI M,SETORKI M,DOUDI M,et al. Atherosclerosis:process,indicators,risk factors and new hopes[J]. Int J Prev Med,2014,5(8):927-946.
MIURA K,SOYAMA Y,MORIKAWA Y,et al. Comparison of four blood pressure indexes for the prediction of 10-year stroke risk in middle-aged and older Asians[J]. Hypertension,2004,
44(5):715-720. DOI:10.1161/01.HYP.0000145108.23948.7b.
刘倩,韩旭,马一涵,等. 非高血压人群平均动脉压对动脉硬化进展的影响[J]. 中华高血压杂志,2021,29(8):733-739. DOI:10.16439/j.issn.1673-7245.2021.08.008.
BENETOS A,LAURENT S,HOEKS A P,et al. Arterial alterations with aging and high blood pressure. A noninvasive study of carotid and femoral arteries[J]. Arterioscler Thromb,1993,13(1):90-97. DOI:10.1161/01.atv.13.1.90.
ZHANG Z Z,WANG P,KONG X L,et al. Association of hemoglobin with arterial stiffness evaluated by carotid-femoral pulse wave velocity among Chinese adults[J]. Chronic Dis Transl Med,2019,5(2):122-128. DOI:10.1016/j.cdtm.2018.06.001.
LIANG J,ZHOU N,TENG F,et al. Hemoglobin A1c levels and aortic arterial stiffness:the Cardiometabolic Risk in Chinese(CRC)study[J]. PLoS One,2012,7(8):e38485. DOI:10.1371/journal.pone.0038485.
FOSSUM E,HØIEGGEN A,MOAN A,et al. Whole blood viscosity,blood pressure and cardiovascular risk factors in healthy blood donors[J]. Blood Press,1997,6(3):161-165. DOI:10.3109/08037059709061932.
BARBIERI M,RAGNO E,BENVENUTI E,et al. New aspects of the insulin resistance syndrome:impact on haematological parameters[J]. Diabetologia,2001,44(10):1232-1237. DOI:10.1007/s001250100634.
CHEN H M,HUA Q,HOU H X. Association of hemoglobin with ambulatory arterial stiffness index in untreated essential hypertensive patients without anemia[J]. Intern Med,2011,50(22):2759-2765. DOI:10.2169/internalmedicine.50.5832.
ANGERMAYR B,MEJIAS M,GRACIA-SANCHO J,et al. Heme oxygenase attenuates oxidative stress and inflammation,and increases VEGF expression in portal hypertensive rats[J]. J Hepatol,2006,44(6):1033-1039. DOI:10.1016/j.jhep.2005.09.021.
SHAH M S,BROWNLEE M. Molecular and cellular mechanisms of cardiovascular disorders in diabetes[J]. Circ Res,2016,
118(11):1808-1829. DOI:10.1161/CIRCRESAHA.116.306923.
KING R J,GRANT P J. Diabetes and cardiovascular disease:pathophysiology of a life-threatening epidemic[J]. Herz,2016,41(3):184-192. DOI:10.1007/s00059-016-4414-8.
FU S H,CHEN W J,LUO L M,et al. Roles of fasting and postprandial blood glucose in the effect of type 2 diabetes on central arterial stiffness:a 5-year prospective community-based analysis[J]. Diabetol Metab Syndr,2017,9:33. DOI:10.1186/s13098-017-0231-3.
WU X X,ZHANG H Y,QI W,et al. Nicotine promotes atherosclerosis via ROS-NLRP3-mediated endothelial cell pyroptosis[J]. Cell Death Dis,2018,9(2):171. DOI:10.1038/s41419-017-0257-3.
WANG Z Y,WANG D,WANG Y. Cigarette smoking and adipose tissue:the emerging role in progression of atherosclerosis[J]. Mediators Inflamm,2017,2017:3102737. DOI:10.1155/2017/3102737.
李建军. 血脂异常与动脉粥样硬化关系的现代观念[J]. 中国循环杂志,2022,37(3):212-214. DOI:10.3969/j.issn.1000-3614.2022.03.002.
CECELJA M,CHOWIENCZYK P. Dissociation of aortic pulse wave velocity with risk factors for cardiovascular disease other than hypertension:a systematic review[J]. Hypertension,2009,
54(6):1328-1336. DOI:10.1161/HYPERTENSIONAHA.
109.137653.
VLACHOPOULOS C,XAPLANTERIS P,ABOYANS V,et al. The role of vascular biomarkers for primary and secondary prevention. A position paper from the European Society of Cardiology Working Group on peripheral circulation:endorsed by the Association for Research into Arterial Structure and Physiology(ARTERY)Society[J]. Atherosclerosis,2015,241(2):507-532. DOI:10.1016/j.atherosclerosis.2015.05.007.
陶立元,张华,赵一鸣. 列线图的制作要点及其应用[J]. 中华儿科杂志,2017,55(5):323. DOI:10.3760/cma.j.issn.0578-1310.2017.05.002.
王俊峰,章仲恒,周支瑞,等. 临床预测模型:模型的验证[J]. 中国循证心血管医学杂志,2019,11(2):141-144. DOI:10.3969/j.issn.1674-4055.2019.02.04.
(收稿日期:2024-02-07;修回日期:2024-06-20)
(本文编辑:邹琳)
