非肥胖2型糖尿病患者肌肉量减少危险因素的列线图预测模型研究
2024-08-07张冰青胡馨云欧阳煜钦向心月汤文娟冯文焕



【摘要】 背景 肌肉量减少能增加2型糖尿病(T2DM)患者高血糖及肌少症发生风险,中国成人T2DM以非肥胖者为主,这些患者较肥胖者更容易伴发肌肉量减少。目的 建立个体化预测非肥胖T2DM患者肌肉量减少危险因素列线图预测模型。方法 回顾性选取2018年1月—2023年9月南京大学医学院附属鼓楼医院内分泌科收治的非肥胖T2DM患者905例为研究对象,以简单随机抽样法按7∶3比例分为训练集(633例)和验证集(272例),收集两组患者的一般资料及临床指标并进行比较。根据多因素Logistic回归分析确定训练集肌肉量减少风险影响因素并构建列线图预测模型,采用受试者工作特征(ROC)曲线、Hosmer-Lemeshow校准曲线及临床决策曲线(DCA)评估列线图预测模型的预测价值和临床实用性。结果 非肥胖T2DM患者肌肉量减少的患病率为42.3%(383/905)。训练集和验证集患者各项临床指标比较,差异均无统计学意义(P>0.05)。多因素Logistic回归分析结果显示,增龄(OR=1.039,95%CI=1.010~1.070,P=0.009)、男性(OR=3.425,95%CI=2.133~5.499,P<0.001)、BMI<23.5 kg/m2(OR=19.678,95%CI=11.319~34.210,P<0.001)、糖化血红蛋白升高(OR=1.196,95%CI=1.081~1.323,P<0.001)、内脏脂肪面积增加(OR=1.021,95%CI=1.010~1.032,P<0.001)是非肥胖T2DM患者肌肉量减少的独立危险因素。列线图预测模型预测训练集和验证集患者肌肉量减少发生风险的ROC曲线下面积(AUC)分别为0.825(95%CI=0.793~0.856,P<0.001)和0.806(95%CI=0.753~0.859,P<0.001)。Hosmer-Lemeshow拟合优度检验结果显示,拟合度较好(训练集:χ2=11.822,P=0.159;验证集:χ2=8.189,P=0.415)。Bootstrap法绘制模型校准图显示校准曲线与标准曲线贴合良好。DCA曲线显示当患者阈值概率为0.06~0.94时,使用列线图预测模型预测T2DM患者发生肌肉量减少的发生风险更有益。结论 增龄、男性、BMI<23.5 kg/m2、糖化血红蛋白升高、内脏脂肪面积增加是非肥胖T2DM患者肌肉量减少的独立危险因素。本研究构建的列线图预测模型可个体化预测非肥胖T2DM患者伴发肌肉量减少风险,便于早期识别高危人群,利于制订个体化干预措施。
【关键词】 糖尿病,2型;非肥胖;肌肉量减少;列线图;危险因素
【中图分类号】 R 587.1 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2024.0055
Study on Nomogram Prediction Model for Risk Factors of Muscle Mass Loss in Non-obese Patients with Type 2 Diabetes
ZHANG Bingqing1,HU Xinyun1,OUYANG Yuqin1,XIANG Xinyue1,TANG Wenjuan2,FENG Wenhuan1*
1.Endocrine and Metabolic Disease Medical Center,Affiliated Drum Tower Hospital,Nanjing University of Chinese Medicine,Nanjing 210008,China
2.Department of Endocrinology,Nanjing Drum Tower Hospital,Affiliated Hospital of Medical School,Nanjing University,Nanjing 210008,China
*Corresponding author:FENG Wenhuan,Chief physician/Doctoral supervisor;E-mail:fengwh501@163.com
【Abstract】 Background Muscle mass loss increases the risk of hyperglycaemia and sarcopenia in patients with type 2 diabetes mellitus(T2DM),and Chinese adults with T2DM are predominantly non-obese,who are more likely to be associated with muscle mass loss than the obese. Objective To establish an individualized Nomogram prediction model for the risk factors of muscle mass loss in non-obese patients with T2DM. Methods A retrospective study was conducted to select 905 non-obese patients with T2DM admitted to the Department of Endocrinology,Nanjing Drum Tower Hospital,Affiliated Hospital of Medical School,Nanjing University from January 2018 to September 2023. The patients were divided into a training set(n=633)and a validation set(n=272)using simple random sampling at a ratio of 7∶3,and the general data and clinical indexes of the two groups of patients were collected and compared. Multivariate Logistic regression analysis was performed to determine risk factors for muscle mass loss in the training set and a Nomogram prediction model was constructed. The predictive value and clinical utility of the Nomogram prediction model were evaluated using receiver operating characteristic(ROC)curve,Hosmer-Lemeshow calibration curve,and decision curve analysis(DCA),respectively. Results The prevalence of muscle mass loss in non-obese patients with T2DM was 42.3%(383/905). Comparison of the clinical indicators of the patients in the training and validation sets showed no statistically significant differences(P>0.05). Multivariate Logistic regression analysis showed that age(OR=1.039,95%CI=1.010-1.070,P=0.009),male(OR=3.425,95%CI=2.133-5.499,P<0.001),BMI<23.5 kg/m2
(OR=19.678,95%CI=11.319-34.210,P<0.001),elevated HbA1c(OR=1.196,95%CI=1.081-1.323,P<0.001),increased visceral fat area(OR=1.021,95%CI=1.010-1.032,P<0.001)were independent risk factors for muscle mass loss in non-obese patients with T2DM. The area under curve(AUC)of the ROC for the Nomogram prediction model to predict the risk of muscle mass loss occurring in patients in the training and validation sets was 0.825(95%CI=0.793-0.856,P<0.001)and 0.806(95%CI=0.753-0.859,P<0.001),respectively. The Hosmer-Lemeshow test showed that the model had a good fit(training set:χ2=11.822,P=0.159;validation set:χ2=8.189,P=0.415). Bootstrap method of plotting the calibration of the model showed that the calibration curves fitted well to the standard curves. The DCA curves showed that it was more beneficial to use the Nomogram prediction model to predict the incidence risk of muscle mass loss in patients with T2DM when the threshold probability of the patient was 0.06 to 0.94. Conclusion Age,male,BMI<23.5 kg/m2,elevated HbA1c,and increased visceral fat area are independent risk factors for muscle mass loss in non-obese patients with T2DM. The Nomogram prediction model established in this study can individually predict the risk of muscle mass loss in non-obese patients with T2DM,which facilitates the early identification of high-risk groups and the development of individualised interventions.
【Key words】 Diabetes mellitus,type 2;Non-obesity;Muscle mass loss;Nomogram;Risk factors
骨骼肌质量在维持人体糖代谢及功能中发挥重要作用,机体摄取的葡萄糖80%由骨骼肌合成肌糖原或氧化分解维持糖代谢平衡[1]。肌肉量减少可引发胰岛素抵抗,影响葡萄糖稳态平衡,同时可致骨骼肌功能减退,促发肌少症,增加跌倒、骨折风险,造成患者生活能力减退甚至丧失[2]。2型糖尿病(type 2 diabetes mellitus,T2DM)肌肉量减少者面临高血糖及机体机能减退的双重风险[3],明确其发生风险,有利于早期干预。
既往研究揭示肌肉量减少与增龄、高血糖、低BMI、营养不良、慢性炎症如C反应蛋白等炎性标志物的升高、体脂增加及内分泌疾病等相关[4-6]。人体肌肉量高峰在30~40岁,40岁后开始下降,70岁前以每10年8%的速率下降,70岁后增至15%~25%,T2DM者下降速率更高[7-8]。中国成人T2DM患者非肥胖者占比76%,非肥胖者较肥胖者肌肉量减少风险更高[9],个体化预测40~70岁非肥胖T2DM患者肌肉量减少风险利于早期精准干预。双能X线骨密度仪(dual energy X-ray absorptiometry,DXA)检测的四肢骨骼肌质量指数(appendicular skeletal muscle mass index,ASMI)是评估肌肉量减少的金标准[7],但DXA检测价格昂贵,需专业技术人员操作,存在辐射风险,临床应用受到限制[10]。人体成分分析仪轻便,操作简便,检测价格低且无辐射风险,临床应用广泛[11]。
列线图可将预测疾病模型的复杂回归方程简单化、可视化,临床应用价值高[12]。目前国内尚缺少在非肥胖T2DM这一肌肉量减少易患人群中相对准确简便的预测模型,本研究分析肌肉量减少相关临床指标,并建立列线图,为临床早期甄别40~70岁非肥胖T2DM患者肌肉量减少高风险人群提供定量预测工具,为后续有效的干预提供临床指导。
1 对象与方法
1.1 研究对象
回顾性选取2018年1月—2023年9月在南京大学医学院附属鼓楼医院内分泌科收治的905例T2DM患者为研究对象。纳入标准:(1)年龄40~70岁;(2)BMI<28 kg/m2;(3)接受DXA(Wisconsin公司GE Healthcare Technologies)及人体成分分析仪(Inbody720,韩国Biospace)检查;(4)符合T2DM诊断标准[13]。排除标准:(1)存在肢体活动障碍;(2)合并精神性疾病;(3)合并恶性肿瘤、感染性疾病;(4)合并甲状腺功能亢进症、甲状腺功能减退症、皮质醇增多症、皮质功能减退症、肢端肥大症、生长激素缺乏症及垂体前叶功能减退症等内分泌疾病;(5)具有皮质激素、减肥药、甲状腺激素、生长激素等药物使用史。本研究通过南京中医药大学附属鼓楼医院伦理委员会批准(批准号:2021-312-01)。
1.2 研究方法
1.2.1 一般资料及临床指标:记录患者的年龄、性别、BMI、收缩压(SBP)、舒张压(DBP)、糖尿病病程;生化指标:丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(GGT)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FBG)、糖化血红蛋白(HbA1c)、C反应蛋白(CRP)、尿酸(UA)、肌酐(Scr)、空腹胰岛素(FINS)、胰岛抵抗指数(HOMA-IR)、血清骨钙素(OCN)、血清Ⅰ型胶原羟末端肽β特殊序列(β-CTX)、血清总Ⅰ型胶原氨基末端肽(P1ND)、25羟维生素D3[25(OH)D3]、尿微量白蛋白/肌酐(UACR)、促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、生长激素(GH)、促肾上腺皮质激素(ACTH);营养指标:血清白蛋白(ALB)、血红蛋白(Hb);通过人体成分分析仪测定内脏脂肪面积。
1.2.2 肌肉量减少定义:采用DXA检测肌肉质量,根据ASMI评估肌肉质量,四肢肌肉质量为双侧上肢和双侧下肢肌肉质量的总和,即ASMI=四肢骨骼肌质量(kg)/身高2(m2),男性ASMI<7.0 kg/m2,女性<5.4 kg/m2诊断为肌肉量减少[14]。
1.2.3 分组及结局变量定义:采用简单随机抽样7∶3比例将患者分为训练集(n=633例)和验证集(n=272例),以训练集构建非肥胖T2DM患者肌肉量减少风险预测模型,再用验证集验证模型的预测效能,以是否发生肌肉量减少为结局指标。
1.3 统计学方法
采用SPSS 27.0统计软件和RStudio 4.1.3软件进行统计学分析。符合正态分布的计量资料以(x-±s)表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用非参数检验;计数资料以例(%)表示,组间比较采用χ2检验;其中,考虑到高BMI对糖代谢的不利影响,以BMI最佳截断值23.5 kg/m2将其转换为二分类变量。在训练集中通过单因素和多因素Logistic回归模型分析非肥胖T2DM患者肌肉量减少的危险因素并构建列线图预测模型,列线图各项指标对应分值相加的总分越高,肌肉量减少发生风险越大。应用受试者工作特征(ROC)曲线下面积(AUC)评价列线图对训练集和验证集患者肌肉量减少风险的预测价值;通过Hosmer-Lemeshow校准曲线检验拟合优度;以决策曲线分析(DCA)评估列线图临床实用性。P值为双侧,以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的临床特征
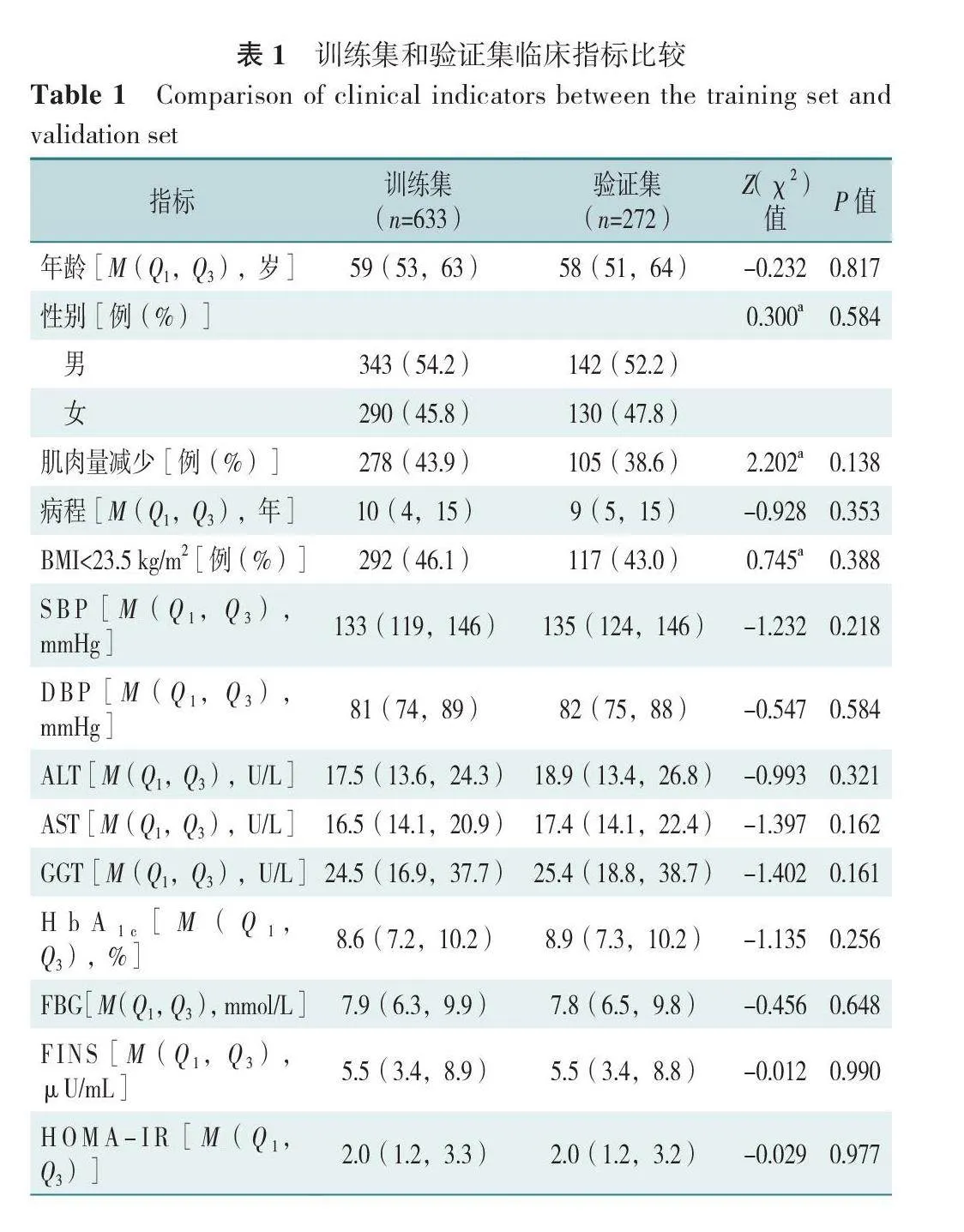
905例非肥胖T2DM患者肌肉量减少患病率为42.3%(383/905),其中训练集患者肌肉量减少278例(43.9%),验证集患者肌肉量减少105例(38.6%);两组患者肌肉量减少患病率比较,差异无统计学意义(P>0.05)。训练集和验证集患者各项临床指标比较,差异均无统计学意义(P>0.05),见表1。
2.2 训练集患者肌肉量减少危险因素的Logistic回归分析
以训练集患者是否发生肌肉量减少(赋值:否=0,是=1)为因变量,以各临床指标(分类变量性别赋值:女=0,男=1;BMI<23.5 kg/m2赋值:否=0,是=1;连续变量赋值均为实测值)为自变量进行单因素Logistic回归分析,结果显示,年龄、男性、BMI<23.5 kg/m2、SBP、HbA1c、ALB、皮质醇(8:00)及内脏脂肪面积是训练集患者肌肉量减少的影响因素(P<0.05)。将以上影响因素纳入多因素Logistic回归分析(赋值同上),采用向前排除法,结果显示,增龄、男性、BMI<23.5 kg/m2、HbA1c升高、内脏脂肪面积增加是非肥胖T2DM患者肌肉量减少的独立危险因素(P<0.05),见表2。
2.3 列线图预测模型的构建
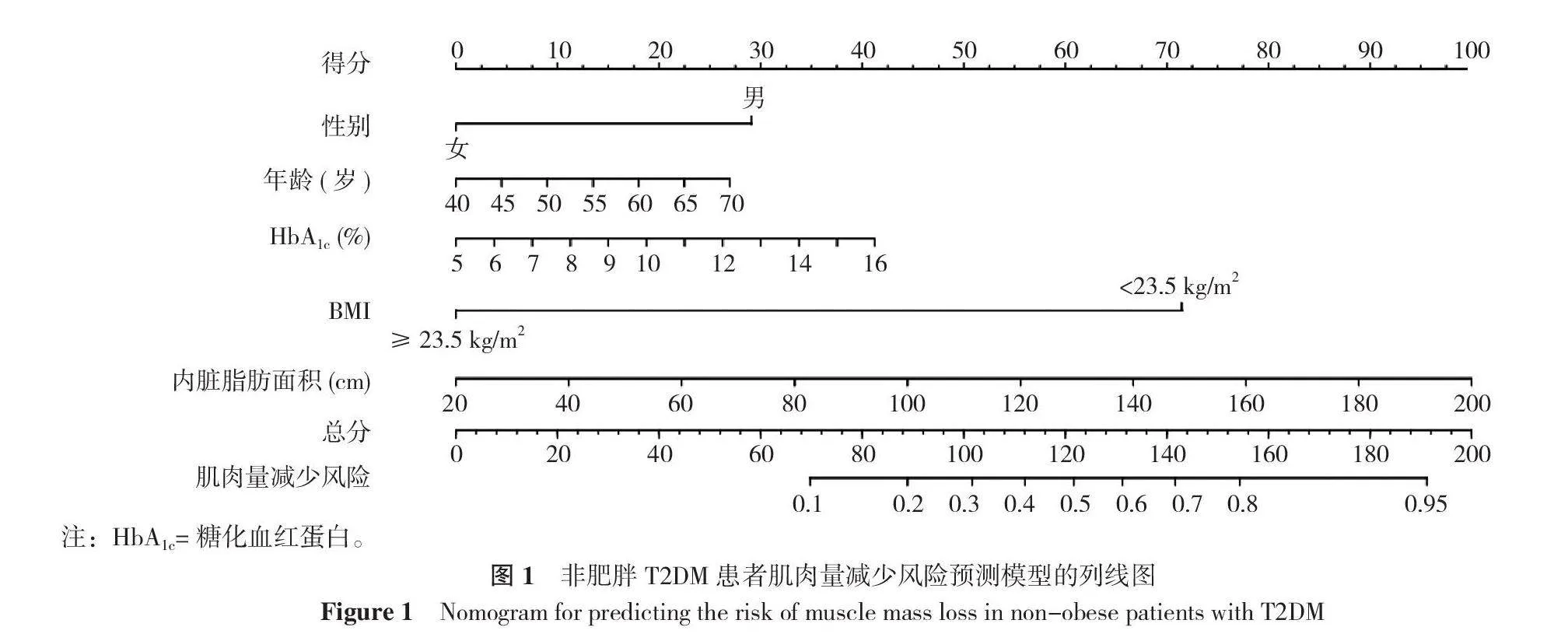
根据多因素Logistic回归模型分析结果构建回归方程Logit(P)=-7.815+1.260×性别+0.042×年龄+0.166×HbA1c+2.922×BMI+0.020×内脏脂肪面积,基于此建立非肥胖T2DM患者肌肉量减少风险的列线图预测模型,将各变量的分数相加得到总分。通过总分向下绘制一条垂直线可得出非肥胖T2DM患者肌肉量减少的风险预测概率,见图1。
2.4 列线图预测模型的验证
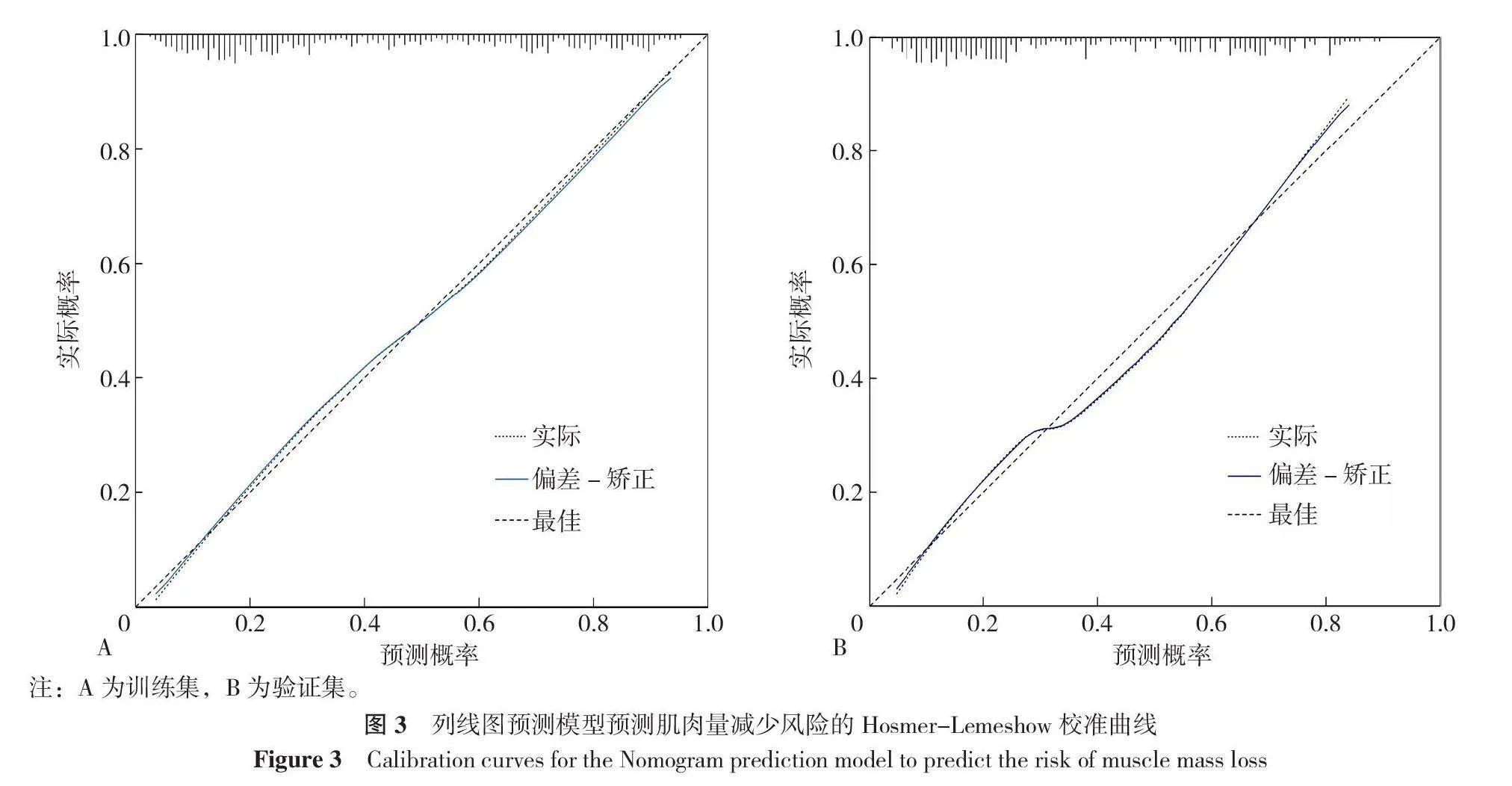
采用ROC曲线对非肥胖T2DM患者肌肉量减少的列线图预测模型进行区分度评估,结果显示,训练集AUC为0.825(95%CI=0.793~0.856,P<0.001),说明具有较好的识别作用(图2A);验证集AUC为0.806(95%CI=0.753~0.859,P<0.001),表现出良好的预测能力(图2B)。采用Bootstrap法1 000次自主抽样进行内部验证,绘制训练集与验证集的校准曲线,结果显示,该模型预测概率与实际概率一致性较好,同时,Hosmer-Lemeshow检验显示列线图预测模型拟合度较高(训练集:χ2=11.822,P=0.159;验证集:χ2=8.189,P=0.415),见图3A、3B。
2.5 列线图预测模型的临床应用
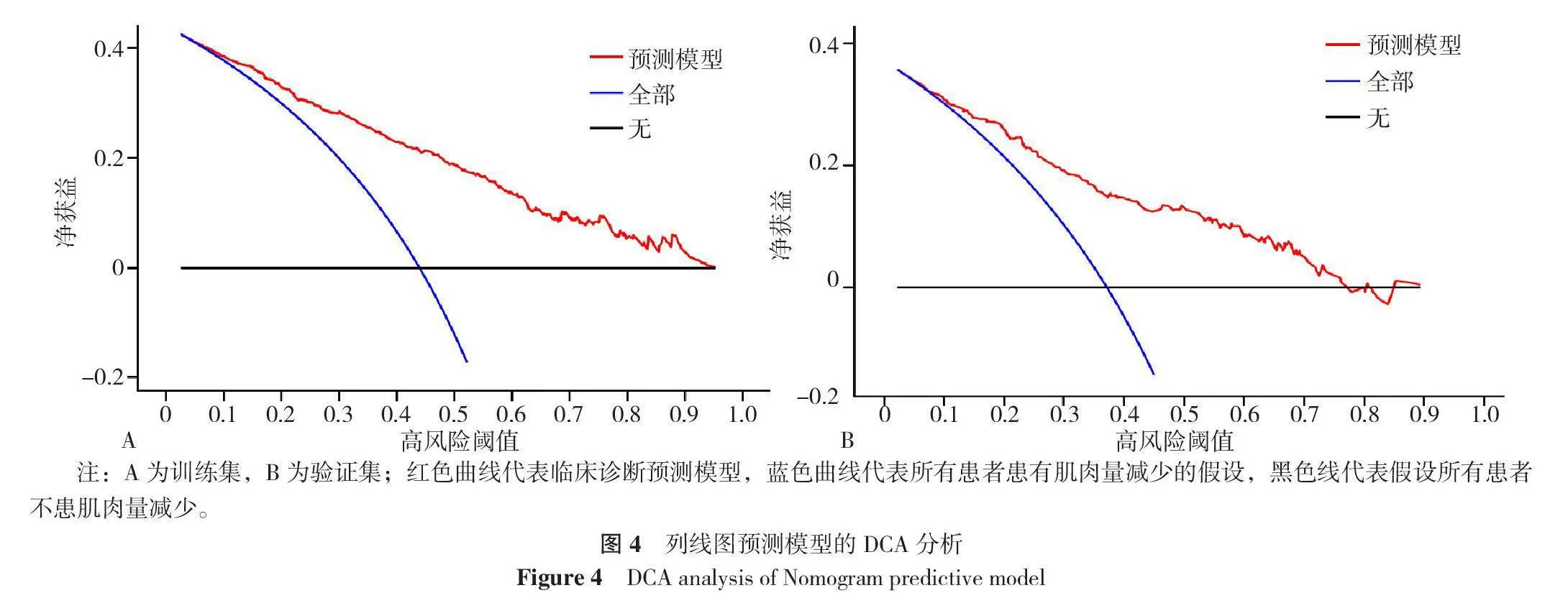
绘制DCA评估列线图预测模型的临床净收益,结果显示,在训练集中,当阈值概率为0.06~0.94时,该列线图预测模型对肌肉量减少风险预测更有利,见图4A、4B。
3 讨论
本研究构建了具有一定实用性的列线图,可个体化地预测40~70岁非肥胖T2DM患者肌肉量减少的发生风险,相关验证提示其有较高的预测准确性,获得途径简便,在门诊短时间内即可完成。本研究显示该人群肌肉量减少发生风险与年龄、HbA1c及内脏脂肪面积呈正相关,男性、BMI<23.5 kg/m2的患者更容易出现肌肉量减少。对于40~70岁非肥胖T2DM患者,将上述指标数值带入列线图,即可得出该患者的肌肉量减少风险评分,这种简单可视化图形提升了复杂回归方程风险预测模型的临床应用。
本研究结果显示,增龄是非肥胖T2DM患者肌肉量减少的独立危险因素,与既往研究一致[15-16]。衰老导致骨骼肌细胞蛋白合成下降,降解增加,Ⅱ型肌纤维数量减少,肌细胞体积缩小,肌肉量减少[7,17]。保持食物热卡20~30 kcal·kg-1·d-1,蛋白质1.2~1.5 g·kg-1·d-1,进食富含亮氨酸的动物蛋白,联合每周150 min中等强度的有氧运动(最大心率的50%~70%)和2~3次抗阻运动,有助于促进蛋白合成,减少降解,增加肌纤维横截面积和长度,维持肌肉的质量和功能[18-19]。每天1 200 mg钙、800~1 000 U维生素D3和适量维生素补充,亦有助于保持肌肉的质量和力量[20]。此外,适合该人群的增肌药物是未来研究方向[21]。
本研究结果显示,T2DM患者肌肉量减少发生风险随HbA1c水平升高而增加,与既往研究肌肉量减少患病率与HbA1c水平呈线性正相关相似[22]。高血糖致骨骼肌细胞糖原合成和葡萄糖分解代谢下降,糖基化终末产物堆积,诱发炎症及过氧化反应,阻碍蛋白合成,骨骼肌的质量和功能下降[23]。作为葡萄糖代谢的主要场所,骨骼肌质量减少下调机体葡萄糖处理能力,提升血糖水平,形成恶性循环[1-2]。HbA1c<6.5%的糖尿病患者,肌肉量减少风险与HbA1c相关性不明显[22],进一步提示在肌肉量减少高风险人群中强化血糖控制的重要性。
低BMI是肌肉量减少的独立危险因素[24]。有研究认为BMI<21 kg/m2的老年群体肌肉量减少风险显著增加,过低的BMI预示肌肉营养不良,减少了骨骼肌对抗重力作用,不利于保有肌肉量[25]。本研究发现BMI<23.5 kg/m2的患者肌肉量减少发生风险迅速增加,但是超重影响血糖等代谢指标,维持该人群BMI在23.5~24 kg/m2可能是更为明智的选择[13]。
然而,仅依据BMI不能区分脂肪在体质量中的占比,内脏脂肪增加可致胰岛素抵抗和机体慢性低度炎症状态,抑制骨骼肌细胞蛋白合成,促进脂质沉积及肌间脂肪细胞肥大,肌肉质量减少、功能减退[26-28],本研究发现内脏脂肪面积增加是肌肉量减少的独立危险因素,内脏脂肪面积增加预示中心性肥胖,中国T2DM患者BMI虽较欧美国家低,但中心性肥胖者占比更高[29-30]。值得提出的是,本研究结果中,内脏脂肪面积在单因素分析中OR值为0.989,经多因素分析后,通过控制其他影响因素的影响,OR值为1.021,两者均接近1,虽然有统计学意义,但是从临床角度,低于其他危险因素的OR值,提示内脏脂肪面积对肌肉量减少的影响低于本研究中其他危险因素,临床意义有限。因此,在40~70岁非肥胖T2DM患者中维持一定水平的BMI的同时需适当控制内脏脂肪堆积。
本研究结果显示,男性是肌肉量减少的独立危险因素,既往研究也揭示男性较女性更容易伴发肌少症[31],原因可能与老龄男性睾酮及胰岛素样生长因子1下降对肌肉量的不利影响超过女性绝经后雌激素水平下降的影响有关[32-33],男性T2DM患者较正常对照人群的睾酮水平更低也可能导致本研究男性更高的肌肉量减少患病率。此外,肌肉量的评估基于四肢骨骼肌质量/身高2,老年女性身高的缩短快于男性,可能致女性肌肉量被高估。新型选择性雄激素受体调节剂,无睾酮性腺不良反应,是否适用于男性肌肉量减少患者值得进一步研究证实[34]。
本研究纳入临床上易获得的5个指标构建非肥胖T2DM患者肌肉量减少列线图预测模型,模型AUC为0.825(95%CI=0.793~0.856,P<0.001),对预测非肥胖T2DM患者肌肉量减少有良好的鉴别能力。Bootstrap内部验证后模型曲线下面积为0.806(95%CI=0.753~0.859,P<0.001),Hosmer-Lemeshow检验显示预测曲线与实际观测曲线有良好的一致性。为进一步证明模型在临床实践中的实用性,本研究采用DCA这一新方法,根据阈概率为临床决策提供依据,当阈概率为0.06~0.94时,使用此模型预测利于识别非肥胖T2DM患者肌肉量减少,采取相应的治疗措施能使患者在临床中获益。
DXA是确诊肌肉量减少的金标准,但价格昂贵,临床中多不作为常规筛查项目,本研究结合年龄、性别、HbA1c、BMI以及内脏脂肪面积这些简单易获取的临床指标预测肌肉量减少的发生,有助于明确T2DM患者是否存在肌肉量减少风险,利于尽早干预,避免后续肌少症的发生。
本研究有一定的局限性。首先,这是一项单中心横断面研究,虽然有验证集对列线图的临床验证,但其预测价值需进一步通过前瞻性、多中心随访研究证实;其次,虽然研究采用了ASMI金标准评估技术DXA,但缺乏肌力及肌肉功能评估数据。肌少症共识建议在肌力及肌肉功能减少人群中筛查肌少症,但是T2DM患者肌肉量减少患病率(42.3%)远高于肌少症患病率(11.38%)[16],提示肌肉量减少出现早于肌力及肌肉功能减少,因此应重视在非肥胖T2DM患者,特别在本研究列线图提示的高风险人群中应用DXA甄别肌肉量减少者,避免后续肌少症的发生。最后,本研究未收集到非肥胖T2DM患者日常饮食或运动(有氧和力量训练)的定量数据,未能评估饮食和运动等生活方式对非肥胖T2DM患者肌肉量减少的影响,有待未来的研究进一步阐明其潜在机制。
综上所述,本研究结果表明非肥胖T2DM患者肌肉量减少患病率随年龄增长而升高,应维持BMI为23.5 ~24.0 kg/m2,减少内脏脂肪,强化血糖控制减少肌肉量减少的发生风险,在男性患者中更应该注意上述指标达标。本研究采用临床易获得指标构建的列线图,简单明了,具有良好的预测能力,有助于早期鉴别肌肉量减少高风险患者。
作者贡献:张冰青负责临床数据收集、整理、分析,并撰写论文初稿;胡馨云负责绘制图表并协助统计分析;欧阳煜钦负责临床资料质量把控,协助初稿撰写;向心月协助参与论文内容及格式修改;汤文娟完善论文的审校;冯文焕提出研究思路,设计研究方案,完善论文最终内容及审校,并对论文负责。
本文无利益冲突。
冯文焕:https://orcid.org/0000-0002-5145-127X
参考文献
MERZ K E,THURMOND D C. Role of skeletal muscle in insulin resistance and glucose uptake[J]. Compr Physiol,2020,10(3):785-809. DOI:10.1002/cphy.c190029.
SARODNIK C,BOURS S P G,SCHAPER N C,et al. The risks of sarcopenia,falls and fractures in patients with type 2 diabetes mellitus[J]. Maturitas,2018,109:70-77. DOI:10.1016/j.maturitas.2017.12.011.
ANAGNOSTIS P,GKEKAS N K,ACHILLA C,et al. Type 2 diabetes mellitus is associated with increased risk of sarcopenia:a systematic review and meta-analysis[J]. Calcif Tissue Int,2020,107(5):453-463. DOI:10.1007/s00223-020-00742-y.
LI C W,YU K,SHYH-CHANG N,et al. Pathogenesis of sarcopenia and the relationship with fat mass:descriptive review[J]. J Cachexia Sarcopenia Muscle,2022,13(2):781-794. DOI:10.1002/jcsm.12901.
BORBA V Z C,COSTA T L,MOREIRA C A,et al. Mechanisms of endocrine disease:sarcopenia in endocrine and non-endocrine disorders[J]. Eur J Endocrinol,2019,180(5):R185-199. DOI:10.1530/EJE-18-0937.
CHHETRI J K,DE SOUTO BARRETO P,FOUGÈRE B,et al. Chronic inflammation and sarcopenia:a regenerative cell therapy perspective[J]. Exp Gerontol,2018,103:115-123. DOI:10.1016/j.exger.2017.12.023.
CRUZ-JENTOFT A J,SAYER A A. Sarcopenia[J]. Lancet,2019,393(10191):2636-2646. DOI:10.1016/S0140-6736(19)31138-9.
KIM T N,PARK M S,YANG S J,et al. Prevalence and determinant factors of sarcopenia in patients with type 2 diabetes:the Korean Sarcopenic Obesity Study(KSOS)[J]. Diabetes Care,2010,33(7):1497-1499. DOI:10.2337/dc09-2310.
JI L N,HU D Y,PAN C Y,et al. Primacy of the 3B approach to control risk factors for cardiovascular disease in type 2 diabetes patients[J]. Am J Med,2013,126(10):925.e11-925.e22. DOI:10.1016/j.amjmed.2013.02.035.
罗琴,苟连平,陈银,等. 小腿围、上臂围和 Ishii评分对冠心病合并肌少症患者的诊断价值比较[J/OL]. 中国全科医学,2023. [2024-02-17]. http://kns.cnki.net/kcms/detail/13.1222.R.20231023.0847.020.html.
CHIANCA V,ALBANO D,MESSINA C,et al. Sarcopenia:imaging assessment and clinical application[J]. Abdom Radiol (NY),2022,47(9):3205-3216. DOI:10.1007/s00261-021-03294-3.
JALALI A,ALVAREZ-IGLESIAS A,ROSHAN D,et al. Visualising statistical models using dynamic nomograms[J]. PLoS One,2019,14(11):e0225253. DOI:10.1371/journal.pone.0225253.
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华内分泌代谢杂志,2021,37(4):311-398. DOI:10.3760/cma.j.cn311282-20210304-00142.
CHEN L K,WOO J,ASSANTACHAI P,et al. Asian working group for sarcopenia:2019 consensus update on sarcopenia diagnosis and treatment[J]. J Am Med Dir Assoc,2020,21(3):300-307.e2. DOI:10.1016/j.jamda.2019.12.012.
MCCORMICK R,VASILAKI A. Age-related changes in skeletal muscle:changes to life-style as a therapy[J]. Biogerontology,2018,19(6):519-536. DOI:10.1007/s10522-018-9775-3.
段明,张欣欣,孔悠然,等. 2型糖尿病患者肌肉量减少的多因素分析[J]. 中华内分泌代谢杂志,2020,36(9):778-782. DOI:10.3760/cma.j.cn311282-20191123-00512.
TERRACCIANO C,CELI M,LECCE D,et al. Differential features of muscle fiber atrophy in osteoporosis and osteoarthritis[J]. Osteoporos Int,2013,24(3):1095-1100. DOI:10.1007/s00198-012-1990-1.
HURST C,ROBINSON S M,WITHAM M D,et al. Resistance exercise as a treatment for sarcopenia:prescription and delivery[J]. Age Ageing,2022,51(2):afac003. DOI:10.1093/ageing/afac003.
PAPADOPOULOU S K,PAPADIMITRIOU K,VOULGARIDOU G,et al. Exercise and nutrition impact on osteoporosis and sarcopenia-the incidence of osteosarcopenia:a narrative review[J]. Nutrients,2021,13(12):4499. DOI:10.3390/nu13124499.
RIZZOLI R,STEVENSON J C,BAUER J M,et al. The role of dietary protein and vitamin D in maintaining musculoskeletal health in postmenopausal women:a consensus statement from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis(ESCEO)[J]. Maturitas,2014,79(1):122-132. DOI:10.1016/j.maturitas.2014.07.005.
KIM H J,JUNG D W,WILLIAMS D R. Age is just a number:progress and obstacles in the discovery of new candidate drugs for sarcopenia[J]. Cells,2023,12(22):2608. DOI:10.3390/cells12222608.
SUGIMOTO K,TABARA Y,IKEGAMI H,et al. Hyperglycemia in non-obese patients with type 2 diabetes is associated with low muscle mass:the Multicenter Study for Clarifying Evidence for Sarcopenia in Patients with Diabetes Mellitus[J]. J Diabetes Investig,2019,10(6):1471-1479. DOI:10.1111/jdi.13070.
ZGUTKA K,TKACZ M,TOMASIAK P,et al. A role for advanced glycation end products in molecular ageing[J]. Int J Mol Sci,2023,24(12):9881. DOI:10.3390/ijms24129881.
IZZO A,MASSIMINO E,RICCARDI G,et al. A narrative review on sarcopenia in type 2 diabetes mellitus:prevalence and associated factors[J]. Nutrients,2021,13(1):183. DOI:10.3390/nu13010183.
KIM H,SUZUKI T,KIM M,et al. Incidence and predictors of sarcopenia onset in community-dwelling elderly Japanese women:4-year follow-up study[J]. J Am Med Dir Assoc,2015,16(1):85.e1-85.e8. DOI:10.1016/j.jamda.2014.10.006.
KALINKOVICH A,LIVSHITS G. Sarcopenic obesity or obese sarcopenia:a cross talk between age-associated adipose tissue and skeletal muscle inflammation as a main mechanism of the pathogenesis[J]. Ageing Res Rev,2017,35:200-221. DOI:10.1016/j.arr.2016.09.008.
WANNAMETHEE S G,ATKINS J L. Muscle loss and obesity:the health implications of sarcopenia and sarcopenic obesity[J]. Proc Nutr Soc,2015,74(4):405-412. DOI:10.1017/S002966511500169X.
LI C,KANG B X,ZHANG T,et al. High visceral fat area attenuated the negative association between high body mass index and sarcopenia in community-dwelling older Chinese people[J]. Healthcare,2020,8(4):479. DOI:10.3390/healthcare8040479.
MURAI J,NISHIZAWA H,OTSUKA A,et al. Low muscle quality in Japanese type 2 diabetic patients with visceral fat accumulation[J]. Cardiovasc Diabetol,2018,17(1):112. DOI:10.1186/s12933-018-0755-3.
HUXLEY R,JAMES W P,BARZI F,et al. Ethnic comparisons of the cross-sectional relationships between measures of body size with diabetes and hypertension[J]. Obes Rev,2008,9(Suppl 1):53-61. DOI:10.1111/j.1467-789X.2007.00439.x.
DU Y P,WANG X D,XIE H,et al. Sex differences in the prevalence and adverse outcomes of sarcopenia and sarcopenic obesity in community dwelling elderly in East China using the AWGS criteria[J]. BMC Endocr Disord,2019,19(1):109. DOI:10.1186/s12902-019-0432-x.
SHIN H E,WALSTON J D,KIM M,et al. Sex-specific differences in the effect of free testosterone on sarcopenia components in older adults[J]. Front Endocrinol,2021,12:695614. DOI:10.3389/fendo.2021.695614.
SEPU N,ADELEYE J O,KUTI M O. Serum testosterone in Nigerian men with type 2 diabetes mellitus and its relationship with insulin sensitivity and glycemic control[J]. J Natl Med Assoc,2021,113(3):285-293. DOI:10.1016/j.jnma.2020.11.014.
ROLLAND Y,DRAY C,VELLAS B,et al. Current and investigational medications for the treatment of sarcopenia[J]. Metabolism,2023,149:155597. DOI:10.1016/j.metabol.2023.155597.
(收稿日期:2024-03-21;修回日期:2024-05-27)
(本文编辑:康艳辉)
