磁共振弛豫时间定量成像预测乳腺浸润性导管癌分子亚型的价值
2024-07-13朱刚明董永德朱瑞婷谭源满陶娟刘晓陈德成杨概
朱刚明 董永德 朱瑞婷 谭源满 陶娟 刘晓 陈德成 杨概
基金项目:东莞市社会发展科技项目重点项目(20211800904732)
作者单位:东莞东华医院放射科,东莞市医学影像功能成像与人工智能应用重点实验室(邮编523808)
作者简介:朱刚明(1979),男,主任医师,主要从事磁共振功能成像方面研究。E-mail:171849102@masu.edu.cn
摘要:目的 探讨磁共振弛豫时间定量成像对乳腺浸润性导管癌(IDC)分子亚型的预测价值。方法 对79例IDC患者行MRI常规扫描及弛豫时间定量成像,根据病灶免疫组化结果分为不同的免疫组化指标组、分子亚型组,比较各组病灶MRI征象、T1值、T2值差异,并采用受检者工作特征(ROC)曲线评价单独使用T1、T2值及二者联用对IDC分子亚型的鉴别诊断价值。结果 79例患者共82个病灶中,Luminal A型16个(19.51%)、Luminal B1型11个(13.41%)、Luminal B2型27个(32.93%)、酪氨酸激酶受体-2过度表达型(Erb-B2过表达型)14个(17.07%)、三阴型(TNBC)14个(17.07%)。各分子亚型患者年龄、病灶分布、最大径、形态、边缘、强化表现差异均无统计学意义(P>0.05)。免疫组化指标中仅Ki-67阳性组T1值高于阴性组(P<0.05)。ROC曲线分析显示,Ki-67阳性病灶T1值临界值为2 145 ms,约登指数为0.368,敏感度为53.47%,特异度为83.33%,曲线下面积(AUC)为0.640(95%CI:0.527~0.744)。Luminal A、Luminal B1、Luminal B2、Erb-B2过表达型、TNBC分子亚型间T1、T2值差异均无统计学意义(P>0.05),而Luminal型病灶T1、T2值均低于TNBC型(P<0.05)。ROC曲线分析显示,联合T1、T2值鉴别Luminal型/TNBC型的效能优于单独使用T1、T2值。结论 T1 mapping可作为预测IDC肿瘤Ki-67高低表达程度的方法之一,联合使用T1、T2值可提高预测Luminal型/TNBC型的效能。
关键词:乳腺肿瘤;癌,导管,乳腺;磁共振成像;弛豫时间定量成像;分子亚型
中图分类号:R737.9,R445.2文献标志码:ADOI:10.11958/20231486
The value of magnetic resonance relaxation time quantitative imaging in predicting molecular subtypes of invasive ductal carcinoma
ZHU Gangming, DONG Yongde, ZHU Ruiting, TAN Yuanman, TAO Juan, LIU Xiao, CHEN Decheng, YANG Gai
Department of Radiology, Dongguan Tungwah Hospital; Dongguan Medical Imaging Functional Imaging and
Artificial Intelligence Application Key Laboratory, Dongguan 523808, China
Abstract: Objective To explore the value of magnetic resonance relaxation time quantitative imaging in predicting molecular subtypes of invasive ductal carcinoma (IDC) of breast. Methods A total of 79 IDC patients underwent routine magnetic resonance imaging (MRI) scanning and relaxation time quantitative imaging. According to immunohistochemical results of lesions, patients were divided into different immunohistochemical index groups and molecular subtype groups. The differences in MRI signs, T1 values and T2 values of lesions were statistically compared between each group. Patient operating characteristic (ROC) curve was used to evaluate values of T1 and T2 alone and the combination of them in differential diagnosis of IDC molecular subtypes. Results There were 82 samples of lesion in 79 patients, in which, Luminal A type 16 (19.51%), Luminal B1 type 11 (13.41%), Luminal B2 type 27 (32.93%), tyrosine kinase receptor-2 overexpression type (Erb-B2) 14 (17.07%) and TNBC 14 (17.07%). There were no significant differences in patient age, lesion distribution, maximum diameter, morphology, margin and enhancement performance between patients with various molecular subtypes (P > 0.05). Among the immunohistochemical indexes, only the Ki-67 positive group had higher T1 value than the negative group (P < 0.05). In ROC analysis, the critical T1 value of Ki-67 positive lesions was 2 145 ms, Yoden index was 0.368, the sensitivity was 53.47%, the specificity was 83.33% and the area under the curve (AUC) was 0.640 (95%CI: 0.527-0.744). There were no significant differences in T1 and T2 values between Luminal A, Luminal B1, Luminal B2, Erb-B2 enriched and TNBC subtypes (P < 0.05). T1 and T2 values were lower in Luminal type lesion than those of TNBC type lesion (P<0.05). ROC curve analysis showed that the combined T1 and T2 values were more effective in differentiating Luminal/TNBC type than those of T1 and T2 values alone. Conclusion T1 mapping can be used as one of the methods to predict the high or low expression levels of Ki-67 in IDC tumors. The combination of T1 and T2 values can improve the ability to predict Luminal/TNBC subtypes.
Key words: breast neoplasms; carcinoma, ductal, breast; magnetic resonance imaging; relaxation quantitative mapping; molecular subtype
浸润性导管癌(invasive ductal carcinoma,IDC)是乳腺癌(breast cancer,BC)最常见的病理类型,约占BC的70%[1]。既往研究证实IDC是一种高度异质性疾病,不同分子亚型IDC的临床特点、生物学行为及治疗反应上存在极大的差异,与患者预后有着密切的关系,因此正确评估IDC分子亚型具有重要意义。随着MRI技术的发展,各种功能成像广泛应用于IDC诊疗中,如运用体素内不相干运动成像(intravoxel incoherent motion,IVIM)对IDC分子亚型进行评估[2]。此外,基于ExtendToffs模型的MRI动态增强灌注(dynamic contrast-enhanced MRI,DCE-MRI)亦应用于IDC,可客观反映肿瘤微血管数量及通透性,间接预测肿瘤分子亚型[3]。但由于使用了钆对比剂,部分患者存在对比剂肾病的风险。目前IDC分子亚型的诊断仍有赖于穿刺活检及免疫组化。近年来,纵向弛豫时间定量成像(T1 mapping)及横向弛豫时间定量成像(T2 mapping)作为无创性影像检查且无需钆对比剂,已经被广泛应用于心肌及关节软骨病变的评估,也有少部分研究运用到IDC病变中。2017年St.Gallen共识[4]对乳腺癌分子亚型进行了定义,其中Luminal B型根据生长因子受体-2(HER-2)表达及增殖程度分为Luminal B1型和Luminal B2型。目前涉及IDC的弛豫时间定量成像研究较少,针对Luminal B1型和Luminal B2型的对比研究更为罕见。本研究旨在探讨弛豫时间定量成像预测IDC新的分子亚型的价值,为制定诊疗策略及预测疾病预后提供参考。
1 对象与方法
1.1 研究对象 收集2021年10月—2023年7月于我院行乳腺T1 mapping、T2 mapping检查的218例女性患者的临床资料。纳入标准:(1)首诊,既往无穿刺史及相关手术史。(2)肿块样病变。(3)本院术后病理及免疫组化资料明确。排除标准:(1)术前行新辅助化疗或放疗。(2)术后病变非IDC的其他类型肿瘤。(3)影像资料不完整,T1 mapping、T2 mapping图像质量达不到诊断标准。最终入组患者共79例,年龄30~67岁,平均(48.29±8.83)岁,其中合并糖尿病7例,高血压13例,痛风2例。本研究经医院伦理委员会批准(编号:2021-KY-005),获得患者及家属知情同意并签署检查知情同意书。
1.2 检查方法 采用西门子3.0 T MR设备(Magnetom Skyra),18通道乳腺专用相控阵线圈进行数据采集。检查前告知患者扫描过程中的注意事项,采取俯卧位横轴位扫描。T1WI扫描参数:重复时间(TR)445 ms,回波时间(TE)7.5 ms,层厚4 mm,层间距0.4 mm,视野(FOV)350 mm×350 mm,矩阵269×384,激励次数(NEX)=1。T2WI使用西门子tirm脂肪抑制技术,TR 4 000 ms,TE 64 ms,反转时间(TI) 230 ms,层厚4 mm,层间距0.4 mm,FOV 350 mm×350 mm,矩阵269×384,NEX=2。T1 mapping采用双翻转角三维容积式插入法自由呼吸检查(3D-VIBE)采集,且采集前进行一次B1场校准;T2 mapping技术采用5个回波的自旋回波(SE)序列,扫描完成后计算机自动计算生成T1 mapping和T2 mapping伪彩图。T1 mapping和T2 mapping参数如下:T1 mapping翻转角2°/15°,TR 4.81 ms,TE 1.77 ms,FOV 340 mm×340 mm,矩阵205×256,层厚3 mm。T2 mapping(采用5个回波SE序列),TR 2 300 ms,TE(13.8 ms、27.6 ms、41.3 ms、55.2 ms、69 ms),FOV 340 mm×340 mm,矩阵288×320,层厚4 mm。
1.3 图像测量及诊断 采用三盲法测量,分别由2名放射医师独立在Siemens syngoView后处理工作站上对T1WI、T2WI、T2抑脂序列、T1 mapping和T2 mapping伪彩图进行测量:横轴面图像上选择病灶径线最大层面,记录病灶大小;综合各序列各层面图像,判断病灶形态、边缘、强化情况;避开出血、坏死、囊变区域,勾画感兴趣区(region of interest,ROI),测量病灶T1值、T2值,同时重建出时间-信号曲线(time-signal intensity curve,TIC)。最终由另外1名高年资放射医师进行审核,结果以3位医师达到意见一致为准。
1.4 病理免疫组化分析 79例IDC患者均行外科手术治疗,其中68例行改良根治术,11例穿刺活检后行保乳术。根治术采集完整的肿瘤大体标本,穿刺活检采集则尽量避开肿瘤坏死区域,病理组织经4%甲醛液固定,梯度乙醇脱水,石蜡包埋后制作厚度为3 μm的切片。切片放置Ventana Benchmark XT全自动免疫组化染色仪内,严格按照仪器使用说明书及操作要求进行染色。苏木精-伊红(HE)染色使用徕卡Heated型全自动染色仪。所用一抗雌激素受体(ER)、孕激素受体(PR)、HER-2和Ki-67购自基因科技(上海)股份有限公司,二抗购自苏州罗氏诊断产品有限公司;荧光原位杂交(FISH)试剂盒购自广州安必平医药科技股份有限公司。最终由1位高年资病理医师在光学显微镜下对病变进行判断。评判标准参考《美国临床肿瘤学会与美国病理医师协会乳腺癌激素受体免疫组化检测指南》[5]。
1.5 统计学方法 采用SPSS 26.0软件进行数据分析。符合正态分布的计量资料以[[x] ±s
]表示,2组间比较采用独立样本t检验;多组间比较方差齐者采用单因素方差分析,组间多重比较行LSD-t检验。非正态分布的计量资料以M(P25,P75)表示,2组间比较采用Mann-Whitney U检验;符合正态分布但方差不齐者及非正态分布的计量资料多组间比较采用Kruskal-Wallis H检验,组间多重比较行Bonferroni校正。计数资料组间比较采用χ2检验或Fisher确切概率法。采用MedCalc 18.11软件绘制受检者工作特征(ROC)曲线,并行Delong法比较单独使用T1、T2值及二者联用预测IDC分子亚型的曲线下面积(AUC)差异。P<0.05为差异有统计学意义。
2 结果
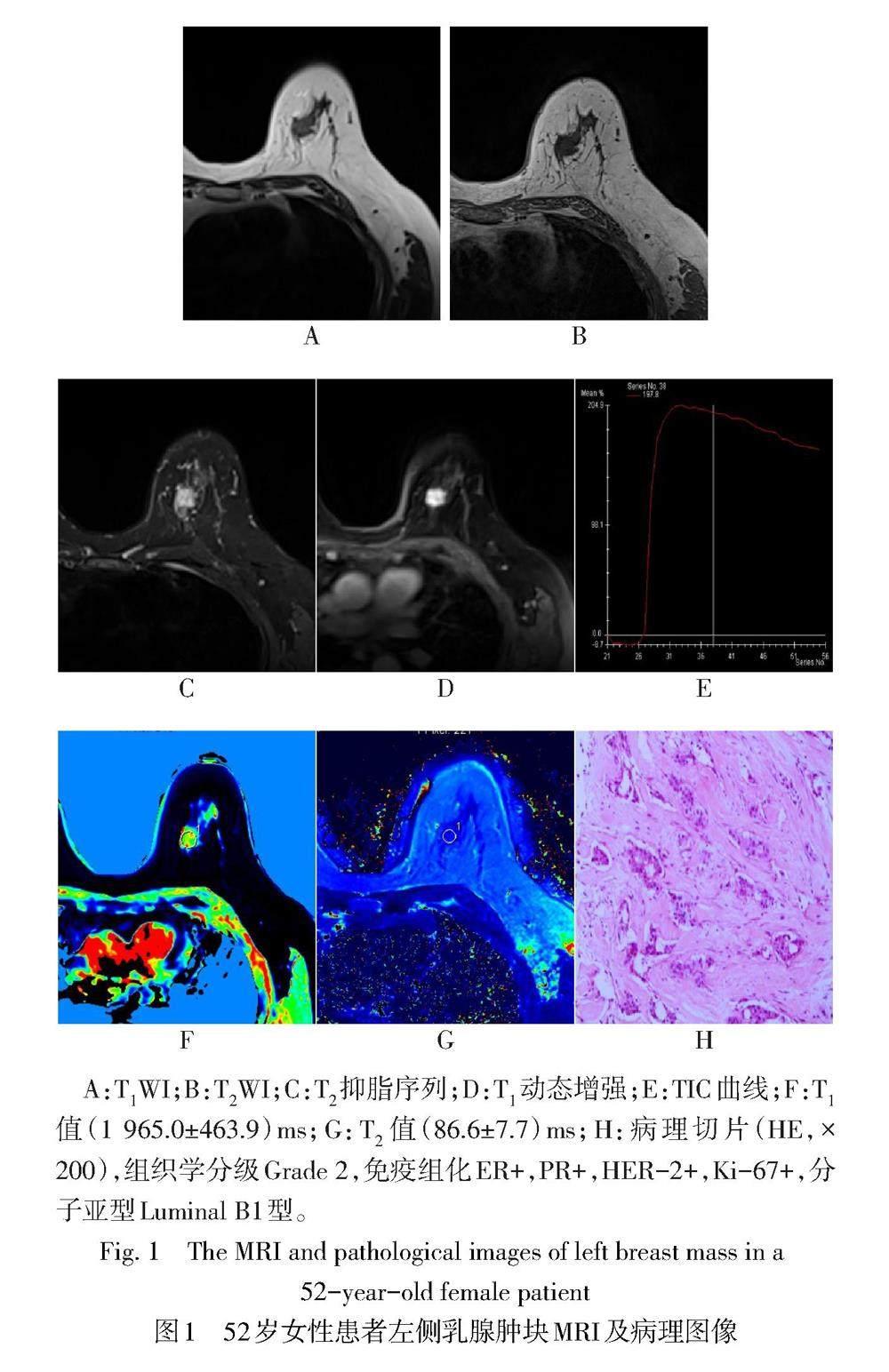
2.1 IDC一般情况及分子亚型结果 79例患者共82个IDC病灶,其中Luminal A型16个(19.51%)、Luminal B1型11个(13.41%)、Luminal B2型27个(32.93%)、酪氨酸激酶受体-2过度表达型(Erb-B2 过表达型)14个(17.07%)、三阴型(TNBC)14个(17.07%)。各分子亚型患者年龄以及病灶的分布、最大径、形态、边缘、强化表现差异均无统计学意义(P>0.05);TIC曲线总体分布差异有统计学意义,Luminal B2型平台型TIC曲线占比高于Luminal A型(P<0.05),见图1、表1。
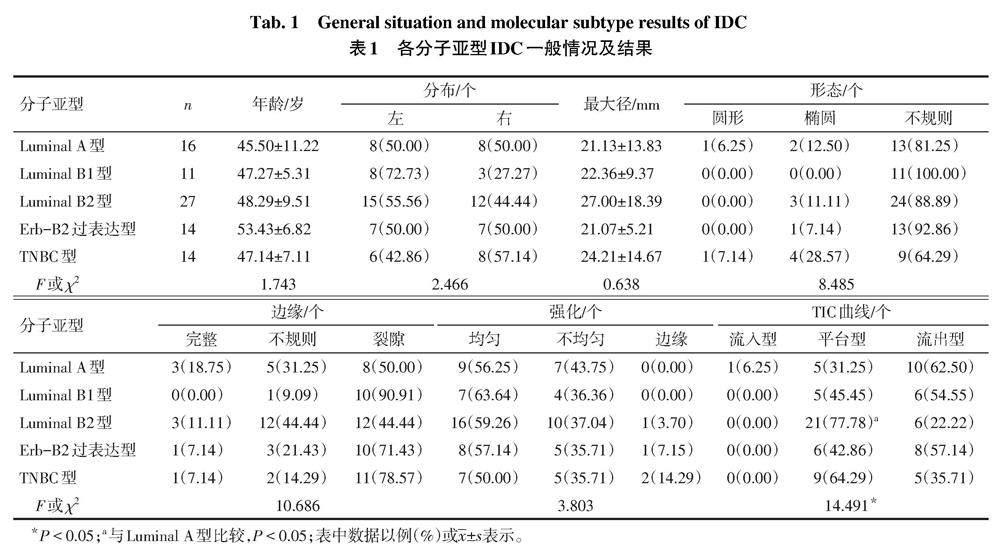
2.2 免疫组化阳性组与阴性组T1、T2比较 82个IDC病灶按照免疫组化指标表达情况分为阳性组和阴性组。Ki-67阳性组T1值高于阴性组(P<0.05),T2值与阴性组差异无统计学意义(P>0.05);ER、PR、HER-2阳性组与阴性组T1、T2值差异均无统计学意义(P>0.05),见表2。ROC曲线分析显示,以Ki-67阳性为二分变量,病灶T1值的最佳临界值为 2 145 ms,Youden指数为0.368,敏感度为53.47%,特异度为83.33%,AUC为0.640(95%CI:0.527~0.744),Z=2.201,P<0.05,见图2。
2.3 各分子亚型间T1、T2值比较 Luminal A、Luminal B1、Luminal B2、Erb-B2过表达型、TNBC分子亚型间T1、T2值差异均无统计学意义(P>0.05),见表3。Luminal型病灶T1值[(2 080.33±330.59)ms]与Erb-B2过表达型、TNBC型总体分布差异有统计学意义(F=3.194,P<0.05),病灶T2值[85.60(77.15,105.95)ms]与Erb-B2过表达型、TNBC型总体分布差异亦有统计学意义(H=6.070,P<0.05),组间多重比较显示Luminal型病灶T1、T2值均低于TNBC型(P<0.05)。ROC曲线分析结果显示,联合T1、T2值鉴别Luminal型/TNBC型的效能优于单独使用T1、T2值,见图3、表4。
3 讨论
磁共振检查纵向弛豫及横向弛豫体现的是受检物固有的组织特性。正常状态下受检物T1、T2值较为稳定,受外界条件影响较小,而是取决于其组织构成,如大分子浓度、水化状态、组织含水量等[6]。当组织构成发生病理性改变时,受检物T1、T2值的变化能间接反映组织的病理类型。Meng等[7]研究显示,联合T1 mapping及T2 mapping在鉴别BC与乳腺良性肿瘤方面具有较高的诊断效能,敏感度可达95.8%,特异度达93.1%。
既往研究对IDC常规MRI征象进行了分析,Boria等[8]发现病灶大小、边缘强化征象与预后不良存在相关性;Szabó等[9]观察到病变边缘强化征象与Ki-67高表达及不良预后相关;Alduk等[10]则认为病灶呈圆形或椭圆形是PR高表达的预测因子。本研究结果显示,各分子亚型病灶分布、最大径、形态、边缘、强化表现均无明显差异,与文献报道不符,仅Luminal A与Luminal B2型的TIC曲线分布存在差异,可能与样本量偏小或选择偏倚有关,提示运用常规MRI征象预测IDC分子亚型存在较大困难。
Ki-67是一种与IDC肿瘤细胞增殖密切相关的核抗原,其表达与肿瘤分化、侵袭、转移、复发、预后有关[11]。高表达Ki-67的IDC预示更强的侵袭性和较差的预后[12]。本研究结果显示,Ki-67阳性组T1值高于阴性组,T2值未见差异,与McSheehy等[13]研究结果一致,原因可能为肿瘤细胞增殖活跃使得细胞外间隙减小,水分子弥散受限,从而影响细胞周围分子的进动频率,延迟质子能量的转移,导致纵向弛豫时间的延长。罗宁斌等[14]研究发现Ki-67高表达的病灶细胞外水分子弥散受限明显,与本研究推测原因相符。此外,McSheehy等[13]研究认为较多的坏死相关大分子聚集在肿瘤细胞外,亦可能是纵向弛豫时间延长的原因。本研究ROC曲线分析结果显示,T1值预测IDC肿瘤Ki-67阳性表达的AUC为0.640(95%CI:0.527~0.744),敏感度仅53.47%,但特异度达83.33%,提示T1 mapping可作为区分IDC肿瘤Ki-67假阳性的方法之一。
IDC众多激素受体中,ER与抑制肿瘤血管生成有关[15]。研究证实ER阳性的IDC侵袭性、病理组织级别较ER阴性者低[16]。有文献报道,ER阳性的IDC病灶T1、T2值较ER阴性病灶低[17],与本研究结果相符,因此临床上以ER阳性作为区分Luminal型与非Luminal型肿瘤的依据。有研究表明,约60%的IDC为Luminal型,其中Luminal A型约占40%[18]。Luminal A型肿瘤细胞在基因表达上与正常的管腔上皮相似[19],对内分泌治疗敏感,较少复发及转移,而TNBC型缺乏ER、PR、HER-2基因的表达,侵袭性与病理组织级别较Luminal型高,预后不佳[20]。本研究结果显示,Luminal型病灶T1、T2值均低于TNBC型,提示Luminal型与TNBC型在肿瘤细胞增殖、微血管数量及通透性、坏死分子聚集、血管外间隙存在较大差异,与既往研究结果[21]相符。ROC曲线分析显示,联合T1、T2值鉴别Luminal型/TNBC型的效能优于单独使用T1、T2值,提示联合T1 mapping及T2 mapping对Luminal型/TNBC型具有较好的鉴别效能。
本研究不同于既往IDC的MRI功能成像研究:首先,对于Luminal B1/B2,较少研究报道两者在弛豫时间定量成像上的区别;其次,较少涉及联合T1 mapping及T2 mapping预测IDC分子亚型价值的探讨。由于HER-2、Ki-67表达程度不同,Luminal B1/B2型在生物学行为上存在差异,同时在新辅助治疗和晚期治疗中,由于HER-2高表达,针对Luminal B2型的靶向治疗可取得较显著的疗效,因此本研究期望找到两者弛豫时间定量成像上的区别,但T1、T2值均无明显差异,应用弛豫时间定量成像能否区分Luminal B1/B2型尚待进一步证实。由于本研究是回顾性研究,可能存在无法避免的选择偏移;另外因聚焦于磁共振弛豫时间定量成像研究,故未探讨其他MRI功能成像、分子代谢功能显像、多模态方式对IDC分子亚型的诊断及预测价值[22],同时本研究为单中心、小样本研究,后续研究将进一步完善上述不足。
参考文献
[1] TSANG J Y S,TSE G M. Molecular Classification of Breast Cancer[J]. Adv Anat Pathol,2020,27(1):27-35. doi:10.1097/PAP.0000000000000232.
[2] 魏玲,江林,马学进,等. 定量MRI在乳腺癌诊断中的研究进展[J]. 国际医学放射学杂志,2023,46(1):55-59. WEI L,JIANG L,MA X J,et al. Research progress of quantitative MRI in the diagnosis of breast cancer[J]. Int J Med Radiol,2023,46(1):55-59. doi:10.19300/j.2023.Z20042.
[3] 杨自力,邵凯,朱来敏,等. 多模态MRI定量参数与乳腺癌HER-2表达状态的相关性分析[J]. 放射学实践,2023,38(8):1197-1200. YANG Z L,SHAO K,ZHU L M,et al. Correlation between mutiple parameters of magnetic resonance imaging and HER-2 expression status of breast cancer[J]. Radiologic Practice,2023,38(8):1197-1200. doi:10.13609/j.cnki.1000-0313.2023.08.009.
[4] CURIGLIANO G,BURSTEIN H J,WINER E P,et al. De-escalating and escalating treatments for early-stage breast cancer:the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer[J]. Ann Oncol,2017,28(8):1700-1712. doi:10.1093/annonc/mdx308.
[5] HAMMOND M E,HAYES D F,WOLFF A C,et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of oestrogen and progesterone receptors in breast cancer[J]. J Oncol Pract,2010,6(4):195-197. doi:10.1200/JOP.777003.
[6] FERNANDES J L,ROCHITTE C E. T1 mapping:technique and applications[J]. Magn Reson Imaging Clin N Am,2015,23(1):25-34. doi:10.1016/j.mric.2014.08.007.
[7] MENG T B,HE N,HE H Q,et al.The diagnostic performance of quantitative mapping in breast cancer patients:apreliminary study using synthetic MRI[J]. Cancer Imaging,2020,20(1):88. doi:10.1186/s40644-020-00365-4.
[8] BORIA F,TAGLIATI C,BALDASSARRE S,et al. Morphological MR features and quantitative ADC evaluation in invasive breast cancer:Correlation with prognostic factors[J]. Clin Imaging,2018,50:141-146. doi:10.1016/j.clinimag.2018.02.011.
[9] SZAB? B K,AAPELIN P,KRISTOFFERSEN W M,et al. Invasive breast cancer:correlation of dynamic MR features with prognostic factors[J]. Eur Radiol,2003,13(11):2425-2435. doi:10.1007/s00330-003-2000-y.
[10] ALDUK A M,BRCIC I,PODOLSKI P,et al. Correlation of MRI features and pathohistological prognostic factors in invasive ductal breast carcinoma[J]. Acta Clin Belg,2017,72(5):306-312. doi:10.1080/17843286.2016.1266432.
[11] DENKERT C,LOIBL S,MULLER B M,et al. Ki67 levels as predictive and prognostic parameters in pretherapeutic breastcancer core biopsies:a translational investigation in the neoadjuvantGeparTrio trial[J]. Ann Oncol,2013,24(11):2786-2793. doi:10.1093/annonc/mdt350.
[12] WANG Z,REN G Y,YIN Q,et al. Correlation of magnetic resonance imaging quantitative parameters and apparent diffusion coefficient value with pathological breast cancer[J]. World J Clin Cases,2022,10(21):7333-7340. doi:10.12998/wjcc.v10.i21.7333.
[13] MCSHEEHY P M,WEIDENSTEINER C,CANNET C,et al.Quantified tumor T1 is a generic early-response imaging biomarker forchemotherapy reflecting cell viability[J]. Clin Cancer Res,2010,16(1):212-225. doi:10.1158/1078-0432.CCR-09-0686.
[14] 罗宁斌,苏丹柯,黄向阳,等. 乳腺癌新辅助化疗前后MR扩散加权成像ADC值与Ki-67表达水平的相关性研究[J]. 临床放射学杂志,2018,37(6):922-925. LUO N B,SU D K,HUANG X Y,et al. Correlation of ADC value of the breast cancer with Ki-67 expression during neoadjuvant chemotherapy[J]. Clinical Radiology,2018,37(6):922-925. doi:10.13437/j.cnki.jcr.2018.06.008.
[15] KIM S H,LEE H S,KANG B J. Dynamic contrast-enhanced MRI perfusion parameters as imaging biomarkers of angiogenesis[J]. PLoS One,2016,11(12):e0168632. doi:10.1371/journal.pone.0168632.
[16] CHOI E J,CHOI H,CHOI S A,et al. Dynamic contrast-enhanced breast magnetic resonance imaging for the prediction of early and late recurrences in breast cancer[J]. Medicine(Baltimore),2016,95(48):e5330. doi:10.1097/MD.0000000000005330.
[17] GAO W,YANG Q,LI X,et al. Synthetic MRI with quantitative mappings for identifying receptor status,proliferation rate,and molecular subtypes of breast cancer[J]. Eur J Radiol,2022,148:110168. doi:10.1016/j.ejrad.2022.110168.
[18] VODUCK D,CHENG M C,TYLDESLEY S,et al. Breast cancer subtypes and the risk of local and regional relapse[J]. J Clin Oncol,2010,28(10):1684-1691. doi:10.1200/JCO.2009.24.9284.
[19] PEROU C M,SORLIE T,EISEN M B,et al. Molecular portraits of human breast tumours[J]. Nature,2000,406(6797):747-752. doi:10.1038/35021093.
[20] BADVE S,DABBS D J,SCHNITT S J,et al. Basal-like and triplenegative breast cancers:a critical review with an emphasis on the implications for pathologists and oncologists[J]. Mod Pathol,2011,24(2):157-167. doi:10.1038/modpathol.2010.200.
[21] 李婧琳,于湛,李然然,等. 浸润性乳腺癌锥光束乳腺CT平扫影像特征与分子亚型及免疫组织化学受体的相关性研究[J]. 临床放射学杂志,2023,42(4):40-45. LI J L,YU Z,LI R R,et al. Study on the correlation between the cheracteristics of non-contrast-enhanced conebeam breast CT with molecular subtypes and immunohistochemical receptors in invasive breast cancer[J]. Clinical Radiology,2023,42(4):40-45. doi:10.13437/j.cnki.jcr.2023.04.017.
[22] 张宇,刘梁生,马文娟,等. 早期肿块型乳腺浸润性导管癌超声征象与分子分型的相关性研究[J]. 天津医药,2022,50(8):853-858. ZHANG Y,LIU L S,MA W J,et al. Correlation between ultrasonographic features and molecular subtypes of early mass-type breast invasive ductal carcinoma[J].Tianjin Med J,2022,50(8):853-858. doi:10.11958/20220230.
(2023-10-10收稿 2024-01-27修回)
(本文编辑 陈丽洁)
