慢性乙型肝炎发展为肝细胞癌过程中血浆游离氨基酸水平的变化及临床意义
2024-07-13吴静范志娟刘树业
吴静 范志娟 刘树业
基金项目:天津市卫生健康科技项目重点学科专项(TJWJ2023XK021)
作者单位:天津市第三中心医院检验科,天津市重症疾病体外生命支持重点实验室,天津市人工细胞工程技术研究中心,天津市肝胆疾病研究所(邮编300170)
作者简介:吴静(1982),女,副研究员,主要从事肝癌诊断新技术及个体化诊疗标志物方面研究。E-mail:wujing-tj@outlook.com
△通信作者 E-mail:lshye@163.com
摘要:目的 探究慢性乙型肝炎(CHB)发展为肝硬化(LC)并最终发展为肝细胞癌(HCC)过程中血浆游离氨基酸水平的变化及临床意义。方法 对49例CHB患者(CHB组)、43例CHB相关LC患者(LC组)和50例CHB相关HCC患者(HCC组)的血浆样本进行氨基酸谱的分析,比较各组间氨基酸水平的差异。同时采用MetaboAnalyst网站对相关的氨基酸代谢通路进行分析。结果 共鉴定出16种表达水平有差异的氨基酸。从CHB发展到LC再到HCC的过程中,血浆胱氨酸、苯丙氨酸和甘氨酸水平逐渐升高,支链氨基酸/芳香族氨基酸逐渐降低;与CHB组和LC组比较,HCC组中的牛磺酸、蛋氨酸、酪氨酸、鸟氨酸、谷氨酸、异亮氨酸和色氨酸水平升高,精氨酸水平降低;与CHB组比较,LC组和HCC组中丝氨酸、丙氨酸、脯氨酸升高,HCC组中缬氨酸水平升高(均P<0.05)。3组的代谢通路分析表明,苯丙氨酸、酪氨酸和色氨酸生物合成,苯丙氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,缬氨酸、亮氨酸和异亮氨酸生物合成和牛磺酸代谢等多种代谢途径发生了显著变化。此外,通过构建氨基酸-酶-基因相互作用的网络图,共发现了79个与氨基酸表达相关的代谢酶基因。结论 血浆氨基酸水平对肝癌的早期预警和预后具有一定指导意义,可为肝癌的早期预警和治疗提供理论基础和方法依据。
关键词:乙型肝炎,慢性;肝硬化;肝肿瘤;氨基酸类
中图分类号:R575.1,R575.2,R735.7文献标志码:ADOI:10.11958/20231456
Changes and clinical significance of plasma free amino acid levels in the development of chronic hepatitis B to hepatocellular carcinoma
WU Jing, FAN Zhijuan, LIU Shuye△
Department of Clinical Laboratory, the Third Central Hospital of Tianjin, Tianjin Key Laboratory of Extracorporeal
Life Support for Critical Diseases, Artificial Cell Engineering Technology Research Center,
Tianjin Institute of Hepatobiliary Disease, Tianjin 300170, China
△Corresponding Author E-mail: lshye@163.com
Abstract: Objective To investigate changes and clinical significance in plasma free amino acid levels during the progression from chronic hepatitis B (CHB) to liver cirrhosis (LC) and ultimately to hepatocellular carcinoma (HCC). Methods The plasma samples of 49 CHB patients, 43 CHB-related LC patients and 50 CHB-related HCC patients were analyzed using the Hitachi L-8900 amino acid analyzer. The differences in amino acid levels were compared between groups. Simultaneously, the MetaboAnalyst website was used to analyze the relevant amino acid metabolism pathways. Results A total of 16 amino acids with different expression levels were identified. During the development from CHB to HCC, plasma levels of cystine, phenylalanine and glycine gradually increased, while the ratio of branched chain amino acids/aromatic amino acids gradually decreased. Compared with the CHB and the LC groups, levels of taurine, methionine, tyrosine, ornithine, glutamate, isoleucine and tryptophan were significantly increased in the HCC group, while the level of arginine was significantly lower. Compared with the CHB group, levels of serine, alanine and proline were higher in the LC and the HCC groups, while the level of valine was also higher in the HCC group (all P<0.05). The metabolic pathway analysis of three groups showed significant changes in various metabolic pathways, including phenylalanine, tyrosine, tryptophan biosynthesis, phenylalanine metabolism, glycine, serine, threonine metabolism, valine, leucine, isoleucine biosynthesis, and taurine metabolism. In addition, by constructing a network diagram of amino acid enzyme gene interactions, a total of 79 metabolic enzyme genes related to amino acid expression were discovered. Conclusion Plasma levels of amino acids are of certain guiding significance for early warning and prognosis of HCC and can provide a theoretical basis and methodological basis for the diagnosis and treatment of HCC in the future.
Key words: hepatitis B, chronic; liver cirrhosis; liver neoplasms; amino acids
全球约三分之一的人感染乙型肝炎病毒(hepatitis B virus,HBV),其中2.4亿~3.5亿将发展为慢性乙型肝炎(chronic hepatitis B,CHB)[1]。大多数CHB患者无明显症状,但可能发展为肝硬化(liver cirrhosis,LC)甚至肝细胞癌(hepatocellular carcinoma,HCC)[2]。LC是一个长期的病理过程,而CHB是导致LC的主要原因之一。HCC是成人最常见的慢性肝癌类型,也是LC患者最常见的死因。慢性HBV感染通过反复诱导机体免疫应答,导致肝细胞被病毒感染,并最终进展为HCC[3]。肝脏是体内氨基酸代谢的主要器官。当肝脏受损伤时,氨基酸代谢会发生紊乱,肝脏受损伤的程度不同,血浆氨基酸水平的变化也各不相同。这些变化常与肝脏的病理改变程度有较好的一致性[4]。因此,分析体内氨基酸水平有助于诊断肝脏的受损伤程度。支链氨基酸水平在肝癌患者中表达下调,补充支链氨基酸可以提高患者的生存质量[5]。然而,有关CHB进展为HCC过程中多类氨基酸水平变化的研究鲜见报道。本研究通过对CHB及其相关LC和HCC患者的血浆氨基酸水平进行测定,旨在探讨CHB进展为HCC过程中血浆氨基酸代谢谱和代谢途径的动态变化及其临床意义。
1 对象与方法
1.1 研究对象 选取2021年10月—2023年6月于天津市第三中心医院肝胆科就诊的142例患者为研究对象,年龄28~85岁,平均(56.33±17.22)岁;其中49例CHB患者、43例CHB相关LC患者和50例CHB相关HCC患者。纳入标准:(1)CHB和LC的诊断符合《慢性乙型肝炎防治指南(2022年版)》中的诊断标准[6]。(2)HCC的诊断符合《原发性肝癌诊疗指南(2022年版)》中的诊断标准[7]。排除已使用氨基酸药物及患有影响氨基酸代谢疾病(如感染性、炎症性疾病等)的患者。同期选取50例来院检查的健康体检者为对照组,年龄23~79岁,平均(56.10±10.55)岁。本研究经本院伦理委员会批准,且研究对象或其家属签署知情同意书。
1.2 方法
1.2.1 实验室检查 取研究对象晨起空腹静脉血3 mL,用肝素抗凝,室温静置30 min后,12 000 r/min离心10 min。分离血浆,置于-80 ℃冰箱中保存。全自动生化分析仪检测丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、γ-谷氨酰转移酶 (γ-GGT)、碱性磷酸酶(ALP)、白蛋白(ALB)、白蛋白/球蛋白(A/G)、总胆汁酸(TBA)、总胆红素(TBIL)、结合胆红素(DBIL)和甲胎蛋白(AFP)。
1.2.2 氨基酸检测 取研究对象晨起空腹静脉血2~3 mL,用肝素抗凝,3 000 r/min离心10 min后取上清液,加入8%磺基水杨酸混匀,静置30 min后12 000 r/min离心15 min,将上清液用0.45 μm的滤器过滤后加入样品瓶中,再放到样品架上,使用日立L-8900型高速全自动氨基酸分析仪对样本进行氨基酸检测。显色液茚三酮、氨基酸标准液和缓冲液均购自FUJIFILM Wako Pure Chemical公司。
1.2.3 氨基酸代谢通路和代谢网络图分析 通过采用MetaboAnalyst网站(http://www.metaboanalyst.ca)和Cytoscape软件进行代谢通路和代谢网络图分析。
1.3 统计学方法 采用SPSS 22.0软件进行数据分析,符合正态分布的计量资料以[[x] ±s
]表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t法;非正态数据采用 M(P25,P75)表示,组间比较采用Kruskal-Wallis检验。P<0.05为差异有统计学意义。
2 结果
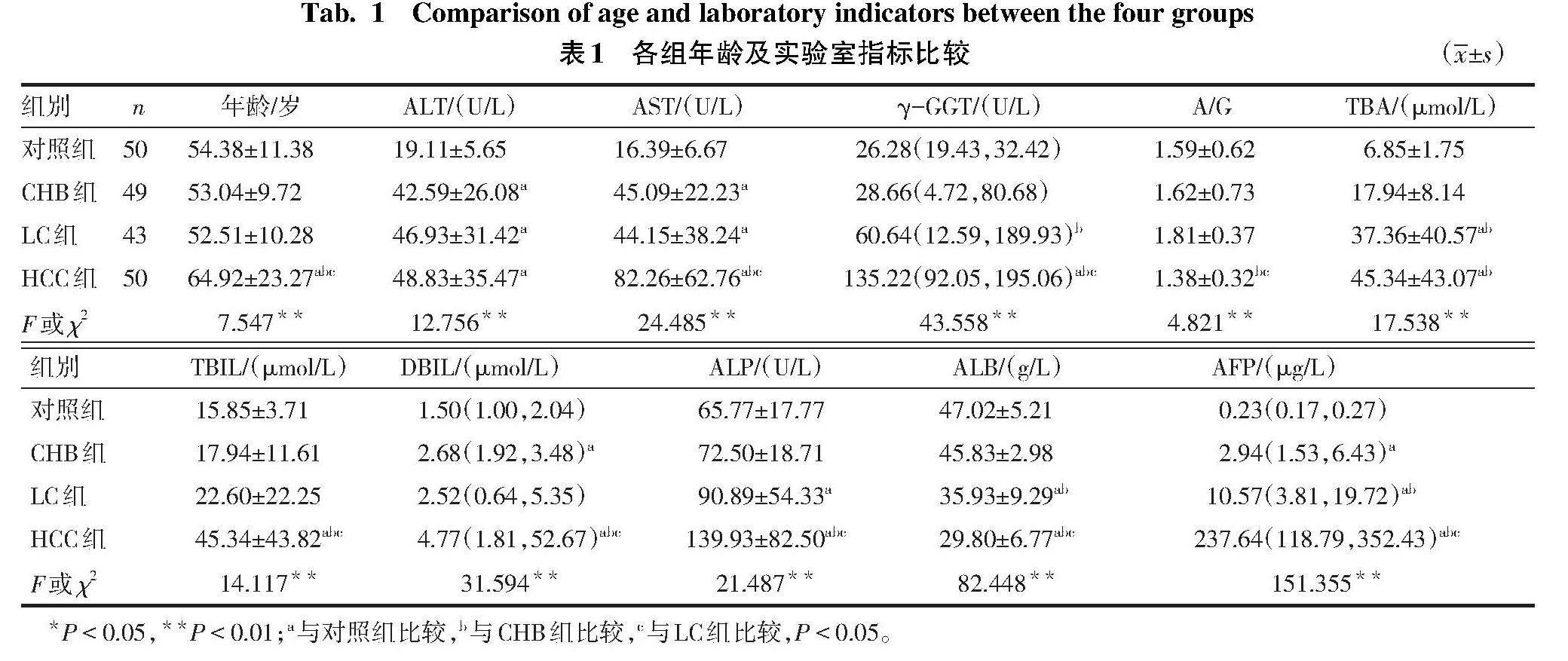
2.1 各组实验室指标比较 所有患者乙肝表面抗原(HBsAg)均呈阳性。与对照组比较,CHB组、LC组和HCC组的ALT、AST、AFP水平升高;与CHB组比较,LC组和HCC组γ-GGT、TBA、AFP水平升高;与LC组比较,HCC组的γ-GGT、TBIL、DBIL、ALP、AST和AFP水平升高,A/G和ALB水平降低(均P<0.05)。见表1。
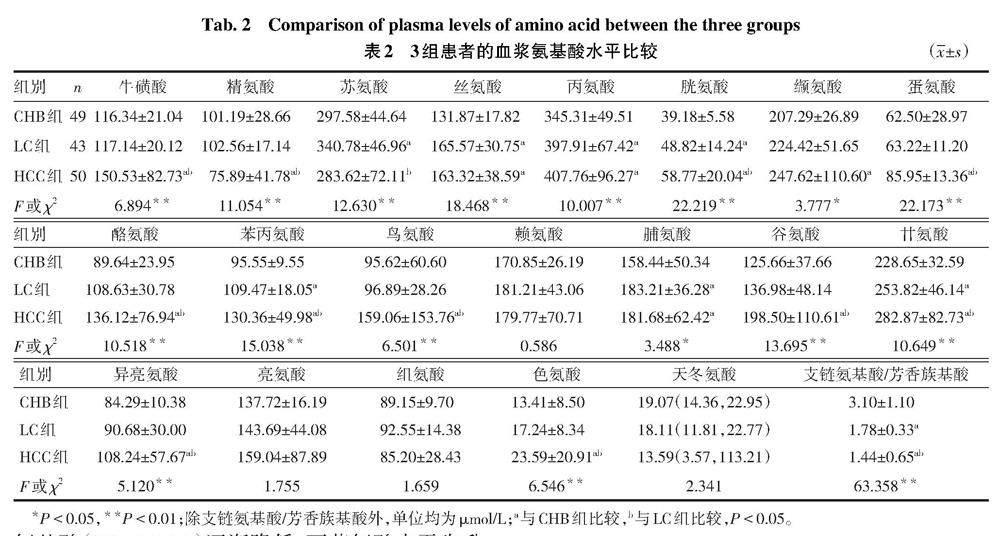
2.2 各组患者血浆氨基酸水平比较 见表2。从CHB到LC再发展到HCC的过程中,血浆胱氨酸、苯丙氨酸和甘氨酸水平逐渐升高,支链氨基酸/芳香族氨基酸(BCAA/AAA)逐渐降低,而苏氨酸水平先升高后降低;与CHB和LC组比较,HCC组中的牛磺酸、蛋氨酸、酪氨酸、鸟氨酸、谷氨酸、异亮氨酸和色氨酸水平升高,精氨酸水平降低;与CHB组比较,LC和HCC组中丝氨酸、丙氨酸和脯氨酸升高,HCC组中缬氨酸水平升高(均P<0.05)。各组患者的赖氨酸、亮氨酸、组氨酸和天冬氨酸水平差异均无统计学意义。
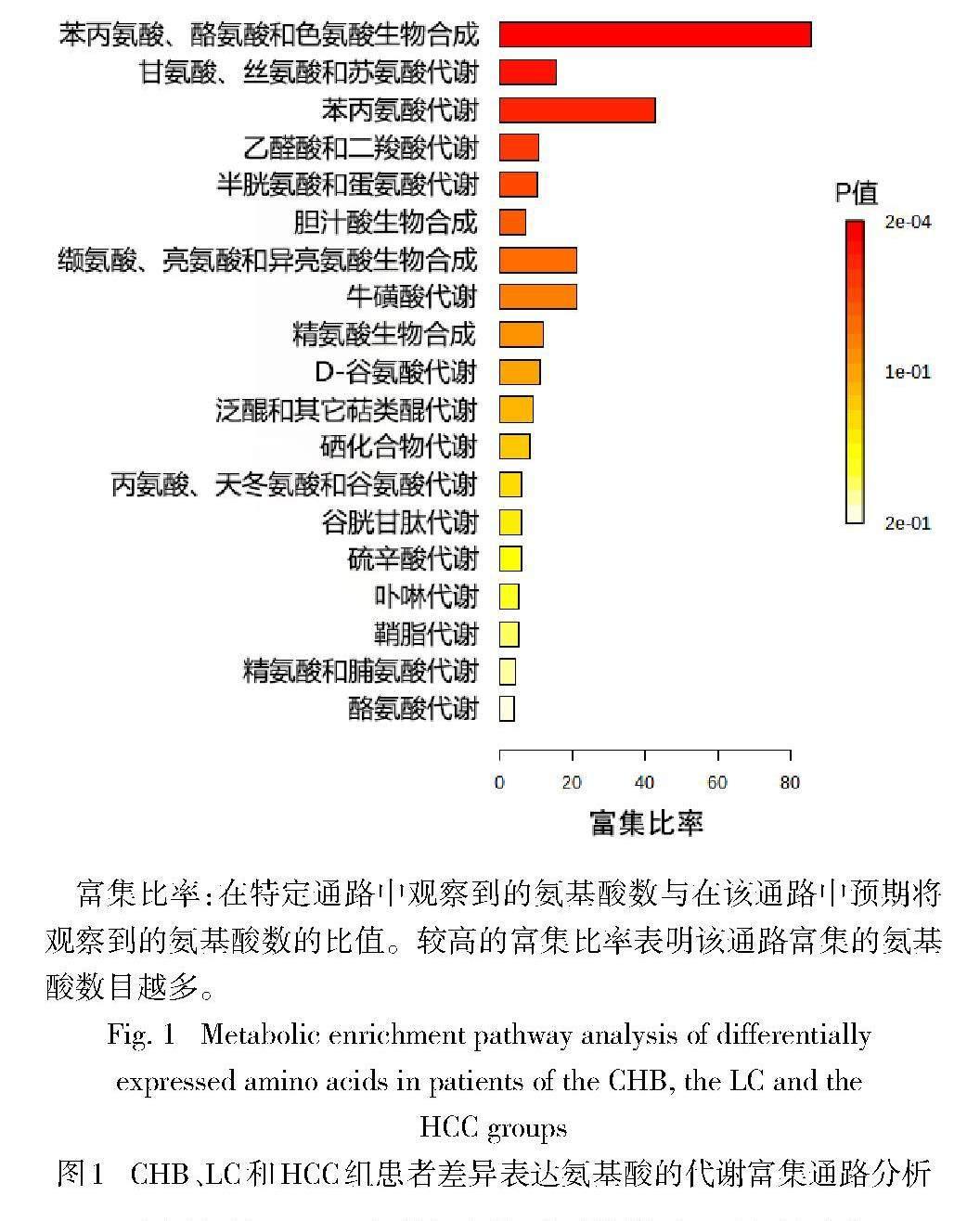
2.3 CHB、LC和HCC差异表达氨基酸的代谢通路分析 通过人类代谢组数据库(Human Metabolome Database,HMDB)搜索以上有变化趋势氨基酸的HMDB ID,并将其导入KEGG数据库中构建相关代谢通路,共发现19类代谢通路,3组间氨基酸水平的变化主要与19类代谢通路有关,见图1、2。而主要富集的代谢通路有5类,按富集比率从大到小依次为苯丙氨酸、酪氨酸和色氨酸生物合成,苯丙氨酸代谢,缬氨酸、亮氨酸和异亮氨酸生物合成,牛磺酸代谢以及甘氨酸、丝氨酸和苏氨酸代谢(均P<0.05),见表3。
2.4 3组差异表达氨基酸相关的代谢网络分析 为进一步鉴定差异表达氨基酸相关的代谢酶和基因,通过Cytoscape构建了氨基酸-酶-基因相互作用的网络图。根据相互作用网络图,共获得了79个与氨基酸表达相关的代谢酶基因,见图3。
3 讨论
3.1 氨基酸代谢紊乱是慢性肝病和肝癌发生的重要特征 肝癌是常见的恶性肿瘤之一,对人类健康构成严重威胁[8]。由CHB引发LC并最终发展为HCC仍然是HCC和肝功能衰竭的主要原因之一。深入研究CHB向HCC发展过程中与病理改变相关的代谢变化,对进一步探索治疗HCC的新策略具有重要意义。研究表明,氨基酸代谢紊乱与慢性肝病和肝癌的发生密切相关[9]。慢性肝病患者的氨基酸和蛋白质代谢方面主要表现为血氨增加、血浆白蛋白减少和血液中氨基酸谱的变化[10]。当肝功能受损时,许多酶系统受损或功能受阻,减少了利用氨基酸合成蛋白,因此大量氨基酸从肝脏释放,导致血液中氨基酸的浓度升高。
3.2 CHB、LC和HCC患者血浆中游离氨基酸水平变化及其临床意义 BCAA主要包括亮氨酸、异亮氨酸和缬氨酸,属于维持人体肝脏正常功能的必需氨基酸。它们不能在人体内合成,只能通过膳食摄取。BCAA可以调节肿瘤的生长代谢,其调控方式包括转录水平调控、表观遗传调控以及直接改变蛋白质水平或酶活力等[11]。BCAA缺乏可以造成肿瘤细胞的快速增殖。AAA包括苯丙氨酸、色氨酸及酪氨酸[12],其功能是促进甲状腺素和肾上腺素的合成,调节宿主局部和全身的免疫、代谢和神经元反应。BCAA/AAA比值的变化能较好反映肝脏受损的严重程度和预后。本研究结果显示,从CHB发展为HCC的过程中,患者血浆中BCAA/AAA比值逐渐降低,苯丙氨酸水平逐渐升高。因此补充BCAA和维持正常的BCAA/AAA比值对肝癌患者的生存和预后是有利的。
本研究显示,从CHB发展为HCC过程中,患者血浆中胱氨酸和甘氨酸水平逐渐升高。与CHB和LC组比较,HCC组中谷氨酸、蛋氨酸等水平明显升高,而精氨酸水平明显降低。谷氨酸是生物机体内氮代谢的基本氨基酸之一[13],属于生糖氨基酸,能参与脑内蛋白质和糖的代谢,促进氧化过程,降低血氨水平,减轻肝昏迷症状。由于高度增殖的肿瘤组织内存在糖有氧代谢障碍,糖酵解增强,糖消耗量增加,因此HCC患者的谷氨酸水平会受机体调节而升高。蛋氨酸是含硫必需氨基酸,已有研究证实蛋氨酸水平的升高与肝脏细胞的损伤程度有关,蛋氨酸的缺乏会导致肝癌细胞DNA、RNA的合成受到抑制,肝癌细胞增殖受阻,还可能提高化疗药物的疗效[14-15],因此HCC患者血浆中蛋氨酸水平会明显升高。而精氨酸具有抑制肿瘤细胞的增殖和转移、降低复发率的作用[16],补充精氨酸可以提高患者生存率。由于精氨酸在体内合成速度缓慢,HCC组精氨酸水平显著降低。丝氨酸也是一种生糖氨基酸[17]。本研究发现,与CHB组比较,LC和HCC组中丝氨酸水平均显著升高,这可能也是由于肝脏损伤程度的加重和病理改变以及肝癌组织的无氧酵解增强所致。
3.3 血浆氨基酸分析对肝癌早期预警和预后的意义 目前,实现HCC的早期诊断仍是一个难题。AFP作为临床上广泛使用的一个肝癌诊断标志物,其灵敏度和特异度并不高[18],大多数患者确诊时已处于晚期。临床研究人员一直在寻找新的诊断HCC的血液标志物,如AFP-L3、异常凝血酶原和鳞状细胞癌抗原[19],但尚未广泛使用。本研究发现,从CHB发展到LC再到HCC的过程中,血浆胱氨酸、苯丙氨酸和甘氨酸水平逐渐升高,BCAA/AAA比值逐渐降低,苏氨酸水平是先升高后降低。因此,多种氨基酸的组合可能有利于预测并区分CHB、LC和HCC,它们的临床价值还有待进一步研究。监测氨基酸相关代谢酶和代谢途径的变化可以直接反映HCC发展过程中的代谢特征和致病机制。通过分析差异表达氨基酸和79种氨基酸相关代谢酶的联合途径发现,从CHB发展到LC再到HCC过程中显著改变的代谢途径主要集中在苯丙氨酸、酪氨酸和色氨酸生物合成,缬氨酸、亮氨酸和异亮氨酸生物合成,苯丙氨酸代谢等。这些发现揭示了肝癌发展过程中的一部分代谢变化及其机制,为下一步详细阐述氨基酸相关代谢酶的表达与肝癌发生发展之间的相关性及其潜在机制奠定了基础。
CHB发展到LC再到HCC是HCC发生的三部曲,由于临床上对患者氨基酸的分析尚未完全普及,而且对同一个患者疾病进程的追踪研究有一定困难。因此,笔者分别选择CHB、LC和HCC患者,比较其氨基酸水平的差异及变化趋势,初步分析与疾病进展相关的氨基酸,并对其进行代谢通路及代谢相关酶的分析,探讨与肝癌进展过程相关的代谢机制,这些对肝癌患者的早期预警和预后也具有一定的指导意义。
参考文献
[1] DUSHEIKO G,AGARWAL K,MAINI M K. New approaches to chronic hepatitis B[J]. N Engl J Med,2023,388(1):55-69. doi:10.1056/NEJMra2211764.
[2] LIN C L,KAO J H. Development of hepatocellular carcinoma in treated and untreated patients with chronic hepatitis B virus infection[J]. Clin Mol Hepatol,2023,29(3):605-622. doi:10.3350/cmh.2022.0342.
[3] ZHOU H,SONG T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma[J]. Biosci Trends,2021,15(3):155-160. doi:10.5582/bst.2021.01091.
[4] WU L,SHI R,BAI H,et al. Porphyromonas gingivalis induces increases in branched-chain amino acid levels and exacerbates liver injury through livh/livk[J]. Front Cell Infect Microbiol,2022,12:776996. doi:10.3389/fcimb.2022.776996.
[5] 孙明辉,闻赵燕,齐若瑶,等. 支链氨基酸水平与恶性肿瘤发病和预后关系研究进展[J]. 公共卫生与预防医学,2022,33(3):1-5. SUN M H,WEN Z Y,QI R Y,et al. Research progress on the relationship between branched chain amino acid levels and the incidence and prognosis of malignant tumors[J]. J Pub Health Prev Med,2022,33(3):1-5. doi:10.3969/j.issn.1006-2483.2022.03.001.
[6] 中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2022年版)[J]. 实用肝脏病杂志,2023,26(3):S18-S39. Chinese Society of Hepatology,Chinese Medical Association;Chinese Society of Infectious Diseases,Chinese Medical Association. The guidelines of prevention and treatment for chronic hepatitis B(2022 version)[J]. J Prac Hepatol,2023,26(3):S18-S39. doi:10.3760/cma.j.cn311365-20230220-00050.
[7] 中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗指南(2022年版)[J]. 中华肝脏病杂志,2022,30(4):367-388. Bureau of Medical Administration,National Health Commission of the Peoples Republic of China. Guidelines for diagnosis and treatment of primary liver cancer in China (2022 edition)[J]. Chin J Hepatol,2022,30(4):367-388. doi:10.3760/cma.j.cn501113-20220413-00193.
[8] 吴琼,李锦源,黄文涛,等. 金合欢素对肝癌HepG2细胞增殖、凋亡和迁移的影响及机制研究[J]. 天津医药,2023,51(3):235-239. WU Q,LI J Y,HUANG W T,et al. Effects of acacetin on proliferation,apoptosis and migration of hepatocellular carcinoma HepG2 cells and its mechanism[J]. Tianjin Med J,2023,51(3):235-239. doi:10.11958/20221115.
[9] ZHAO Y,ZHANG J,WANG S,et al. Identification and validation of a nine-gene amino acid metabolism-related risk signature in HCC[J]. Front Cell Dev Biol,2021,9:731790. doi:10.3389/fcell.2021.731790.
[10] MRDJEN M,HUANG E,PATHAK V,et al. Dysregulated meta-organismal metabolism of aromatic amino acids in alcohol-associated liver disease[J]. Hepatol Commun,2023,7(11):e0284. doi:10.1097/HC9.0000000000000284.
[11] SIVANAND S,VANDER HEIDEN M G. Emerging roles for branched-chain amino acid metabolism in cancer[J]. Cancer Cell,2020,37(2):147-156. doi:10.1016/j.ccell.2019.12.011.
[12] STANKOVI? I M,NIU S,HALL M B,et al. Role of aromatic amino acids in amyloid self-assembly[J]. Int J Biol Macromol,2020,156:949-959. doi:10.1016/j.ijbiomac.2020.03.064.
[13] SEARS S M,HEWETT S J. Influence of glutamate and GABA transport on brain excitatory/inhibitory balance[J]. Exp Biol Med(Maywood),2021,246(9):1069-1083. doi:10.1177/1535370221989263.
[14] WANDERS D,HOBSON K,JI X. Methionine restriction and cancer biology[J]. Nutrients,2020,12(3):684. doi:10.3390/nu12030684.
[15] KAISER P. Methionine dependence of cancer[J]. Biomolecules,2020,10(4):568. doi:10.3390/biom10040568.
[16] MATOS A,CARVALHO M,BICHO M,et al. Arginine and arginases modulate metabolism,tumor microenvironment and prostate cancer progression[J]. Nutrients,2021,13(12):4503. doi:10.3390/nu13124503.
[17] PAN S,FAN M,LIU Z,et al. Serine,glycine and one?carbon metabolism in cancer(review)[J]. Int J Oncol,2021,58(2):158-170. doi:10.3892/ijo.2020.5158.
[18] LUO P,WU S,YU Y,et al. Current status and perspective biomarkers in AFP negative HCC:towards screening for and diagnosing hepatocellular carcinoma at an earlier stage[J]. Pathol Oncol Res,2020,26(2):599-603. doi:10.1007/s12253-019-00585-5.
[19] SAMMAN B S,HUSSEIN A,SAMMAN R S,et al. Common sensitive diagnostic and prognostic markers in hepatocellular carcinoma and their clinical significance:a review[J]. Cureus,2022,14(4):e23952. doi:10.7759/cureus.23952.
(2023-10-17收稿 2024-03-26修回)
(本文编辑 李鹏)
