双链RNA依赖的蛋白激酶与阿尔茨海默病相关性研究进展
2024-07-08龚奕肖星洋胡有生谢义炜伍知辉
龚奕 肖星洋 胡有生 谢义炜 伍知辉

摘要:阿尔茨海默病(AD)是一种严重威胁人类健康的疾病,也是引起人类死亡的三大因素之一。双链RNA依赖的蛋白激酶(PKR)又称为前炎症细胞因子,是人类先天免疫干扰素刺激因子之一。在AD发生和发展中,PKR表达上调并持续激活,一方面引发脑组织细胞发生整合应激反应,另一方面间接上调β位淀粉样前体蛋白裂解酶1的表达,促进β淀粉样蛋白(Aβ)的积累,而Aβ的积累又可以激活PKR,进一步促进Aβ的积累,形成一个Aβ持续积累的循环。PKR还可以促进Tau蛋白磷酸化,降低神经细胞微管稳定性。脑组织炎症反应、Aβ的积累所引起神经毒性和微管稳定性的破坏会导致AD发生发展,引起患者记忆和认知的下降,因此PKR是AD发生发展中的关键分子。有效进行PKR检测可以预测AD进展,为临床治疗AD提供先机。目前PKR已成为研发治疗AD药物的靶点,因此靶向PKR的抑制剂有望控制PKR的活性,从而有效控制AD发生发展。
关键词:阿尔茨海默病;双链RNA依赖的蛋白激酶;β淀粉样蛋白;Tau蛋白
中图分类号: R34 文献标识码: A 文章编号:1000-503X(2024)03-0425-10
DOI:10.3881/j.issn.1000-503X.15792
Research Advances in the Association Between Alzheimers Disease and Double-Stranded RNA-Dependent Protein Kinase
GONG Yi XIAO Xingyang HU Yousheng 2,XIE Yiwei3,WU Zhihui3
1Fuzhou Medical College,Nanchang University,Fuzhou,Jiangxi 344000,China
2Key Laboratory of Chronic Diseases of Fuzhou Medical College,Nanchang University,Fuzhou,Jiangxi 344000,China
3Health Science Center,Jinggangshan University,Jian,Jiangxi 343009,China
Corresponding author:HU Yousheng Tel:0794-825168 E-mail:huyousheng68@163.com
ABSTRACT:Alzheimers disease (AD) is a severe threat to human health and one of the three major causes of human death.Double-stranded RNA-dependent protein kinase (PKR) is an interferon-induced protein kinase involved in innate immunity.In the occurrence and development of AD,PKR is upregulated and continuously activated.On the one hand,the activation of PKR triggers an integrated stress response in brain cells.On the other hand,it indirectly upregulates the expression of β-site amyloid precursor protein cleaving enzyme 1 and facilitates the accumulation of amyloid-β protein (Aβ),which could activate PKR activator to further activate PKR,thus forming a sustained accumulation cycle of Aβ.In addition,PKR can promote Tau phosphorylation,thereby reducing microtubule stability in nerve cells.Inflammation in brain tissue,neurotoxicity resulted from Aβ accumulation,and disruption of microtubule stability led to the progression of AD and the declines of memory and cognitive function.Therefore,PKR is a key molecule in the development and progression of AD.Effective PKR detection can aid in the diagnosis and prediction of AD progression and provide opportunities for clinical treatment.The inhibitors targeting PKR are expected to control the activity of PKR,thereby controlling the progression of AD.Therefore,PKR could be a target for the development of therapeutic drugs for AD.
Key words:Alzheimers disease;double-stranded RNA-dependent protein kinase;amyloid-beta;Tau
Acta Acad Med Sin,2024,46(3):425-434
阿尔茨海默病(Alzheimers disease,AD)是一种慢性神经退行性病变引起的疾病。轻度AD患者首先表现为轻度认知障碍,约15%的轻度患者在两年后病情会发展成中重度痴呆[1]。中度AD患者在记忆和语言方面会产生障碍,且难以完成洗澡和穿衣等日常事务。重度AD患者大脑中参与运动调节和控制吞咽的区域会受损,出现卧床不起、进食和饮水困难等症状[2]。有研究认为AD是一种复杂的疾病,由遗传和环境因素及其他复杂的原因(如性别、年龄和不良生活习惯等)导致[3]。
AD引起老年痴呆的特征表现为思维和个人日常活动独立性的下降,也是全球第五大死亡原因。目前全球约有5000万AD患者,预测每5年会增长1倍,到2050年全球AD患者将可能增至1.52亿。AD造成的经济负担不仅影响个人、家庭,同时预计还会造成全球社会经济每年损失达1万亿美元[3]。目前尚未发现完全治愈AD的方法,现有的治疗方案也只能改善患者症状,但AD的预防、早期诊断和早期干预却可及时有效地延缓AD的发生发展。
目前研究者普遍认为影响AD发生发展关键因素是患者脑内出现的β淀粉样蛋白(amyloid-β protein,Aβ)斑块和Tau蛋白过度磷酸化[4-11]。研究发现,双链RNA依赖的蛋白激酶(double-stranded RNA-dependent protein kinase,PKR)异常表达和激活不仅会使中枢神经系统中炎症因子的表达增加,还会促进Aβ积累和Tau蛋白过度磷酸化,PKR在AD发生发展过程中的作用不仅体现在mRNA水平的调节上,还表现在对AD关键致病蛋白的翻译调控上,因此PKR与AD的发生发展密切相关[12-18]。通过对AD患者脑组织中PKR及其作用机制的研究可以帮助我们更好地了解AD发病机制,有针对性地制订AD的治疗方案[15-18]。本文将AD与PKR关系的研究进展进行综述。
1 AD的发病机制
目前,研究人员普遍认为AD发病的主要机制如下:(1)Aβ积累形成的Aβ斑块会引起炎症等一系列反应,促使神经元细胞变性,从而诱导痴呆发生;(2)Tau蛋白变性导致神经原纤维变性,进一步引起神经元细胞变性,从而诱导痴呆发生[4]。Aβ是通过淀粉样前体蛋白(amyloid precursor protein,APP)被β位淀粉样前体蛋白裂解酶1(β-site amyloid precursor protein cleaving enzyme BACE1)和γ-分泌酶依次作用后裂解释放出Aβ[5]。Cline等[6]提出Aβ形成的级联反应假说:Aβ及其寡聚形式的积累可能导致许多有害的后果,如出现大量炎症反应、神经元坏死和突触功能障碍等,从而诱导痴呆的发生。Tau蛋白又称微管相关蛋白Tau,具有微管结合结构域,参与微管装配和稳定,以维持细胞骨架的完整性[7-8]。Tau蛋白过度磷酸化降低其对微管的亲和力,造成易形成神经原纤维缠结,并沉积在胞质溶胶中,导致不能执行维持细胞结构的功能,且这种沉积还会严重影响正常的细胞功能,如突触传递、轴突运输、信号转导,导致神经细胞逐渐退化,从而诱导痴呆发生[9]。Tau蛋白磷酸化对Aβ积累会起到一定抑制作用,可能的机制是通过Tau蛋白磷酸化诱导小胶质细胞活化状态改变,增加小胶质细胞吞噬能力,从而增强了不溶性Aβ的清除[10]。磷酸化的Tau蛋白从突触后位点解离,成为其他激酶的底物,导致不同位点的过度磷酸化,这种过度磷酸化的Tau蛋白还可以通过轴突内连接从轴突扩散到其他健康神经元内,该过程常会引起突触功能障碍,导致神经变性和痴呆症状[11](图1)。
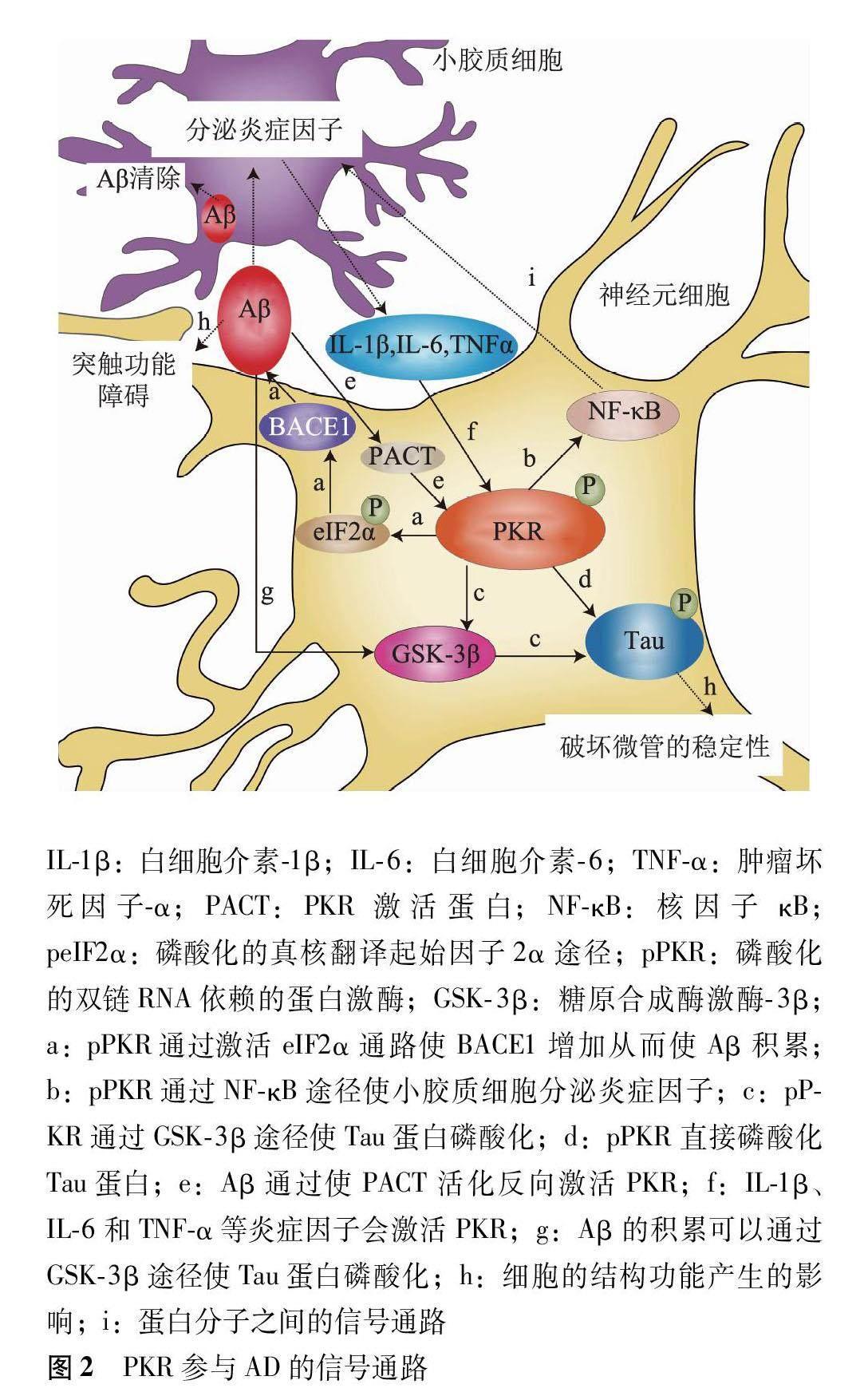
PKR是一种广泛表达的蛋白激酶,在AD的发生发展过程中发挥了重要作用[12-18]。PKR通过多途径参与AD的发生发展,PKR活化后能够磷酸化真核翻译起始因子2α(eukaryotic translation initiation factor 2α,eIF2α),从而抑制蛋白翻译,引起神经细胞凋亡[12]。活化的PKR也可以通过核因子κB(nuclear factor κB,NF-κB)途径激活转录,上调在中枢神经系统中表达的多种炎症因子,从而引起痴呆发生[13]。PKR还可以通过控制如BACE1和γ-分泌酶等蛋白质的合成,促进Aβ积累和Tau蛋白过度磷酸化,从而影响突触的信号传递和记忆认知的功能,使AD进一步恶化[14-18](图2)。
2 PKR与AD的神经炎症及整合应激反应
2.1 AD与整合应激反应
AD患者的主要症状是神经胶质细胞介导的神经炎症。大脑中的小胶质细胞和星形胶质细胞在中枢神经系统中有着先天性免疫功能,小胶质细胞和星形胶质细胞可以介导促炎症因子的释放,诱导细胞发生整合应激反应,从而调节突触产生和重组,以及还可通过非常活跃的吞噬作用和巨胞饮作用,清除死亡的神经元、细胞碎片和错误折叠的蛋白质,对突触功能造成损害来影响学习和记忆[19-22]。
有研究发现,在Aβ诱导的AD模型小鼠的脑组织中,小胶质细胞和星形胶质细胞均被激活,促炎症细胞因子表达增加,并释放大量炎症细胞因子;另有研究者在对死后AD样本的组织学分析发现了脑部炎症-老年斑周围经常能检测到星形胶质细胞和小胶质细胞的炎症反应;还有研究者对AD患者脑内表达的炎症相关基因进行统计学分析后发现,AD患者脑内的炎症基因表达也显著增强;这些研究结果表明炎症可增加AD期间突触完整性丧失和神经元变性的风险[23-27]。根据淀粉样蛋白假说,Aβ的积累是导致AD神经退行性病变事件发生的触发事件,在这个前提下BACE1水平升高也参与了AD的发病或进展[28-29]。当Aβ积累时,神经元凋亡并伴随炎性细胞因子和其他蛋白表达的增加,这些
蛋白质包括白细胞介素(interleukin,IL)-1β、IL-6、IL-8和肿瘤坏死因子(tumor necrosis factor,TNF)-α等[30](图2)。神经系统在大量的炎症细胞因子刺激下产生慢性神经炎症,诱导细胞发生适应性自救反应,称为整合应激反应,该反应可以促进Aβ积累,造成神经元变性,损害突触功能,从而影响记忆和认知能力,也是导致AD发生发展的关键反应之一[24-31]。
2.2 整合应激反应中的PKR及其与AD的关系
整合应激反应是指细胞在接收到应激信号后,迅速减少整体的蛋白质合成,同时增加特定蛋白翻译以维持细胞稳态的一系列反应,该反应通过调控神经系统中重要蛋白质参与神经退行性疾病的发生发展[31]。整合应激反应的主要分子事件是激活PKR-eIF2α途径,进而PKR又被称为前炎症细胞因子[31-32]。PKR在先天免疫中是一个活跃的参与者,可通过丝裂原活化蛋白激酶、干扰素调节因子3 (interferon regulatory factor 3,IRF3)和NF-κB参与炎症反应途径,增强炎症反应,从而诱导AD发生发展[33]。有研究表明在AD早期,PKR可通过NF-κB和丝裂原活化蛋白激酶途径来促进炎症反应,诱导炎症细胞因子释放、增强NF-κB活性,从而增强炎症反应[34]。
目前,有实验用天麻素、肝豆汤改良方等制剂可以抑制PKR/eIF2α通路,从而实现了改善认知功能障碍小鼠模型中的小鼠记忆认知功能[35-36]。随着AD患者病情进一步的发展恶化,AD晚期患者脑中的炎症信号显著增强,从而增加了小胶质细胞和星形胶质细胞活化,使小胶质细胞和星形胶质细胞在清除更多Aβ的同时,也通过吞噬作用清除了大量突触,导致突触功能减退,使大脑记忆认知功能进一步减退[24-37]。在AD晚期,Aβ又会反过来促进小胶质细胞活化,并诱导促炎症细胞因子如IL-1β、IL-6和TNF-α等的释放,这些炎症因子加速神经元细胞坏死,进一步导致记忆认知功能障碍,使AD晚期患者病情加重[38-41](图1)。
PKR对神经炎症的调节是AD神经炎症产生机制的重要组成部分,抑制 PKR活性可导致神经炎症减弱,神经元的修复能力增强。有研究通过使用PKR抑制剂,发现对Aβ积累和神经炎症均有一定的抑制作用,这一实验支持Aβ积累会导致神经元凋亡的假设,且有研究者在动物模型中也找到Aβ积累引起神经炎性反应的证据[42]。在小胶质细胞中,抑制PKR活性也可降低Aβ引起的神经炎症反应[42]。在最近PKR抑制剂与神经炎症反应的相关研究中发现:(1)利福平能抑制PKR活化,减轻神经炎症反应,从而发挥神经保护作用[43]。(2)选择性PKR抑制剂抑制PKR活性时,AD实验小鼠认知缺陷得到显著改善,促炎症细胞因子的积累和神经元变性显著减少[42]。(3)当使用基因沉默技术降低PKR活性时,实验小鼠的记忆和大脑的神经病理学变化表现出显著的改善[15,18]。
3 PKR与AD的神经毒性及Aβ代谢
3.1 AD的Aβ神经毒性
Aβ的来源是APP正常切割的改变而发生的一种病理现象。APP是一种集中在神经元突触中的单跨膜蛋白,在脑组织细胞中高度表达[44]。APP可以通过两种不同的途径进行加工:(1)在非淀粉样蛋白生成途径中,APP可以首先被α-分泌酶切割,然后被γ-分泌酶切割,产生较短的可溶性细胞外片段(非淀粉样的);(2)在Aβ生成途径中,APP首先被BACE1在其N-末端β域切割,而不是被α-分泌酶切割,之后被γ-C末端的分泌酶裂解,最后生成Aβ[45](图1)。Aβ的形成过程也被称作淀粉样变性,是一种蛋白质的错误折叠,具有稳定的交叉β超二级结构、纤维状和不溶于水等特征,也不能被蛋白水解酶降解。Aβ的积累会改变神经元细胞的正常功能,引发一系列病理事件,使神经元细胞功能障碍和死亡,最终导致突触缺陷和记忆功能障碍[46]。Aβ早在1984年就被鉴定,其积累在AD患者脑组织的神经元细胞外,可导致AD脑组织中神经炎性斑块的形成,神经炎性斑块也称为老年斑或淀粉样斑块,这种斑块过度积累会严重影响神经元之间的信号传递,从而影响到患者的记忆和认知能力,导致AD发生发展[46-48]。
3.2 PKR与Aβ积累
Aβ形成的关键酶是BACE 由于BACE1的mRNA的5非翻译区中含有3个上游开放阅读框,正常情况下其表达会受到抑制,而无法翻译出BACE1蛋白,Aβ也不会产生和积累[49]。有实验证明BACE1的表达可被PKR的磷酸化激活,这是通过逆转了BACE1 中mRNA的5非翻译区对BACE1翻译的抑制作用,从而导致了Aβ的产生与积累[18]。Tible等[18]通过蛋白质印迹法和酶联免疫吸附测定法证实,PKR激活可解除对BACE1表达的抑制,同时激活BACE1的翻译,进而导致Aβ的积累(图2)。有研究者在暴露于氧化应激条件下的人神经母细胞瘤细胞中发现PKR还可以上调BACE1蛋白的水平,这表明PKR激活可以促进Aβ的产生和积累[50]。这些实验都证实了PKR的过度活化会导致Aβ水平的增加,且与患者出现认知功能下降和记忆障碍有关[28-29,51]。
将PKR基因敲除后,AD小鼠表现出Aβ的积累水平降低,Aβ的神经毒性作用减弱,Aβ诱导的神经元细胞坏死数目明显减少[52]。在野生型和PKR基因敲除小鼠的原代神经元中显示,PKR的抑制剂可以明显减少Aβ的产生和积累,这表明PKR的抑制可能对增强神经保护有效[52]。在多种实验动物模型中,如在猴子脑室内注射Aβ寡聚体与TNF-α,可以诱导PKR和eIF2α磷酸化和认知障碍发生。在PKR和TNF-α基因敲除小鼠中,小鼠的认知功能下降和记忆障碍等症状可减轻,这表明TNF-α介导了PKR激活,从而诱导形成大量的Aβ寡聚体,由此所引起的神经元功能损伤和神经毒性作用[53-54]。研究者通过注射脂多糖诱导实验小鼠产生炎症反应和氧化应激,发现炎症反应和氧化应激的产生,增加小鼠脑中PKR的磷酸化,而PKR的磷酸化又会使Aβ的产生和积累,引起记忆与运动功能的障碍。通过对实验小鼠进行PKR基因的敲除/抑制后,Aβ水平会降低,记忆与运动功能的障碍也可改善[33,55-56]。
有研究通过对AD患者、APP/PS1 KI转基因小鼠和暴露于氧化应激的培养细胞进行免疫荧光检测来评估PKR激活蛋白(PKR associated protein activator,PACT)和PKR的表达水平,实验结果表明,AD患者的大脑中Aβ可诱导PACT的表达,使PKR激活,这说明Aβ的积累会反向激活PKR[57]。理论上,减少Aβ可减少PKR激活,所以通过抑制PKR激活,同时联合使用药物降低Aβ可以用来治疗AD。
总的来说,PKR在被炎症刺激的神经元细胞中表达增加,PKR激活后可通过诱导BACE1表达来上调Aβ的表达,反过来Aβ的积累可以通过活化PACT来激活PKR,又进一步促进Aβ的积累,形成了一个恶性循环,使AD进一步发展恶化(图2)。
4 PKR与AD突触传导及Tau蛋白磷酸化
4.1 Tau蛋白磷酸化对AD突触传导的影响
Tau蛋白由1个微管相关蛋白Tau基因编码,存在6种亚型[58]。Tau蛋白是一种主要在神经元轴突中表达的微管相关蛋白,其主要功能是促进微管的组装和稳定性[59]。在AD和其他Tau蛋白病的发生发展过程中,Tau蛋白的过度磷酸化是最早发生和持续病变事件之一[60]。磷酸化Tau蛋白可破坏突触组成和结构,导致突触功能障碍或突触功能的完全丧失[1 61]。当磷酸化Tau蛋白不断聚集后,可通过突触向未出现磷酸化Tau的正常神经元扩散,进一步使AD的病情恶化[62-63]。
4.2 PKR与Tau蛋白磷酸化
PKR参与了Tau蛋白的磷酸化,在对AD患者脑组织切片的检测中证实,磷酸化的PKR可以与磷酸化的Tau蛋白在受影响的神经元中共定位[64-65]。最近研究发现,PKR过表达会增加HEK-293T细胞中Tau蛋白及其mRNA的水平[62]。PKR沉默可降低SH-SY5Y细胞中Tau蛋白及其mRNA水平,在脑组织急性炎症中PKR可以不依赖其他激酶直接磷酸化Tau蛋白的多个和疾病相关的残基,触发Tau蛋白的病理转变,这说明PKR可以直接调控Tau蛋白的表达和Tau蛋白的磷酸化[62,66]。
PKR的激活与磷酸化的Tau蛋白聚集在AD病理发展中也扮演了重要角色,研究者通过对具有AD标志病变的淀粉样蛋白斑块和Tau磷酸化病变的人类神经元细胞的研究发现:磷酸化Aβ积累会使糖原合成酶激酶3β激活并导致磷酸化的Tau蛋白聚集,而PKR磷酸化又可以通过激活糖原合成酶激酶3β间接导致磷酸化的Tau蛋白聚集[67](图2)。
有研究提出在 AD发病早期,磷酸化的Tau蛋白聚集会严重影响微管细胞骨架的稳定性,从而使AD病情进一步恶化发展,PKR磷酸化直接和间接诱导Tau蛋白磷酸化,磷酸化Tau蛋白从微管中脱落,破坏了微管细胞骨架的稳定,从而使轴突的信号传导障碍,导致AD患者出现记忆认知功能的障碍,因为PKR激活会使Tau蛋白磷酸化,同时促进Tau蛋白从微管中移除的病理转变,所以PKR连接了AD神经变性中的Aβ积累机制和Tau蛋白磷酸化机制[62](图2)。
5 PKR与AD的诊断和临床治疗
5.1 PKR与AD的诊断
到目前为止,很难在血液或脑脊液中找到一种可靠的生物标志物来预测AD患者的认知衰退程度。AD患者大脑中活化的PKR水平有所增加,且AD患者的外周血淋巴细胞中的总PKR及磷酸化PKR水平均有所升高[68-69]。研究者通过对PKR进行抑制后来观察对患者的记忆、认知等的影响,发现当抑制PKR之后,患者明显减少了神经元的损伤和变性,Tau蛋白的磷酸化水平也降低,同时恢复了突触可塑性,又减少神经炎症等,因此PKR有希望成为未来预测AD的标志物[18,35,43,63]。
大量科研团队开始进行PKR与AD疾病预测及后续发展的趋势相关性的研究。有研究发现通过检测脑脊液中磷酸化PKR浓度可以预测AD患者未来的认知功能衰退程度[70]。有研究证明了磷酸化PKR较经典生物标志物对AD患者病情发展的速度预测有更好的效果,但是脑脊液抽取存在侵入性、有创性以及成像技术的高昂费用等问题,研究者希望还是寻找血源性生物标志物进行AD预测和诊断[71]。生晓娜等[68]通过临床研究发现AD 患者的外周血淋巴细胞中总PKR及磷酸化PKR的水平均较正常组有明显升高,同时对认知水平和PKR水平之间进行统计学分析发现AD患者淋巴细胞中的总PKR与磷酸化PKR水平与认知障碍严重程度呈正相关。Monllor等[69]通过研究证明PKR与Aβ积累相关,PKR的血清浓度反映了患者的淀粉样病变程度,说明PKR是AD的潜在生物标志物。这些研究结果表明使用PKR检测比传统的检测方法更有助于助于AD的早期诊断,同时还可以更好地检测AD的发展和预后情况,PKR检测在未来或许可以成为 AD病情的早期诊断及评价的一种更有效的方法。
5.2 PKR对AD治疗的潜在作用
AD通常以记忆和认知能力下降为标志,PKR的激活与记忆和认知功能障碍有关,PKR的上调和激活会加速细胞外Aβ形成,导致大脑海马区神经元细胞凋亡增加,PKR的激活可以通过促进Tau蛋白磷酸化而抑制神经突触的形成和发展,因此PKR是影响记忆和认知过程中的关键分子[15,62,72]。
天麻素在AD转基因Tg2576小鼠中作为PKR抑制剂,能降低AD实验小鼠发生记忆障碍的水平[36]。在AD转基因模型5xFAD小鼠中PKR基因缺失可以减少5xFAD小鼠的发生记忆障碍,且部分挽救了在5xFAD小鼠模型中观察到的空间记忆缺陷[18]。这些实验均反映出PKR对AD的发展和恶化起重要作用,为未来通过抑制PKR来治疗或缓解AD提供了思路。
目前已有研究开始探索PKR在AD发展中的作用的临床应用,但还未开发出有效临床治疗药物[73]。默克公司研发的治疗AD候选药物verubecestat完成了两项大型Ⅲ期临床试验,一项针对轻度至中度AD,另一项针对前驱期AD,但这两项试验均因无效而提前终止,其中失败的因素还需要通过进一步的试验来探索论证[73-74]。
6 总结与展望
综上,在AD进展过程中,PKR起着关键的作用。PKR活化可通过一个闭环反复活化,导致Aβ不断积累。PKR活化可以通过NF-κB途径促进炎症细胞因子的表达,还可以通过PKR-eIF2α途径抑制蛋白翻译,引起神经细胞凋亡,从而使AD进一步发展。
AD是一个多因素引发、发病机制复杂的疾病。目前,AD尚无有效检测预测和治疗手段。PKR参与了AD发生发展的多个病理生理过程,特别是在PKR活化eIF2α磷酸化,整体蛋白翻译抑制的条件下,APP和炎症细胞因子蛋白却表达上调,并在AD的发展中导致Aβ积累和炎症反应增强。因此,对于AD进展过程中,蛋白翻译表达调控机制仍需要深入地研究,AD患者中PKR表达谱、突变谱和PKR在AD进程中的活性变化也需要进一步研究。AD诊疗需开发更有效、准确地检测PKR来预测AD发生发展的试剂盒,并进一步开展PKR抑制剂研究,开发出有效缓解和治疗AD的相关药物。
利益冲突 所有作者声明无利益冲突
作者贡献声明 龚奕:文献研究、图片绘制、文稿撰写和修改;肖星洋:文献筛选和整理分类;胡有生:研究思路和撰写大纲提出;谢义炜:流行病学和临床医学数据搜集和分析;伍知辉:参与文稿撰写和校正,并同意対研究工作诚信负责
参 考 文 献
[1]Petersen RC,Lopez O,Armstrong MJ,et al.Practice guideline update summary:mild cognitive impairment:report of the Guideline Development,Dissemination,and Implementation Subcommittee of the American Academy of Neurology[J].Neurology,2018,90(3):126-135.DOI:10.1212/wnl.0000000000004826.
[2]Alzheimers Association.2023 Alzheimers disease facts and figures[J].Alzheimers Dement,2023,19(4):1598-1695.DOI:10.1002/alz.13016.
[3]Livingston G,Huntley J,Sommerlad A,et al.Dementia prevention,intervention,and care:2020 report of the Lancet Commission[J].Lancet (London,England),2020,396(10248):413-446.DOI:10.1016/s0140-6736(20)30367-6.
[4]Kapasi A,Leurgans SE,Arvanitakis Z,et al.Abeta (Amyloid Beta) and Tau tangle pathology modifies the association between small vessel disease and cortical microinfarcts[J].Stroke,202 52(3):1012-1021.DOI:10.1161/STROKEAHA.120.031073.
[5]Behl T,Kaur I,Fratila O,et al.Exploring the potential of therapeutic agents targeted towards mitigating the events associated with Amyloid-β cascade in Alzheimers disease[J].Int J Mol Sci,2020,21(20):7473.DOI:10.3390/ijms21207443.
[6]Cline EN,Bicca MA,Viola KL,et al.The amyloid-β oligomer hypothesis:beginning of the third decade[J].J Alzheimers Dis,2018,64(s1):S567-S610.DOI:10.3233/jad-179941.
[7]Hamano T,Enomoto S,Shirafuji N,et al.Autophagy and Tau protein[J].Int J Mol Sci,202 22(14):7574.DOI:10.3390/ijms22147475.
[8]Otero-Garcia M,Mahajani SU,Wakhloo D,et al.Molecular signatures underlying neurofibrillary tangle susceptibility in Alzheimers disease[J].Neuron,2022,110(18):2929-2948.e8.DOI:10.1016/j.neuron.2022.06.021.
[9]Huang F,Wang M,Liu R,et al.CDT2-controlled cell cycle reentry regulates the pathogenesis of Alzheimers disease[J].Alzheimers Dement,2019,15(2):217-231.DOI:10.1016/j.jalz.2018.08.013.
[10]Wang Q,Xie C.Microglia activation linking amyloid-β drive tau spatial propagation in Alzheimers disease[J].Front Neurosci,2022,16:951128.DOI:10.3389/fnins.2022.951128.
[11]Ittner A,Ittner LM.Dendritic Tau in Alzheimers disease[J].Neuron,2018,99(1):13-27.DOI:10.1016/j.neuron.2018.06.003.
[12]Chukwurah E,Farabaugh KT,Guan BJ,et al.A tale of two proteins:PACT and PKR and their roles in inflammation[J].FEBS J,202 288(22):6365-6391.DOI:10.1111/febs.15691.
[13]Lee S,Jee HY,Lee YG,et al.PKR-Mediated phosphorylation of eIF2a and CHK1 is associated with doxorubicin-mediated apoptosis in hCC1143 triple-negative breast cancer cells[J].Int J Mol Sci,2022,23(24):15872.DOI:10.3390/ijms232415872.
[14]Zhang J,Zhang X,Li L,et al.Activation of double-stranded RNA-activated protein kinase in the dorsal root ganglia and spinal dorsal horn regulates neuropathic pain following peripheral nerve injury in rats[J].Neurotherapeutics,2022,19(4):1381-1400.DOI:10.1007/s13311-022-01255-2.
[15]Lu W,Tang S,Li A,et al.The role of PKC/PKR in aging,Alzheimers disease,and perioperative neurocognitive disorders[J].Front Aging Neurosci,2022,14:973068.DOI:10.3389/fnagi.2022.973068.
[16]Upadhyay A,Chhangani D,Rao NR,et al.Amyloid fibril proteomics of AD brains reveals modifiers of aggregation and toxicity[J].Mol Neurodegener,2023,18(1):61.DOI:10.1186/s13024-023-00654-z.
[17]Futamura A,Hieda S,Mori Y,et al.Toxic Amyloid-β42 conformer may accelerate the onset of Alzheimers disease in the preclinical stage[J].J Alzheimers Dis,202 80(2):639-646.DOI:10.3233/jad-201407.
[18]Tible M,Mouton Liger F,Schmitt J,et al.PKR knockout in the 5xFAD model of Alzheimers disease reveals beneficial effects on spatial memory and brain lesions[J].Aging cell,2019,18(3):e12887.DOI:10.1111/acel.12887.
[19]Hasan U,Singh SK.The Astrocyte-Neuron Interface:An overview on molecular and cellular dynamics controlling formation and maintenance of the tripartite synapse[J].Methods Mol Biol,2019,1938:3-18.DOI:10.1007/978-1-4939-9068-9_1.
[20]Ikegami A,Haruwaka K,Wake H.Microglia:lifelong modulator of neural circuits[J].Neuropathology,2019,39(3):173-180.DOI:10.1111/neup.12560.
[21]Konishi H,Kiyama H,Ueno M.Dual functions of microglia in the formation and refinement of neural circuits during development[J].Int J Dev Neurosci,2019,77:18-25.DOI:10.1016/j.ijdevneu.2018.09.009.
[22]Olsen M,Aguilar X,Sehlin D,et al.Astroglial responses to amyloid-beta progression in a mouse model of Alzheimers disease[J].Mol Imaging Biol,2018,20(4):605-614.DOI:10.1007/s11307-017-1153-z.
[23]Litwiniuk A,Juszczak GR,Stankiewicz AM,et al.The role of glial autophagy in Alzheimers disease[J].Mol Psychiatry,2023,28(11):4528-4539.DOI:10.1038/s41380-023-02242-5.
[24]Liu Q,Contreras A,Afaq MS,et al.Intensity-dependent gamma electrical stimulation regulates microglial activation,reduces beta-amyloid load,and facilitates memory in a mouse model of Alzheimers disease[J].Cell Biosci,2023,13(1):138.DOI:10.1186/s13578-023-01085-5.
[25]Zhang Y,Jia J.Betaine Mitigates Amyloid-β-Associated neuroinflammation by suppressing the NLRP3 and NF-κB signaling pathways in microglial cells[J].J Alzheimers Dis,2023,94(s1):S9-S19.DOI:10.3233/jad-230064.
[26]Liu W,Chen S,Rao X,et al.The inflammatory gene PYCARD of the entorhinal cortex as an early diagnostic target for Alzheimers disease[J].Biomedicines,2023,11(1):194.DOI:10.3390/biomedicines11010194.
[27]panic′ E,Langer Horvat L,Ilic′ K,et al.NLRP1 inflammasome activation in the hippocampal formation in Alzheimers disease:correlation with neuropathological changes and unbiasedly estimated neuronal loss[J].Cells,2022,11(14):2223.DOI:10.3390/cells11142223.
[28]Bouteiller JC,Mergenthal AR,Hu E,et al.Pathogenic processes underlying Alzheimers disease:modeling the effects of Amyloid beta on synaptic transmission[J].Annu Int Conf IEEE Eng Med Biol Soc,2019,2019:1956-1959.DOI:10.1109/embc.2019.8857871.
[29]Castellani RJ,PLASCENCIA-VILLA G,Perry G.The amyloid cascade and Alzheimers disease therapeutics:theory versus observation[J].Lab Invest,2019,99(7):958-970.DOI:10.1038/s41374-019-0231-z.
[30]Ratan Y,Rajput A,Maleysm S,et al.An insight into cellular and molecular mechanisms underlying the pathogenesis of neurodegeneration in Alzheimers disease[J].Biomedicines,2023,11(5):1398.DOI:10.3390/biomedicines11051398.
[31]Bond S,Lopez-Lloreda C,Gannon PJ,et al.The integrated stress response and phosphorylated eukaryotic initiation factor 2α in neurodegeneration[J].J Neuropathol Exp Neurol,2020,79(2):123-143.DOI:10.1093/jnen/nlz129.
[32]Qiao H,Jiang T,Mu P,et al.Cell fate determined by the activation balance between PKR and SPHK1[J].Cell Death Differ,202 28(1):401-418.DOI:10.1038/s41418-020-00608-8.
[33]Hugon J,Paquet C.The PKR/P38/RIPK1 signaling pathway as a therapeutic target in Alzheimers disease[J].Int J Mol Sci,202 22(6):3136.DOI:10.3390/ijms22063136.
[34]Chiarini A,Armato U,Hu P,et al.Danger-Sensing/Patten recognition receptors and neuroinflammation in Alzheimers disease[J].Int J Mol Sci,2020,21(23):9036.DOI:10.3390/ijms21239036.
[35]刘松杨,程楠,徐陈陈,等.肝豆汤改良方调控PKR/eIF2α通路改善Wilson病模型TX小鼠突触功能障碍的机制研究[J].安徽中医药大学学报,202 40(6):75-81.DOI:10.3969/j.issn.2095-7246.2021.06.017.
[36]Zhang J S,Zhou SF,Wang Q,et al.Gastrodin suppresses BACE1 expression under oxidative stress condition via inhibition of the PKR/eIF2α pathway in Alzheimers disease[J].Neuroscience,2016,325:1-9.DOI:10.1016/j.neuroscience.2016.03.024.
[37]Ries M,Sastre M.Mechanisms of Aβ clearance and degradation by glial cells[J].Front Aging Neurosci,2016,8:160.DOI:10.3389/fnagi.2016.00160.
[38]Khandelwal PJ,Herman AM,Moussa CE.Inflammation in the early stages of neurodegenerative pathology[J].J Neuroimmunol,201 238(1-2):1-11.DOI:10.1016/j.jneuroim.2011.07.002.
[39]Deng Z,Dong Y,Zhou X,et al.Pharmacological modulation of autophagy for Alzheimers disease therapy:opportunities and obstacles[J].Acta Pharm Sin B,2022,12(4):1688-1706.DOI:10.1016/j.apsb.2021.12.009.
[40]Suresh S,Larson J,Jenrow KA.Chronic neuroinflammation impairs waste clearance in the rat brain[J].Front Neuroanat,2022,16:1013808.DOI:10.3389/fnana.2022.1013808.
[41]Doroszkiewicz J,Mroczko P,Kulczyńska-Przybik A.Inflammation in the CNS:understanding various aspects of the pathogenesis of Alzheimers disease[J].Curr Alzheimer Res,2022,19(1):16-31.DOI:10.2174/1567205018666211202143935.
[42]Lopez-Grancha M,Bernardelli P,Moindrot N,et al.A novel selective PKR inhibitor restores cognitive deficits and neurodegeneration in Alzheimer disease experimental models[J].J Pharmacol Exp Ther,202 378(3):262-275.DOI:10.1124/jpet.121.000590.
[43]邓嘉强,井秀娜,林淡钰,等.利福平通过抑制蛋白激酶R活化调节鱼藤酮诱导的小胶质细胞炎症而发挥神经保护作用[J].岭南急诊医学杂志,202 26(2):121-124.DOI:10.3969/j.issn.1671-301X.2021.02.004.
[44]Rice HC,de Malmazet D,Schreurs A,et al.Secreted amyloid-β precursor protein functions as a GABA(B)R1a ligand to modulate synaptic transmission[J].Science,2019,363(6423):eaao4827.DOI:10.1126/science.aao4827.
[45]Maucat-Tan NB,Saadipour K,Wang YJ,et al.Cellular trafficking of amyloid precursor protein in amyloidogenesis physiological and pathological significance[J].Mol Neurobiol,2019,56(2):812-830.DOI:10.1007/s12035-018-1106-9.
[46]Ma C,Hong F,Yang S.Amyloidosis in Alzheimers disease:pathogeny,etiology,and related therapeutic directions[J].Molecules,2022,27(4):1210.DOI:10.3390/molecules27041210.
[47]Glenner GG,Wong CW.Alzheimers disease:initial report of the purification and characterization of a novel cerebrovascular amyloid protein[J].Biochem Biophys Res Commun,1984,120(3):885-890.DOI:10.1016/s0006-291x(84)80190-4.
[48]Yakupova EI,Bobyleva LG,Shumeyko SA,et al.Amyloids:the history of toxicity and functionality[J].Biology,202 10(5):394.DOI:10.3390/biology10050394.
[49]Guix FX,Sartório CL,Ill-Raga G.BACE1 translation:at the crossroads between Alzheimers disease neurodegeneration and memory consolidation[J].J Alzheimers Dis Rep,2019,3(1):113-148.DOI:10.3233/adr-180089.
[50]Syeda T,Cannon JR.Environmental exposures and the etiopathogenesis of Alzheimers disease:the potential role of BACE1 as a critical neurotoxic target[J].J Biochem Mol Toxicol,202 35(4):e22694.DOI:10.1002/jbt.22694.
[51]Volloch V,Rits-Volloch S.The amyloid cascade hypothesis 2.0 for Alzheimers disease and aging-associated cognitive decline:from molecular basis to effective therapy[J].Int J Mol Sci,2023,24(15):12246.DOI:10.3390/ijms241512246.
[52]Gourmaud S,Mouton-Liger F,Abadie C,et al.Dual kinase inhibition affords extended in vitro neuroprotection in Amyloid-β toxicity[J].J Alzheimers Dis,2016,54(4):1659-1670.DOI:10.3233/jad-160509.
[53]Lourenco MV,Clarke JR,Frozza RL,et al.TNF-α mediates PKR-dependent memory impairment and brain IRS-1 inhibition induced by Alzheimers β-amyloid oligomers in mice and monkeys[J].Cell Metab,2013,18(6):831-843.DOI:10.1016/j.cmet.2013.11.002.
[54]Chan AWS,Cho IK,Li CX,et al.Cerebral Aβ deposition in an Aβ-precursor protein-transgenic rhesus monkey[J].Aging Brain,2022,2:100044.DOI:10.1016/j.nbas.2022.100044.
[55]Mouton-Liger F,Rebillat AS,Gourmaud S,et al.PKR downregulation prevents neurodegeneration and β-amyloid production in a thiamine-deficient model[J].Cell Death Dis,2015,6(1):e1594.DOI:10.1038/cddis.2014.552.
[56]Carret-Rebillat AS,Pace C,GourmauDS,et al.Neuroinflammation and Aβ accumulation linked to systemic inflammation are decreased by genetic PKR down-regulation[J].Sci Rep,2015,5:8489.DOI:10.1038/srep08489.
[57]Paquet C,Mouton-Liger F,Meurs EF,et al.The PKR activator PACT is induced by Aβ:involvement in Alzheimers disease[J].Brain Pathol,2012,22(2):219-229.DOI:10.1111/j.1750-3639.2011.00520.x.
[58]Chen Y,Yu Y.Tau and neuroinflammation in Alzheimers disease:interplay mechanisms and clinical translation[J].J Neuroinflammation,2023,20(1):165.DOI:10.1186/s12974-023-02853-3.
[59]el Mammeri N,Duan P,Dregni AJ,et al.Amyloid fibril structures of tau:conformational plasticity of the second microtubule-binding repeat[J].Sci Adv,2023,9(28):eadh4731.DOI:10.1126/sciadv.adh4731.
[60]Congdon EE,Sigurdsson EM.Tau-targeting therapies for Alzheimer disease[J].Nat Rev Neurol,2018,14(7):399-415.DOI:10.1038/s41582-018-0013-z.
[61]Dejanovic B,Huntley MA,de Mazière A,et al.Changes in the synaptic proteome in tauopathy and rescue of Tau-induced synapse loss by c1q antibodies[J].Neuron,2018,100(6):1322-1336.e7.DOI:10.1016/j.neuron.2018.10.014.
[62]Reimer L,Betzer C,Kofoed RH,et al.PKR kinase directly regulates tau expression and Alzheimers disease-related tau phosphorylation[J].Brain Pathol,202 31(1):103-119.DOI:10.1111/bpa.12883.
[63]Dubbelman MA,Mimmack KJ,Sprague EH,et al.Regional cerebral tau predicts decline in everyday functioning across the Alzheimers disease spectrum[J].Alzheimers Res Ther,2023,15(1):120.DOI:10.1186/s13195-023-01267-w.
[64]Moradi Majd R,Mayeli M,Rahmani F.Pathogenesis and promising therapeutics of Alzheimer disease through eIF2α pathway and correspondent kinases[J].Metab Brain Dis,2020,35(8):1241-1250.DOI:10.1007/s11011-020-00600-8.
[65]Drummond E,Pires G,Macmurray C,et al.Phosphorylated tau interactome in the human Alzheimers disease brain[J].Brain,2020,143(9):2803-2817.DOI:10.1093/brain/awaa223.
[66]Turab Naqvi AA,Hasan GM,Hassan MI.Targeting Tau hyperphosphorylation via kinase inhibition:strategy to address Alzheimers disease[J].Curr Top Med Chem,2020,20(12):1059-1073.DOI:10.2174/1568026620666200106125910.
[67]Amin J,Paquet C,Baker A,et al.Effect of amyloid-β (Aβ) immunization on hyperphosphorylated tau:a potential role for glycogen synthase kinase (GSK)-3β[J].Neuropathol Appl Neurobiol,2015,41(4):445-457.DOI:10.1111/nan.12205.
[68]生晓娜,李潇潇,张晓炜,等.阿尔茨海默病患者淋巴细胞中双链RNA-依赖的蛋白激酶水平与认知障碍的相关性[J].中风与神经疾病杂志,2017,34(8):692-695.DOI:10.19845/j.cnki.zfysjjbzz.2017.08.005.
[69]Monllor P,Giraldo E,Badia MC,et al.Serum levels of clusterin,PKR,and RAGE correlate with amyloid burden in Alzheimers disease[J].J Alzheimers Dis,202 80(3):1067-1077.DOI:10.3233/jad-201443.
[70]Dumurgier J,Mouton-Liger F,Lapalus P,et al.Cerebrospinal fluid PKR level predicts cognitive decline in Alzheimers disease[J].PLoS One,2013,8(1):e53587.DOI:10.1371/journal.pone.0053587.
[71]Paquet C,Dumurgier J,Hugon J.Pro-apoptotic kinase levels in cerebrospinal fluid as potential future biomarkers in Alzheimers disease[J].Front Neurol,2015,6:168.DOI:10.3389/fneur.2015.00168.
[72]Zeng Y,Wang L,Zhou Y,et al.NMDA receptor antagonists engender neuroprotection against gp120-induced cognitive dysfunction in rats through modulation of PKR activation,oxidative stress,ER stress and IRE1α signal pathway[J].Eur J Neurosci,2022,56(2):3806-3824.DOI:10.1111/ejn.15688.
[73]Egan MF,Kost J,Voss T,et al.Randomized trial of verubecestat for prodromal Alzheimers disease[J].N Engl J Med,2019,380(15):1408-1420.DOI:10.1056/NEJMoa1812840.
[74]Egan MF,Kost J,Tariot PN,et al.Randomized trial of verubecestat for mild-to-moderate Alzheimers disease[J].N Engl J Med,2018,378(18):1691-1703.DOI:10.1056/NEJMoa1706441.
(收稿日期:2023-08-08)
