雌性恒河猴月经周期异常与肠道微生物的相关性研究
2024-07-07谢明学赵宸颜宇宸彭正华李娇春谭银珍王学付张朝武杨武赵远
谢明学 赵宸 颜宇宸 彭正华 李娇春 谭银珍 王学付 张朝武 杨武 赵远

[摘要] 目的 以健康雌性育龄期恒河猴为研究对象,采用16S rRNA 宏基因组方法探讨雌性恒河猴月经周期异常与肠道微生物组成的相关性。方法 将27只健康雌性恒河猴分为月经规律和不规律两组,分别采集两组实验猴卵泡期(follicular phase,FP)、排卵期(ovulatory period,OP)和黄体期(luteal phase,LP)粪便样品,对16S rRNA 基因的V3~V4高变区测序,分析比较两组实验猴月经周期肠道菌群结构及多样性。结果 在门水平,规律组和不规律组猕猴在卵泡期、黄体期和排卵期 3个不同时期均以厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为主要菌群,占比总和超过98%;在属水平以普雷沃菌属_9(Prevotella_9)、瘤胃球菌(Ruminococcaceae_UCG-002)、乳杆菌属(Lactobacillus)、普雷沃菌属_2(Prevotella_2)、考拉杆菌属(Phascolarctobacterium)、瘤胃球菌_UCG-005(Ruminococcaceae_UCG-005)、链球菌属(Streptococcus)、布劳特菌属(Blautia)、普雷沃菌属_NK3B31(Prevotellaceae_NK3B31_group)、理研菌属(Rikenellaceae_RC9_gut_group)为主;在黄体期规律组厚壁菌门(Firmicutes)占比高于不规律组,而拟杆菌门(Bacteroidetes)刚好相反。规律组3个阶段,螺旋体门(Spirochaetes)均高于不规律组(P<0.05)。结论 月经周期规律与月经周期不规律的两组猕猴肠道微生物组成存在一定差异,为研究肠道细菌与排卵障碍提供一定的参考依据。
[关键词] 恒河猴;月经周期;肠道微生物;宏基因组
[中图分类号] R37 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.17.001
Study on the correlation between abnormal menstrual cycle and intestinal microbiome in female rhesus monkeys
XIE Minxue1, ZHAO Chen1, YAN Yuchen1, PEN Zhenghua1, LI Jiaochun1, TAN Yinzhen1, WANG Xuefu1, ZHANG Chaowu1, YANG Wu1, ZHAO Yuan2
1.Department of Production, Institute of Medical Biology, Chinese Academy of Medical Sciences Peking Union Medical College, Kunming 650118, Yunnan, China; 2.Laboratory Animal Department, Institute of Medical Biology, Chinese Academy of Medical Sciences Peking Union Medical College, Kunming 650118,Yunnan , China
[Abstract] Objective Using healthy female reproductive-age rhesus macaques as the research subjects, we explored the correlation between menstrual cycle abnormalities and gut microbiota composition by using 16S rRNA metagenomic sequencing. Methods Twenty-seven healthy female rhesus macaques were divided into regular menstrual and irregular menstrual groups. Fecal samples were collected at follicular phase (FP), ovulation phase (OP) and luteal phase (LP) of the two groups. The structure and diversity of bacterial flora in different physiological periods were analyzed and compared between the two groups. Results At the phylum level, Firmicutes, Bacteroidetes, and Proteobacteria dominated the sample flora in the follicular, luteal, and ovulatory phases of the rhesus macaques in both the regular and irregular groups, with a combined percentage of more than 98%. At the genus level, the genus Prevotella_9, Ruminococcaceae_UCG-002, Lactobacillus, Prevotella_2, Phascolarctobacterium, Ruminococcaceae_UCG-005, Streptococcus, Blautia, Prevotellaceae_NK3B31_group, Rikenellaceae_ RC9_gut_group were dominant. In the luteal phase the percentage of Firmicutes was higher in the regular group than in the irregular group, while the opposite was true for Bacteroidetes. Spirochaetes were higher in the regular group than in the irregular group at all 3 stages (P<0.05). Conclusion There were some differences in intestinal microbial composition between the two groups of macaques with regular and irregular menstrual cycles, which provided some reference for the study of intestinal bacteria and ovulation disorders.
[Key words] Rhesus monkey; Menstrual cycle; Gut microbes; Metagenome
人类肠道微生物群是一个高度多样化的生态系统,在个体之间变化极大[1]。这种微生物群落可能在人类健康和疾病中发挥关键作用[2]。越来越多的证据表明,宿主基因、基因表达模式、环境暴露(包括药物和饮食)和生活方式因素在界定肠道微生物多样性的界限方面发挥着重要作用[3-4]。研究表明,女性微生物多样性比男性更高,微生物组成在青春期后出现性别差异,这种差异和多样性多与其性激素的水平相关关[5-8]。人类微生物组影响女性生殖的每个阶段和水平,包括卵巢中的卵泡和卵母细胞成熟、受精和胚胎迁移、植入和整个妊娠,甚至在分娩期间[9]。
非人灵长类动物(non-human primates,NHP),因为它们在行为、生理和基因方面与人类有许多相似之处经常被用作医学研究中的动物模型[10-11]。这些相似之处扩展到肠道、皮肤和微生物群,调查表明非人灵长类动物和人类有相似的微生物物种组成[12]。在NHP动物模型中,恒河猴和食蟹猴是使用最广泛的物种[13]。恒河猴的生理周期全年都有,且它们的生殖周期与人类相似,在性周期、怀孕和产后,它们的激素水平也会发生与人类似的变化[14]。因此,以恒河猴替代人类进行生殖生理和肠道微生物研究有极大优势。然而,目前对非人灵长类动物肠道微生物种群组成的影响因素的研究主要集中在宿主种类及其系统发育关系、饮食、年龄和性别、社会互动、肠道段差异,健康状态等[15-18]。大多数研究性激素与微生物变化有关的研究都集中在阴道微生物区系上,但这些报告产生了不一致的数据,其中一些研究表明,在雌性生殖周期的过程中,阴道微生物种群发生了变化,而另一些研究则没有[19-22]。目前对肠道微生物对生理周期是否有影响知之甚少。另有报道发现,雌性小鼠肠道微生物群在整个发情周期中未发生变化[23-24]。而对于非人灵长类动物月经周期各阶段粪便微生物种群的研究未见报道。因此本研究尝试使用 16S rRNA 基因扩增子分析比较正常月经周期与异常月经周期恒河猴粪便样品中微生物组成及功能,以探究月经周期与肠道微生物种群的关系。
1 材料与方法
1.1 实验动物
健康雌性恒河猴27只,6~12岁,来自中国医学科学院医学生物学研究所,生产许可证号:SCXK滇K2020-0005,普通环境单笼饲养,每日自由饮水,饲喂全价颗粒饲料、水果,每日清洗猴笼。实验前排除国标规定的病毒及肠道致病菌。观察并记录实验猴3次月经周期,最终确定实验分组。实验内容经医学生物学研究所动物实验伦理审查委员会审查通过(伦理审批号:DWSP201810002),实验过程按实验动物使用的3R原则给予人道的关怀。
1.2 动物分组
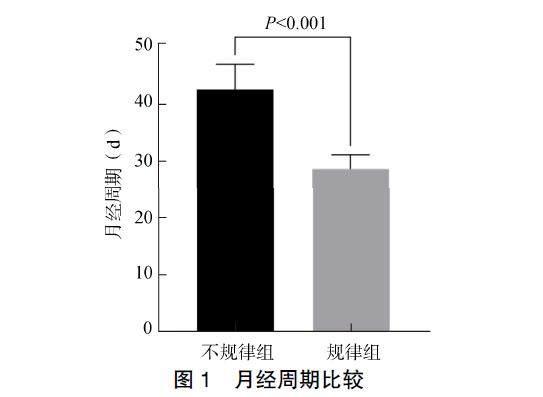
记录3次月经周期并计算平均值,根据恒河猴正常月经周期25~32d,将月经周期在此范围内的动物归为月经规律组(regular menstrual cycle,RMC,n=19),将月经周期不在此范围内的动物归为月经不规律组(irregular menstrual cycle,IMC,n=8)。最终按每1个月经周期中3个时期:卵泡期(follicular phase,FP)、排卵期(ovulatory period,OP)、黄体期(luteal phase,LP)进行分组,即:规律组_卵泡期、规律组_排卵期、规律组_黄体期和不规律组_卵泡期、不规律组_排卵期、不规律组_黄体期。
1.3 样品采集
每次观察月经周期时分别采集实验猴卵泡期、排卵期、黄体期粪便样品,粪便的采集在排泄后10min内用无菌棉签收集后置于冰盒中,迅速转至实验室-80℃冰箱冻存待检。
1.4 样品测序分析
将每只动物每个时期采集到的粪便样品提取基因组DNA,用带有条码的特异引物扩增16S rDNA的V3~V4区,引物序列为341F:5-CCTACGGGNGG CWGCAG-3;806R:5-GGACTACHVGGGTATCTA cAT-3。扩增产物回收,用QuantiFluorTM荧光计进行定量。将扩增产物等量混合,连接测序接头,构建文库,Hiseq2500 PE250上机测序。对原始数据过滤,组装、再过滤,获得有效序列,Uparse 软件对一致性>97%的序列聚类成为操作分类单位(operational taxonomic unit,OTU)。根据OTU数量绘制稀释曲线,进行Alpha多样性分析。
1.5 统计学方法
采用 SPSS 23.0统计学软件对数据进行处理分析,计量资料以均数±标准差(![]() )表示,采用Welchs T检验进行两组间比较;两个以上分组比较时,使用Kruskal-Wallis秩和检验进行差异分析。P<0.05为差异有统计学意义。
)表示,采用Welchs T检验进行两组间比较;两个以上分组比较时,使用Kruskal-Wallis秩和检验进行差异分析。P<0.05为差异有统计学意义。
2 结果
2.1 月经周期统计
平均月经周期两组动物差异有统计学意义(t=8.275,P<0.001)。见图1。
2.2 测序结果与质量分析
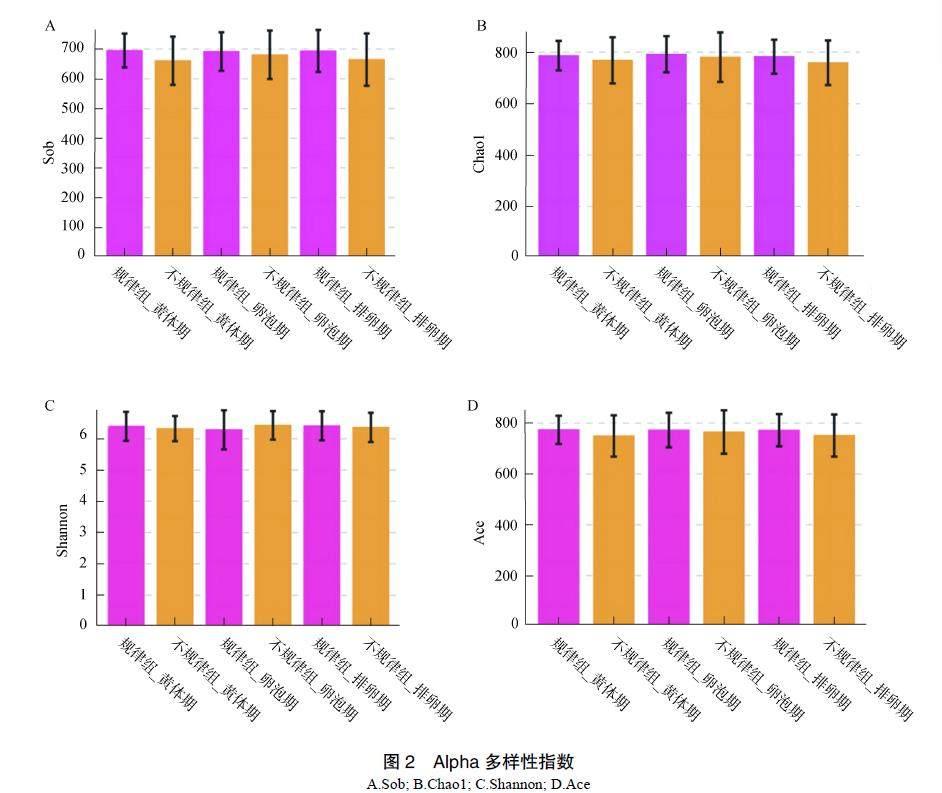
根据OTU聚类进行Alpha多样性分析,计算Sop、Chao1、Shannon、Ace指数。规律组在卵泡期、黄体期和排卵期3个不同时期的Sop、Chao1、Ace指数均高于不规律组,表明月经周期规律的猕猴肠道菌群的多样性丰富,见图2。
2.3 各阶段肠道微生物组成
在门水平,两组猕猴在卵泡期、黄体期和排卵期3个不同时期样本菌群均以厚壁菌门、拟杆菌门和变形菌门为主。不规律组在卵泡期、黄体期和排卵期3个不同时期以上3个物种占比总和超过98%,规律组在这3个时期以上3个物种占比总和超过95%。
在属水平,两组猕猴在卵泡期、黄体期和排卵期3个不同时期样本菌群均以普雷沃菌属_9、瘤胃球菌_UCG-002、乳杆菌属、普雷沃菌属_2、考拉杆菌属、瘤胃球菌_UCG-005、链球菌属、布劳特菌属、普雷沃菌属_NK3B31、理研菌属。
2.4 各阶段肠道微生物比较
为了解不同分组之间的物种差异情况,本研究根据OTU丰度信息开展韦恩图分析。两组在卵泡期、黄体期和排卵期 3个不同时期组间共有OUT数量分别为703、718和706,而月经期规律组特有OTU均高于不规律组,见图3。
2.5 差异物种分析
为进一步了解两组3个不同时期组间物种丰度差异有统计学意义情况。门水平,螺旋体门月经规律组3个阶段均高于不规律组(P<0.05),浮霉菌门在卵泡期和黄体期两个阶段规律组明显高于不规律组(P<0.05)。其他菌门:埃普西隆菌门、圣诞岛盐菌门、软壁菌门、黏胶球形菌门均在不同阶段表现出规律组明显高于不规律组(P<0.05),见图4。在属水平,两组比较发现,在卵泡期、黄体期和排卵期3个不同时期两组分别有14、9和10个物种差异有统计学意义(P<0.05),而且绝大多数物种表现出规律组高于不规律组。
2.6 功能分析
根据已知微生物的基因种类和丰度信息,结合京都基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路信息来预测不同生理期粪便样品的通路情况,最后进行功能分析。在2级水平月经规律组黄体期在复制和修复、脂质代谢、翻译、核苷酸代谢、膜运输、传染病、细胞群落功能明显高于不规律组(P<0.05)。其他阶段差异无统计学意义,见图5。
2.6 相关性分析
以网络图展示物种与月经周期的Pearson相关性。本研究默认以相关系数绝对值>0.5且P <0.05为阈值,筛选展示满足条件的结果,然后挑选相关性强度top20的关系对,绘制网络图。结果显示,月经规律组在门水平与厚壁菌门、软壁菌门、髌骨菌门等6个菌门呈正相关,而与拟杆菌门、变形菌门、螺旋体门等9个菌门呈负相关;在属水平与普雷沃菌属_9、瘤胃球菌_UCG-002、瘤胃球菌_UCG-005等11个菌属成显著负相关,与乳杆菌属、普雷沃菌属_2、链球菌属等9个菌属成显著正相关。月经不规律组在门水平与拟杆菌门、放线菌门呈正相关,与厚壁菌门、软壁菌门、髌骨菌门等13个菌门呈负相关;属水平与普雷沃菌属_9、瘤胃球菌_UCG-002、瘤胃球菌_UCG-005等12个菌属呈正相关,与乳杆菌属、普雷沃菌属_2、链球菌属等8个菌属呈负相关。
3 讨论
肠道微生物群影响多种生理功能,生态失调(微生物失衡)可能导致病理综合征。本研究针对生理期规律与不规律的两组恒河猴在卵泡期、排卵期、黄体期3个时期粪便中微生物种类进行分析研究。本研究从Alpha多样性结果分析发现尽管两组之间无差异有统计学意义,但月经规律的恒河猴肠道微生物多样性还是高于月经不规律雌猴。
在门水平物种构成方面,两组动物3个不同时期菌群均以厚壁菌门、拟杆菌门和变形菌门为主,占比超过95%,在属水平上,普雷沃菌属相对丰度最高,其次是瘤胃球菌、乳杆菌属和考拉杆菌属,这一结果与已有文献报道基本一致[25]。大量研究表明机体激素和微生物可相互影响,性类固醇激素可影响肠道菌群的结构、多样性、活性、生长,繁殖等从而调控机体代谢活动及健康。有研究通过切除性腺的方法探讨激素对89个常见的杂交系小鼠肠道微生物结构的影响,结果表明性类固醇激素可导致肠道菌群的差异,同时,微生物可影响宿主的内分泌[26]。微生物中存在孕酮、雌二醇等生殖激素受体,孕酮、雌二醇等可通过受体介导调节肠道微生物生长,并影响微生物的代谢活动[27-28]。
正常猕猴血清激素水平,雌二醇水平以卵泡期最高,黄体期最低;孕酮以黄体期最高,卵泡期最低[29]。本研究结果显示规律组黄体期厚壁菌门的占比(53.65%)高于不规律组(49.41%),而拟杆菌门刚好相反,即规律组黄体期占比(40.28%)低于不规律组(46.48%)。属水平上规律组黄体期乳杆菌属占比(8.22%)高于不规律组(3.38%),而普雷沃菌属在规律组黄体期占比(3.64%)低于不规律组(6.10%),而瘤胃球菌规律组(0.52%)显著高于不规律组(0.25%),该结果与Sasaki等[30]在人类的研究结果一致,普雷沃菌含有与肠道通透性增加有关的黏蛋白降解细菌,而丁酸盐由瘤胃球菌产生,有利于维持肠道稳态,因为丁酸是肠上皮细胞的能量来源,并且由于黏蛋白的产生,可能会形成微炎症环境,炎症已被证明对卵巢卵泡生长和排卵有负面影响,故而可能会导致排卵障碍。通过对各阶段肠道微生物比较发现螺旋体门在规律组3个阶段均高于不规律组(P<0.05),尽管螺旋体门占比很低(0.5%~2.4%),但研究发现其作为核心菌群似乎只存在于猕猴属非人灵长类动物肠道中[31-32]。功能预测结果显示,月经不规律组黄体期在复制和修复、脂质代谢、翻译、核苷酸代谢、膜运输、传染病、细胞群落功能明显高于规律组(P<0.05)。相关性分析发现规律组与不规律组在门水平和属水平与物种相关性均有较大差异。尽管目前对相关菌群对宿主所产生的功能还不明确,但实验分析结果显示规律月经周期与不规律月经周期两组猕猴肠道微生物组成存在差异,可能与激素水平相关。
综上所述,本研究以月经周期规律和不规律恒河猴为研究对象,分析其肠道菌群的多样性和结构,发现月经周期规律组恒河猴肠道微生物多样性高于不规律组;在孕酮激素较高的黄体期,月经周期规律组厚壁菌门占比高于不规律组,拟杆菌门占比刚好相反;而在雌二醇较高的卵泡期,月经周期规律组厚壁菌门占比低于不规律组,拟杆菌门占比却高于不规律组。这项研究证明了月经周期不规则的雌性恒河猴肠道微生物群的差异。特别是,富集的普雷沃菌微生物组和产丁酸细菌比例的降低与排卵障碍有关,这些发现还为排卵障碍提供了潜在的新诊断,并为通过纠正生态失调来治疗排卵障碍开辟了新的研究方向。同时,本研究结果显示规律月经周期与不规律月经周期两组猕猴肠道微生物组成存在差异,可能与性激素水平相关。然而肠道微生物可能参与了性激素的调节,相反,也可能是性激素改变了微生物的多样性,其调节机制有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] Gomaa E Z. Human gut microbiota/microbiome in health and diseases: a review[J]. Antonie Van Leeuwenhoek, 2020 , 113(12): 2019–2040.
[2] Wu J, Wang K, Wang X, et al. The role of the gut microbiome and its metabolites in metabolic diseases[J]. Protein Cell, 2021, 12(5): 360–373.
[3] Wang J, Chen L, Zhao N, et al. Of genes and microbes: Solving the intricacies in host genomes[J]. Protein Cell, 2018, 9(5): 446–461.
[4] McDonald D, Hyde E, Debelius J W, et al. American gut consortium, Knight R. American gut: An open platform for citizen science microbiome research[J]. mSystems, 2018, 3(3): e00031.
[5] Cuesta-Zuluaga J, Kelley S T, Chen Y, et al. Age-and sex-dependent patterns of gut microbial diversity in human adults[J]. mSystems, 2019, 4(4): e00261.
[6] Shin J H, Park Y H, Sim M, et al. Serum level of sex steroid hormone is associated with diversity and profiles of human gut microbiome[J]. Res Microbiol, 2019, 170(4-5): 192–201.
[7] Thackray V G. Sex, microbes, and polycystic ovary syndrome[J]. Trends Endocrinol Metab, 2019, 30(1): 54–65.
[8] Sinha T, Vich Vila A, Garmaeva S, et al. Analysis of 1135 gut metagenomes identifies sex-specific resistome profiles[J]. Gut Microbes, 2019, 10(3): 358–366 .
[9] Qi X, Yun C, Pang Y, et al. The impact of the gut microbiota on the reproductive and metabolic endocrine system[J]. Gut Microbes, 2021, 13(1): 1–21.
[10] Brenchley J M, Ortiz A M. Microbiome studies in non-human primates[J]. Curr HIV/AIDS Rep, 2021, 18(6): 527–537.
[11] inacho-Guendulain B, Montiel-Castro A J, Ramos-Fernández G, et al. Social complexity as a driving force of gut microbiota exchange among conspecific hosts in non-human primates[J]. Front Integr Neurosci, 2022, 16: 876849.
[12] Chen Z , Yeoh Y K , Hui M , et al. Diversity of macaque microbiota compared to the human counterparts[J]. Sci Rep, 2018, 8(1): 15573.
[13] Koo B S, Lee D H, Kang P, et al. Reference values of hematological and biochemical parameters in young-adult cynomolgus monkey (Macaca fascicularis) and rhesus monkey (Macaca mulatta) anesthetized with ketamine hydrochloride[J]. Lab Anim Res, 2019 , 35: 7.
[14] Hallmaier-Wacker L K , S Lüert, Roos C , et al. Lactation and menstruation shift the vaginal microbiota in captive rhesus monkeys to be more similar to the male urethral microbiota[J]. Sci Rep, 2019, 9(1): 17399.
[15] Clayton J B, Gomez A, Amato K, et al. The gut microbiome of nonhuman primates: Lessons in ecology and evolution[J]. Am J Primatol, 2018 , 80(6): e22867.
[16] Wu Y, Yao Y, Dong M, et al. Characterisation of the gut microbial community of rhesus macaques in high- altitude environments[J]. BMC Microbiol, 2020 , 20(1): 68.
[17] 赵远, 杨凤梅, 禹文海等. 人工饲养恒河猴幼猴不同肠段微生物宏基因组学研究[J]. 中国微生态学杂志, 2017, 29(8): 869–873.
[18] Newman T M, Shively C A, Register T C, et al. Diet, obesity, and the gut microbiome as determinants modulating metabolic outcomes in a non-human primate model[J]. Microbiome, 2021, 9(1): 100.
[19] Janiak M C, Montague M J, Villamil C I, et al. Age and sex-associated variation in the multi-site microbiome of an entire social group of free-ranging rhesus macaques[J]. Microbiome, 2021, 9(1): 68.
[20] Sharma M, Chopra C, Mehta M, et al. An insight into vaginal microbiome techniques[J]. Life (Basel), 2021 , 11(11): 1229.
[21] Barba M, Martínez-Boví R, Quereda J, et al. Vaginal microbiota is stable throughout the estrous cycle in Arabian maress[J]. Animals (Basel), 2020 , 10(11): 2020.
[22] Cheng L, Gao Y, Xia Q, et al. Reproductive tract microbiota of women in childbearing age shifts upon gynecological infections and menstrual cycle[J]. BMC Microbiol, 2021, 21(1): 252.
[23] Jessica G W, Ryan H. The murine female intestinal microbiota does not shift throughout the estrous cycle[J]. PLoS One, 2018, 13(7): e0200729.
[24] 季维智. 猕猴繁殖生物学[M]. 北京: 科学出版社, 2013: 33–35.
