百香果CBF基因家族鉴定与表达分析
2024-07-03梁宇尧钟昌桦潘若云任锐方庭
梁宇尧 钟昌桦 潘若云 任锐 方庭

doi:10.15889/j.issn.1002-1302.2024.10.007
摘要:百香果(Passiflora edulis Sims)原产热带地区,对低温十分敏感。CBF(C-repeat binding factor)基因家族是AP2转录因子家族的一类成员,在植物应对低温、干旱和盐等非生物胁迫中发挥重要作用。对百香果CBF基因家族进行鉴定和分析,并探究其在低温胁迫下的表达模式,可为进一步研究百香果CBF基因功能提供重要的参考信息。采用生物信息学方法鉴定百香果CBF基因家族成员,并对家族成员的序列组分、理化性质、系统进化关系、染色体定位、基因结构、保守基序、启动子顺式作用元件和转录因子结合位点等进行分析,通过qRT-PCR方法分析其在低温胁迫下的表达模式。结果显示,百香果基因组中共有5个CBF基因家族成员,其中3个分布在1号染色体上,2个分布在7号染色体上,被预测定位到细胞核、质膜和过氧化物酶体中;含有1~2个外显子,11~12个motif;系统进化显示5个百香果CBF基因、10个水稻CBF基因及6个拟南芥CBF基因共分成了2大亚组:亚组Ⅰ中包括拟南芥的全部6个CBF基因、百香果的全部5个CBF基因和水稻的4个CBF基因,水稻剩下的6个CBF基因分到了亚组Ⅱ中;启动子区域含有25种顺式作用元件,以光响应、激素与逆境胁迫响应元件为主;共有20个转录因子结合位点;3个百香果CBF基因在低温胁迫下表达量极显著上升,推测上述基因参与了百香果低温胁迫响应。
关键词:百香果;CBF基因;低温胁迫;表达分析
中图分类号:S667.901 文献标志码:A
文章编号:1002-1302(2024)10-0055-07
收稿日期:2023-07-22
基金项目:福建省自然科学基金(编号:2021J05022);福建省种业创新与产业化工程项目(编号:zycxny2021010);福建省高原学科建设经费(编号:102/71201801101)。
作者简介:梁宇尧(1998—),男,山西阳泉人,硕士研究生,从事果树遗传育种方面的研究。E-mail:670915524@qq.com。
通信作者:方 庭,博士,副教授,从事果树遗传育种方面的研究。E-mail:fangting@fafu.edu.cn。
低温胁迫是植物生长发育阶段面临的一种主要的非生物胁迫,可能会导致植物发育不良,甚至死亡。部分转录因子会响应低温胁迫,提高植物的低温的耐受性,例如AP2/ERF、NAC、MYB、WRKY、BHLH和bZIP等[1]。CBF(C-repeatbinding factor)是一种对植物抵御低温十分重要的转录因子,属于 AP2/ERF (Apetala2/Ethylene responsive factor)转录因子家族中的 DREB 亚家族[2]。CBF 转录因子除了具有1个高度保守的 AP2/ERF 结构域外,还有2个保守的特征基序(PKK/RPAGRxKFxETRHP 和 DSAWR)[3]。CBF参与多种逆境响应和植株发育等过程,目前低温信号途径研究比较清楚的是ICE1(inducer of CBF exoresion 1)-CBF (C-repeatCRT-binding factors-COR cold responsive)信号途径[4-6]。CBF能够识别冷响应COR基因启动子区CRT/DRE元件,在植物对低温的调控中起重要作用[7-9]。在拟南芥中一共发现了6个CBF基因,分别是AtCBF1、AtCBF2、AtCBF3、AtCBF4、AtDDF1和AtDDF2,其中AtCBF1、AtCBF2和AtCBF3为低温胁迫响应因子[10],AtCBF4、AtDDF1和AtDDF2与干旱和盐响应有关[11-12],这6个CBF基因在拟南芥的逆境胁迫中都发挥出了重大的作用。目前有多个物种的CBF基因家族成员得到鉴定,例如甘蓝型油菜[6]、水稻[13]、石榴[14]、胡杨[15]和烟草[16]等。
百香果 (Passiflora edulis Sims)是西番莲科(Passifloraceae)西番莲属(Passiflora)的藤本植物,因其含有多种水果的风味而得名百香果。百香果原产热带地区,目前在我国广西、福建、广东、海南、云南、贵州和台湾等地广泛种植。百香果当年种植当年挂果,具有“短、平、快”的特点,是福建省重点发展的特色水果,也被称为“脱贫果”“致富果”,为精准扶贫和乡村振兴起到一定推动作用[17]。百香果属于亚热带植物,容易受到低温胁迫,导致产量低、质量差等问题。CBF基因在植物低温胁迫响应中发挥重要作用,但其在百香果的研究中尚未被报道。本研究主要开展百香果CBF基因家族成员的鉴定及其在低温胁迫下的表达分析,为进一步研究该基因家族成员在百香果低温胁迫响应中的功能提供理论基础。
1 材料与方法
1.1 试验时间和地点
本试验于2023年4月在福建农林大学园艺学院园艺植物遗传育种实验室内完成。
1.2 百香果CBF基因家族成员鉴定
百香果的基因组信息数据下载自中国国家基因库生命大数据平台(China National GeneBank DataBase,CNGBdb)[18]。拟南芥CBF蛋白的氨基酸序列下载自拟南芥数据库TAIR网站(https://www.arabidopsis.org/ )。以拟南芥CBF基因蛋白质序列为Query,与百香果的蛋白序列进行BLASTP比对,将得到的结果在NCBI蛋白结构域中验证,去掉没有蛋白结构PKKPAGRxKFxETRHP、AP2domain和DSAWR的候选序列,得到最终的5个百香果CBF基因。
使用MG2C(http://mg2c.iask.in/mg2c_v2.0/)在线分析百香果CBF家族成员的染色体定位结果;利用ProtParam tool在线网站(https://web.expasy.org/protparam/)分析百香果CBF蛋白的理化性质;利用BioEdit软件分析得到百香果CBF基因的序列组分;利用Cello软件(http://cello.life.nctu.edu.tw/)预测百香果CBF蛋白的亚细胞定位;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_ sopma.html)进行百香果CBF蛋白二级结构预测;利用在线网站SWISS-MODEL(http://swissmodel.expasy.org/)进行百香果CBF蛋白三级结构预测。
1.3 百香果CBF基因家族成员的系统进化树分析
提取拟南芥、水稻和百香果CBF蛋白序列,放入MEGA 7软件中使用MUSCLE比对方法进行序列比对,采用Neighbor-Joining(NJ)法构建系统发育树,Bootstrap method 参数值设为1 000。
1.4 百香果CBF基因家族成员的基因结构与保守基序分析
使用TBtools软件分析百香果CBF家族成员的基因结构。利用MEME(https://meme-suite.org/meme/tools/meme)网站进行百香果CBF蛋白保守基序分析,并将得到的结果在TBtools中进行可视化分析。
1.5 百香果CBF基因家族成员的启动子顺式作用元件分析
提取百香果CBF基因起始密码子前的 2 000 bp 片段作为启动子序列,上传至PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线网站进行启动子顺式作用元件预测,并将得到的结果在TBtools中进行可视化。
1.6 百香果CBF基因家族成员的转录因子结合位点预测
利用PlantTFDB(http://planttfdb.cbi.pku.edu.cn/)在线网站进行转录因子结合位点预测,将得到的结果在TBtools中进行可视化。
1.7 百香果CBF基因在果皮中的表达模式分析
基于本课题组保存的百香果转录组数据分析百香果CBF基因家族成员在百香果果皮中的表达模式。
1.8 百香果低温处理和实时荧光定量分析
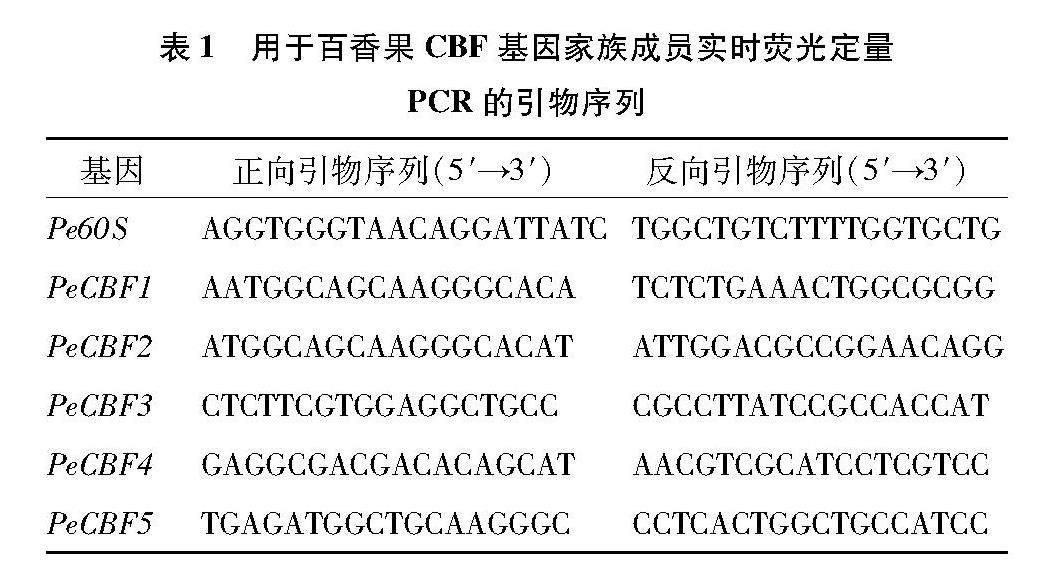
植物材料为台农百香果幼苗,低温胁迫处理条件为在4 ℃培养8 h,以28 ℃生长的幼苗为对照,处理与对照均为3株。处理完成后取相同部位的叶片样品并立即用液氮冷冻,并在-80 ℃保存待进一步分析。RNA提取采用天根生化科技(北京)有限公司的RNAprep Pure多糖多酚植物RNA提取试剂盒进行;cDNA合成按照北京全式金生物技术有限公司的TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒进行。采用实时荧光定量PCR技术检测各基因的表达量水平,试剂为SYBR Green I Master Mix (Takara),所用仪器为LightCycler 96 Real-Time PCR Systems(Roche),内参基因为Pe60S基因[19],所用引物序列如表1所示。基因相对表达量的计算采用2-ΔΔCT方法[20],并利用SPSS软件中的Duncans新复极差法对试验数据进行显著性分析,柱形图采用Origin 9.1软件绘制。
2 结果与分析
2.1 百香果CBF基因家族成员的鉴定
由表2可知,从百香果基因组中共鉴定获得5个CBF家族成员,参考其在染色体上的位置分别命名为PeCBF1~PeCBF5。百香果CBF基因的长度在723~1 186 bp之间,最长的是PeCBF3基因,有 1 186 bp,最短的则是PeCBF1,有723 bp。每个CBF基因的脱氧核苷酸的比例都在50%左右。百香果CBF基因双链分子量在439 455~720 631 u之间。
2.2 百香果CBF基因家族成员编码的蛋白质理化性质分析
百香果CBF基因编码的蛋白质理化性质如表3所示,分析可知5个蛋白的长度在237~245 aa之间,长度接近;分子量在26 003.13~27 499.40 u之间,等电点在4.92~6.46,其中最大的PeCBF2为(6.46),最小的PeCBF1为(4.92),每个PeCBF编码蛋白的等电点都小于7说明预测都是酸性蛋白。5个PeCBF基因编码蛋白不稳定系数都大于40,都属于不稳定蛋白。亲水性在-0.860~-0.478之间,都小于0,预测都为亲水性蛋白。PeCBF1、PeCBF3和PeCBF5基因亚细胞定位预测在细胞核中,PeCBF2在细胞核或者质膜上有定位信号,PeCBF4在过氧化物酶体中有定位信号。
2.3 百香果CBF基因家族成员的基因结构分析
百香果CBF基因结构如图1所示。PeCBF1、PeCBF4和PeCBF5基因均只含有1个外显子结构,PeCBF2和PeCBF3均有1段内含子片段,全部5个PeCBF基因均没有UTR片段。
2.4 百香果CBF基因家族成员的染色体定位
百香果CBF基因染色体定位如图2所示,5个PeCBF基因在染色体上呈现不均匀分布,定位在2条染色体上,其中PeCBF1、PeCBF2和PeCBF3定位在1号染色体上,PeCBF4和PeCBF5定位在7号染色体上,PeCBF1和PeCBF2串联排布在1号染色体上,其余的染色体都没有CBF基因的分布。
2.5 百香果CBF基因家族成员编码的蛋白质的保守基序分析
为进一步了解百香果保守基序(motif)情况将百香果基因组放入MEME在线分析软件分析,百香果CBF基因的蛋白基序(motif)分析如图3所示,在5个PeCBF基因中分析预测出了19个保守motif。其中PeCBF4含有12个保守motif,其他的4个PeCBF基因中均含有11个保守motif,整体相差不大。motif1、motif2、motif3、motif4、motif5和motif6在每个PeCBF基因中都存在,说明这些保守基序是高度保守的。motif7分布在PeCBF1、PeCBF4和PeCBF5中,motif8分布在PeCBF2和PeCBF4中,motif9和motif17分布在PeCBF2和PeCBF5中,motif10和motif18分布在PeCBF1和PeCBF4中,motif11和motif14分布在PeCBF3和PeCBF5中,motif12分布在PeCBF1和PeCBF2中,motif13分布在PeCBF3和PeCBF4中,motif15分布在PeCBF1和PeCBF3中,motif16分布在PeCBF2和PeCBF3中,motif19只分布在PeCBF4中。
2.6 百香果CBF基因家族成员的系统进化树分析
通过对5个百香果CBF基因、10个水稻CBF基因和6个拟南芥CBF基因进行进化序列比对,构建NJ进化树(图4)。21个CBF蛋白被分为2个亚组,与前人研究结果一致。亚组Ⅰ中包含有15个成员(百香果的和拟南芥的全部11个成员和水稻的4个成员),亚组Ⅱ中的包含有6个成员,均来自水稻的CBF家族。
2.7 百香果CBF基因二、三级蛋白结构预测
百香果CBF基因二级蛋白结构预测如表4所示,其中5个PeCBF基因编码蛋白中无规则卷曲占比最大,为57.50%~61.63%,占比超过50%,其次是α螺旋占比为23.85%~30.42%,延伸链占比为9.58%~12.55%,占比最小的是β折叠,仅为2.07%~2.95%,不到3%。
百香果CBF基因三级蛋白结构预测如图5所示,整体结构与二级结构预测的结果相差不大,各蛋白间还是有明显差异。
2.8 百香果CBF基因家族成员的启动子顺式作用元件分析
启动子结构影响着基因的表达水平,通过PlantCARE网站分析启动子顺式作用元件,百香果CBF基因启动子顺式作用元件如图6所示。PeCBF1最少,含有22个顺式作用元件,PeCBF3最多,含有52个顺式作用元件,PeCBF2含有50个顺式作用元件,PeCBF4和PeCBF5均含有32个顺式作用元件,主要有脱落酸、光响应、水杨酸、茉莉酸甲酯响应性、厌氧诱导、赤霉素、昼夜调节、防御应急、低温响应、生长素和MYB结合过程中参与干旱诱导的位点等顺式作用元件。
PeCBF1中有8种顺式作用元件,大部分是脱落酸和光响应的顺式作用元件,还有1个低温响应元件。PeCBF2中有11种顺式作用元件, 其中最多的是脱落酸和光响应顺式作用元件,还有一些水杨酸和生长素元件,有5个茉莉酸甲酯响应性、3个玉米醇溶酶蛋白代谢调节和1个防御和应急响应元件。
PeCBF3中有10种顺式作用元件,茉莉酸甲酯响应性元件占大多数,说明PeCBF3对茉莉酸甲酯有着高度的响应,还有2个MYB结合过程中参与干旱诱导的位点和2个MYBHv1结合位点。PeCBF4种有7种顺式作用元件,光响应顺式作用元件占大多数,有1个低温响应元件,还有1个昼夜节律控制元件。PeCBF5种有7种顺式作用元件,其中脱落酸顺式作用元件占多数。
2.9 转录因子结合位点预测
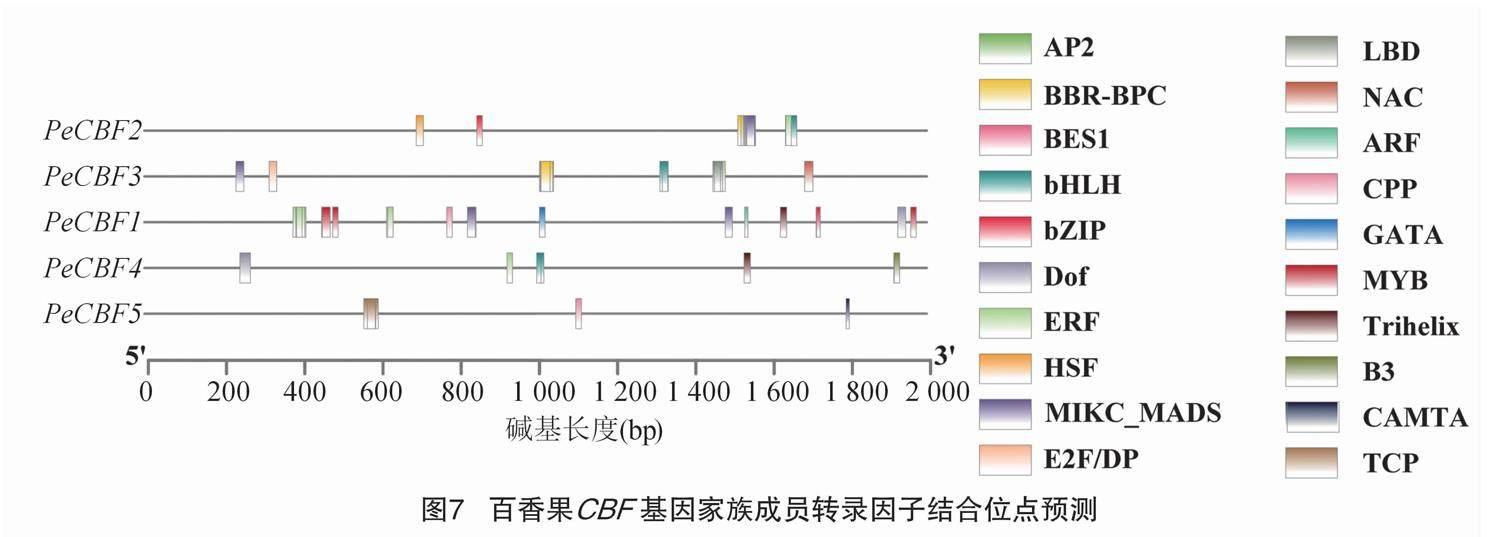
为进一步了解百香果CBF基因的转录因子结合位点情况,将百香果基因组在plantTFDB中进行转录因子结合位点预测,百香果CBF基因转录因子结合位点预测结果如图7所示,共预测出了20个结合位点。PeCBF1中有11种结合位点,以ERF为主。PeCBF2中有9种结合位点,以BBR-BPC和AP2为主。PeCBF3种有8种结合位点,以BBR-BPC为主,还有3个特有的E2F/DP、NAC和LBD结合位点。PeCBF4有5种结合位点,而且结合位点的数量最少,有1个ERF结合位点和1个特有的B3结合位点。PeCBF5中有3种结合位点,以TCP为主,还有1个特有的CAMTA结合位点。只有PeCBF5没有ERF结合位点,其余的PeCBF基因均有ERF结合位点,AP2结合位点在PeCBF1、PeCBF2和PeCBF3中都有体现。
2.10 百香果CBF基因家族成员的表达模式分析
百香果CBF基因分别在紫果转色前(PS1)、紫果成熟(PS2)、黄果转色前(YS1)和黄果成熟(YS2)4个阶段的表达情况如图8所示,在PS1阶段表达水平较高的有PeCBF2、PeCBF3和PeCBF5,在PS2阶段高度表达的仅有PeCBF3,在YS1和YS2阶段表达水平较高的有PeCBF2和PeCBF3。
2.11 百香果CBF基因在低温胁迫下的表达分析
PeCBF基因在低温胁迫条件下的表达分析结果如图9所示, PeCBF1、 PeCBF2和PeCBF3在低
温条件下的表达量均极显著上升,而PeCBF4和PeCBF5与对照相比表达量只有微量的增加。
3 讨论
CBF基因对植物的低温胁迫发挥着重大作用,在植物中已经鉴定出了许多CBF基因,如拟南芥中有6个CBF基因[10-12,21],石榴中有7个CBF基因[14],胡杨中有8个CBF基因[15],烟草中有19个CBF基因[16]等,百香果中一共筛选出5个CBF基因,这可能是物种间基因组大小差异和CBF基因扩增程度不同所导致[22]。相同进化分支上的PeCBF基因的特有保守基序也是类似的,PeCBF1和PeCBF4均有motif10和motif18;PeCBF2和PeCBF5均有motif9和motif17,但是相同进化分支的PeCBF基因也有些motif丢失,可能是串联重复过程中造成
的碱基丢失。不同的PeCBF基因的motif差异可能反映了其中功能的差异。
通过对不同PeCBF的顺式作用元件分析可得出它们均含有脱落酸、赤霉素、光响应等多个顺式作用元件,说明PeCBF在光诱导和脱落酸激素中起到作用。而光敏色素互作因子(PIFs)在调控植物发育中起着关键作用[23-25],部分(PIFs)可以绑定到 G-box 和AtCBF启动子中的E-box顺式元件调控其转录[26]。不同的PeCBF还含有独特的顺式作用元件,其中包含了厌氧诱导、干旱、生长素、低温胁迫、防御应激和MBY结合位点等,这些也反映了不同的PeCBF基因在发挥着不同的作用。
百香果对低温较为敏感[27],CBF基因家族在抗冻性中具有重要作用,如在拟南芥中过表达龙眼CBF家族基因DlCBF1、DlCBF2和 DlCBF3可提高其抗寒能力[28]。PeCBFs基因启动子中含有多个与低温胁迫响应有关的顺式作用元件,基因表达分析也发现PeCBF1、PeCBF2和PeCBF3基因在低温胁迫下表达量极显著上升,暗示这3个基因可能参与了百香果低温胁迫响应。
综上所述,本研究从百香果基因组中鉴定出5个CBF基因,并对其进行了一系列的生物信息学分析。低温胁迫下的表达分析表明,PeCBF1、PeCBF2和PeCBF3基因在低温胁迫下表达量极显著上升。本研究结果为后续研究CBF基因在百香果抗寒中的功能奠定了一定的理论基础。
参考文献:
[1]刘紫烟,刘佳乐,朱圆圆,等. 木本植物低温应答机制研究进展[J]. 西北林学院学报,2022,37(2):1-7.
[2]Agarwal P K,Agarwal P,Reddy M K,et al. Role of DREB transcription factors in abiotic and biotic stress tolerance in plants[J]. Plant Cell Reports,2006,25(12):1263-1274.
[3]Jaglo K R,Kleff S,Amundsen K L,et al. Components of the Arabidopsis C-repeat/dehydration-responsive element binding factor cold-response pathway are conserved in Brassica napus and other plant species[J]. Plant Physiology,2001,127(3):910-917.
[4]Gilmour S J,Sebolt A M,Salazar M P,et al. Overexpression of the Arabidopsis CBF3 transcriptional activator mimics multiple biochemical changes associated with cold acclimation[J]. Plant Physiology,2000,124(4):1854-1865.
[5]Zhang X,Fowler S G,Cheng H M,et al. Freezing-sensitive tomato has a functional CBF cold response pathway,but a CBF regulon that differs from that of freezing-tolerant Arabidopsis[J]. The Plant Journal:for Cell and Molecular Biology,2004,39(6):905-919.
[6]解 盼,刘 蔚,康 郁,等. 甘蓝型油菜CBF基因家族的鉴定和表达分析[J]. 作物学报,2021,47(12):2394-2406.
[7]Cook D,Fowler S,Fiehn O,et al. A prominent role for the CBF cold response pathway in configuring the low-temperature metabolome of Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(42):15243-15248.
[8]Savitch L V,Allard G,Seki M,et al. The effect of overexpression of two Brassica CBF/DREB1-like transcription factors on photosynthetic capacity and freezing tolerance in Brassica napus[J]. Plant and Cell Physiology,2005,46(9):1525-1539.
[9]Gilmour S J,Zarka D G,Stockinger E J,et al. Low temperature regulation of the Arabidopsis CBF family of AP2 transcriptional activators as an early step in cold-induced COR gene expression[J]. The Plant Journal,1998,16(4):433-442.
[10]Thomashow M F. Molecular basis of plant cold acclimation:insights gained from studying the CBF cold response pathway[J]. Plant Physiology,2010,154(2):571-577.
[11]Haake V,Cook D,Riechmann J,et al. Transcription factor CBF4 is a regulator of drought adaptation in Arabidopsis[J]. Plant Physiology,2002,130(2):639-648.
[12]Lehti-Shiu M D,Uygun S,Moghe G D,et al. Molecular evidence for functional divergence and decay of a transcription factor derived from whole-genome duplication in Arabidopsis thaliana[J]. Plant Physiology,2015,168(4):1717-1734.
[13]Dubouzet J G,Sakuma Y,Ito Y,et al. OsDREB genes in rice,Oryza sativa L.,encode transcription activators that function in drought-,high-salt- and cold-responsive gene expression[J]. The Plant Journal,2003,33(4):751-763.
[14]刘龙博,郑树轩,郑 洁. 石榴低温响应因子CBF基因家族鉴定及其表达分析[J]. 西北农业学报,2022,31(9):1154-1167.
[15]贾会霞,李建波,孙 佩,等. 胡杨CBF基因家族的鉴定及表达特性分析[J]. 分子植物育种,2017,15(2):492-500.
[16]隋晓燕,胡日生,晏伟杰,等. 烟草CBF基因全基因组鉴定及响应低温胁迫表达分析[J]. 分子植物育种,2023,21(3):799-808.
[17]牛先前,江 莉,林秋金,等. 福建百香果果实品质优势区域划分[J]. 中国农学通报,2023,39(7):40-45.
[18]Ma D N,Dong S S,Zhang S C,et al. Chromosome-level reference genome assembly provides insights into aroma biosynthesis in passion fruit (Passiflora edulis)[J]. Molecular Ecology Resources,2021,21(3):955-968.
[19]Munhoz C F,Santos A A,Arenhart R A,et al. Analysis of plant gene expression during passion fruit-Xanthomonas axonopodis interaction implicates lipoxygenase 2 in host defence[J]. Annals of Applied Biology,2015,167(1):135-155.
[20]Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4):402-408.
[21]Medina J,Bargues M,Terol J,et al. The Arabidopsis CBF gene family is composed of three genes encoding AP2 domain-containing proteins whose expression is regulated by low temperature but not by abscisic acid or dehydration[J]. Plant Physiology,1999,119(2):463-470.
[22]汪泽文,杨依维,王鹏飞,等. 欧李DREB基因家族的鉴定与分析[J]. 植物生理学报,2020,56(3):413-422.
[23]Castillon A,Shen H,Huq E. Phytochrome interacting factors:central players in phytochrome-mediated light signaling networks[J]. Trends in Plant Science,2007,12(11):514-521.
[24]Leivar P,Monte E,Oka Y,et al. Multiple phytochrome-interacting bHLH transcription factors repress premature seedling photomorphogenesis in darkness[J]. Current Biology,2008,18(23):1815-1823.
[25]Kami C,Lorrain S,Hornitschek P,et al. Light-regulated plant growth and development[J]. Current Topics in Developmental Biology,2010,91:29-66.
[26]Jiang B C,Shi Y T,Zhang X Y,et al. PIF3 is a negative regulator of the CBF pathway and freezing tolerance in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2017,114(32):E6695-E6702.
[27]李丽容,杨 凯,陈 惠,等. 百香果寒冻害低温等级指标研究[J]. 自然灾害学报,2023,32(1):191-198.
[28]Yang X Y,Wang R,Jing H H,et al. Three novel C-repeat binding factor genes of Dimocarpus longan regulate cold stress response in Arabidopsis[J]. Frontiers in Plant Science,2020,11:1026.
