无机化工流程题高考核心考点归纳例析
2024-07-01赖陆锋李春燕肖承云
赖陆锋 李春燕 肖承云


以实际工业生产过程为背景设置的化工流程题是历年高考必考题型,该题型考查的知识范围包括化学基本概念、化学反应及转化、化学反应原理应用、化学实验操作、化学计算等,综合考查了学生对化学知识的实际应用能力。
一、无机化工流程题的题型结构
流程图一般三大部分:原料预处理、转化与分离阶段、获取最终产物阶段。
二、解题基本思路
1.整体浏览,明确化学工艺流程的主要目的。
2.在起始原材料里分析需提取的目标元素和含有的杂质元素,分析流程中每一个步骤的反应物和生成物,每一步分离和提纯的物质和操作方法。
3.从题干中获取有效信息,有针对性地解决题设中提出的每一个问题。
三、核心考点归纳例析
1.考查原料预处理的方法和目的
预处理的目的是使原料中待提取元素的状态,由难浸出的物质转变成易浸出的物质。常考的原料预处理操作和目的有:
【例1】(2021年山东高考卷节选)工业上以铬铁矿(FeCr2O4,含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7·2H2O)的工艺流程如图。回答下列问题:
焙烧的目的是将FeCr2O4转化为Na2Cr2O4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是 。
【答案】增大反应物接触面积,提高化学反应速率,提高反应物转化率。
2.考查控制反应条件的目的
【例2】(2021年全国乙卷节选)磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
回答下列问题:
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至116,依次析出的金属离子是 。
【解析】由题给金属离子开始沉淀和完全沉淀的pH可知,将pH约为20的滤液加入氨水调节溶液pH为116时,铁离子首先沉淀,然后是铝离子、镁离子,钙离子没有沉淀。
【答案】(2)Fe3+、Al3+、Mg2+ 。
3.考查混合物分离与提纯操作
(1)固体与固体的分离
(2)固体与液体的分离
(3)液体与液体的分离
【例3】(2022年广东高考卷节选)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸(C11H23COOH)熔点为44°C;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=18×10-8,Al(OH)3开始溶解时的pH为88;有关金属离子沉淀的相关pH见下表。
(1)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是 。
②“操作X”的过程为:先 ,再固液分离。
【解析】(1)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是加热可以提高反应物粒子运动速度,搅拌增加溶剂与溶质的接触面积,使溶出更彻底,提高溶出速度,提高产率;② “操作X”的结果是分离出月桂酸,由信息可知,月桂酸(C11H23COOH)熔点为44°C,故“操作X”的过程为:先冷却结晶,再固液分离。
【答案】①加热可以提高反应物粒子运动速度,搅拌增加溶剂与溶质的接触面积,使溶出更彻底,提高溶出速度,提高产率 ②冷却结晶
4.判断工艺流程可循环物质、副产品或滤渣滤液成分
在工艺流程中,某种物质在流程前期加入后期又重新生成或将提纯后的母液再次纯化的过程都称之为循环。
(1)循环物质的确定
①从流程图上看:箭头回头。②从物质的转化上看:在流程中加入的物质,后续步骤中又会产生(在滤渣或滤液中寻找)。
(2)副产品的判断
①从流程图上看:支线产品。②从制备的目的上判断:不是主产品;
(3)滤渣成分的确定;
①过量的反应物。②原料中不参与反应的物质。③由原料转化的生成物。④由杂质转化的沉淀物。
【例4】(2019年全国卷Ⅰ节选)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(4)在“沉镁”中生成Mg(OH)2·MgCO3,母液经加热后可返回 工序循环使用。
【解析】由分析可知,母液加热分解后生成硫酸铵溶液,可以返回“溶浸”工序循环使用。
【答案】溶浸
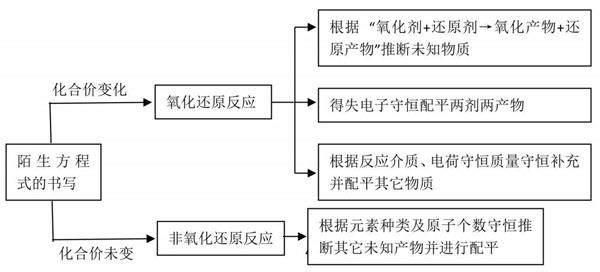
5.考查陌生化学(离子)方程式的书写
陌生方程式的书写基本思路:
【例5】(2023年广东高考卷节选)Ni、Co均是重要的战略性金属。从处理后的矿石硝酸浸取液(含Ni2+、Co2+、Al3+、Mg2+)中,利用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下:
已知:氨性溶液由NH3·H2O、(NH4)2SO3和(NH4)2CO3配制。回答下列问题:
(1)活性MgO可与水反应,化学方程式为 。
(2)“氨浸”时,由Co(OH)3转化为[Co(NH3)6]2+的离子方程式为 。
【解析】活性MgO可与水反应,化学方程式为MgO+H2O=Mg(OH)2; “氨浸”时,Co(OH)3与亚硫酸根发生氧化还原反应,再与氨水反应生成[Co(NH3)6]2+,则由Co(OH)3转化为[Co(NH3)6]2+的离子方程式为2Co(OH)3+12NH3·H2O+SO2-3=2[Co(NH3)6]2++SO2-4+13H2O+4OH-或2Co(OH)3+8NH3·H2O+4NH+4+SO2-3=2[Co(NH3)6]2++SO2-4+13H2O
【答案】(1)MgO+H2O=Mg(OH)2
(2)2Co(OH)3+12NH3·H2O+SO2-3=2[Co(NH3)6]2++SO2-4+13H2O+4OH-或2Co(OH)3+8NH3·H2O+4NH+4+SO2-3=2[Co(NH3)6]2++SO2-4+13H2O
6.考查Ksp计算
化工流程中常常需要控制条件进行离子的分离或除杂从而产生难溶电解质,关于难溶电解质高考中命题方向包括通过溶度积常数计算溶液中金属离子的浓度、离子完全沉淀时的pH、判断废水排放是否符合标准、沉淀完全转化时所需离子浓度。
(1)已知pH值判断是否析出沉淀:
解题思路:
已知pH值pH=-lgc(H+)c(H+)=10-pHKW=c(H+)·c(OH-)c(OH-).→求出Qc比较Qc与Ksp大小判断是否析出沉淀
(2)求离子浓度或pH值及调控范围:
对于:M(OH)n(s)Mn+(aq)+nOH-(aq)
解题思路:
已知c(Mn+)Ksp=c(Mn+)·cn(OH-)求出
c(OH-)KW=c(H+)·c(OH-)
求出c(H+)→pH=-lgc(H+)。
【例6】(2021年广东高考卷节选)对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如下:
已知:25℃时,H2CO3的Ka1=4.5×10-7,Ka2=4.7×10-11;Ksp(BaMoO4)=3.5×10-8;Ksp(BaCO3)=2.6×10-9;该工艺中,pH>6.0时,溶液中Mo元素以MoO2-4的形态存在。
(1)“沉钼”中,pH为7.0。生成BaMoO4的离子方程式为 。若条件控制不当,BaCO3也会沉淀。为避免BaMoO4中混入BaCO3沉淀,溶液中c(HCO-3):c(MoO2-4)= (列出算式)时,应停止加入BaCl2溶液。
【解析】滤液Ⅱ中含有钼酸钠,加入氯化钡溶液后生成BaMoO4沉淀,该反应的离子方程式为MoO2-4+Ba2+=BaMoO4↓。若开始生成BaCO3沉淀,则体系中恰好建立如下平衡:HCO-3+BaMoO4BaCO3+MoO2-4+H+,该反应的化学平衡常数为:K=c(H+)·c(MoO2-4)c(HCO-3)
=c(H+)·c(CO2-3)·c(MoO2-4)·c(Ba2+)c(HCO-3)·c(CO2-3)·c(Ba2+)
=Ka2·Ksp(BaMoO4)Ksp(BaCO3)。
为避免BaMoO4中混入BaCO3沉淀,必须满足c(H+)·c(MoO2-4)c(HCO-3)≤Ka2·Ksp(BaMoO4)Ksp(BaCO3),由于“沉钼”中pH为70,c(H+)=1×10-7mol/L,所以溶液中c(MoO2-4)c(HCO-3)=Ka2·Ksp(BaMoO4)1×10-7mol/L×Ksp(BaCO3)时,开始生成BaCO3沉淀,因此,c(HCO-3):c(MoO2-4)=1×10-7mol/L×Ksp(BaCO3)Ka2·Ksp(BaMoO4)=1×10-7mol/L×2.6×10-94.7×10-11×3.5×10-8时,应停止加入BaCl2溶液。
【答案】MoO2-4+Ba2+=BaMoO4↓
1×10-7mol/L×2.6×10-94.7×10-11×3.5×10-8。
7.考查图像图表的数据分析
解决图像题的基本思路:
(1)识图:一看面、二看线、三看点(弄清纵、横坐标的含义;弄清起点、拐点、终点的含义;看清曲线的变化趋势)。
(2)析数:分析数据、图像中隐含的信息,弄清各数据的含义及变化规律,将数据和图像信息加工成化学语言,同时联系化学概念、化学原理等理论知识进行分析解答。
【例7】(2022年湖南高考卷节选)钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为TiO2,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知“降温收尘”后,粗TiCl4中含有的几种物质的沸点:
回答下列问题:
(1)已知ΔG=ΔH-TΔS,ΔG的值只决定于反应体系的始态和终态,忽略ΔH、ΔS随温度的变化。若ΔG<0,则该反应可以自发进行。根据下图判断:600℃时,下列反应不能自发进行的是 。
A.C(s)+O2(g)=CO2(g)
B.2C(s)+O2(g)=2CO(g)
C.TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)
D.TiO2(s)+C(s)+2Cl2(g)=TiCl4(g)+CO2(g)
【解析】A.由图可知,600℃时C(s)+O2(g)=CO2(g)的ΔG<0,反应自发进行,故A不符合题意;B.由图可知,600℃时2C(s)+O2(g)=2CO(g)的ΔG<0,反应自发进行,故B不符合题意;C.由图可知,600℃时TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)的ΔG>0,反应不能自发进行,故C符合题意;D.根据盖斯定律,TiO2(s)+C(s)+2Cl2(g)=TiCl4(g)+CO2(g)可由①+③得到,则600℃时其ΔG<0,反应自发进行,故D不符合题意;故选C。
【答案】C
8.考查化工流程的评价
对工艺流程的评价方向包括:
(1)绿色化学思想:杜绝环境污染、原子的经济性、节约能源,包括使用催化剂。
(2)高效节能、控制成本思想:原料来源广、最好是可再生的,或可循环利用的、减少工艺的繁琐性,化繁为简。
(3)工艺、设备的安全性。
【例8】(2019年全国卷节选)咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为10-4,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。
(1)与常规的萃取相比,采用索氏提取器的优点是 。
(2)提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是 。
【解析】根据题干中的已知信息可判断与常规的萃取相比较,采用索式提取器的优点是使用溶剂量少,可连续萃取(萃取效率高);乙醇是有机溶剂,沸点低,因此与水相比较乙醇作为萃取剂的优点是乙醇沸点低,易浓缩;
【答案】(1)使用溶剂少,可连续萃取(萃取效率高) (2)乙醇沸点低,易浓缩
责任编辑 李平安
