?卷丹百合生根期镉吸收转运规律初探?
2024-06-30谢进戴艳娇郑思乡周利孙梦姗宋荣
谢进 戴艳娇 郑思乡 周利 孙梦姗 宋荣
摘要:为了探讨卷丹百合根系对镉胁迫的生理响应,以卷丹百合为实验材料,设置不同浓度的水培试验,比较不同镉浓度处理的卷丹百合生根期根部镉吸收、转运规律,并比较根系蛋白质表达的差异。结果表明:在镉胁迫下,卷丹百合鳞茎生根期没有富集镉的特性,而卷丹百合根在20 μmol/L及以上浓度情况下,富集系数大于1;转运系数分析表明,卷丹百合生根期鳞茎对镉的转运能力很弱,同时卷丹百合根系蛋白质发生了差异表达,这些蛋白功能包括与氧化活性相关的过氧化物歧化酶、与异黄酮分解相关的异黄酮还原酶、多功能调节酶核苷二磷酸激酶b。
关键词:卷丹百合;镉;蛋白质
中图分类号:X53文献标识码:A文章编号:1006-060X(2024)05-0038-05
Preliminary Study on Law of Cadmium Absorption and Transport at Rooting Stage of
Lilium lancifolium
XIE Jin1,2,DAI Yan-jiao1,ZHENG Si-xiang1,2,ZHOU Li1,2,SUN Meng-shan1,2,SONG Rong1,2
(1. Hunan Institute of Agricultural Environment and Ecology, Changsha 410125, PRC; 2. Center for Research & Development of Medicinal Plants, Hunan Academy of Agricultural Sciences, Changsha 410125, PRC)
Abstract: In order to explore the physiological response of Lilium lancifolium roots to cadmium stress, Lilium lancifolium was used as the experimental material, and hydroponic experiments at different concentrations were set up to compare the cadmium absorption and transport laws of Lilium lancifolium roots treated with different cadmium concentrations at the rooting stage, and the protein expression differences in the roots were compared. The results show that under cadmium stress, the bulbs of Lilium lancifolium do not enrich cadmium at the rooting stage, while the enrichment coefficient of Lilium lancifolium roots is greater than 1 at 20 μmol/L and above. The transport coefficient analysis shows that the transport capacity of bulbs to cadmium is very weak at the rooting stage of Lilium lancifolium, and the protein in the root of Lilium lancifolium is differentially expressed. These proteins include superoxide dismutase related to oxidative activity, isoflavone reductase related to isoflavone decomposition, and multifunctional regulatory enzyme nucleoside diphosphate kinase b.
Key words:Lilium lancifolium; cadmium; protein
随着“健康中国”战略的提出,大健康产业已成为当前拥有巨大潜力的朝阳产业。在大健康产业背景下,药食同源资源因其独特的优势具有重要的研究意义[1]。中国是百合种质资源最丰富的国家,在食用和药用百合产品研发方面处于国际领先地位。百合种植区域分布广泛,甘肃兰州、湖南龙山、湖南隆回、江苏宜兴为全国主要食用百合产地,种植面积超过2万hm2[2]。百合作为国家卫生部首批公布的药食同源食品,富含膳食纤维、蛋白质、脂肪、氨基酸、微量元素以及维生素类等,同时富含多种活性成分,有多糖类、生物碱类、甾体皂苷类、黄酮类以及酚类化合物等多种药效活性成分[3]。在“健康中国”“药食同源”“龙山百合”的加持下,百合的食品安全和药用安全的问题受到国内外关注。
近年来,重金属污染逐渐成为人们在日常饮食用药中的关注重点,尤其是金属镉,它对人体有肾毒性和神经毒性,可造成人体骨、心血管等多器官损伤,甚至有致癌危险[4-6]。而对于植物,镉降低了植物的光合能力,导致植物生长迟缓,发生氧化应激,并影响次生代谢[7]。
20世纪70年代,就有关于植物对镉的吸收和分配规律、重金属镉在植物体内的转运途径等报道,各种研究表明,植物根系中的Cd2+含量通常高于地上部分,且地上部分对镉更加敏感,表明植物可能通过限制镉进入根中输导组织,减少Cd2+向地上部分的转运[8]。大部分的镉离子主要是从根部吸收的,镉离子进入根部表皮层主要有3种方式:(1)根部表皮细胞的质膜处,存在由植物呼吸释放出的CO2和H2O 生成的H2CO3解离而来的H+和HCO3-,H+迅速与Cd2+交换吸附,使Cd2+被吸附在植物根系表皮细胞表面,这种交换吸附不需要能量且速度很快,为Cd2+以质外体途径进入表皮细胞做好准备[9];
(2)Cd2+是非必需元素,却可以占用特异度低的必需元素如 Fe2+、Zn2+和 Ca2+的离子通道进入植物细胞,Cd2+通过锌钙转运通道时与锌转运蛋白质和钙转运蛋白质结合,以共质体途径进入根表皮细胞,该转运过程受到转运蛋白质 ZIP(zrt-,irt- like protein)家族中的IRT1转运蛋白质的控制[10];(3)为使根际土壤溶液中离子利用率升高,植物根部会积极分泌麦根酸等小分子化合物,而麦根酸可以有效螯合Cd2+形成金属配位体复合物,使Cd2+以螯合物的形式通过YSL(yellow- stripe 1- like)蛋白质,最终进入根细胞[11-13]。重金属镉进入根细胞后通过共质体途径木质部主要利用重金属酶P1B-ATP,如AtHMA2和AtHMA4编码转运蛋白[14],也有可能和YSL蛋白质结合进入木质部[15]。此外,拟南芥(Arabidopsis thaliana)AtPDR8基因编码的三磷酸腺苷(ATP,denosine triphosphate)转运体已经被证明能够将Cd2+从根毛和表皮细胞细胞膜上导出[16]。
目前,水稻镉污染的研究比较深入,Cd从根到芽再到籽粒[17],根吸收Cd后,通过木质部转移到嫩枝上,而木质部介导的Cd从根到枝的转运是影响产量的主要因素。OsHMA2和OsHMA3在这一过程中起重要的作用[18],OsHMA3在根细胞中Cd进入液泡过程起关键作用;而OsHMA2参与Cd向发育组织传递[19]。同时作为自然抗性相关巨噬细胞蛋白(NRAMP,NRAMP,natural resistance-associated macrophage protein)的一员,OsNRAMP5负责铁、锰和镉从外部运输到根细胞[20-21],而Tang等[22]利用CRISPR/Cas9系统敲除金属转运蛋白基因OsNramp5,开发出低Cd积累、无转基因的籼稻新品系。由此可见,植物吸收镉主要是通过根,而后进入植物体内向植物地上部分运输,导致镉在植物各个部位的积累,并且这些过程都是通过蛋白质、酶完成的,尤其是转运蛋白,因此,研究植物根系吸收镉的蛋白,并对其表达进行调控,对植物镉吸收转运积累起到关键作用。
试验以卷丹百合为试验材料,采用水培试验,比较卷丹百合生根期镉吸收转运规律,同时对其根系蛋白质差异进行初探,该研究结果将有助于了解卷丹百合吸收转运镉的规律,为解决百合食用和药用安全问题提供数据支撑,对整个百合产业有重要的理论价值和现实意义。
1 材料与方法
1.1 试验试剂与仪器
试验试剂包括四水硝酸钙、硝酸钾、磷酸二氢铵、七水硫酸镁、硼酸、四水硫酸锰、一水硫酸锰、七水硫酸锌、五水硫酸铜、七钼酸铵和乙二胺四乙酸铁钠。
试验仪器包括AB 5800 MALDI-TOF/TOF(AB SCIEX,美国),PROTEAN i12 IEF Cell(BIO-RAD,美国)。
1.2 试验方法
1.2.1 卷丹百合鳞茎水培 将卷丹百合种球分割成小鳞茎,收集无病的小鳞茎,在1∶500的苯菌灵水溶液中浸泡30 min,栽种在水培体系中,在室温下培养。水培使用容量20 L(45.5 cm×32 cm×14 cm)的18个水箱(12个小鳞茎/箱),外加通气泵6个,以保证根系供氧。将小鳞茎固定在隔板上,仅将鳞茎底部接触到水箱中的营养液,营养液10 d左右更换一次,防止滋生细菌。
1.2.2 卷丹百合镉胁迫试验 试验分为8组,以Cd2+ 0 μmol/L为对照(CK),营养液Cd2+浓度2、5、10、20、30、50和70 μmol/L为处理1~7组,对生根期卷丹百合进行取样。
1.3 镉含量测定
将试验样品按照根、鳞茎等分离,用自来水将百合各部位洗净,再用去离子水淌洗3遍,晾干,待百合植株无明显水珠后装入信封,105℃杀青15 min,60℃恒温烘干至恒重后称重。将粉碎成粉末状的百合各组织部位样品分别称取0.50 g装入锥形瓶中,采用HNO3∶HClO4 =4∶1的混合酸消煮,原子吸收分光光度法测定,采用国家标准与技术研究所提供的植株标准物质对测定结果进行质量监控。
1.4 卷丹百合根蛋白质双向电泳
1.4.1 等点聚焦 17 cm IPG胶条的上样体积为600 μL,根据蛋白定量结果,使所有样品蛋白上样总量保持一致,不足的体积用水化液补齐,水化液与裂解液相同。水化板用超纯水清洗干净,自然晾干。将制好的样品加入胶条槽中,取出IPG干胶条,胶面向下放置于样品之上,使液体浸润整个胶条,加入覆盖油,胶条水化16 h。将胶条从水化板中取出,胶面向上放入等电聚焦板中,添加覆盖油,等电聚焦在20℃下自动进行,每根胶条的极限电流为50 μA/根。
1.4.2 胶条平衡 (1)平衡液配制:50 mmol/L Tris-HCl (pH值8.8) +6 mol/L Urea +20% (v/v) Glycerol +2% (w/v) SDS。配制好的平衡液分装并保存在-20℃冰箱中。
(2)第一步平衡:等电聚焦结束后,取出IPG胶条,放入的含有1%(w/v)DTT的平衡液中,将平衡管置于摇床上平衡15 min。
(3)第二步平衡:第一步平衡结束后,将胶条放入含有2.5%碘乙酰胺(IAA)的平衡液中,将平衡管置于摇床上平衡15 min。
1.4.3 第二向SDS-PAGE垂直电泳 (1)配制15%的聚丙烯酰胺凝胶,将胶灌至距玻璃板上檐1 cm处,加入1 mL饱和正丁醇封胶液,室温静置3 h使凝胶完全聚合。倒出饱和正丁醇,用超纯水清洗胶面,在用滤纸将胶上残余水分吸干。
(2)将平衡好的胶条放置在SDS-PAGE胶面上,使胶条与胶面充分接触(不要有气泡),胶条的一端加入蛋白分子量Marker,覆盖一层0.5%的低熔点琼脂糖封胶液。
(3)将装好胶条的玻璃板放入电泳槽中冰浴,以80 V/胶先电泳30 min,然后以100 V/胶继续电泳,直到溴酚蓝移至胶的下缘处,停止电泳。
采用blue silver染色方法进行固定、平衡、染色和脱色,采用凝胶成像系统对双向电泳行图像采集。
1.4.4 蛋白质胶内酶切 通过软件分析,将得到的差异蛋白质胶点切下,将切下来的不同蛋白的胶点转移至离心管,用脱色液(50%乙腈/100 mmol/L碳酸氢铵)将胶粒的蓝色脱去,每次30 min,重复数次,直至将蓝色考马斯全部洗涤掉,将胶粒冻干。取含50 ng胰蛋白酶(测序级)的50 mmol/L碳酸氢铵溶液10 μL与离心管中,静置10 min,充分吸胀,补入50 mmol/L碳酸氢铵溶液,彻底浸没胶粒,37℃孵育14~16 h。将提取液从上述离心管转移到新的离心管中,再在胶粒离心管中加入10~20 μL含0.1%三氟乙酸的60%的乙腈溶液孵育30 min,得到的溶液与之前的溶液合并,冷冻离心干燥至2~5 μL,备用。
1.4.5 质谱测定 采用AB 5800 MALDI-TOF/TOF超高分辨飞行时间质谱仪,紫外激光器以400 Hz的重复频率操作,波长为355 nm。加速电压在20 kV下运行,质量分辨率为最大值为1 600 Da。用胰蛋白酶消化的肌红蛋白用于使用内部校准模式校准质量仪表,采用Protein Pilot TM 4.0软件处理数据,采用NCBI,Uniprot库对质谱信息进行检索,得到相应蛋白点信息。
2 结果与分析
2.1 卷丹百合根和鳞茎镉含量
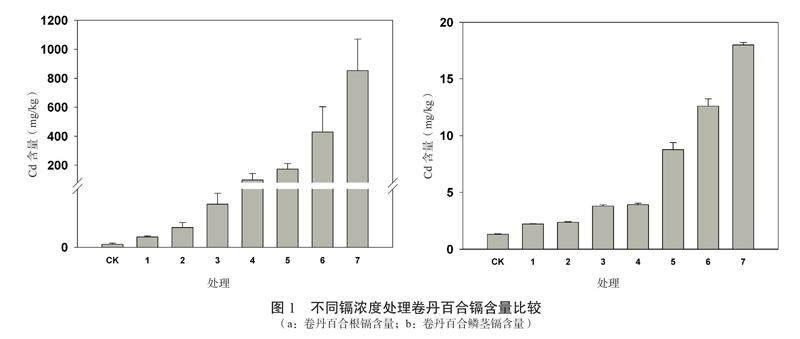
将每组镉浓度处理的水培苗随机取样,每组3个重复,将样品处理后,对卷丹百合根、鳞茎进行镉含量测定,结果表明卷丹百合根和鳞茎的镉含量随着水培镉浓度的增加而增加(图1)。
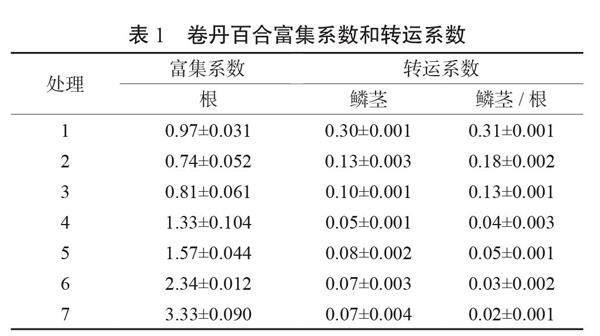
同时对不同镉处理的富集系数统计分析(表1),结果表明,卷丹百合根/土壤的富集系数变化范围为0.74~3.33,卷丹百合鳞茎/土壤的富集系数变化范围为 0.07~0.30,卷丹百合鳞茎富集系数均小于1,说明卷丹百合鳞茎在生根期没有富集镉的特性,而卷丹百合根在20 μmol/L及以上浓度情况下,富集系数大于1,说明卷丹百合根在生根期有富集特性;对于不同镉处理的转运系数分析表明,鳞茎/根的转运系数范围为0.02~0.31,说明卷丹百合生根期鳞茎对镉的转运能力很弱。
2.2 卷丹百合根的双向电泳
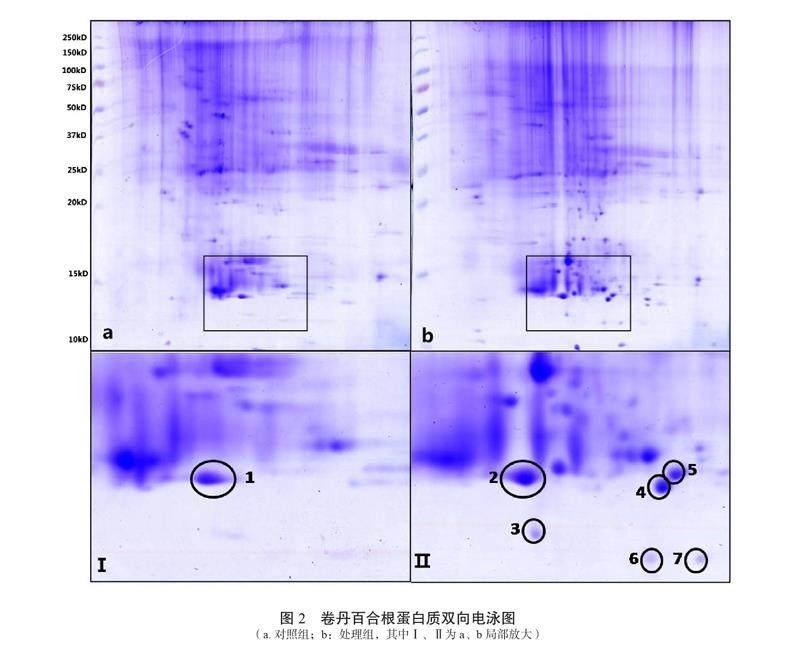
在这些处理当中,将处理7(营养液中镉含量为70 μmol/L)与对照组卷丹百合根系进行蛋白质提取分离,对差异蛋白进行分析。
由图2可见,对照组卷丹百合根与镉处理卷丹百合根的蛋白质发生了变化,选取了差异较明显的7个蛋白点进行分析鉴定,蛋白质鉴定结果如表2。
由表2可知,卷丹百合根系在镉胁迫下,许多蛋白质都发生了差异表达,其中有多功能调节酶核苷二磷酸激酶b及一些未知蛋白质,与氧化活性相关的过氧化物歧化酶,其中3号蛋白点通过质谱鉴定为Cu/Zn超氧化物歧化酶,在镉处理组中的表达量远高于对照组。
3 结论与讨论
在试验中发现Cu/Zn超氧化物歧化酶在镉处理卷丹百合根中的表达量远高于对照组卷丹百合根,镉胁迫诱导植物细胞内产生大量活性氧,从而导致细胞内蛋白质、核酸等大分子物质受损,阻碍植物的正常代谢和生长,甚至导致植物细胞死亡,而Cu/Zn超氧化物歧化酶量的增加了镉处理卷丹百合根对超氧阴离子的歧化作用,将更多的超氧阴离子歧化为过氧化氢,从而使镉处理卷丹百合根中的超氧阴离子水平低于对照组。后续试验可以对卷丹百合Cu/Zn超氧化物歧化酶的功能和作用机制进行深入研究,该研究结果将有助于解决卷丹百合重金属镉超标的问题,对整个百合产业有重要的理论价值和现实意义。
参考文献:
[1] 胡思,王超,孙贵香,等. 大健康产业背景下药食同源资源开发的现状与对策研究[J]. 湖南中医药大学学报,2021,41(5):815-820.
[2] 山东农业大学大数据研究中心. 我国百合市场与产业调查分析报告[EB/OL]. http://journal.crnews.net/ncpsczk/2021n/d17q/dcyj/93 6525_20210929104542.html.
[3] 米璐,林玉红,廖小军等. 百合鳞茎营养素与植物化学成分研究进展 [J/OL]. 食品工业科技,1-21[2024-03-10]. https://doi.org/10.13386/j.issn1002-0306.2023080319.
[4] CHEN H Y,TENG Y G,LU S J,et al. Contamination features and health risk of soil heavy metals in China[J]. Science of the Total Environment,2015,512:143-153.
[5] 李娟,王艳敏,胡玲玲,等. 江西省食品中铅和镉污染调查及健康风险评估[J]. 现代预防医学,2023,50(3):446-450.
[6] 方圆,孙家正,孙明玉,等. 镉毒性危害及其防治措施研究进展[J]. 毒理学杂志,2022,8(6):517-520.
[7] 彭佳师,王娅婷,王梦琦,等. 植物重金属镉积累调控机制及其应用研究进展[J]. 植物生理学报,2024,60(2):185-210.
[8] CONN S,GILLIHAM M. Comparative physiology of elemental distributions in plants[J]. Annals of Botany,2010,105(7):1081-1102.
[9] YILMAZ D D. Effects of salinity on growth and nickel accumulation capacity of Lemna gibba(Lemnaceae)[J]. Journal of Hazardous Materials,2007,147(1/2):74-77.
[10] IVANOV R,BAUER P. Sequence and coexpression analysis of iron-regulated ZIP transporter genes reveals crossing points between iron acquisition strategies in green algae and land plants[J]. Plant and Soil,2017,418(1):61-73.
[11] CURIE C,CASSIN G,COUCH D,et al. Metal movement within the plant:contribution of nicotianamine and yellow stripe 1-like transporters[J]. Annals of Botany,2009,103(1):1-11.
[12] FENG S S,TAN J J,ZHANG Y X,et al. Isolation and characterization of a novel cadmium-regulated Yellow Stripe-Like transporter(SnYSL3)in Solanum nigrum[J]. Plant Cell Reports,2017,36(2):281-296.
[13] 张丽婷,王志强,马兴立,等. 植物中锌转运蛋白的研究进展[J]. 贵州农业科学,2014(8):55-60.
[14] MILLS R F,PEASTON K A,RUNIONS J,et al. HvHMA2,a P1B-ATPase from barley,is highly conserved among cereals and functions in Zn and Cd transport[J]. PLoS One,2012,7(8):e42640.
[15] VERBRUGGEN N,HERMANS C,SCHAT H. Mechanisms to cope with arsenic or cadmium excess in plants[J]. Current Opinion in Plant Biology,2009,12(3):364-372.
[16] KIM D Y,BOVET L,MAESHIMA M,et al. The ABC transporter AtPDR8 is a cadmium extrusion pump conferring heavy metal resistance[J]. The Plant Journal,2007,50(2):207-218.
[17] URAGUCHI S,FUJIWARA T. Cadmium transport and tolerance in rice:perspectives for reducing grain cadmium accumulation[J]. Rice,2012,5(1):5.
[18] SASAKI A,YAMAJI N,MA J F. Overexpression of OsHMA3 enhances Cd tolerance and expression of Zn transporter genes in rice[J]. J Exp Bot,2014,65(20):6013-6021.
[19] MIYADATE H,ADACHI S,HIRAIZUMI A,et al. OsHMA3,a P1B-type of ATPase affects root-to-shoot cadmium translocation in rice by mediating efflux into vacuoles[J]. New phytologist,2011(189):190-199.
[20] CHANG J D,HUANG S,YAMAJI N,et al. OsNRAMP1 transporter contributes to cadmium and manganese uptake in rice[J]. Plant,Cell & Environment,2020,43(10):2476-2491.
[21] ZHENG XUEAO,JIANG JIARUI,WANG CHEN,et al. NRAMP6c plays a key role in plant cadmium accumulation and resistance in tobacco(Nicotiana tabacum L.)[J]. Ecotoxicology
and Environmental Safety; 2024;271. doi:10.1016/j.ecoenv. 2023.115885.
[22] TANG L,MAO B G,LI Y K,et al. Knockout of OsNramp5 using the CRISPR/Cas9 system produces low Cd-accumulating indica rice without compromising yield[J]. Scientific Reports,2017,7(1):14438.
(责任编辑:肖彦资)
收稿日期:2024-03-05
基金项目:湖南省农业科学院创新项目(2022CX99,2023CX108,2023CX109);湖南省种业创新项目(2021NK1005);湖南省重点研发项目(2022NK2008,2023NK2014)
作者简介:谢进(1984—),女,湖南株洲市人,助理研究员,主要从事药用植物生物化学研究。
通信作者:宋荣
