某院精神科住院患者艰难梭菌定植的分子流行病学特征
2024-06-28王玲林珊黄益花段慈东田梦伦沈宇航宋小军陈毓赵龙友金大智
王玲 林珊 黄益花 段慈东 田梦伦 沈宇航 宋小军 陈毓 赵龙友 金大智

摘要:目的 研究精神科住院患者艰难梭菌定植的分子流行病学特征,并探讨定植的相关因素。方法 于2020年6月1日至9月30日期间,收集丽水市第二人民医院精神科住院患者的粪便样本。分离培养艰难梭菌,并进行毒素基因鉴定、多位点序列分型和抗生素敏感性试验。结合患者的临床资料,分析艰难梭菌定植的相关因素。结果 共收集粪便样本442份,分离到24株(5.4%)艰难梭菌。其中,20株为TcdA和TcdB毒素基因阳性、二元毒素基因阴性(A+B+CDT-),3株为A-B+CDT-,1株为A+B+CDT+。共鉴定出14种序列分型(ST),包括1株高毒力ST11型。所有菌株对甲硝唑、万古霉素、利福平和哌拉西林敏感,但对环丙沙星(95.8%)、克林霉素(87.5%)和红霉素(62.5%)的耐药率较高。二元Logistic回归分析结果显示,在不同科室中,年龄(≥60岁)、住院天数(>200 d)和服用劳拉西泮片与老年精神科患者艰难梭菌定植具有显著相关性(OR=3.762~15.556,P<0.05),而住院天数(>20 d)与早期干预科患者艰难梭菌定植具有显著相关性(OR=0.004,P<0.001)。结论 研究发现精神科住院患者存在5.4%的艰难梭菌定植率,年龄较大、住院天数较长且长期服用精神治疗性药物的患者与艰难梭菌定植间存在相关性,需加强院内感染防控监测进而遏制艰难梭菌在精神科的暴发和传播。
关键词:艰难梭菌定植;精神科;分子特征;相关因素
中图分类号:R978.1文献标志码:A
Molecular epidemiological characteristics of Clostridioides difficile colonization in psychiatric inpatients in a hospital
Wang Ling1, Lin Shan2,3, Huang Yihua1, Duan Cidong3, Tian Menglun3, Shen Yuhang3,4, Song Xiaojun5,6, Chen Yu3,5, Zhao Longyou1, and Jin Dazhi3,5,6
(1 Lishui Second People's Hospital, Lishui 323020; 2 TEDA Institute of Biological Sciences and Biotechnology, Nankai University, Tianjin 300457; 3 School of Laboratory Medicine and Bioengineering, Hangzhou Medical College, Hangzhou 310053; 4 Institute of Ageing Research, School of Basic Medical Sciences, Hangzhou Normal University, Hangzhou 311121; 5 Key Laboratory of Biomarkers and in vitro Diagnosis Translation of Zhejiang Province, Hangzhou 310063; 6 Laboratory Medicine Center, Department of Clinical Laboratory, Zhejiang Provincial People's Hospital, Hangzhou Medical College, Hangzhou 310014)
Abstract Objective To investigate the molecular epidemiology of Clostridioides difficile colonization (CDC) in psychiatric inpatients and explore the associated factors. Methods Stool samples were collected from psychiatric inpatients in Lishui Second People's Hospital between June 1 and September 30, 2020. C. difficile was cultured and analyzed for toxin gene identification, multilocus sequence typing, and antimicrobial resistance. Associated factors for CDC were analyzed according to patients' clinical data. Results Out of 442 stool samples, 24 (5.4%) C. difficile isolates were obtained. Among them, 20 isolates were identified as TcdA and TcdB positive and binary toxin genes negative (A+B+CDT-), three as A-B+CDT-, and one as A+B+CDT+. Fourteen sequence types (ST) were identified, including one hypervirulent ST11. All isolates were susceptible to metronidazole, vancomycin, rifampin, and piperacillin, but exhibited high resistance rates to ciprofloxacin (95.8%), clindamycin (87.5%), and erythromycin (62.5%). Binary logistic regression results showed that in different departments, age (≥60 years), length of hospital stays (>200 days), and lorazepam usage were significantly associated with CDC (OR=3.762~15.556, P<0.05). In contrast, there was a significant association between length of hospital stays (>20 days) and CDC (OR=0.004, P<0.001). ConclusionThe study revealed a 5.4% colonization rate among psychiatric inpatients. There is a correlation between older age, prolonged hospitalization, and long-term usage of psychotropic medications with CDC. Monitoring and controlling nosocomial infection should be enforced to prevent the outbreak and transmission of C. difficile in this hospital.
Key words Clostridioides difficile colonization; Psychiatry department; Molecular characteristics; Associated factors
艰难梭菌(Clostridioides difficile)是一种革兰阳性芽孢杆菌,是引起院内感染腹泻的主要病原体之一[1]。艰难梭菌感染(C. difficile infection, CDI)的临床表现范围从轻度腹泻到伪膜性结肠炎,甚至可能导致死亡[2]。2019年美国CDC发布了抗生素耐药性威胁报告,将艰难梭菌列为最高级别的“极危”等级[3]。同时,报告指出在美国约有22.39万例CDI病例,导致1.28万人死亡,相关医疗费用高达10亿美元[4]。近年来,国内临床已检出高毒力核糖体027型和078型菌株[5]。同时,携带TcdA毒素基因阴性、TcdB毒素基因阳性和二元毒素基因阴性(A-B+CDT-)菌株的CDI病例正呈上升趋势,并且这些菌株对多种抗生素呈现出更高的耐药性[6]。因此,艰难梭菌已成为国内外临床高度关注的病原体之一。
艰难梭菌作为人体肠道菌群的一部分,常定植于人体大肠或结肠内[7]。然而,当长期接受抗生素治疗时,定植的艰难梭菌(C. difficile colonization, CDC)可迅速增殖并释放毒素TcdA/B,导致机体出现腹泻等临床感染症状[1]。当前研究表明,艰难梭菌在成年人中的定植率约为4%至15%,在住院患者中约为3%至21%,在医护人员中约为4.2%;而在长期护理机构的患者中可高达51%[8]。值得注意的是,已有报道指出CDC菌株的型别具有多样性[9],而且CDC携带者容易发展为CDI患者[10],因此深入研究CDC的分子流行病学对于控制该病原体的传播至关重要。尽管国内临床已对神经外科[11]、血液科[12]和老年医学科[13]患者的CDC进行了研究,但目前仍缺乏其他疾病患者CDC的相关数据。精神科住院患者长期服用精神治疗性药物,且具有住院时间长、自理能力差、认知力缺乏的特点[14],增加了艰难梭菌在医院内传播的风险。因此,本研究旨在阐明精神科住院患者CDC的分子流行病学特征,以期为早期识别和及时控制CDI的院内感染和暴发流行提供必要的科学依据。
1 材料与方法
1.1 研究对象
本横断面研究于2020年6月1日—9月30日在丽水市第二人民医院进行,该医院是一所三级甲等精神病专科医院。在研究期间,采集非腹泻精神科住院患者入院48 h后的粪便标本进行艰难梭菌分离检测。同时,收集患者的临床资料,包括年龄、性别、住院天数、诊断及药物使用史等。CDC病例定义为在没有CDI症状的患者中携带艰难梭菌[15]。本研究通过丽水市第二人民医院伦理委员会审批(审批号:20201012-01),以确保在研究过程中遵循伦理原则和规范。
1.2 研究方法
1.2.1 艰难梭菌培养
按照文献所述方法[16],从粪便中分离并培养艰难梭菌。简要流程如下,取200 mg粪便标本,加入800 μL无水乙醇中,振荡混匀。室温静置1 h后,8000 r/min离心2 min,取沉淀物接种于CDCA显色培养基(购自浙江青谷生物工程有限公司),于37 ℃厌氧培养24 h。将疑似艰难梭菌菌落再次接种CDCA,37 ℃厌氧培养24 h,获得纯的艰难梭菌菌落后,将菌株于-80 ℃保存。
1.2.2 毒素基因鉴定
采用Qiagen基因组提取试剂盒(货号:Cat. No. 69504)提取菌株基因组DNA,具体操作见说明书。根据Griffiths等方案[17],扩增毒素基因tcdA和tcdB。反应体系总量为25 μL,包括Premix Taq缓冲液4.7 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板2 μL,ddH2O 16.3 μL。通过1.5%琼脂糖凝胶电泳检测PCR产物。
1.2.3 多位点序列分型(MLST)
根据Griffiths等方案[17],扩增7个管家基因(adk、atpA、dxr、glyA、recA、sodA和tpi),反应体系同“1.2.2”部分。选取条带明亮的PCR产物送至生工生物工程(上海)股份有限公司进行Sanger测序。随后,测序结果上传至艰难梭菌MLST在线数据库(https://pubmlst. org/organisms/clostridioides-difficile)进行比对,以获得相应的序列分型(sequence type,ST)。最后,根据ST型的种类,使用基于MSTree V2算法的GrapeTree软件构建最小生成树[18]。
1.2.4 抗生素敏感性试验
根据美国临床实验室标准化协会(CLSI)发布的M100-S33标准[19],采用琼脂稀释法测定菌株对12种抗生素(甲硝唑、万古霉素、红霉素、克林霉素、夫西地酸、利福平、四环素、哌拉西林、左氧氟沙星、莫西沙星、加替沙星和环丙沙星)的最小抑菌浓度(minimal inhibitory concentration,MIC)。进一步计算MIC值的相关参数,包括MIC50、MIC90、MIC的几何平均数(geometric mean,GM)和MIC范围。其中,红霉素和利福平的折点判定参照相关文献[20],万古霉素和夫西地酸的折点判定参照欧洲抗生素敏感性测试委员会(EUCAST)标准[21],其余抗生素的折点判定则遵循CLSI标准[19]。选用艰难梭菌标准菌株(ATCC 700057)和脆弱拟杆菌(ATCC25285)作为抗生素敏感性试验的质控菌株[20]。菌株若对3种及以上不同种类的抗生素呈现耐药性,将其定义为多重耐药株[20]。
1.3 统计学分析
采用SPSS 26.0软件进行数据分析。计量资料使用(x±s)表示,计数资料用率或百分比描述。计量资料分析使用t检验或Mann-Whitney U检验,计数资料分析采用χ2检验或Fisher精确检验法。采用二元Logistic回归计算比值比(OR)和95%置信区间(CI),进一步采用多元Logistic回归确定独立相关因素。P<0.05认为差异具有统计学意义。
2 结果
2.1 艰难梭菌分离培养与毒素基因鉴定
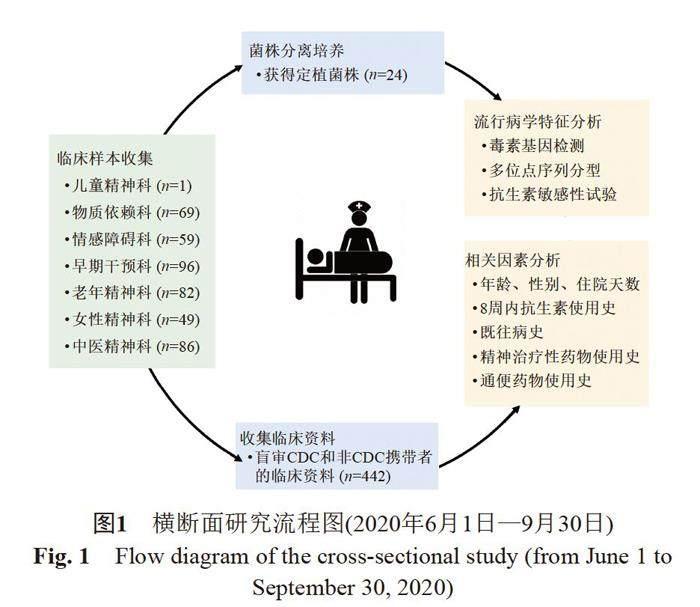
本研究共收集442名住院患者的粪便样本,包括儿童精神科(n=1)、物质依赖科(n=69)、情感障碍科(n=59)、早期干预科(n=96)、老年精神科(n=82)、女性精神科(n=49)和中医精神科(n=86),具体实验研究流程详见图1。研究结果显示,在442份粪便样本中,共检出24株艰难梭菌,定植率为5.4%。毒素基因鉴定结果显示,24株菌株均为产毒型艰难梭菌,其中20株为A+B+CDT-(83.3%,20/24),3株为A-B+CDT+(12.5%,3/24),1株为A+B+CDT+(4.2%,1/24)。
2.2 临床基本资料
24例CDC携带者中,男性20例(83.3%),女性4例(16.7%),平均年龄为(45.7±12.4)岁,平均住院时间为(157.8±244.0) d。临床资料显示,在早期干预科中,仅有1位CDC携带者在8周内接受了抗生素(阿奇霉素)治疗。值得注意的是,在不同科室中,早期干预科的阳性率最高(54.2%,13/24),其次为物质依赖科(16.7%,4/24)、老年精神科(12.5%,3/24)、中医精神科(12.5%,3/24)和情感障碍科(4.2%,1/24)。此外,在早期干预科中,精神分裂症患者的占比较大(76.9%,10/13)。这些精神分裂症患者中,使用奥氮平片、氨磺必利片和富马酸喹硫平片的人数最多,分别为6、6和4人。同时,这些患者还使用了通便药物,其中4人使用酚酞片、6人使用复方嗜酸乳杆菌片和1人使用复方消化酶胶囊。详细数据见表1。
2.3 MLST
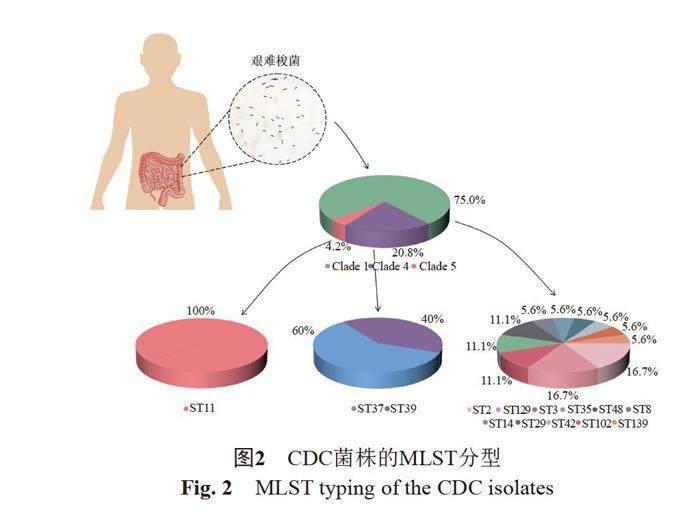
经过MLST分析,24株艰难梭菌共检出14种ST型。这些ST型主要分布在Clade1中,占比为75.0%(共18株)。具体而言,Clade1中包括ST2和ST129(均为16.7%,3/18), ST3、ST35和ST48(均为11.1%,2/18),以及ST8、ST14、ST29、ST42、ST102和ST139(均为5.6%,1/18)。值得注意的是,在Clade4中检出了3株ST37(60%,3/5)和2株ST39(40%,2/5)。同时,还检出1株Clade5中的高毒力ST11株(100%,1/1),详见图2。
在不同科室中,根据ST型的分布情况构建最小生成树,详见图3。圆形代表ST型,圆形大小和分割份数表示相应菌株的数量,圆形之间连线上的数字表示相邻ST型之间的位点变化数量。在早期干预科中检测到的ST48是所有ST型的共同祖先,与物质依赖科中的ST8、老年精神科和中医精神科中的ST3以及早期干预科中的ST102之间有2个位点差异,亲缘关系较近;与情感障碍科中的ST29之间有3个位点差异;与物质依赖科中的ST35之间有6个位点差异;而与早期干预科中的ST37和老年精神科中的高毒力ST11之间则存在8个位点差异,亲缘关系较远。
2.4 抗生素敏感性分析
24株CDC菌株对12种抗生素的MIC分布和耐药情况详见表2。所有菌株均对甲硝唑、万古霉素、利福平和哌拉西林敏感(0,0/24)。然而,这些菌株对环丙沙星的耐药率最高(95.8%,23/24),其次为克林霉素(87.5%,21/24)和红霉素(62.5%,15/24)。有18株菌株具有多重耐药特征,占总数的75%。此外,在不同年龄段(35、40、45、50、55和60岁)之间,未观察到耐药率有显著性差异(P>0.05,数据未显示)。
2.5 CDC相关因素
在本研究中,对每位患者的病历资料进行了盲审,并运用二元Logistic回归分析评估了CDC的相关因素。在物质依赖科、情感障碍科和女性精神科中未观察到CDC的相关因素(P>0.05,数据未显示)。在早期干预科中,住院时间(>20 d)与CDC的发生存在显著相关性(OR=0.004,P<0.001)。同时,在老年精神科中,年龄(≥60岁)、住院时间(>200 d)以及服用劳拉西泮片与CDC的发生也存在显著相关性(OR= 3.762~15.556,P<0.05,见表3)。进一步针对这些具有显著性差异的参数进行多元Logistic回归分析,未发现老年精神科中CDC的独立相关因素(P>0.05,数据未显示)。
3 讨论
CDC和CDI是艰难梭菌在体内引起的不同宿主反应,当长期使用抗生素或人体免疫功能低下时,CDC菌株会迅速增殖并释放毒素引发CDI[22]。一项Meta分析研究表明,入院时携带产毒型艰难梭菌的CDC携带者发展为CDI患者的概率是无携带者的5.9倍[10]。尽管无症状CDC携带者被认为是医疗环境中艰难梭菌传播的重要媒介,但由于其不是院内感染控制的关注重点,因而不会接受主动的定植监测[23]。精神科住院患者通常病程长,住院时间长,其临床特征主要表现为明显的意识和行为功能障碍[24]。因此,在病房封闭管理的情况下,患者间的相互接触可能较为频繁,从而增加了CDI的风险[24]。然而,目前国内尚未对精神科住院患者开展艰难梭菌的分子流行病学调查。因此,及时掌握这类无症状CDC携带者的分子特征及相关因素,对于有效预防和控制艰难梭菌在院内传播至关重要。
在本研究中,精神科住院患者的CDC定植率为5.4%。这一比率低于上海地区ICU患者的定植率(19.02%)[25]、江苏地区神经外科患者的定植率(16.15%)[26],以及浙江地区结直肠癌术前患者的定植率(16.10%)[7]。这种差异可能是由于这些科室的患者通常病情危重、免疫力低下,需要接受复杂的治疗,包括长期抗生素治疗、使用免疫抑制药物以及有创性操作等[27],从而增加了感染艰难梭菌的风险。临床资料显示,在所有精神科住院患者中,仅有6人使用了抗生素,包括替硝唑、左氧氟沙星、盐酸莫西沙星以及阿奇霉素(数据未显示)。同时,在24名CDC携带者中仅有1人使用了阿奇霉素,这表明这类精神科住院患者的肠道菌群相对稳定。值得注意的是,尽管精神科住院患者长期服用精神治疗性药物可能导致机体免疫力下降[14],但由于大部分精神治疗性药物具有抗胆碱能作用,可以通过抑制乙酰胆碱的分泌来减缓胃肠道的蠕动[28-29],这可能在一定程度上抑制了腹泻症状,因而有可能使得这类CDC携带者在精神治疗过程中未发展成为CDI患者。然而,在结束阶段性治疗后是否会出现CDI尚不清楚。同时,除情感障碍科外,其他科室均有部分CDC携带者使用通便药物,如酚酞片、复方嗜酸乳杆菌片、复方消化酶胶囊等,说明这类CDC携带者可能存在便秘。因此,后续需要对精神疾病治疗结束后CDI发病情况及精神类药物对肠道的影响等进行更深入的研究,以阐明精神病患者中CDC和CDI之间的关系。
本研究共检出14种ST型别,这些型别呈现散在分布。当前国外研究指出,CDI和CDC菌株中存在相同的流行型别,并且CDC菌株的型别类型更具多样化[9],这与我们在浙江地区开展的另一项研究结果一致[30]。因此,CDC菌株可在人群中形成多条传播链,从而加速其在院内传播。同时,本研究检出了3株ST37型菌株,这是亚太地区主要的流行型别之一,并且在国内与引起临床重症CDI有关[31]。值得注意的是,这3株菌株在早期干预科中被集中检出,且分离时间在35 d内。根据流行病学调查结果,该科室精神病患者通常随意走动,无固定床位,因此该科室极有可能出现ST37型菌株的暴发流行。此外,本研究首次在老年精神科中检出高毒力ST11菌株。尽管该患者未表现出与CDI相关的临床症状,但考虑到患者的高龄(68 岁)和长时间住院(83 d),存在服用抗生素后发展为CDI的潜在风险。因此,有必要加强该患者病房的消毒措施,以有效控制ST11型菌株在该医院迅速蔓延。
抗生素敏感性试验结果显示,除了甲硝唑和万古霉素外,利福平和哌拉西林对所有CDC菌株敏感。相反,环丙沙星对CDC菌株的耐药率最高(95.8%),这与该药物对亚太地区CDI菌株的高耐药率(95.1%)和对结直肠癌患者中CDC菌株的高耐药率(78.8%)一致[7, 32]。尽管在本研究中,第三代喹诺酮类药物环丙沙星(95.8%)和左氧氟沙星(16.7%)对CDC菌株的耐药率高于第四代药物莫西沙星和加替沙星(均为8.3%)。然而,左氧氟沙星对这些CDC菌株的耐药率明显低于其对亚太地区CDI菌株的耐药率(93.4%)和对结直肠癌患者CDC菌株的耐药率(66.7%)[7,32]。此外,克林霉素和红霉素对CDC菌株的耐药率也相对较高,分别为87.5%和62.5%,与亚太地区报道的克林霉素(86.3%)和红霉素(54.4%)对CDI菌株的耐药率,以及结直肠癌患者中克林霉素和红霉素(均为63.6%)对CDC菌株的耐药率相一致[7,32]。值得注意的是,在本研究中,多重耐药株的比例较大(75.0%),尤其是3株ST37型菌株均为多重耐药株。因此,需要持续监测这些CDC菌株的耐药水平变化,以指导临床合理用药。
目前,国内仍然缺乏CDC相关因素的数据。在本研究中,二元Logistic回归分析结果显示,年龄(≥60 岁)、住院时间(>200 d)以及服用劳拉西泮片与CDC的发生存在显著相关性。据报道,6个月内使用抗生素可增加CDC风险3.7倍[33]。然而,与ICU中CDC携带者的危险因素分析结果一致[34],本研究未发现抗生素使用是老年精神科患者CDC的相关因素,这可能与这类患者均未使用抗生素有关。此外,本研究首次发现服用劳拉西泮片与老年精神科患者CDC的发生存在相关性,并且其可使CDC的发生增加15.6倍。因此,在临床治疗中应谨慎使用该药物。然而,尽管已有研究显示,住院天数是ICU患者CDC的独立危险因素[35]。在本研究中,由于病例数量限制,多元Logistic回归分析结果显示上述变量差异均无统计学意义(P>0.05)。另外,在本研究中,住院时间(>20 d)与早期干预科患者CDC的发生存在相关性。临床资料显示,早期干预科中的CDC携带者具有年轻化(41.92±12.05)岁的特点。当前,已有证据显示,与CDI患者相比,CDC携带者往往更年轻,并且查尔森共病指数(Charlson Comorbidity Index)得分较低[9]。因此,持续监测对于防控CDC携带者的院内传播及其发展为CDI患者至关重要。
本研究存在一定的局限性。首先,所有临床样本均来自同一家医院,未来应开展多中心合作,覆盖不同地理位置和医疗机构,以全面描述精神科住院患者CDC的分子流行病学特征。其次,未能获取环境样本,因而无法全面评估艰难梭菌在精神科住院患者中的传播情况。未来应进一步采用全基因组测序技术,以描绘CDC携带者之间的传播链条。最后,未能对CDC携带者进行追踪随访,因而无法判断这些CDC携带者精神疾病治疗停止后是否发展为CDI患者。后续需要开展长期随访,为评估精神科住院患者CDC的疾病发展模式提供必要的科学依据。
综上所述,精神科住院患者存在5.4%的艰难梭菌定植率,定植的菌株均为产毒型艰难梭菌,且对环丙沙星、克林霉素和红霉素存在较高耐药率。年龄较大、住院天数较长且长期服用精神治疗性药物,特别是服用劳拉西泮片的患者与艰难梭菌定植存在相关性。这些研究成果对深入了解精神科住院患者CDC的分子流行病学特征及防控艰难梭菌的院内感染传播具有重要意义。
参 考 文 献
林珊, 宋小军, 屈平华, 等. 艰难拟梭菌重命名及相关致病因子研究进展[J]. 疾病监测, 2021, 36(4): 344-349.
Jin D, Tang Y, Riley T. Editorial: Clostridium difficile infection in the Asia-Pacific region[J]. Front Cell Infect Microbiol, 2022, 12: 983563.
林珊, 宋广忠, 胡继红, 等. 艰难梭菌感染的检测方法与实验室诊断策略[J]. 中华传染病杂志, 2021, 39(10): 642-646.
Centers for Disease Control and Prevention (CDC): Antibiotic resistance threats in the United States[J/OL]. [2023-12-28]. https://www.cdc.gov/drugresistance/biggest-threats.html.
Wu Y, Wang Y Y, Bai L L, et al. A narrative review of Clostridioides difficile infection in China[J]. Anaerobe, 2022, 74: 102540.
许星星, 罗芸, 王贤军, 等. 国内外艰难梭菌感染现状分析[J]. 传染病信息, 2018, 31(2): 175-180.
Zheng Y, Luo Y, Lv Y, et al. Clostridium difficile colonization in preoperative colorectal cancer patients[J]. Oncotarget, 2017, 8(7): 11877-11886.
Crobach M J T, Vernon J J, Loo V G, et al. Understanding Clostridium difficile colonization[J]. Clin Microbiol Rev, 2018, 31(2): e00021-17.
Kim B, Seo M R, Kim J, et al. Ribotype variability of Clostridioides difficile strains in patients with hospital-acquired C. difficile infections, community-acquired C. difficile infections, and colonization with toxigenic and non-toxigenic strains of C. difficile[J]. Anaerobe, 2019, 60: 102086.
Zacharioudakis I M, Zervou F N, Pliakos E E, et al. Colonization with toxinogenic C. difficile upon hospital admission, and risk of infection: A systematic review and meta-analysis[J]. Am J Gastroenterol, 2015, 110(3): 381-390.
祁琪, 高洁, 石荃, 等. 神经外科患者入院时产毒性艰难梭菌定植率及其危险因素研究[J]. 中华医院感染学杂志, 2020, 30(6): 872-877.
王洁, 杨靖, 刘晓雷, 等. 血液病患者产毒艰难梭菌无症状定植和感染相关危险因素的前瞻性研究[J]. 中国感染与化疗杂志, 2021, 21(6): 641-645.
顾吉娜, 金慧, 蔡雅卫, 等. 老年医学科患者艰难梭菌检测结果与定植危险因素分析[J]. 中华医院感染学杂志, 2016, 26(10): 2183-2185.
赵胜楠, 周莉萍, 连卓. 精神科住院患者院内感染影响因素分析及应对措施[J]. 河南医学研究, 2020, 29(25): 4651-4653.
Johnson S, Lavergne V, Skinner A M, et al. Clinical practice guideline by the infectious diseases society of America (IDSA) and society for healthcare epidemiology of America (SHEA): 2021 focused update guidelines on management of Clostridioides difficile infection in adults[J]. Clin Infect Dis, 2021, 73(5): 755-757.
边俏, 罗芸, 许星星, 等. 一种用于艰难梭菌分离培养的新型显色培养基的性能评价[J]. 临床检验杂志, 2019, 37(4): 301-304.
Griffiths D, Fawley W, Kachrimanidou M, et al. Multilocus sequence typing of Clostridium difficile[J]. J Clin Microbiol, 2010, 48(3): 770-778.
周秀娟, 崔妍, 何逸尘, 等. 沙门氏菌泛耐药基因组特征分析[J]. 微生物学报, 2021, 61(8): 2358-2369.
CLSI. Performance standards for antimicrobial susceptibility testing (M100-S33)[S]. Wayne, PA: CLSI, 2023.
Jin D, Luo Y, Huang C, et al. Molecular epidemiology of Clostridium difficile infection in hospitalized patients in eastern China[J]. J Clin Microbiol, 2017, 55(3): 801-810.
EUCAST. EUCAST guidelines for susceptibility testing (Version 13.1)[S]. V?xj?, Sweden: EUCAST, 2023.
苗瑞雪, 汪志凌, 周伟, 等. 艰难梭菌在儿童肠道定植和感染的研究进展[J]. 重庆医学, 2019, 48(1): 134-137.
Khanafer N, Vanhems P, Bennia S, et al. Factors associated with Clostridioides (Clostridium) difficile infection and colonization: Ongoing prospective cohort study in a French university hospital[J]. Int J Environ Res Public Health, 2021, 18(14): 7528.
袁景, 孙莲芳. 住院精神分裂症患者并发感染影响因素分析[J]. 河北医科大学学报, 2022, 43(9): 1029-1032.
Mi H, Bao R, Xiao Y, et al. Colonization of toxigenic Clostridium difficile among intensive care unit patients: A multi-centre cross-sectional study[J]. Front Cell Infect Microbiol, 2020, 10: 12.
马开慧, 吕治, 周妍妍, 等. 住院患者艰难梭菌定植和感染特征分析[J]. 检验医学, 2023, 38(2): 153-156.
宋晓超, 丁蔚, 金美娟. 重症监护室与普通病房碳青霉烯类耐药鲍曼不动杆菌医院感染分布与耐药性分析[J]. 中国消毒学杂志, 2024, 41(1): 33-37.
Rodríguez-Ramallo H, Báez-Gutiérrez N, Prado-Mel E, et al. Association between anticholinergic burden and constipation: A systematic review[J]. Healthcare (Basel), 2021, 9(5): 581.
Joshi Y B. Cholinergic functioning, cognition, and anticholinergic medication burden in Schizophrenia[J]. Curr Top Behav Neurosci, 2023, 63: 393-406.
Shen Y, Lin S, You P, et al. Rapid discrimination between clinical Clostridioides difficile infection and colonization by quantitative detection of TcdB toxin using a realtime cell analysis system[J]. Front Microbiol, 15: 1348892.
Xu X, Luo Y, Chen H, et al. Genomic evolution and virulence association of Clostridioides difficile sequence type 37 (ribotype 017) in China[J]. Emerg Microbes Infect, 2021, 10(1): 1331-1345.
Luo Y, Cheong E, Bian Q, et al. Different molecular characteristics and antimicrobial resistance profiles of Clostridium difficile in the Asia-Pacific region[J]. Emerg Microbes Infect, 2019, 8(1): 1553-1562.
Nissle K, Kopf D, R?sler A. Asymptomatic and yet C. difficile-toxin positive? Prevalence and risk factors of carriers of toxigenic Clostridium difficile among geriatric in-patients[J]. BMC Geriatr, 2016, 16(1): 185.
Cui Y, Dong D, Zhang L, et al. Risk factors for Clostridioides difficile infection and colonization among patients admitted to an intensive care unit in Shanghai, China[J]. BMC Infect Dis, 2019, 19(1): 961.
Yu M, Zhao B, Chen Y, et al. Epidemiology and risk factors for hospital acquired Clostridium difficile infection and colonization in emergency intensive care unit of a general hospital in Shanghai[J]. Chin Crit Care Med, 2021, 33(11): 1358-1361.
