多黏菌素对头孢他啶/阿维巴坦与碳青霉烯共耐药铜绿假单胞菌的体
2024-06-28外杀菌作用研究陈玲霞邹雪寒张晓璠李曦潘红英
外杀菌作用研究陈玲霞 邹雪寒 张晓璠 李曦 潘红英

摘要:目的 头孢他啶/阿维巴坦(CZA)是治疗碳青霉烯耐药铜绿假单胞菌(CRPA)的一种有效的替代抗生素,在临床上被广泛应用,然而CZA耐药CRPA菌株的出现使得治疗铜绿假单胞菌感染的难度不断增加。本研究旨在通过体外时间杀菌分析,探讨多黏菌素(COL)对携带不同碳青霉烯耐药基因的CZA耐药铜绿假单胞菌菌株的体外杀菌活性,为铜绿假单胞菌感染的临床治疗提供科学依据。方法 从浙江省的一家三甲医院收集了CZA耐药的铜绿假单胞菌菌株。通过聚合酶链反应(PCR)和全基因组测序筛选了携带不同碳青霉烯耐药基因的5株代表性铜绿假单胞菌菌株,包括携带blaKPC-2的PA4696、携带blaKPC-90的PA2207、携带blaKPC-33的PA1308、携带blaVIM的PA2070、携带blaIMP-45的PA6227。通过微量肉汤稀释法确认了实验菌株的抗生素敏感性。对COL敏感的菌株进行重复的时间杀菌实验。结果 5株CRPA菌株均对CZA耐药(MIC≥16/4 mg/L),对COL敏感(MIC≤2 mg/L);
其中携带blaIMP-45的菌株PA6227表现出特殊的药敏表型(ISMR),对亚胺培南(IPM)敏感(MIC=2 mg/L)而对美罗培南(MEM)(MIC=128 mg/L)等其他碳青霉烯类药物耐药。时间杀菌曲线显示,5株CZA耐药的铜绿假单胞菌菌株在前2~8 h被不同浓度的COL完全抑制,但随后恢复生长。结论 COL对CZA耐药的CRPA菌株具有体外杀菌活性,但不能单独使用。不同类型的碳青霉烯耐药基因会影响CZA的作用效果,但与COL的杀菌活性无关,携带不同碳青霉烯耐药基因的分离株均在不同时间恢复生长。在治疗铜绿假单胞菌感染时,可以调整给药间隔或药物浓度,以维持COL的浓度,从而获得更好的治疗效果。同时应注意具有ISMR这一特殊药敏表型的CRPA在临床上的出现,避免抗生素的不合理应用。
关键词:多黏菌素;头孢他啶/阿维巴坦;碳青霉烯耐药铜绿假单胞菌;时间杀菌曲线
中图分类号:R978.1文献标志码:A
Antibacterial activity of colistin against Pseudomonas aeruginosa isolates co-resistant to carbapenem and ceftazidime-avibactam in vitro
Chen Lingxia1, Zou Xuehan1, Zhang Xiaofan 2, Li Xi2, and Pan Hongying1
(1 Center for General Practice Medicine, Department of Infectious Diseases, Zhejiang Provincial People's Hospital, Affiliated People's Hospital, Hangzhou Medical College, Hangzhou 310014; 2 Laboratory Medicine Center, Department of Clinical Laboratory, Zhejiang Provincial People's Hospital, Affiliated People's Hospital, Hangzhou Medical College, Hangzhou 310014)
Abstract Objective Ceftazidime-avibactam (CZA) is an effective alternative antibiotic for the clinical treatment of carbapenem-resistant Pseudomonas aeruginosa (CRPA) strains. However, the emergence of CZA-resistant CRPA in clinics has increased the difficulty of treating P. aeruginosa infections. The objective of our study was to investigate the in vitro bactericidal activity of colistin (COL) against CZA-resistant P. aeruginosa isolates carrying different carbapenemase genes using time-kill analysis, which provided a scientific basis for the clinical treatment of P. aeruginosa infections. Methods CZA-resistant P. aeruginosa isolates were collected from a tertiary hospital in Zhejiang Province, China. Five representative P. aeruginosa isolates carrying carbapenemase genes, including P. aeruginosa PA 4696 carrying blaKPC-2, P. aeruginosa PA 2207 carrying blaKPC-90, P. aeruginosa PA 1308 carrying blaKPC-33, P. aeruginosa PA 2070 carrying blaVIM, P. aeruginosa and PA 6227 carrying blaIMP-45 were selected by polymerase chain reaction (PCR) and whole genome sequencing. Antibiotic susceptibility was confirmed by broth microdilution. Time-kill experiments were performed in duplicates for each isolate. Results All five isolates were resistant to CZA (MIC≥16/4 mg/L) and sensitive to COL (MIC≤2 mg/L). And P. aeruginosa PA 6227, which carried blaIMP-45, showed a specific drug-sensitive phenotype (ISMR) and was sensitive to IPM (MIC=2 mg/L) but resistant to other carbapenems such as MEM (MIC=128 mg/L). Time-killing curves showed that the five CZA-resistant P. aeruginosa isolates were completely inhibited for the first 2~8 hours at different concentrations of COL, but then resumed regrowth. Conclusion COL had in vitro bactericidal activity against CZA-resistant CRPA isolates but could not be used alone. The presence of different carbapenem resistance genes affected the efficacy of CZA, but was not related to the bactericidal activity of COL, and isolates carrying different carbapenem resistance genes all showed regeneration at different times. In the treatment of P. aeruginosa infections, the dosing interval or drug concentration can be adjusted to maintain the concentration of COL to achieve a better treatment effect. Attention should also be paid to the clinical presence of CRPA with this particular phenotype of ISMR to avoid the irrational application of antibiotics.
Key words Colistin; Ceftazidime-avibactam; Carbapenem-resistant Pseudomonas aeruginosa; Time-kill curves
铜绿假单胞菌(Pseudomonas aeruginosa, PA)是一种机会性病原体,与高发病率和死亡率有关[1]。2022年,欧洲疾病预防控制中心(European Centre for Disease Prevention and Control,ECDC)表示,多重耐药或广泛耐药(multidrug-resistant or extensively drug-resistant, MDR/XDR)PA占所有被测菌株的17.3%,且其耐药性正在上升[2-3]。MDR/XDR-PA的日益出现已成为全球公共卫生威胁。此外,PA基因组中的可变毒力因子和抗生素抗性导致多种复杂的耐药机制,使常规疗法可能无效[4-6]。MDR/XDR-PA感染的主要后果之一是难以选择适当的抗生素治疗。
头孢他啶/阿维巴坦(ceftazidime-avibactam,CZA)在大型监测研究中对MDR/XDR-PA分离株表现出很高的体外活性[7]。它是广谱β-内酰胺酶抑制剂阿维巴坦和第三代头孢菌素头孢他啶的组合,可通过与革兰阴性杆菌的青霉素结合蛋白(penicillin binding proteins,PBPs)结合来抑制细胞壁合成[8]。它对产B类金属β-内酰胺酶(metallo-β-lactamase,MBLs)的分离株无效,对产A类、C类和D类β-内酰胺酶的分离株有效[9]。增强合理使用抗菌药物抗碳青霉烯类耐药铜绿假单胞菌(the enhancing rational antimicrobials against carbapenem-resistant P. aeruginosa,ERACE-PA)全球研究小组发现,CZA对大多数碳青霉烯类敏感和碳青霉烯类耐药铜绿假单胞菌(carbapenem-resistant P. aeruginosa,CRPA)均具有活性,敏感率分别为91%和72%[10]。然而由于耐药机制和表型的区域差异,已经出现了对碳青霉烯和CZA共耐药的PA分离株[11-12],且CRPA对CZA的耐药率已达到25.5%。产不同碳青霉烯酶CRPA的CZA耐药率存在显著差异,产KPC菌株的CZA耐药率为35.7%,产NDM菌株的CZA耐药率为97%[13]。由于CZA在临床上使用时间并不久,关于CZA耐药PA感染的替代疗法的临床研究很少。
随着MDR/XDR-PA分离株的增多,多黏菌素(colistin,COL)在某些情况下仍然是治疗多重耐药革兰阴性菌(Gram-negative bacterial,GNB)感染的最后一道防线[14]。自1959年以来,COL已被批准用于治疗各种类型的感染,包括感染性腹泻和尿路感染。目前,它仍被临床用于治疗由顽固性GNB引起的感染。COL在体内外对重症宿主中产碳青霉烯酶的XDR微生物均有效[15],它通过破坏细菌的外膜和内膜导致细胞死亡[16],且对易感菌株具有快速的浓度依赖性杀菌作用[17]。
在本研究中,用时间杀菌曲线实验研究不同浓度的COL对携带不同碳青霉烯耐药基因的CZA耐药PA分离株的体外杀菌活性。COL是一种杀菌剂,具有肾毒性和神经毒性,时间杀菌实验提供了有关COL杀菌效果的信息,有助于调整重症患者的治疗剂量,为铜绿假单胞菌感染的临床治疗提供科学依据。
1 材料
1.1 菌株
所有菌株均收集自浙江省一家三甲医院,保存于-80 ℃冰箱中。铜绿假单胞菌ATCC27853作为质控菌株,购买于美国 Microbiologics公司。
1.2 试剂及培养基
用于药敏实验的抗菌药物包括亚胺培南(imipenem,IPM)、美罗培南(meropenem,MEM)、头孢他啶(ceftazidime,CAZ)、头孢吡肟(cefepime,FEP)、阿米卡星(amikacin,AK)、环丙沙星(ciprofloxacin,CIP)、CZA和COL,均购自美国MedChem Express公司;CAMHB培养基干粉、MHA培养基干粉购自美国赛默飞世尔科技公司;Mueller-Hinton(MH)琼脂平板购自温州康泰生物科技有限公司;聚合酶链式反应(polymerase chain reaction, PCR)相关试剂购自北京擎科生物科技公司;凝胶染色试剂(GelRed)购自南京诺维赞公司;药敏纸片:colistin (0.016~256 mg/L),购自意大利利飞驰公司(LOT:012320020);碳青霉烯酶检测试剂盒:NG-Test CARBA 5购自上海复星诊断科技有限公司(LOT:W22010111);碳青霉烯酶五型卡购自北京金山川科技发展有限公司(LOT:230429)。
1.3 仪器
通过VITEK MS质谱仪(生物梅里埃公司Marcy l'Etoile,法国)对实验菌株进行分析和鉴定;恒温摇床为美国精骐公司大容量SYC-2105型水平摇床;WGZ-XT型细菌浊度仪购自杭州齐威公司;96孔微量稀释板购自美国康宁公司;电泳仪为美国BIO RAD公司PowerPac型电泳仪。
2 方法
2.1 碳青霉烯类耐药基因检测
采用PCR法用特定引物检测实验菌株的碳青霉烯类耐药基因型[18](表1),同时采用胶体金免疫层析法检测实验菌株的碳青霉烯酶。PCR扩增参数如下:初始变性95 ℃ 10 min,36个循环,每个循环包括95 ℃ 30 s、52 ℃ 30 s、72 ℃ 50 s,最后72 ℃延伸6 min。扩增产物用1.0%琼脂糖凝胶电泳进行分析。PCR阳性产物测序委托杭州有康生物科技有限公司进行,二代测序委托杭州天科高新技术发展有限公司完成,利用基因组流行病学中心的ResFinder 4.1查找抗生素耐药基因(http://www.genomicepidemiology.org/)。
2.2 抗菌药物敏感性试验
采用微量肉汤稀释法测试抗菌药物敏感性。用无菌生理盐水将过夜培养的菌株调整至1.5×108 CFU/mL,并稀释20倍获得最终接种菌液。取最终接种菌液10 μL接种到含抗生素(0.125、0.25、0.5、1、2、4、8、16、32、64和128 mg/L)100 μL的96孔微量肉汤稀释板,于37 ℃孵育16~18 h后进行读数,未出现细菌生长的最低浓度即为最低抑菌浓度(minimum inhibitory concentration, MIC)。本研究的实验结果根据临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)2022版进行解释[19]。
2.3 时间杀菌曲线实验
对所选菌株进行重复的COL时间杀菌曲线实验[20]。根据菌株的MIC,将COL的浓度设定为1/4×MIC、1/2×MIC和1×MIC。将过夜培养的菌液1: 100稀释到4 mL CAMHB肉汤中,并在37 ℃下进一步培养1 h以达到早期对数生长期(A600=0.2~0.4)。使用含4 mL CAMHB的10 mL无菌离心管,加入相应的抗生素。培养物在3000 r/min下离心5 min并用生理盐水稀释,最终的细菌接种浓度约为1.5×108 CFU/mL。
取40 μL悬菌液接种至4 mL的含药肉汤中,作为实验组;取一管无菌CAMHB肉汤4 mL加入40 μL
1.5×108 CFU/mL的悬菌液,作为生长组(不含药);取一管无菌CAMHB肉汤4 mL作为空白对照。培养物在37 ℃恒温摇床中培养24 h(200 r/min)。随后,分别在0、2、4、8和24 h取出培养物样品,从每个管中取50 μL培养物,与450 μL生理盐水混合进行连续十进制稀释,以减少药物残留,取100 μL接种在MH琼脂平板上,并在37 ℃下培养16~18 h。过夜培养后进行菌落计数,计数时应选取菌落数在30~300之间的平板,结果取3次实验数据的平均值,选取一个最佳的稀释梯度,使用稀释系数计算原始样品中的细菌密度,原始菌液浓度=平均菌落个数×稀释倍数×体积(CFU/mL)。使用Graphpad Prism 8.0.1绘制时间杀菌曲线。当细菌负荷降低到至少3log10 CFU/mL时,表示COL在该浓度下对测试细菌具有杀菌作用。
2.4 纸片扩散法
采用纸片扩散法对实验菌株进行COL异质性耐药初筛,用无菌生理盐水将培养过夜的菌株调整至0.5×
108 CFU/mL,此时菌悬液的浓度约为1.5×108 CFU/mL,采用KB法用无菌棉签将菌悬液接种至MH琼脂平板,贴上COL药敏纸片,37 ℃孵育16~18 h,观察抑菌圈内有无菌落生长,抑菌圈内有菌落生长则认为该菌株存在COL异质性耐药。
3 结果
3.1 碳青霉烯类抗生素耐药基因
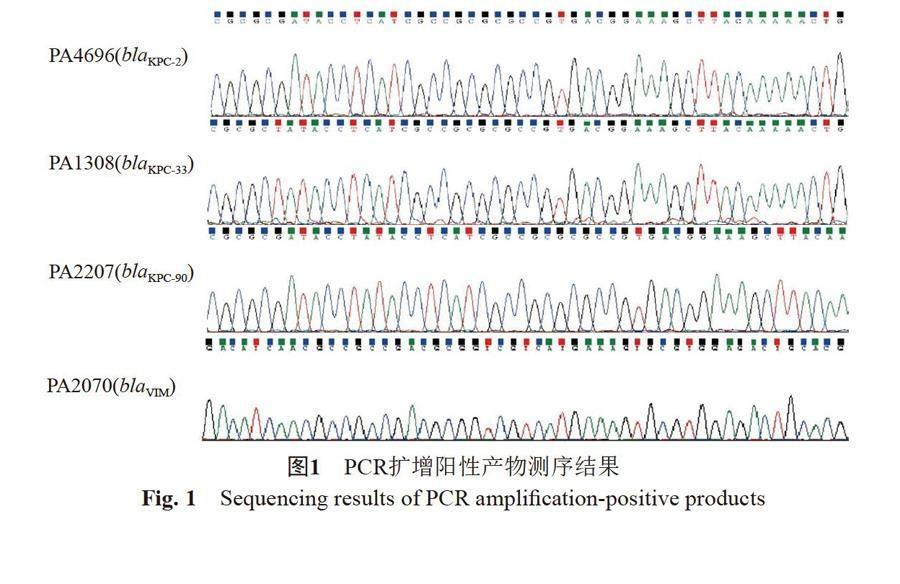
筛选出5株携带不同碳青霉烯耐药基因的铜绿假单胞菌(表2),其中PA2070来源未知,其他4株均来源于不同患者。菌株PA2207携带blaKPC-90,不表达碳青霉烯酶,KPC-90会赋予菌株CZA抗性,但不表达碳青霉烯酶,可能是由于oprD基因的表达而产生碳青霉烯耐药性[12]。菌株PA6227碳青霉酶检测为IMP阳性,但PCR检测为阴性,二代测序发现该菌株携blaIMP-45。菌株PA4696(blaKPC-2)、菌株PA1308(blaKPC-33)、菌株PA2070(blaVIM)、菌株PA2207(blaKPC-90)PCR扩增阳性产物测序片段见图1。
3.2 抗菌药敏感性
5株PA均为多重耐药菌株,均对CZA耐药,对COL(MIC≤2 mg/L)敏感(表3)。其中菌株PA6227对IPM的MIC为2 mg/L,对MEM的MIC为128 mg/L,表现出特殊的药敏表型(ISMR),即对IPM敏感而对MEM等其他碳青霉烯类药物耐药。
3.3 时间杀菌曲线实验
时间杀菌曲线显示了不同浓度COL对菌株的作用趋势,对5株CZA耐药的PA分离株均进行了重复3次的时间杀菌曲线测定(图2)。1×MIC、1/2×MIC下COL在前2~8 h内对所有菌株都显示出明显的杀菌作用,但随后都出现了再生长现象,除菌株PA1308在1×MIC浓度下24 h内未出现再生长,其他菌株在1×MIC浓度COL下的生长速率均比生长对照组略低。1/4×MIC浓度的COL对于菌株PA4696、PA2207在前2 h内仅显示出抑菌作用,而在前4~8 h内将菌株PA1308、PA6227和PA2070完全抑制后以更快的速度出现再生长。COL对于CZA耐药PA分离株的杀伤作用具有浓度依赖性,1×MIC浓度下作用效果最好但大部分菌株仍会出现再生长现象,碳青霉烯耐药基因的存在并未影响其作用效果。
3.4 异质性耐药
KB法观察5株实验菌株的抑菌圈大小,圈内均无散在菌落生长(图3),表明5株实验菌株均不存在异质性耐药情况,均为COL敏感表型。
4 讨论
PA对碳青霉烯类抗生素的耐药性通常与其他抗菌药物类别相关,本研究中的PA分离株均产β-内酰胺酶,包括3种A类β-内酰胺酶(KPC-2、KPC-33、KPC-90)和两种B类β-内酰胺酶(VIM和IMP-45),药敏结果显示这些菌株均为多重耐药,对头孢菌素类(FEP、CAZ)、碳青霉烯类(IPM、MEM)等均耐药。其中菌株PA6227表现出特殊的药敏表型,对IPM敏感而对MEM等其他碳青霉烯类药物耐药(ISMR),通过二代测序发现菌株PA6227携带blaIMP-45。IMP-45是IMP-9的氨基酸突变体(G214S),于2014年在北京的犬源性PA中首次报道,研究发现产IMP-45的PA对MEM的耐药性高于对IPM的耐药性[21]。此外,另一项研究收集了17株携带blaIMP-45的MDR-PA,其中菌株GZ18-2a对IPM敏感(MIC=2 mg/L),对MEM耐药(MIC=8 mg/L)[22],与本研究结果相似。IPM作为碳青霉烯类的代表性药物,ISMR导致IMP赋予菌株的碳青霉烯耐药性检测不到,因此具有这种特殊药敏表型的菌株在临床上容易被忽视。
本研究中携带blaKPC-33、blaKPC-90、blaVIM和blaIMP-45的分离株均表现出对CZA的高度抗性,不同类型的碳青霉烯耐药基因会影响CZA的疗效。据报道,KPC编码基因突变等不同耐药机制的发展都会威胁到CZA的疗效[23-24],如由野生型KPC-2点突变衍生的KPC-90和KPC-33,均使菌株对CZA产生抗性[12,25]。在CZA治疗下,越来越多的KPC突变体出现。此外,CZA对产MBLs的分离株并不活跃,携带MBLs可能导致菌株对CZA产生高水平抗性[9,26],这进一步限制了CRPA感染的治疗选择。在临床治疗MDR-PA感染时,应注意分离株携带的碳青霉烯耐药基因。
在时间杀菌曲线中,发现这些分离株在不同浓度的COL下2、4和8 h后恢复生长,这与之前的研究结果一致[27]。这可能是由于COL功能丧失或出现异质性耐药分离株造成的,目前关于PA对COL异质性耐药的报道较少,也有研究表明COL对异质性耐药PA的杀菌作用会减弱[28],而在本研究中不存在PA对COL异质性耐药的情况。细菌再生可能表明抗生素治疗的临床失败,所以单一使用COL处理存在局限性。已有研究证明,CZA、AK、氨曲南和COL的组合对MDR-PA分离株有效,包括对CZA耐药分离株和流行的高危克隆株[27,29-30],需要进一步的研究来评估这些可能性。此外,根据COL的药动学和药效学研究,COL的给药方案应适应患者的肾功能,在临床实践中通常每8 h或每24 h给药1次[31-33]。然而本研究在探究体外COL对携带blaKPC-2、blaKPC-90、blaKPC-33和 blaVIM的CZA耐药PA分离株的杀菌作用时,提示应适当缩短给药间隔至每2或4 h一次,以避免细菌恢复生长。携带不同碳青霉烯耐药基因的分离株均在不同时间恢复生长,不同类型碳青霉烯耐药基因会影响CZA的作用效果,但与COL的杀菌活性无关。
通过比较不同浓度COL的时间杀菌曲线,我们还发现1×MIC的COL对PA4696、PA2207、PA1308、PA2070具有最佳杀菌活性,1/2×MIC的对PA6227具有杀菌活性。先前的研究表明,低剂量不足以治疗MDR/XDR-PA感染,较高剂量会导致肾毒性[34]。时间杀菌曲线提供了COL杀菌作用的信息,由于COL具有高度肾毒性,这可能有助于调整重症患者的治疗剂量。本研究选取的实验菌株数量较少,且缺乏体内实验证据,这些模型的结果只能为临床药物使用提供参考,后续需要进一步的实验来证实COL对携带不同碳青霉烯耐药基因的CZA耐药CRPA菌株的杀菌作用。
5 结论
本研究证明COL在体外对CZA耐药CRPA分离株具有杀菌活性,但不能单独使用。不同类型的碳青霉烯耐药基因会影响CZA的作用效果,但与COL的杀菌活性无关,携带不同碳青霉烯耐药基因的分离株均在不同时间恢复生长。在COL治疗CZA耐药CRPA感染的临床应用中,可以调整给药间隔或药物浓度,以维持COL的血液浓度,从而使用更少的抗生素达到更好的治疗效果。同时应注意具有ISMR这一特殊药敏表型的CRPA在临床上的出现。
参 考 文 献
Pang Z, Raudonis R, Glick B R, et al. Antibiotic resistance in Pseudomonas aeruginosa: Mechanisms and alternative therapeutic strategies[J]. Biotechnol Adv, 2019, 37(1): 177-192.
ECDC. Antimicrobial resistance surveillance in Europe 2022. An-nual report of the European Antimicrobial Resistance Surveillance Network (EARS-Net)[R]. European Centre for Disease Prevention and Control, 2022: 34.
Noval M, Banoub M, Claeys K C, et al. The battle is on: New β-lactams for the treatment of multidrug-resistant Gram-negative organisms[J]. Curr Infect Dis Rep, 2020. doi: 10.1007/s11908-020-0710-9.
Riquelme S A, Liimatta K, Wong Fok Lung T, et al. Pseudomonas aeruginosa utilizes host-derived itaconate to redirect its metabolism to promote biofilm formation[J]. Cell Metab, 2020, 31(6): 1091-1106.e6.
Maurice N M, Bedi B, Sadikot R T. Pseudomonas aeruginosa biofilms: Host response and clinical implications in lung infections[J]. Am J Respir Cell Mol Biol, 2018, 58(4): 428-439.
Kunz Coyne A J, El Ghali A, Holger D, et al. Therapeutic strategies for emerging multidrug-resistant Pseudomonas aeruginosa[J]. Infect Dis Ther, 2022, 11(2): 661-682.
Yahav D, Giske C G, Gramatniece A, et al. New β-lactam-β-lactamase inhibitor combinations[J]. Clin Microbiol Rev, 2020, 34(1): e00115-20.
Sharma R, Park T E, Moy S. Ceftazidime-avibactam: A novel cephalosporin/β-lactamase inhibitor combination for the treatment of resistant Gram-negative organisms[J]. Clin Ther, 2016, 38(3): 431-444.
Poirel L, de la Rosa J M O, Kieffer N, et al. Acquisition of extended-spectrum β-lactamase GES-6 leading to resistance to ceftolozane-tazobactam combination in Pseudomonas aeruginosa[J]. Antimicrob Agents Chemother, 2018, 63(1): e01809-18.
Gill C M, Aktathorn E, Alfouzan W, et al. The ERACE-PA global surveillance program: Ceftolozane/tazobactam and ceftazidime/avibactam in vitro activity against a global collection of carbapenem-resistant Pseudomonas aeruginosa[J]. Eur J Clin Microbiol Infect Dis, 2021, 40(12): 2533-2541.
Zhu Y, Chen J, Shen H, et al. Emergence of ceftazidime- and avibactam-resistant Klebsiella pneumoniae carbapenemase-producing Pseudomonas aeruginosa in China[J]. mSystems, 2021, 6(6): e00787-21.
Tu Y, Wang D, Zhu Y, et al. Emergence of a KPC-90 Variant that confers resistance to ceftazidime-avibactam in an ST463 carbapenem-resistant Pseudomonas aeruginosa strain[J]. Microbiol Spectr, 2022, 10(1): e01869-21.
Kiratisin P, Kazmierczak K, Stone G G. In vitro activity of ceftazidime/avibactam and comparators against carbapenemase-producing enterobacterales and Pseudomonas aeruginosa isolates collected globally between 2016 and 2018[J]. J Glob Antimicrob Resist, 2021. doi: 10.1016/j.jgar.2021.08.010.
Zabidi M S, Abu Bakar R, Musa N, et al. Population pharmacokinetics of colistin methanesulfonate sodium and colistin in critically III patients: A systematic review[J]. Pharmaceuticals (Basel), 2021, 14(9): 903.
Karaiskos I, Giamarellou H. Multidrug-resistant and extensively drug-resistant Gram-negative pathogens: Current and emerging therapeutic approaches[J]. Expert Opin Pharmacother, 2014, 15(10): 1351-1370.
Falagas M E, Kasiakou S K. Colistin: The revival of polymyxins for the management of multidrug-resistant Gram-negative bacterial infections[J]. Clin Infect Dis, 2005, 40(9): 1333-1341.
Bergen P J, Landersdorfer C B, Zhang J, et al. Pharmacokinetics and pharmacodynamics of 'old' polymyxins: What is new?[J]. Diagn Microbiol Infect Dis, 2012, 74(3): 213-223.
Poirel L, Walsh T R, Cuvillier V, et al. Multiplex PCR for detection of acquired carbapenemase genes[J]. Diagn Microbiol Infect Dis, 2011, 70(1): 119-123.
Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. M100-S30[S]. Clinical and Laboratory Standards Institute, Pittsburgh, PA, 2022.
Drusano G L. Pre-clinical in vitro infection models[J]. Curr Opin Pharmacol, 2017, 36: 100-106.
Wang Y, Wang X, Schwarz S, et al. IMP-45-producing multidrug-resistant Pseudomonas aeruginosa of canine origin[J]. J Antimicrob Chemother, 2014, 69(9): 2579-2581.
Zhang X, Wang L, Li D, et al. An IncP-2 plasmid sublineage associated with dissemination of blaIMP-45 among carbapenem-resistant Pseudomonas aeruginosa[J]. Emerg Microbes Infect, 2021, 10(1): 442-449.
Findlay J, Poirel L, Juhas M, et al. KPC-mediated resistance to ceftazidime-avibactam and collateral effects in Klebsiella pneumoniae[J]. Antimicrob Agents Chemother, 2021, 65(9): e00890-21.
Alsenani T A, Viviani S L, Kumar V, et al. Structural characterization of the D179N and D179Y variants of KPC-2 β-lactamase: ω-loop destabilization as a mechanism of resistance to ceftazidime-avibactam[J]. Antimicrob Agents Chemother, 2022, 66(4): e0241421.
Shi Q, Yin D, Han R, et al. Emergence and recovery of ceftazidime-avibactam resistance in blaKPC-33-harboring Klebsiella pneumoniae sequence type 11 isolates in China[J]. Clin Infect Dis, 2020, 71(Suppl 4): S436-S39.
Marshall S, Hujer A M, Rojas L J, et al. Can ceftazidimeavibactam and aztreonam overcome β-lactam resistance conferred by metallo-β-lactamases in Enterobacteriaceae?[J]. Antimicrob Agents Chemother, 2017, 61(4): e02243-16.
Montero M M, Domene Ochoa S, Lopez-Causape C, et al. Time-kill evaluation of antibiotic combinations containing ceftazidime-avibactam against extensively drug-resistant Pseudomonas aeruginosa and their potential role against ceftazidime-avibactam-resistant isolates[J]. Microbiol Spectr, 2021, 9(1): e0058521.
许磊. 铜绿假单胞菌多黏菌素异质性耐药及联合药敏研究[D]. 杭州: 浙江大学, 2017.
Wang Y, Li C, Wang J, et al. The efficacy of colistin combined with amikacin or levofloxacin against Pseudomonas aeruginosa biofilm infection[J]. Microbiol Spectr, 2022, 10(5): e0146822.
Satlin M J, Lewis J S, Weinstein M P, et al. Clinical and laboratory standards institute and european committee on antimicrobial susceptibility testing position statements on polymyxin B and colistin clinical breakpoints[J]. Clin Infect Dis, 2020, 71(9): e523-e29.
Ram K, Sheikh S, Bhati R K, et al. Steady-state pharmacokinetic and pharmacodynamic profiling of colistin in critically ill patients with multi-drug-resistant gram-negative bacterial infections, along with differences in clinical, microbiological and safety outcome[J]. Basic Clin Pharmacol Toxicol, 2021, 128(1): 128-140.
Grégoire N, Aranzana-Climent V, Magréault S, et al. Clinical pharmacokinetics and pharmacodynamics of colistin[J]. Clin Pharmacokinet, 2017, 56(12): 1441-1460.
Wacharachaisurapol N, Sukkummee W, Anunsittichai O, et al. Dose recommendations for intravenous colistin in pediatric patients from a prospective, multicenter, population pharmacokinetic study[J]. Int J Infect Dis, 2021, 109: 230-237.
Benattar Y D, Omar M, Zusman O, et al. The effectiveness and safety of high-dose colistin: Prospective cohort study[J]. Clin Infect Dis, 2016, 63(12): 1605-1612.
