巴西苏木素通过抑制SarA以PIA依赖性方式减少MRSA生物膜形成的研究
2024-06-28李明哲杨智芳周小仙刘和兰黎瑞周永雯陈泽慧
李明哲 杨智芳 周小仙 刘和兰 黎瑞 周永雯 陈泽慧

摘要:目的 探究巴西苏木素(brazilin,BN)抑制耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)生物膜形成的机制,为开展中医药防治MRSA感染提供新思路。方法 建立MRSA ATCC43300菌株生物膜模型,试验分为BN 8、16和32 μg/mL组及对照组;通过结晶紫法测定BN对MRSA生物膜的抑制作用;刚果红平板法、硫酸-苯酚法检测BN对细胞间多糖黏附素(polysaccharide intercellular adhesion,PIA)合成的影响;使用real-time PCR(qRT-PCR)方法验证胞间黏附素操纵子icaA和icaD转录水平;分析高通量转录组测序可能存在的生物膜抑制基因;通过qRT-PCR、Western blot方法对相关基因及蛋白加以验证;通过皮下埋植静脉导管建立MRSA生物膜感染小鼠模型进一步验证BN疗效。结果 与对照组相比,不同浓度的BN组均能显著减少MRSA生物膜及PIA生成,其中在最低剂量8 μg/mL BN作用下,MRSA生物膜形成量下降40.17% (P<0.01)、PIA减少55.56% (P<0.01);通过qRT-PCR验证不同浓度的BN组均能显著抑制icaA和icaD基因的表达,其中在8 μg/mL浓度下,icaA和icaD基因的表达量分别比对照组降低了59.03%(P<0.01)、48.33%(P<0.05);高通量测序显示sarA下调-1.458 log2;qRT-PCR、Western blot结果显示,BN能显著抑制sarA转录及其蛋白表达;通过体内实验显示,BN能有效抑制小鼠体内MRSA生物膜的形成。结论 BN通过抑制SarA的表达,减少PIA的合成,进而干预生物膜的形成。
关键词:巴西苏木素;耐甲氧西林金黄色葡萄球菌;生物膜;PIA;sarA
中图分类号:R978文献标志码:A
Study on the reduction of MRSA biofilm formation by Brazilin through the inhibition of SarA in a PIA-dependent manner
Li Mingzhe1,2, Yang Zhifang3, Zhou Xiaoxian1, Liu Helan2, Li Rui2, Zhou Yongwen2 and Chen Zehui1,2
(1 Department of Laboratory Medicine, Affiliated Hospital of Zunyi Medical University, Zunyi 563003; 2 School of Laboratory Medicine, Zunyi Medical University, Zunyi 563006; 3 The Second Affiliated Hospital of Zunyi Medical University, Zunyi 563000)
Abstract Objective The goal was to find out how Brazilin (BN) inhibited methicillin-resistant Staphylococcus aureus (MRSA) from making biofilms and to give new ideas for using traditional Chinese medicine to prevent and treat MRSA infections. Methods A biofilm model of the MRSA ATCC43300 strain was established. The experiment was divided into BN 8, 16 and 32 μg/mL groups as well as a control group. The inhibitory effect of BN on MRSA biofilm was determined through the crystal violet method. The Congo red agar plate method and the sulfuric acid-phenol method were employed to detect the effect of BN on the synthesis of polysaccharide intercellular adhesion (PIA). Quantitative real-time PCR (qRT-PCR) was used to verify the transcription levels of the icaA and icaD gene clusters involved in intercellular adhesion. High-throughput transcriptomic sequencing was performed to identify potential biofilm-inhibitory genes. qRT-PCR and Western blot validated the relevant genes and proteins. The mouse model of MRSA biofilm infection through subcutaneous placement of an intrvenous catheter was established to further validate the efficacy of BN. Results Compared to the control group, BN at different concentrations significantly reduced MRSA biofilm and PIA formation. Specifically, at the lowest dose of 8 μg/mL BN, MRSA biofilm formation was decreased by 40.17% (P<0.01) and PIA by 55.56% (P<0.01). qRT-PCR verification indicated that BN at different concentrations significantly inhibited the expression of the icaA and icaD genes. Compared to the control group, the expression levels of icaA and icaD genes were reduced by 59.03% (P<0.01) and 48.33% at an 8 μg/mL concentration (P<0.05), respectively. High-throughput sequencing revealed a sarA downregulation of -1.458 log2. qRT-PCR and Western blot results showed that BN significantly inhibited the transcription and protein expression of sarA. In vivo experiments indicated that BN effectively inhibited MRSA biofilm formation in mice. Conclusion BN reduces the synthesis of PIA by inhibiting the expression of SarA and thereby intervening in biofilm formation.
Key words Brazilian; Methicillin-resistant Staphylococcus aureus; Biofilm; PIA; sarA
耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)在金黄色葡萄球菌分离株中的比例高达5%~82%,其导致的菌血症、心内膜炎在内的临床综合征死亡率高达15%~60%[1]。MRSA对现有的β-内酰胺类抗生素普遍耐药,耐万古霉素金黄色葡萄球菌的出现,使金黄色葡萄球菌有可能突破抗生素防御的最后一道防线[2]。因此,深入探究MRSA的耐药机制及寻找新的抗菌药物对于金黄色葡萄球菌的治疗和预防具有重大临床意义。生物膜是导致机体80%的慢性和复发性细菌感染的主要原因[3],多糖胞间黏附素(polysaccharide intercellular adhesion,PIA)是生物膜相关性多糖,在细菌生物膜的形成中发挥重要作用,主要由胞间黏附素操纵子icaABCD表达产物共同催化合成[4-5]。SarA是MRSA主要毒力因子表达调控系统之一,能促进或抑制金黄色葡萄球菌许多毒力基因的表达[6]。有研究发现,金黄色葡萄球菌sarA突变株ica表达量减少,抑制了PIA合成,从而导致生物被膜表型缺失[7]。本课题组前期研究发现,巴西苏木素(brazilin,BN)在体外可抑制金黄色葡萄球菌生物膜的形成[8]。因此,本研究拟探索BN是否能够通过抑制SarA减少由ica介导合成的PIA,进而干预生物膜的形成,为新型生物膜抑制剂研发提供思路。
1 材料与仪器
1.1 材料和试剂
BN(成都普思生物科技有限公司,纯度≥98%);细菌组DNA提取试剂盒(北京天根生化有限公司);溶葡萄球菌酶(南京都莱生物技术有限公司);结晶紫(BeckMan);无水乙醇(成都金山化工公司);PrimeScript RT reagent kit、SYBR、Green Realtime PCR Master Mix(Takara);刚果红(北京索莱宝生物有限公司);MRSA ATCC43300、E.coli DH5α、原核表达载体pET28a均为本实验室保存。
1.2 试验仪器
3111型二氧化碳培养箱;722型分光光度计;T100型PCR仪;FUSIONFX凝胶成像分析仪;CFX-96 Real-time PCR系统;TS-211B型恒温摇床;MICRO21R高速低温微量离心机等。
2 方法
2.1 BN对MRSA生物膜形成的影响
2.1.1 结晶紫染色法测定生物膜
从-80 ℃取出保存菌种,接种至血平板上过夜培养。挑取单菌落,用TSB培养基将菌液稀释至1×106 CFU/mL,向96微孔板中加入菌液200 μL,加入不同浓度的BN,使其终浓度为8、16和32 μg/mL以及对照组(未加BN)。于37 ℃培养24 h。对菌株进行生物膜染色,测定590 nm波长下的吸光度。
2.1.2 刚果红法测定PIA
从血平板上挑取单菌落,用TSB培养基将菌液稀释至1×106 CFU/mL,吸取5 μL菌液滴至含不同药物浓度(8、16、32 μg/mL)以及对照组的刚果红平板中心,37 ℃静置培养24 h。其中菌落颜色呈黑色的为PIA阳性菌株,根据中心黑色变化观察BN对PIA合成的影响。
2.1.3 硫酸-苯酚法测定PIA
生物膜的培养参照“2.1.1”的方法培养24 h后,弃去TSB,用PBS重悬,超声20 min后,4000 r/min离心30 min,4 ℃保存备用。先将标准葡萄糖溶液经硫酸-苯酚法测定制作标准曲线,再将多糖沉淀按同样的方法进行显色,酶标仪测定A490值,根据标准曲线并结合回归方程由测得的A值计算出相应的PIA含量。
2.2 Real-time PCR
参考文献方法对生物被膜态细菌进行总RNA提取[9],反转录得到cDNA后进行qRT-PCR,以检测生物膜相关调控基因的转录水平,引物序列见表1。
2.3 高通量转录组测序
分别将不加BN的对照组以及抑制生物膜最佳药物浓度组所提取的细菌总RNA,送至上海生物工程股份有限公司,使用Illumina Hiseq软件进行测序,由公司提供具体数据。
2.4 SarA抗体的制备
2.4.1 重组表达质粒pET28a-sarA的构建和鉴定
以ATCC43300的基因组为模板,扩增sarA基因全长片段,引物序列见表1,经快速限制性内切酶Nde Ⅰ和Xho I双酶切后克隆至pET28a质粒,转入大肠埃希菌(E.coli DH5α),抽提质粒,经酶切、PCR及DNA测序后获得重组表达质粒pET28a-sarA,随后转入表达菌株E.coli BL21(DE3),获得重组表达菌株BL21- pET28a-sarA;
2.4.2 重组蛋白SarA的诱导表达和纯化
参考文献[10]对蛋白进行大量诱导,并利用镍柱亲和层析法获得高纯度蛋白。
2.4.3 血清效价鉴定
将免疫原SarA重组蛋白与弗氏佐剂1:1混合,选择小鼠皮下注射,共3次,每次间隔14 d,收集血清,用ELISA法检测其效价。
2.5 Western blot
从血平板上挑取单菌落,37 ℃摇至A600=0.3,加入BN,使其终浓度为8、16、32 μg/mL以及对照组,继续以200 r/min,37 ℃摇至A600=1.6后离心,取上清液,加入三氯乙酸4 ℃过夜沉淀蛋白。加入上样缓冲液混匀,煮沸后在12.5%的SDS-PAGE上进行电泳,结束后转至聚偏二氟乙烯(PVDF)膜上转膜,5%脱脂牛奶室温下封闭2 h后加入制备的SarA抗体(1:2000),4 ℃下孵育过夜,TBST洗涤3次后加入稀释的二抗(1:10000),室温孵育2 h,TBST洗涤3次用ECL检测系统进行显影并观察蛋白条带。
2.6 BN对MRSA生物膜感染小鼠模型的治疗效果
2.6.1 构建小鼠生物膜感染模型
参考文献[11]采用皮下埋植法进行MRSA生物膜感染小鼠模型建立,采取静脉导管作为MRSA生物膜生长载体,将载体浸泡MRSA菌液后于脊柱中段埋入皮下,将小鼠分为空白组、对照组以及实验组,对照组不给药,实验组于造模24 h后皮下注射
32 μg/mL BN治疗,一周后观察创面感染情况。
2.6.2 HE染色
取皮肤感染病理组织,放入组织盒,浸泡在配制10%的多聚甲醛溶液中,石蜡包埋后切片,经脱蜡、苏木素染色、分化、返蓝、伊红染色和脱水封片后倒置显微镜拍照并进行病理分析。
3 结果
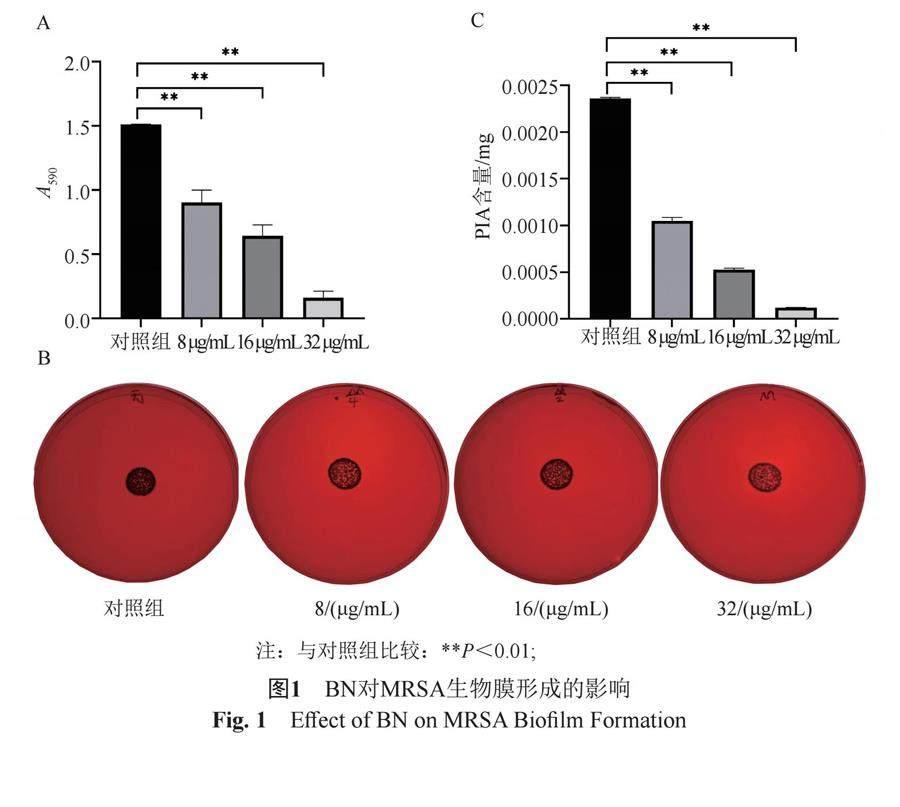
3.1 BN对MRSA生物膜形成的影响
采用结晶紫染色法测定不同浓度的BN对MRSA生物膜形成的影响,与对照组相比,BN 8、16和
32 μg/mL均能显著抑制MRSA生物膜形成,并呈现剂量依赖性,各组生物膜形成量分别下降了40.17%、57.32%和89.43%(P<0.01),见图1A。采用刚果红平板观察BN对MRSA生物膜中PIA合成的影响,与对照组相比,8、16和32 μg/mL BN组菌落中心黑色明显变浅,见图1B。采用硫酸-苯酚法对PIA含量进行定量检测,葡萄糖标准曲线得到线性方程为:Y=94.29X+0.1006(R2=0.9989),根据方程计算PIA含量,在8、16和32 μg/mL BN的作用下,MRSA PIA
形成量分别下降了55.56%、77.64%和94.89% (P<0.01),呈明显的剂量依赖性,见图1C。
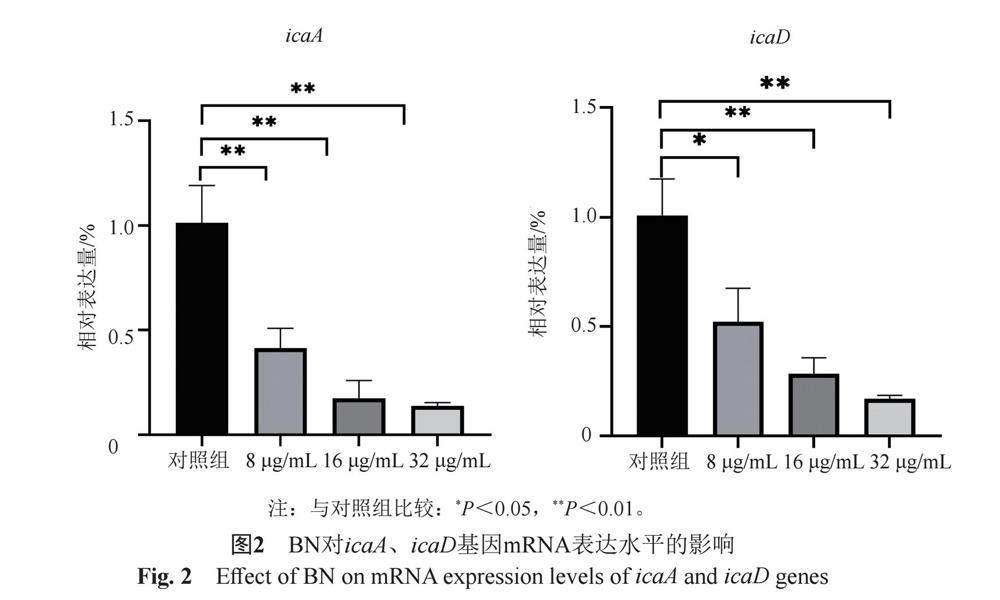
3.2 BN对MRSA icaA和icaD基因表达的影响
采用qRT-PCR技术检测BN对MRSA icaA和icaD基因表达的影响,与对照组相比8、16和32 μg/mL BN组以上基因相对表达量均呈现下降趋势,且呈现剂量依赖性。icaA表达量分别下降了59.03%、82.63%和86.35% (P<0.01),icaD表达量分别下降了48.33%、71.73%、83.17% (P<0.05),见图2。
3.3 高通量转录组测序结果
通过不加药组与32 μg/mL BN处理后的测序对比结果发现,大量差异基因富集在生物致病相关功能通路上GO:0009405,其中与金黄色葡萄球菌生物膜密切相关的毒力调控因子sarA(SAOUHSC_00620),下调-1.458 log2,见表2;sarA基因共作网络图并结合相关文献,发现sarA参与胞间黏附素操纵子icaABCD的调控,见图3。
3.4 BN对MRSA sarA基因表达的影响
通过qRT-PCR技术验证BN对MRSA sarA基因表达的影响,与对照组相比,8、16和32 μg/mLBN均能减少sarA基因相对表达量,呈现剂量依赖性,sarA表达量分别下降了59.03%、76.63%和83.13% (P<0.01),见图4。
3.5 制备SarA抗体
将构建的重组质粒双酶切后经1%琼脂糖凝胶电泳分析,结果显示重组质粒pET28a-sarA可以被酶切为pET28a质粒和sarA基因片段两部分,菌液PCR、基因测序鉴定结果显示重组质粒pET28a-sarA构建成功,见图5A;并经诱导成功表达出SarA(13.7 kDa)蛋白,200和300 mmol咪唑洗脱出高纯度蛋白,将洗脱的蛋白样品使用10 kDa超滤浓缩管浓缩,用于多克隆抗体制备,见图5B。
3.6 BN对MRSA SarA蛋白表达的影响
通过ELISA法测定小鼠血清抗体效价达到1:128000后进行Western blot检测SarA蛋白的表达量,在8~32 μg/mL浓度范围内,随着BN浓度增加,SarA蛋白表达量逐渐减少,见图6。
3.7 BN在小鼠体内抑制MRSA生物膜的形成
静脉穿刺管植入72 h后,模型组创口部位形成红肿凸起,BN处理一周后,红肿消失,创面减小趋于愈合。HE病理染色结果显示,阴性对照组皮肤组织显示表皮层、真皮层和皮下附属器轮廓清晰,结构完整,模型组皮下组织出现退化中性粒细胞组成的脓肿病变,同时表皮层、真皮层损害严重。BN处理组与对照组相比,中性粒细胞浸润减少,表皮层和真皮层损伤明显减轻,见图7。
4 讨论
金黄色葡萄球菌是常见的食源性致病菌,在自然环境中广泛存在,其生物膜的形成是造成金黄色葡萄球菌耐药和持续性感染的主要原因。因此,抑制金黄色葡萄球菌生物膜的形成是改善细菌耐药和抗菌药物开发的重要策略[12]。BN是中药苏木的主要活性成分,属于高异黄酮类化合物的衍生物,具有抗氧化、抗菌、抗老化、降血糖、抗痤疮、抗血小板浓缩及抗癌等多种生物学活性[13-14]。本课题组前期研究已证实BN能够抑制MRSA生物膜的形成,但其作用机制尚不清楚。因此,本课题拟深入研究其抑制生物膜形成的机制。首先采用了结晶紫法验证了BN对生物膜形成的抑制作用,结果显示在本实验条件下,8、16和32 μg/mL BN能够显著抑制MRSA生物膜的形成,不仅验证了前期研究结果,更为后续机制研究奠定可靠的实验基础。
金黄色葡萄球菌生物膜的形成分为4个阶段,分别为黏附、聚集、成熟和脱落,PIA是生物膜形成聚集阶段重要的物质基础,能够介导细菌间黏附促进生物膜的形成,并参与细菌感染宿主的过程[15]。因此,抑制PIA的生成是抑制细菌生物膜形成和感染宿主能力的关键。本研究采用了刚果红法和硫酸-苯酚法两种不同的方法对BN抑制MRSA生物膜形成的作用进行定性和定量分析。刚果红染色结果显示,与对照组相比,8、16和32 μg/mL BN组菌落中心黑色明显变浅,说明BN能够显著抑制PIA的生成。同时,硫酸-苯酚法定量分析结果显示,8、16和32 μg/mL BN能够剂量依赖性地降低PIA的合成量,进一步验证了BN抑制PIA合成的作用,说明BN抑制生物膜形成与抑制PIA合成有关。
细菌生物膜的形成不仅受外界因素的影响,同时也受自身基因的调控,有研究证实PIA生成与ica操纵子密切相关[16]。ica操纵子基因座由调节基因icaR和串联存在的icaABCD组成,共同调控PIA的合成,其中icaA基因是编码乙酰葡萄糖胺转移酶的基因[17],与icaD基因的共表达可提高乙酰葡糖胺转移酶活性,从而促进PIA合成,且有研究证实将icaA/icaD敲除后发现生物膜形成能力明显降低[18]。因此,本研究检测了BN对icaA和icaD基因的表达,结果显示,BN 8、16和32 μg/mL均能显著抑制icaA和icaD基因的表达。说明BN抑制PIA的生成可能与抑制其上游调控基因表达有关。
葡萄球菌附属蛋白调节系统中SarA是一种二聚体DNA结合蛋白[19],Tormo等[20]研究发现SarA与icaR-icaA启动子序列之间具有高亲和力并存在多个DNA结合位点,SarA易与这些DNA位点结合,促进ica操纵子的表达,从而调节纤连蛋白和结合蛋白的表达抑制细菌生物膜的形成,并且icaA不能在没有sarA的情况下表达[21]。SarA是抗生物膜制剂开发的重要靶点,目前已有针对SarA的生物膜抑制剂取得了良好效果[22]。基于BN对生物膜有良好的抑制作用,本研究进行了高通量转录组测序,结果发现与胞间多糖黏附素操纵子icaABCD密切相关的sarA基因显著下调。并采用了qRT-PCR进行验证,结果显示BN 8、16和32 μg/mL均能显著抑制sarA基因的表达,说明BN可能通过抑制sarA从而减少ica操纵子的表达,调控细菌生物膜的形成。有研究发现SarA蛋白的C端具有较好的柔性、亲水性(≥0.5)和表面可及性(≥1),抗原指数也较高,分布较均匀,易形成抗原表位,与抗体结合的可能性较大[23]。参考此方法,本研究成功构建重组表达质粒pET28a-sarA并诱导出SarA蛋白,通过免疫小鼠成功获得SarA抗体。将此抗体用于western blot观察BN对SarA的表达的影响,在8、16和32 μg/mL浓度范围内,BN均能显著抑制SarA的表达。以上结果说明BN可能通过抑制SarA从而减少ica操纵子的表达,减少细菌生物膜的形成。据文献报道[24],sarA启动子区域广泛,包括3个不同的启动子(P2、P3和P1),每个都携带主要的372 bp sarA开放阅读框,而其中P1启动子是最活跃的,被广泛用于在金黄色葡萄球菌中表达各种荧光报告基因,BN是否可能通过与sarA的P1启动子结合而抑制其转录,其具体机制还有待进一步研究。
为了进一步探讨BN对小鼠体内MRSA生物膜感染的治疗效果,进行了小鼠生物膜模型构建,目前已建立的生物膜感染动物模型有小鼠中心静脉导管插管模型、大鼠心静脉导管插管模型、兔皮下埋植支架模型、小鼠皮下埋植导管模型等[25],由于中心静脉导管是由MRSA感染引起败血症的重要来源[11]。因此,选取中心静脉导管对小鼠进行皮下埋植建模,在32 μg/mL BN浓度皮下注射一周后可以发现BN处理组对比模型组皮肤红肿明显减轻,且有效减少皮肤表皮层、真皮层损害。因此,进一步说明BN能在体内抑制MRSA生物膜的形成,为BN用于MRSA导致的创面感染奠定理论基础。
综上所述,BN抑制MRSA生物膜形成可能与抑制sarA调控的ica操纵子表达,从而减少PIA合成有关。更深的作用机制将通过敲除或过表达sarA基因进行验证。
参 考 文 献
Wang M, Fan Z, Han H. Autophagy in Staphylococcus aureus infection[J]. Front Cell Infect Microbiol, 2021, 11: 750222.
Sievert D M, Rudrik J T, Patel J B, et al. Vancomycin-resistant Staphylococcus aureus in the United States, 2002—2006[J]. Clin Infect Dis, 2008, 46(5): 668-674.
陈瑶, 刘张玲, 汤荣睿. 金黄色葡萄球菌生物膜预防和治疗的研究进展[J]. 中国抗生素杂志, 2021, 46(1): 20-26.
Hobley L, Harkins C, MacPhee C E, et al. Giving structure to the biofilm matrix: An overview of individual strategies and emerging common themes[J]. FEMS Microbiol Rev, 2015, 39(5): 649-669.
Gogoi-Tiwari J, Dorji D, Tiwari H K, et al. Phenotypic PIA-dependent biofilm production by clinical non-typeable Staphylococcus aureus is not associated with the intensity of inflammation in mammary gland: A pilot study using mouse mastitis model[J]. Animals (Basel), 2021, 11(11): 3047.
Nasser A, Dallal M, Jahanbakhshi S, et al. Staphylococcus aureus: Biofilm formation and strategies against it[J]. Curr Pharm Biotechnol, 2022, 23(5): 664-678.
Valle J, Toledo-Arana A, Berasain C, et al. SarA and not sigmaB is essential for biofilm development by Staphylococcus aureus[J]. Mol Microbiol, 2003, 48(4): 1075-1087.
Peng D, Chen A, Shi B, et al. Preliminary study on the effect of brazilin on biofilms of Staphylococcus aureus[J]. Exp Ther Med, 2018, 16(3): 2108-2118.
毛彦妮, 常佳伟, 李娜, 等. 金黄色葡萄球菌在生物被膜态与浮游态的转录组差异表达分析[J]. 畜牧兽医学报, 2022, 53(8): 2697-2707.
许园园, 丁宇, 刘云灵, 等. 金黄色葡萄球菌双组份调节系统SaeRS对重要毒力基因的分子调控机制[J]. 温州医科大学学报, 2015, 45(9): 625-630.
Mihu M R, Cabral V, Pattabhi R, et al. Sustained nitric oxide-releasing nanoparticles interfere with methicillin-resistant Staphylococcus aureus adhesion and biofilm formation in a rat central venous catheter model[J]. Antimicrob Agents Chemother, 2017, 61(1): e02020-02016.
元炼, 张姣, 刘兰妹, 等. 中药提取物对金黄色葡萄球菌生物膜作用的研究[J]. 天然产物研究与开发, 2022, 34(8): 1273-1280.
Pattananandecha T, Apichai S, Julsrigival J, et al. Antibacterial activity against foodborne pathogens and inhibitory effect on anti-inflammatory mediators production of brazilin-enriched extract from caesalpinia sappan Linn[J]. Plants (Basel), 2022, 11(13): 1698.
Liu F, Wang Y, Sang J, et al. Brazilin inhibits α-synuclein fibrillogenesis, disrupts mature fibrils, and protects against amyloid-induced cytotoxicity[J]. J Agric Food Chem, 2019, 67(42): 11769-11777.
李新圃, 王胜义, 杨峰, 等. 金黄色葡萄球菌生物膜感染机制及药物作用研究进展[J]. 动物医学进展, 2020, 41(4): 99-103.
Skurnik D, Cywes-Bentley C, Pier G B. The exceptionally broad-based potential of active and passive vaccination targeting the conserved microbial surface polysaccharide PNAG[J]. Expert Rev Vaccines, 2016, 15(8): 1041-1053.
Cue D, Lei M G, Lee C Y. Genetic regulation of the intercellular adhesion locus in staphylococci[J]. Front Cell Infect Microbiol, 2012, 2: 38.
韩雨希, 张婷婷, 吕丽丽, 等. 乳源耐甲氧西林金黄色葡萄球菌icaA/D基因缺失株的构建及其生物被膜形成能力与耐药性分析[J]. 微生物学通报, 2021, 48(1): 93-103.
郑艳阳, 曹凤娇, 明迪, 等. SarA调控金黄色葡萄球菌生物被膜形成的研究进展[J]. 中国兽药杂志, 2017, 51(12): 62-67.
Tormo M A, Martí M, Valle J, et al. SarA is an essential positive regulator of Staphylococcus epidermidis biofilm development[J]. J Bacteriol, 2005, 187(7): 2348-2356.
Tamber S, Cheung A L. SarZ promotes the expression of virulence factors and represses biofilm formation by modulating SarA and agr in Staphylococcus aureus[J]. Infect Immun, 2009, 77(1): 419-428.
Zheng J, Shang Y, Wu Y, et al. Diclazuril inhibits biofilm formation and hemolysis of Staphylococcus aureus[J]. ACS Infect Dis, 2021, 7(6): 1690-1701.
程旭, 杨雨晴, 吴赛男, 等. 金黄色葡萄球菌SarA蛋白原核表达及免疫原性研究[J]. 北华大学学报(自然科学版), 2021, 22(1): 47-52.
Oriol C, Cengher L, Manna A C, et al. Expanding the Staphylococcus aureus SarA regulon to small RNAs[J]. mSystems, 2021, 6(5): e0071321.
陈兆芳, 张维娜, 孟勇, 等. 植入物动物感染模型在葡萄球菌生物膜研究中的应用与进展[J]. 微生物学通报, 2022, 49(12): 5321-5330.
