基于微透析技术的付罐疗法在体经皮促渗作用评价
2024-06-28刘锦萍郑晓霞徐剑张永萍刘耀缪艳燕
刘锦萍 郑晓霞 徐剑 张永萍 刘耀 缪艳燕

【摘 要】 目的:建立芍药苷的经皮微透析方法,探究付罐疗法(FCT)在体经皮促渗效果。方法:通过增量法和减量法对微透析探针的体外回收率和传递率进行测定,并利用反向渗析法校正探针对芍药苷的在体回收率;以SD大鼠为动物模型,含5%氮酮处理的芍药苷溶液作为阳性对照组,3号罐留罐法产生负压为-0.30MPa处理10min作为FCT促渗处理组,采用皮下微透析取样技术结合HPLC法测定付罐疗法对芍药苷的经皮药动学的影响。结果:增量法和减量法所测得的芍药苷的探针体外回收率与传递率基本一致,药物与渗析膜间无相互作用;芍药苷的在体回收率为(51.71±0.75)%。FCT促渗处理组能显著提高芍药苷的透皮速率0.0767μg/min(空白组0.0042μg/min),降低时滞,对芍药苷的促渗倍数(ER)为18.26;5%氮酮组促渗倍数(17.69)比FCT组低。结论:付罐对芍药苷具有明显的在体经皮促渗作用,提示付罐疗法可作为一种新型的经皮给药物理促渗技术进行应用。
【关键词】 付罐疗法;物理促渗新技术;微透析技术;在体经皮吸收;芍药苷;反相渗析法
【中图分类号】R285.6 【文献标志码】 A【文章编号】1007-8517(2024)10-0039-07
DOI:10.3969/j.issn.1007-8517.2024.10.zgmzmjyyzz202410009
Evaluation of the in Vivo Transdermal Osmotic Effect of Fus Cupping Therapy Based on Microdialysis Technique
LIU Jinping1 ZHENG Xiaoxia1 XU Jian1,2,3﹡ ZHANG Yongping1,2,3 LIU Yao1,2,3 MIAO Yanyan1,2,3
1.College of Pharmaceutical Sciences, Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China;
2.National Engineering Technology Research Center for Miao Medicine, Guiyang 550025, China;
3.Guizhou Engineering Research Center for Processing and Preparation of Traditional Chinese
Medicine and Ethnic Medicine, Guiyang 550025, China
Abstract:Objective To establish a method of percutaneous microdialysis of paeoniflorin and to explore the effect of Fus Cupping Therapy (FCT) on percutaneous permeation in vivo.Methods The in vitro recovery and transmission rate of microdialysis probe were determined by incremental method and subtractive method, and the in vivo recovery rate of paeoniflorin was corrected by reverse dialysis.SD rats were used as animal model, paeoniflorin solution treated with 5% azone as positive control group, and 10 min was treated with negative pressure as-0.30MPa in No.3 can as FCT osmotic treatment group.Subcutaneous microdialysis sampling technique combined with HPLC method was used to determine the effect of cupping therapy on the transdermal pharmacokinetics of paeoniflorin.Results The probe recovery rate and transmission rate of paeoniflorin by incremental method and subtractive method were basically consistent, and there was no interaction between dialysis membranes; the in vivo recovery of paeoniflorin was (51.71±0.75)%.The permeation rate of paeoniflorin in FCT group was significantly increased by 0.0767 μg/min (blank group 0.0042 μg/min), and the time lag was reduced.The penetration ratio (ER) of paeoniflorin in azone group was 18.26%, which was lower than that in FCT group.Conclusion Cupping has obvious effect on transdermal penetration of paeoniflorin in vivo, which suggests that cupping therapy can be used as a new technique of transdermal drug delivery.
Key words:Cupping Therapy; New Technology of Physical Osmosis; Microdialysis; in Vivo Percutaneous Absorption; Paeoniflorin;Reverse Dialysis
白芍为毛茛科植物芍药(Paeonia lactiflora Pall)的干燥根,具有养血调经、敛阴止汗、柔肝止痛、平抑肝阳等功效[1]。研究[2]表明白芍具有镇痛抗炎、调节免疫等作用,可用于治疗风湿类疾病、自身免疫性疾病、皮肤黏膜疾病等。白芍的质量控制成分和主要药效成分为芍药苷,具有抗自由基损伤、抗炎等作用[3]。然而,由于芍药苷脂溶性差不易透过生物膜,从而导致其口服给药生物利用度低、半衰期短,影响药效发挥[4]。研究[5]发现经皮给药是提高其生物利用度的有效途经,但由于皮肤角质层的物理屏障是其经皮制剂研发的一大挑战,为克服其屏障作用,已有物理、化学、制剂等层面的多种促渗方法应用于经皮给药系统领域[6]。
拔罐疗法(罐疗)是一种具有悠久历史的传统外治疗法,付罐疗法(Fus cupping therapy,FCT)是由付文心教授在中国传统拔罐疗法的基础上,经过基础研究及大量临床试验研究研制的一种新型罐疗方法[7-8]。通过罐疗处理对人体皮肤产生物理、化学、生物效应及其他刺激作用可改变皮肤表皮的角质层结构[9],从而促进一般药物的透皮吸收率,提高疗效。课题组前期研究[10-15]表明,付罐疗法对不同类型的药物成分具良好经皮促透效果,具备发展成为一种经皮给药物理促渗新技术的潜力。但是,目前对付罐疗法经皮促透效果的评价主要采用离体动物皮肤为模型进行研究,对药物经皮促渗活体研究较少。由于实验活体动物的体内环境与其剥离皮肤的离体皮肤所处的客观环境存在一定的差异[16],如动物的血液循环系统、酶系统等因素对药物的经皮通透性有一定程度的影响,常用的体外促透实验是否能准确反映付罐疗法的实际经皮促渗效果,还有待进一步证实。
微透析技术(microdialysis,MD)是一种新型的活体生物釆样技术,具有实时、在体、在线且对活体动物组织损伤小的优点,可很好地检测药物在体内的药动学过程、评价药物局部生物利用度和生物等效性,目前已广泛用于药物的局部药动学、药效学、药动-药效学等研究领域[17]。本文拟在前期付罐疗法体外经皮促透研究基础上[15],以芍药苷作为模型药物,设立空白对照组、5%氮酮阳性对照组、FCT促渗处理组,采用皮下微透析取样技术结合HPLC法测定付罐疗法对芍药苷的经皮药动学的影响,研究其在体经皮促透特征,进一步验证FCT的体外经皮促透效果,为FCT作为其他药物促渗方法研究奠定一定的基础。
1 材料
1.1 仪器 Agilen1260 Infinity II高效液相色谱仪(安捷伦公司生产),Agilent ZoRBAX SB-C18色谱柱(4.6 mm×150 mm,5μm);微透析系统(含CMA30线性微透析探针,半透膜长度为1 cm,截留相对分子质量6000 Da;Pump11Elite四通道注射泵;MAB85接样器);AE240电子天平(METTLER公司生产);SK8210HP型超声波清洗仪(上海科导超声仪器有限公司);付罐(贵州中医药大学针灸推拿学院提供)。
1.2 试药与试剂 芍药苷对照品(批号:110736-201438,HPLC≥96.4%,中国食品药品检定研究院生产);芍药苷原料药(批号:170318,纯度≥99%,成都兰贝植化科技有限公司生产);乌来糖(国药集团化学试剂有限公司生产);乙腈(进口色谱纯,Merck公司生产);甲酸(CNYTechnologies);水为屈臣氏蒸馏水;脱毛膏为自制;其余试剂均为分析纯。
1.3 动物 BALB/c-nu小鼠,等级SPF级,4周龄,雄性(北京华阜康生物科技股份有限公司),合格证号:SCXK(京)2014-0004。SD大鼠,SPF级[5周龄,体重(200±10)g],雄性(重庆腾鑫生物物科技有限公司),合格证号:SCXK(军)2012-0011。
2 方法与结果
2.1 芍药苷微透析样品HPLC方法的建立
2.1.1 色谱条件 色谱柱:Agilent ZoRBAX SB-C18 (4.6 mm×150 mm,5μm);流动相:乙腈∶[KG-*3/5]0.1%磷酸水(15∶[KG-*3/5]85);流速1 mL/min,柱温30℃,进样体积10 μL,检测波长230 nm,理论塔板数按芍药苷计不低于2000。
2.1.2 标准曲线的建立及方法学考察 取空白对照液、透析液芍药苷样品、芍药苷对照品,考察测定方法色谱条件的专属性,结果显示,在对照品出峰位置处无其他色谱峰干扰,表明灌流液不存在干扰,该分析条件可行。精密称取芍药苷对照品10.36 mg,用甲醇稀释配置成浓度为175.00 μg/mL、87.50 μg/mL、43.75 μg/mL、21.88 μg/mL、10.94 μg/mL、5.47 μg/mL、2.73 μg/mL、0.68 μg/mL的标准溶液,考察方法线性关系,芍药苷在0.68~175.00 μg/mL线性范围内良好,得回归曲线方程为y=12.041x+34.205(R2=0.9991)。取配制浓度为高、中、低43.75 μg/mL、10.94 μg/mL、2.73 μg/mL的3个质量浓度对照品溶液,室温放置0 h、2 h、4 h,计算高中低3个质量浓度的RSD分别为2.41%、0.42%、0.17%,实验结果表明样品在4 h内稳定。取高、中、低质量浓度为43.75 μg/mL、10.94 μg/mL、2.73 μg/mL的对照品溶液,1日内每个质量浓度连续测定5次,测得日内精密度分别为0.27%、0.14%、0.21%;在3日内对同一高、中、低质量浓度的样品进行连续进样,计算其日间精密度RSD分别为0.18%、0.40%、0.64%,结果表明仪器精密度良好。
2.2 影响付罐疗法促渗效果因素考察 FCT促渗作为一种新型物理促渗技术,不同的罐法(颤罐、刮罐、留罐)、不同罐体大小(2号、3号、4号、5号)、不同的处理时间、不同罐疗压力、不同透皮介质都会对它的促渗效果有影响。基于本课题组的前期研究[11],本实验在FCT罐法的选择上选择留罐法(由于动物皮肤面积的大小有限,不宜使用颤罐或者走罐);考察芍药苷药液对BALB/c-nu小鼠以留罐法、3号罐体处理5 min、10 min、15 min不同时间的促渗效果影响。
2.2.1 离体皮肤预处理 将健康的BALB/c-nu小鼠饲养1周后,脱颈处死且小心剪下动物的皮肤,角质层朝下置于玻璃板上使用手术眼科剪剔除多于的脂肪组织,然后反复使用0.9%的生理盐水清洗,直至生理盐水不浑浊为止,再使用10%的甘油润湿置于-0.4℃的冰箱中保存,1周内使用完。
2.2.2 体外透皮实验 精密称取一定量的芍药苷提取物,使用80%的丙二醇溶液制备芍药苷饱和药液备用。采用Franz扩散池,将皮肤固定在供给池与接受池之间,角质层朝上,接受池注满37℃的接受液,平衡0.5 h后,供给池注入1 mL供给液,并用保鲜膜封口。于恒温37.0℃、转速300 r/min条件下进行芍药苷的体外透皮实验,间隔时间2 h、4 h、6 h、8 h、10 h、12 h时取出1 mL透皮接收液,并补充等体积等温的空白接收液。取出的透皮液以14000 r/min离心10 min,过0.45μm的微孔滤膜后进行HPLC含量测定。按公式(1)计算药物累积透过量:
其中,Q表示单位面积累积透过量,Cn和Ci分别表示第n次和第i次取样时接收液中药物的质量浓度,A为扩散池面积(2.80 cm2),V为扩散池的体积(7 mL),1为每次取样体积1 mL,以累积透过量Q对时间t作图,所得直线部分的斜率即为稳态透皮速率(Jss),直线部分反向延长线与X轴的交点即为滞后时间(Tlag )。
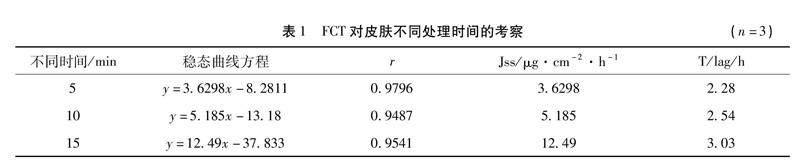
2.2.3 付罐处理不同时间的促渗效果考察 付罐采用3号罐体,罐法为留罐法,产生的负压为-0.3 MPa,对BALB/c-nu小鼠皮肤的处理时间分别为5 min、10 min、15 min,比较FCT不同作用时间对BALB/c-nu小鼠皮肤的促渗效果。根据表1的结果可知,FCT对BALB/c-nu小鼠皮肤的处理时间分别为5 min、10 min、15 min的透皮速率最好的是15 min。FCT对皮肤处理的时间越长其对角质层破坏的程度越高,渗透效果越好,但是如果负压过大或时间过长则会破坏到皮肤的真皮层影响皮肤的可恢复性,虽然FCT处理15 min的效果最佳,但是个别皮肤会出现皲裂,所以最终选择10 min作为FCT处理的最佳时间。
2.3 线性探针体外回收率影响因素考察
2.3.1 灌流速度对线性探针回收率的影响
2.3.1.1 增量法测定回收率 用等渗PBS缓冲液(pH=7.3)配制浓度为5.47 μg/mL的芍药苷溶液,将微透析线性探针浸没其中,以300 r/min的转速持续搅拌,恒温37℃;用空白PBS缓冲液以0.8μL/min、1μL/min、2μL/min、3μL/min、4μL/min的流速进行灌注,每个灌流速度收集3次样品(收集前均平衡1 h)。利用HPLC方法测定渗析液中芍药苷浓度,然后按公式(2):Re=Cout/Cin×100%计算芍药苷的相对回收率。
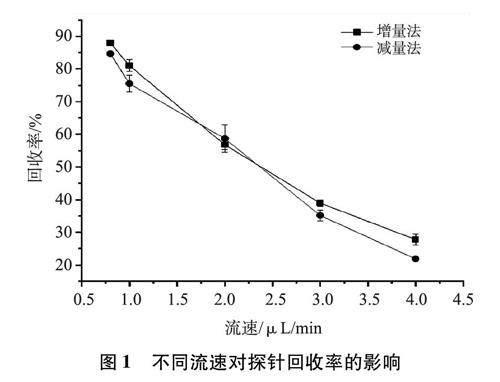
2.3.1.2 减量法测定回收率 将微透析线性探针置于在空白PBS缓冲液中,以300 r/min的转速持续搅拌,恒温37℃,用浓度为5.47 μg/mL芍药苷的等渗PBS缓冲液(pH=7.3)以0.8μL/min、1μL/min、2μL/min、3μL/min、4μL/min流速进行灌注,每个灌流速度收集3次样品(收集前均平衡1 h)。利用HPLC方法测定渗析液中芍药苷的浓度,然后按公式(3):Re=(Cin-Cout)/Cin×100%计算芍药苷的相对损失率,结果如图1。结果显示,随着灌流速度的增大,探针的回收率降低,当以0.8 μL/min的速度进行灌注时,增量法与减量法测量的回收率大致相同且最高。故选择0.8μL/min为灌流液的流速;且增量法、减量法测得的回收率在各自的流速下均无显著性差异(P<0.05),提示可以采用反向透析法测定芍药苷体内回收率。
2.3.2 浓度对回收率的影响 用等渗PBS缓冲液(pH=7.3)配制成不同浓度芍药苷(43.75 μg/mL、21.88 μg/mL、5.47 μg/mL、0.68 μg/mL)溶液,将微透析线性探针置于其中,以300 r/min的转速持续搅拌,恒温37℃,用空白PBS缓冲液以0.8μL/min流速进行灌注,每个浓度收集3次样品,利用HPLC方法测定渗析液中芍药苷浓度,按公式(2)计算芍药苷的相对回收率,结果见表2。由表2可知,线性探针在芍药苷浓度为43.75~0.68 μg/mL范围内,所得回收率无显著性差异(P<0.05),表明药物质量浓度对探针的回收率影响较小。
2.4 反向渗析法测定探针体内回收率
2.4.1 线性探针体内回收率校正 取健康雄性SD大鼠[5周龄,(200±10)g],用乌拉坦(0.5 mL/100 g,腹腔注射)麻醉后固定在鼠板上,用剃毛机剃除腹部毛发,再用脱脂棉蘸8%的硫化钠溶液清除剩余毛发。将微透析线性探针(半透膜长度为10 mm)用引导针穿剌植入大鼠皮下后,引导针小心抽回,采用等渗的PBS缓冲液(pH7.3)排除微透析探针内的气泡。然后用43.75 μg/mL、21.88 μg/mL、5.47 μg/mL、0.68 μg/mL的不同浓度芍药苷溶液为灌流液,以0.8μL/min的流速进行灌注,每间隔40 min收集1次透析液,每个浓度收集3次样品(收集样品前均平衡系统1 h),利用HPLC测定透析液中芍药苷浓度。通过减量法(公式3)计算芍药苷的相对损失率,同时计算平均回收率为(51.71±0.75)%。结果见表3。
2.4.2 探针回收率日内稳定性 线性探针植入皮下平衡后,用浓度21.876 μg/mL的芍药苷溶液为灌流液,以灌流速度为0.8μL/min,平衡1 h之后收集样品,每间隔40 min之后收集1次透析液,利用HPLC测定透析液中芍药苷浓度,结果如图2。由图2可知,芍药苷的体内相对回收率约为(51.71±0.75)%,在12 h内探针回收率稳定,可用于经皮微透析试验中的药物分析测定。
2.5 在体经皮微透析 实验釆用80%丙二醇溶液,配制含20 mg/mL芍药苷的5%氮酮溶液,只由溶剂系统配制的芍药苷溶液组作为空白对照组,含5%氮酮处理的芍药苷溶液作为阳性对照组,以3号罐留罐法产生负压-0.30MPa处理10 min作为FCT促渗处理组。如图3。取健康雄性SD大鼠,用乌拉坦按体重麻醉后固定在鼠板上,剃毛机去除腹部毛发,再用8%的硫化钠溶液清除剩余毛发,采用引导针将微透析线性探针植入大鼠皮下组织中,然后用502胶水将Franz扩散池的供给池贴于大鼠皮肤上,并保证微透析半透膜区域位于供给池正中央。用PBS缓冲液(pH7.3)灌注10min排除微透析探针内的气泡,再切换为0.8μL/min的流速灌注平衡微透析系统1 h,随后加入2 mL不同组别的药物溶液(为防止药物溶液中水分挥发供给池用封口胶封口),每40 min收集渗析液样品1次,共收集720 min,每组重复4次。
将各组渗析液样品利用已建立的HPLC进行含量测定,按芍药苷的线性回归方程求算对应的浓度值,根据探针对芍药苷的体内相对回收率Re为51.71%,求算得皮肤组织下芍药苷的真实浓度:C0=Cdialysis/RR。根据每个时间点内皮肤组织下的芍药苷浓度值和流经探针的渗析体积(即32 μL),计算该时间点内皮肤组织下的芍药苷质量,按公式计算720 min内药物累积透过量:Q=∑ni=1Ci×Vi(其中,Q为累积透过量,Ci为第i个时间点的透析液的药物浓度,Vi为每次取样体积)。以累积透过量Q对时间t作图,所得直线部分的斜率即为稳态透皮速率(Js),直线部分反向延长线与X轴的交点即为滞后时间(Tlag)。促渗方法的促渗倍数(ER)按公式(4)计算:ER=Js/J0,其中Js、J0分别为促渗组和空白组药物的稳态渗透速率。
FCT促渗处理组、5%氮酮阳性对照组及空白组对芍药苷透过大鼠皮肤的在体渗透药时曲线如图4。不同时间点对应药物累积透过量如图5,不同促渗组作用下芍药苷在体透皮吸收参数见表4。由图表可知,在FCT、5%氮酮作用下对芍药苷的在体透皮吸收均具显著促进作用,但FCT对芍药苷的促渗倍数(18.26)比氮酮(17.69)高,表明其促渗效果最佳。
3 讨论
由于经皮微透析技术不适合于大量且较大极性范围药物的经皮吸收实验研究,因此该实验根据课题组前期不同极性模型药物的体外透皮试验选择了极性适宜的芍药苷为代表[10],研究FCT对芍药苷的在体透皮吸收情况;同时选择外用透皮制剂中常用的促渗剂氮酮作为阳性对照,进一步对比评价FCT在体经皮促透效果。
在微透析试验中,探针的回收率受到探针种类、灌流液流速、灌流液的成分、温度、pH、药物自身的理化性质及采样间隔等因素的影响[18]。因此,灌流液不同流速、不同浓度等因素对探针回收率的影响本实验采用增量法、减量法对其进行考察。研究结果显示,探针回收率随灌注速率增加而减低,当灌流液流速较小时,通过探针半透膜时药物与半透膜内外组织形成一个微小的平衡,流速越大平衡易被破坏,回收率越低。当灌流速度为0.8μL/min时增量法和减量法测得的回收率近似相等且最高,也充分验证了反向渗析法可用于芍药苷的体内回收率的校正,故选择0.8μL/min为灌流液流速;不同浓度的药物溶液对探针的体外回收率影响不大。由于动物体内的药物浓度是一个动态的变化过程,为准确求算皮肤组织中药物含量,必须要保证探针回收率测定的稳定性,该实验釆用反向渗析法测定了芍药苷的在体探针回收率,研究结果显示,芍药苷的体内相对回收率在12 h内稳定,因此选用测定的平均值(51.71±0.75)%来计算体内药物浓度。
基于本课题组的前期研究,在FCT罐法的选择上选择留罐法,是由于动物皮肤面积的大小有限,不宜使用颤罐或者走罐。付罐疗法(FCT)对皮肤的促渗效果机理主要通过在皮肤和杯壁之间封闭并创造一个负压空间,利用负压吸引、熨烫皮肤,拉动浅层肌肉、刺激经络、穴位,从而调节血液和阴阳、疏通经络,对皮肤和皮下结构产生各种刺激作用[14,19],使皮肤角质层遭到破坏,使药物很好地透过皮肤角质层阻碍到达真皮层从而发挥药效。在罐法、罐体、FCT产生的负压、动物皮肤相同的条件下,不同的处理时间也会影响药物的渗透效果,FCT对皮肤处理的时间越长其对角质层破坏的程度越高,渗透效果越好,但是如果负压过大或时间过长则会破坏到皮肤的真皮层影响皮肤的可恢复性,对3个不同处理时间来说,15 min的效果最佳,但是个别皮肤会出现皲裂,所以最终选择10 min作为FCT处理的最佳时间。
研究表明,付罐疗法能显著提高盐酸川芎嗪[10]、盐酸维拉帕米[11]和延胡索乙素[13]等药物的经皮渗透,但这些付罐疗法经皮促透效果的评价主要基于离体动物皮肤进行研究,对药物经皮促渗活体研究较少,为了进一步评价FCT对药物的在体促透作用,实验以芍药苷为模型药物进行了体内透皮试验。结果表明,与空白对照组相比,FCT促渗处理组和5%氮酮阳性对照组均能使芍药苷的在体透过量显著增加,但相较之下FCT对芍药苷的促渗倍数更高;FCT促渗处理组的透皮率和皮肤渗透系数高于其他组,说明FCT对芍药苷具良好的促透效果。同时,与前期体外透皮试验的经皮促透倍数进行相关性分析[15],比较发现FCT对芍药苷的体内外促渗效果(ER)呈直线线性相关,表明FCT对药物促透评价的离体实验可以大致反映动物体内促透效果。可见,拔罐治疗与经皮给药相结合可以提高药物的透皮速率,为经皮渗透提供了一种新的方法和途径,FCT可作为一种具有中医药特色的经皮给药物理促渗新技术应用,具有显著的促透作用及较高的临床应用价值。
参考文献
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2020:1088.
[2]张正媚,高宏杰,王梅杰,等.基于VOSviewer和CiteSpace的白芍总苷研究热点可视化分析[J].中国中医药信息杂志,2022,29(5):44-50.
[3]杨山景,封安杰,孙越,等.白芍总苷的药理作用及机制研究进展[J].中国现代应用药学,2021,38(13):1627-1633.
[4]王春,魏伟.芍药苷药物代谢动力学研究进展[J].中国药理学通报,2014,30(12):1646-1650.
[5]杨畅,冯健男,杜守颖,等.芍药苷醇质体凝胶剂体外释放及透皮特性研究[J].中国新药杂志,2017,26(21):2590-2594.
[6]王锐,张贝贝,杨婧,等.经皮给药系统中促渗方法的研究进展[J].中华中医药杂志,2021,36(5):2855-2858.
[7]王云,张永萍,徐剑,等.物理促渗技术在中药经皮给药系统中的研究进展[J].贵阳中医学院学报,2019,41(6):84-87.
[8]付文心.付罐疗法及其应用[R].贵阳:贵阳中医学院,2010-06-25.
[9]谢伟杰,张永萍,徐剑,等.罐疗作为经皮给药物理促渗新技术的研究状况[J].世界科学技术-中医药现代化,2015,17(7):1530-1536.
[10]杨芳芳,张永萍.罐疗提高盐酸川芎嗪透皮吸收的研究[J].时珍国医国药,2009,20(6):1396-1397.
[11]张永萍,林亚平,邱德文,等.罐疗提高盐酸维拉帕米透皮吸收的研究[J].中国药学杂志,2003(12):36-37.
[12]卞冰瑶,张永萍.罐疗促进川芎嗪凝胶剂透皮吸收后血液中盐酸川芎嗪的富集研究[J].微量元素与健康研究,2011,28(5):6-7.
[13]徐剑,张永萍,谢伟杰,等.付罐疗法对延胡索乙素贴剂透皮吸收的影响[J].中国实验方剂学杂志,2013,19(24):43-46.
[14]XIE W J, ZHANG Y P, XU J, et al. The Effect and Mechanism of Transdermal Penetration Enhancement of Fus Cupping Therapy: New Physical Penetration Technology for Transdermal Administration with Traditional Chinese Medicine (TCM) Characteristics[J]. Molecules, 2017, 22(4):13-17.
[15]MIAO Y, XU J, LIU Y, et al. Comparative Evaluation of the Transdermal Permeation Effectiveness of Fus Cupping Therapy on Eight Different Types of Model Drugs[J].Curr Drug Deliv,2021,18(4):446-459.
[16]兰颐,杨琳,史大勇,等.基于微透析技术的花椒挥发油在体经皮促透作用研究[J].中国中药杂志,2017,42(14):2676-2682.
[17]雷雅婷,张也,蔡雄,等.微透析技术在中药经皮给药系统中研究进展[J].中成药,2021,43(6):1555-1559.
[18]李秀敏,汤湛,张琪,等.葛根素在眼用微透析探针上的回收率研究[J].中国药学杂志,2022,57(1):62-68.
[19]XIE W J, WU Y M, CHEN S S, et al. In vitro evaluation of transdermal permeation effects of Fus cupping therapy via six diffusion kinetics models[J]. Traditional Medicine Research, 2019, 4(1): 42-53.
(收稿日期:2023-08-18 编辑:陶希睿)
基金项目:国家苗药工程技术研究中心能力提升(黔科合中引地[2023]006);贵州省高等学校中药民族药(苗药)新剂型新制剂工程研究中心(黔教技[2022]022)。
作者简介:刘锦萍(1998—),女,汉族,硕士研究生在读,研究方向为中药及民族药药物新制剂与新剂型研究。E-mail: 960778533@qq.com
作者简介:徐剑(1977—),男,汉族,硕士,教授、硕士研究生导师,研究方向为中药制剂新技术与新剂型。E-mail: 10423108@qq.com
