帕金森病脑深部电刺激术后电极错位修正2例报道及文献回顾
2024-06-27杨森麦荣康郑勇
杨森 麦荣康 郑勇

【摘要】 目的 探讨帕金森病(PD)脑深部电刺激(DBS)术后疗效不佳与电极错位的关系,以及靶点调整时机和方法、术后疗效改善分析。方法 回顾性分析深圳大学第二附属医院2020年9月—2021年4月收治的2例因植入电极错位导致疗效不佳的DBS术后患者,分别行更换靶点和原靶点重新植入的修正手术,观察结果,结合文献加以总结。结果 患者1的刺激靶点由双侧丘脑底核(STN)更换为双侧内侧苍白球(GPi),术前、术后药物关期刺激下UPDRS运动评分改善率32.1%,药物开期可改善46.4%;患者2行原左侧STN靶点电极取出并重新植入,术前、术后药物关期刺激下UPDRS运动评分改善率21.4%,药物开期可改善35.7%。结论 脑深部电刺激术后,在明确诊断为与电极位置错位相关的疗效不佳时,有必要进行个体化的修正手术。
【关键词】 帕金森病;脑深部电刺激;电极错位;修正手术
【中图分类号】 R651 【文献标志码】 B 【文章编号】 1672-7770(2024)03-0357-04
脑深部电刺激术(deep brain stimulation,DBS)是目前临床上治疗帕金森病(Parkinsons disease,PD)、特发性震颤(essential tremor,ET)及肌张力障碍的主要手术方式[1]。DBS术中电极植入靶点的准确性是影响术后疗效的最关键因素,通过严格的患者选择、影像学规划及精细的手术操作,配合术中电生理、术中影像辅助及副反应测试,一般可获得良好的症状控制[1]。电极错位会给术后程控带来困难,极易引发刺激周围神经结构所引起的副反应,当术后程控及药物治疗均无法进一步得到满意的症状控制时,可考虑采用修正手术调整电极位置[2]。随着DBS的广泛临床应用,术后程控患者逐渐增多,使得修正手术的需求也逐渐增长,相关的研究正引起医务工作者的重视。本研究回顾性分析深圳大学第二附属医院2020年9月—2021年4月收治的2例PD患者,因DBS术后疗效欠佳,分别行更换靶点及原靶点重新植入修正手术治疗,结合文献复习探讨PD患者DBS术后疗效欠佳时修正手术的诊治思路。现报告如下。
1 资料与方法
1.1 患者1
1.1.1 一般资料 患者女,57岁,因外院DBS术后3年疗效不佳于2020年9月入院。患者首次手术在PD发病14年时,主要表现为四肢肌张力增高、行走困难,药物难以改善。首次手术靶点为双侧丘脑底核(subthalamic nucleus,STN),术后1个月(植入设备为美敦力Activa RC)程控时行走困难、肢体僵硬缓解低于预期,在外院多次程控,效果不满意。患者为进一步诊治于深圳大学第二附属医院神经内科门诊咨询、程控,主要通过逐步增加刺激电压、调整药物组合及剂量来维持适度的肌张力缓解程度。当左侧STN电极电压达到3.5 V时即出现右侧肢体麻木,右侧STN电极电压上升至3.0 V以上即出现左侧肢体异动,过低的电压则肌张力难以缓解。反复调校后将左侧STN刺激参数调整为单极模式C+8-,2.7 V、60 μs、130 Hz,右侧STN刺激参数调整为单极模式C+4-,3.0 V、60 μs、130 Hz予维持。服药美多巴等效剂量(modopar equivalent dose,MED)为475 mg,药物关期刺激下Hoehn yahr分期为Ⅳ期,UPDRS Ⅲ评分56。经与神经内科医师沟通,结合患者沟通后意愿,决定行电极修正手术。入院后在为期12 h的洗脱期后,进行1.5倍左旋多巴等效剂量冲击试验,改善率为44.6%,出现肢体异动。
1.1.2 影像学检查 修正手术前行1.5 T核磁共振成像(magnetic resonance imaging,MRI)扫描(T1轴冠矢位、T2轴冠位),手术当天在局麻下安装立体定向头架行1 mm薄层计算机断层扫描(computer tomography,CT)扫描,导入Surgiplan手术计划系统,结合参考值、可视化定位双侧STN,重新定位双侧STN理想靶点,可知双侧实际植入电极位置与理想靶点比较均稍深、偏内、偏后(图1),证实患者病情控制不良、程控困难原因为与电极相关的位置不良。
1.1.3 方法及预后 因患者症状主要以肌张力异常增高伴异动为主,故修正手术方案为更换刺激靶点由双侧STN至双侧苍白球内侧核(Globu Pallidus interna,GPi)。手术过程中,首先拔除双侧STN刺激电极,后在电生理、宏刺激及副反应测试下,植入双侧GPi电极,改全麻将双侧刺激电极与原有延伸导线连接、固定,测试通畅。术后复查头部CT导入计划系统,融合见电极位置满意(图1B)。围手术期未出现与电极相关并发症,术后20 d开机程控,刺激参数为左侧Gpi C+6-,2.3 V、90 μs、150 Hz,右侧Gpi C+3-,2.5 V、90 μs、150 Hz。术前、术后1个月药物关期刺激下UPDRS运动评分较术前改善32.1%。术后药物等效剂量不变,开期延长,关期缩短,开期运动评分较术前同期最好情况下可改善46.4%,程控过程中未再出现右侧肢体麻木及左侧肢体异动等反应。
1.2 患者2
1.2.1 一般资料 患者女,68岁,因PD患者DBS术后4年右侧下肢震颤加重1年于2021年4月入院。患者首次DBS手术在PD发病5年时,主要表现为四肢不自主震颤,药物难以改善。手术靶点为双侧STN。术后1个月(植入设备为美敦力Activa RC)药物关期改善率最高可达约48%,开期改善率最高可达约56%;近1年效果下降,表现为右侧下肢震颤明显加重,药物治疗无效。修正手术前的最佳刺激参数为左侧STN C+2-,2.2 V、90 μs、120 Hz(更高的电压导致眼球活动异常),右侧STN C+7-,3.0 V、90 μs、120 Hz。服药MED为375 mg,患者药物关期刺激下Hoehn yahr分期Ⅲ期,UPDRS Ⅲ评分42。入院后在12 h洗脱期后进行1.5倍左旋多巴等效剂量冲击试验,改善率为33.3%。
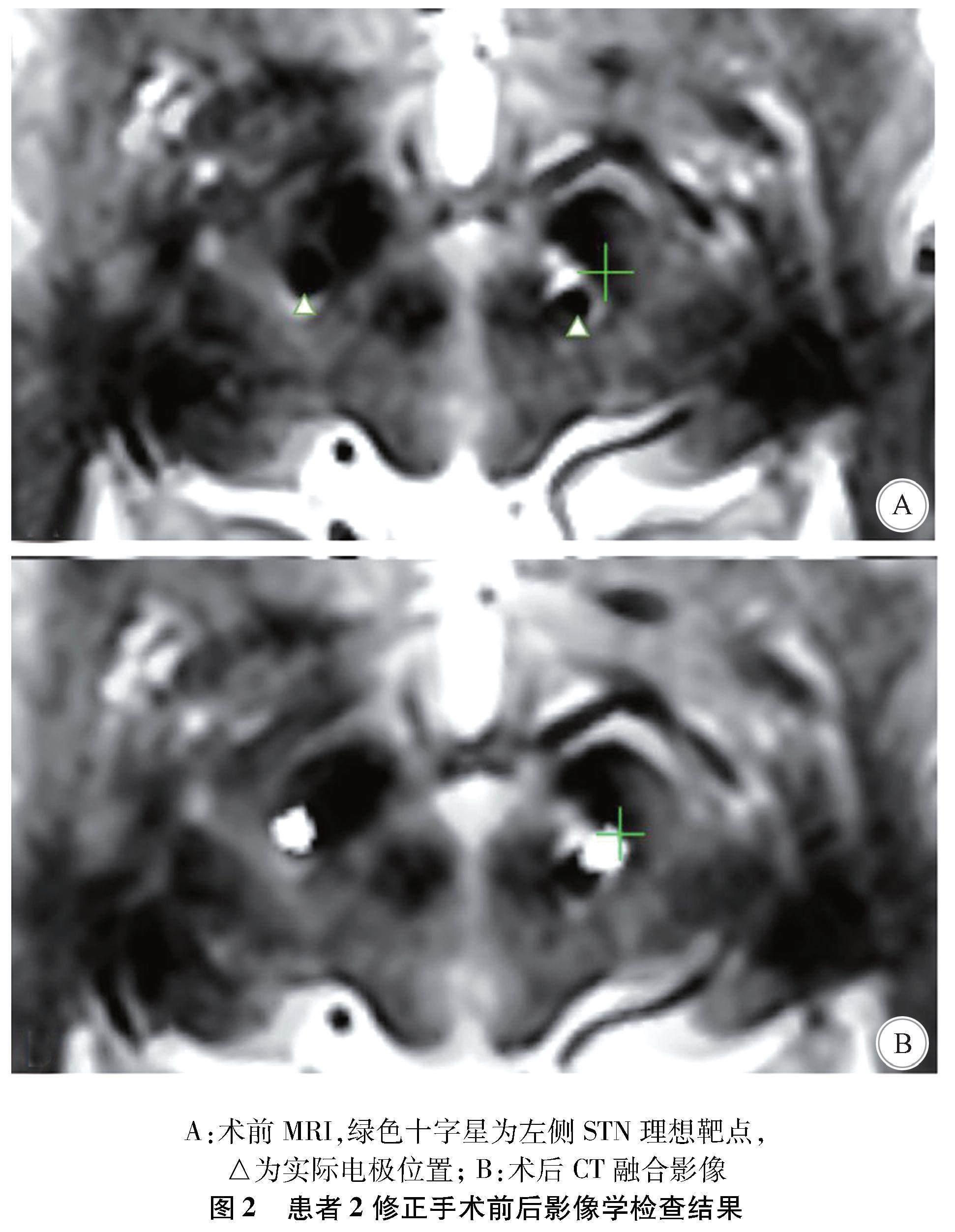
1.2.2 影像学检查 修正手术前行1.5 T MRI扫描(T1轴冠矢位、T2轴冠位),手术当天在局麻下安装立体定向框架,行1 mm薄层CT扫描,导入Surgiplan手术计划系统,重新定位左侧STN理想靶点,可见实际电极位置偏内、偏后(图2),右侧STN电极位置满意。
1.2.3 方法及预后 再次手术仅考虑修正左侧STN电极,以原颅骨骨孔规划新穿刺道,注意避开原有电极通道。术中先缓慢拔除原左侧STN电极,然后在电生理、宏刺激和副反应测试下重新植入靶点,后改全麻将左侧电极与原有延伸导线连接并固定,测试通畅。术后复查头部CT导入计划系统,融合见电极位于理想靶点与原电极位置中间(图2B)。术后20 d开机,刺激参数为左侧STN C+6-,2.9 V、90 μs、120 Hz,右侧同前。术前、术后1个月对比药物关期刺激下UPDRS运动评分改善21.4%。术后药物等效剂量不变,开期延长,关期缩短,开期运动评分较术前同期最好情况下可改善35.7%,右侧下肢震颤明显改善,肌张力降低,刺激电压上升到3.5 V未见出现异动。
2 讨 论
DBS逐渐成为PD及运动障碍疾病的主要外科治疗手段,术后效果直接取决于DBS电极位置的准确性[2]。电极错位将对术后程控造成很大困难,直接影响症状的改善率。Rolston等[3]认为因电极错位导致的疗效欠佳是导致DBS术后再次手术的最主要原因,而目前关于电极错位修正手术的报道却很少,这一问题在临床中可能广泛存在,但尚缺乏专门研究。
DBS术后短期的治疗重点在于预防与手术相关的颅内出血,此时如再次手术的目的是处理与手术操作相关的并发症;随着术后时间的延长,再次手术的目的主要是处理与电极硬件相关的各种问题,如电极感染/皮肤感染、线路断路及电极错位导致的疗效下降[4]。
由于DBS的手术技术进展迅速,过早的报道已无参考价值。Cabral等[5]完成的一项META分析纳入了2017年—2021年针对不同靶点的共一万余侧DBS术后患者的研究,将硬件相关的负性事件分为高电阻、电极/导线折断、感染、电极错位、脉冲发生器故障等分别进行分析,这可能反映出目前DBS术后远期再次手术的主要原因。
异常的电阻改变反映出电路某部分的损坏,可能是局部脑组织变性,也可能是电极-脑组织界面的理化性质改变(如产生了微小的局部气栓等),电阻的改变导致刺激电流的变化,增加程控困难[6]。电极/导线的折断一般是由于身体异常的姿势,导致了局部明显异常的压力所致。感染可能是局部的皮肤感染,也可能是颅内的电极感染,多发生于电极在颅骨锁的卡槽处、耳后切口及胸前的脉冲刺激器埋置处,常见于葡萄球菌或金黄色葡萄球菌在微小的皮肤破溃处出现繁殖,并未得到及时处理[7];当电极感染严重而抗生素治疗无效,需要拔除刺激电极[4,78],治愈后重新植入电极者不可归入修正手术的范畴内。
本研究中的修正手术是为了改善PD患者在DBS术后与电极错位相关的疗效不佳。虽然目前已有多种技术确保电极植入的准确性,但总体来看,电极错位在DBS中的发生率仍在2.47%左右[9]。造成电极位置不理想或疗效下降的因素有很多,术中脑脊液丢失、气颅、脑室容积、手术时间等因素对首次手术的电极位置影响较大[10]。王滔等[11]的研究认为,DBS术后电极有发生向靶点内侧、后侧及深部偏移的倾向;本研究的2例患者首次DBS术后均可见不同程度地向内、后侧偏移(图1、图2)证实了这种观点。
即使首次准确植入,随着术后时间延长,电极电阻的变化、导线在颅骨锁上的松动或局部外力等多种情况,均可导致触点的移位,造成疗效波动[2]。当发现患者存在电极错位情况,程控或药物治疗无法进一步提高疗效时,修正手术的目的在于调整刺激电极位置或更换靶点以达到更好的临床疗效,当考虑更换靶点时尤其需要结合患者临床特点进行个体化考量。有研究[1213]指出,STN-DBS主要通过减药和调整刺激位点控制异动症,而GPi-DBS具有直接抑制异动症的作用。国外学者如Frizon等[14]报道的电极错位病例,大多数是予STN原位修正,仅在少数伴有明显异动的患者中将靶点改至GPi取得满意的改善。本研究中患者1的表现符合僵直型PD的典型表现,疗效不理想主要表现在四肢肌张力增高伴左侧上肢难以解决的异动症状,故将靶点由双侧STN修正为双侧GPi,取得了良好的效果。
不同的刺激电极有不同的触点间距,本研究中所植入的刺激电极包含了4个触点,每个触点1.5 mm,间距0.5 mm,共跨越7.5 mm的范围,在大多数情况下,沿电极触点跨越范围内的纵向偏差可通过调节电极触点来解决,故针对原靶点的修正手术,重点在于纠正与电极垂直方向的偏差。杜婷婷等[15]研究认为,与电极垂直方向修正的平均距离为2.8 mm(测量平面为AC-PC平面下3.5 mm),术后取得了满意的效果。
具体的手术方法不一而足,部分学者在植入电极时将原有电极作为参考(结合术中影像如X线透视),避免植入电极滑入原有隧道,可在新电极植入完成后拔除;为防止拔除过程出血,可对旧电极做保留处理;也可将手术分为2期进行,先1期拔除原有电极,2期再行植入,这样既可以避免滑入原有脑内隧道,又可以保证再次植入时电生理监测结果的准确性[14]。本研究采用首先拔除原电极,同时重新置入新电极的方法。患者2的疗效减弱主要表现为DBS术后右侧下肢震颤加重,反复程控效果差,增加药物剂量又诱发肢体异动等不良反应,修正手术的目的是将左侧STN电极向前、外侧进行适度移动。虽然在规划该例患者的穿刺入路时特别注意了规避原电极隧道,但是术后融合影像仍可见电极偏离预定靶点,实际落于理想靶点与原靶点之间,修正距离为1.8 mm(测量平面为AC-PC平面下3.5 mm)。Falowski等[16]认为新路径应与原电极隧道保留至少2 mm的距离,否则电极极易滑入原有隧道,影响修正手术效果;该研究术后药物关期下最好的改善率仅为21.4%,与已有的文献报道结果相比较(改善率多为24%~44.6%)偏低[16],不能排除原穿刺道影响了电极尖端位置的可能,因此更理想的电极穿刺通道规划方式或许可以带来更好的结果。术中保留原电极进行电生理监测,通过对比两电极的电生理结果,复核植入的靶点准确性,或许是一种值得积极尝试的方法,但采用此种方式时可能需要更加巧妙地设计植入通道。
