Toll样受体4信号通路在心力衰竭中的应用价值
2024-06-26陈坤王聪颖孙鑫李少杰谷剑陈淑霞王立立
陈坤 王聪颖 孙鑫 李少杰 谷剑 陈淑霞 王立立
【摘要】心力衰竭是全球发病率最高的疾病之一,在心力衰竭及其合并症的发生和发展过程中炎症机制起着至关重要的作用。大量研究表明Toll样受体4信号通路可通过介导不同的炎症因子,对心肌造成损害。因此近期发现Toll样受体4信号通路可用于预测心力衰竭及其合并症病情的严重程度及预后,同时也可作为许多新型抗心力衰竭药物的靶点,改善症状,使心力衰竭患者获益。现就Toll样受体4信号通路在心力衰竭中上述两方面的应用价值做一综述。
【关键词】Toll样受体4;心力衰竭;疾病预后;药物靶点;预测价值
【DOI】10.16806/j.cnki.issn.1004-3934.2024.05.013
Application Value of Toll-Like Receptor 4 Signaling Pathway in Heart Failure
【Abstract】Heart failure is one of the most prevalent diseases in the world,and inflammation plays a crucial role in the occurrence and development of heart failure and its comorbidities.A large number of studies have shown that the Toll-like receptor 4 signaling pathway can cause damage to the myocardium by mediating different inflammatory factors.Therefore,it has recently been found that the Toll-like receptor 4 signaling pathway can be used to predict the severity and prognosis of heart failure and its comorbidities,and at the same time,it can also be used as a target for many new anti-heart failure drugs to improve symptoms and benefit patients with heart failure.This article reviews the application value of the Toll-like receptor 4 signaling pathway in the above two aspects in heart failure.
【Keywords】Toll-like receptor 4;Heart failure;Disease prognosis;Drug target;Predicted value
心力衰竭(heart failure,HF)是多种心脏疾病的晚期,具有高住院率和高死亡率,2017年全球估计有6 430万人患有HF,预计其流行率将会提高,给全球卫生保健带来很大的负担[1]。因此能监测HF患者病情的进展及预后,并且通过治疗HF延长患者生存时间显得尤为重要,而Toll样受体4(Toll-like receptor 4,TLR4)信号通路体现了这一优势,现总结TLR4信号通路在HF中预测及药物靶点两方面的价值。
1 TLR4的背景与信号传导
1.1 TLR4的背景与结构
TLR4是第一个被发现的哺乳动物的Toll样受体,属于跨膜蛋白,是模式识别受体的一种,被各种配体激活:(1)病原体相关分子模式,包括细菌脂多糖(lipopolysaccharide,LPS)等;(2)由激活的巨噬细胞和脂肪组织释放的损伤相关分子模式,如热激蛋白(heat shock protein,HSP)60、HSP70和高迁移率族蛋白1[2]。
1.2 TLR4信号传导通路
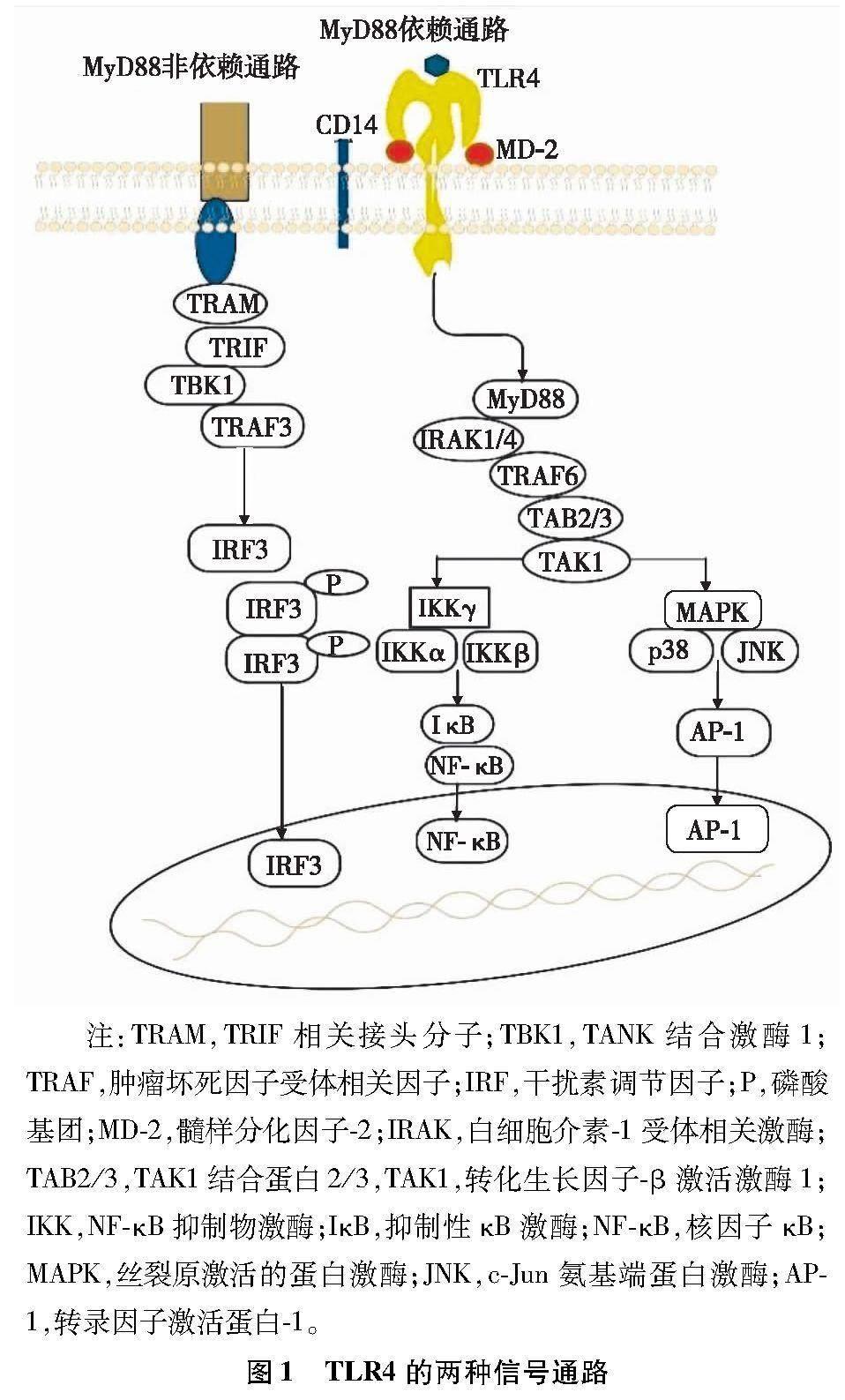
TLR4包含细胞内、跨膜和细胞外结构域。细胞内结构域,也称为Toll白细胞介素-1受体(Toll-interleukin-1 receptor,TIR)结构域,在信号传导中起作用,细胞外结构域由富含亮氨酸的重复序列组成[3]。目前已鉴定出4种主要的含TIR结构域适配器:(1)髓样分化因子88(myeloid differentiation factor 88,MyD88);(2)β干扰素TIR结构域衔接蛋白(TIR domain-containing adaptor inducing interferon-β,TRIF);(3)含Toll白细胞介素-1受体域衔接蛋白(Toll interleukin-1 receptor domain contain adaptor protein,TIRAP);(4)TRIF相关接头分子。不同于其他Toll样受体,TLR4通过诱导适配器蛋白触发MyD88依赖和TRIF依赖两种信号通路,进而产生促炎细胞因子[4],如图1所示。
1.2.1 MyD88依赖通路
TLR4信号通路将MyD88与丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子κB(nuclear factor-κB,NF-κB)的激活联系在一起,并表达了许多促炎细胞因子。越来越多的证据表明,LPS和CD14是形成TLR4/髓样分化因子-2复合体的关键诱导物,导致MyD88的激活,进而相继激活白细胞介素-1受体相关激酶(interleukin-1 receptor-associated kinase,IRAK)家族如IRAK1或IRAK4、肿瘤坏死因子受体相关因子6,转化生长因子-β激活激酶1(transforming growth factor-β-activated kinase 1,TAK1)和抑制性κB激酶(inhibitor of nuclear factor-κB,IκB)。LPS刺激IκB磷酸化进而促进NF-κB核转位,促进白细胞介素(interleukin,IL)-6、IL-1、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎细胞因子的基因表达。除了IκB磷酸化外,MAPK通路的组成部分,包括信号调节激酶、c-Jun氨基端蛋白激酶(c-Jun N-terminal kinase,JNK)和p38,也被TAK1激活,产生炎症因子。除了NF-κB和MAPK通路外,MyD88还被证明调控其他通路,如Ca2+-钙调蛋白依赖性蛋白激酶(Ca2+/calmodulin-dependent protein kinase,CaMK)和磷脂酰肌醇3激酶/蛋白激酶B 通路[5-6]。
1.2.2 MyD88非依赖通路
MyD88非依赖通路又称MyD88独立通路或TRIF依赖通路。多项研究表明,TRIF相关接头分子定位于CD14富集的区域,CD14在TRIF依赖通路中发挥重要作用。TRIF过表达可激活两种非典型的酶:(1)NF-κB抑制物激酶(inhibitor of NF-κB kinases,IKK):TANK结合激酶1和IKKε;(2)干扰素调节因子 (interferon regulatory factor,IRF)3和IRF7。最后,IRF3和IRF7诱导干扰素的表达,导致炎症反应。此外,与MyD88依赖通路相似,TRIF依赖通路也诱导NF-κB的晚期激活,产生促炎介质[7]。
2 TLR4通路与HF
HF是一种复杂的临床综合征,其特点是心脏结构和功能的损害,导致左心室充盈或射血异常。TLR4信号介导的先天性免疫和炎症反应对心脏的损伤至关重要。TLR4在心肌细胞和血管内皮细胞中表达,一旦被激活,TLR4会触发一系列细胞信号,最终激活NF-κB,从而导致相关促炎细胞因子的产生,如TNF-α、IL-1、IL-6和细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)。这些细胞因子的产生可作为正反馈进一步激活NF-κB[8],最终导致心肌细胞死亡,因此可将TLR4信号通路作为预测因子或药物作用靶点,从而使HF患者获益。
2.1 TLR4信号通路在HF及其合并症中的价值
2.1.1 TLR4信号通路可用于判断HF的严重程度及其预后
在慢性心力衰竭(chronic heart failure,CHF)患者的研究[9]中,结果表明TLR4、NF-κB与HF严重程度呈正相关,是其影响因素。在另一个研究[10]中也证实了这一观点并有了更多发现,在CHF组中TLR4、MyD88和NF-κB mRNA的表达及左心室舒张末期内径均高于对照组,患者按纽约心功能分级进行评估后发现与上述4种指标的表达呈正相关,发生不良心血管事件的患者4种指标的表达高于未发生的患者,且ROC曲线显示当TLR4、MyD88和NF-κB三者联合诊断时其ROC曲线下面积、敏感度和特异度均高于单独指标诊断价值,表明TLR4信号通路对CHF患者病情的发展及预后有重要的意义。
2.1.2 TLR4信号通路在HF合并症中的意义
TLR4信号通路在HF合并症中也有作用,上呼吸道感染是HF病情加重的重要诱因,在2023年发布的试验[11]中表明上呼吸道感染伴急性心力衰竭(acute heart failure,AHF)患者高迁移率族蛋白1和TLR4水平上调,与心肺功能有显著相关性,对于AHF患者病情的监测与控制有重要的临床意义。不仅是在AHF患者中,在CHF患者中也有相关发现,同年研究[12]发现降钙素原、TLR4、N末端脑钠肽前体和丙二醛是CHF合并社区获得性肺炎的危险因素,TLR4的表达与降钙素原、N末端脑钠肽前体和丙二醛呈正相关,对评估CHF患者合并社区获得性肺炎疾病严重程度具有一定临床价值。
2.2 TLR4信号通路可作为抗HF药物的作用靶点
HF是由于心脏结构和/或功能异常导致的一种异质性、多因素、进行性综合征,可引起心肌功能障碍、循环功能不全和多器官淤血。由于其高患病率、住院率和死亡率以及高昂的医疗费用,成为主要的全球健康问题[13],因此改善HF症状,延缓HF恶化至关重要。除之前基础药物以外,近年来随着研究的不断深入,一些新型药物也在不断出现及应用,如钠-葡糖糖共转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitor,SGLT2i)、血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor neprilysin inhibitor,ARNI)、胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor,GLP-1R)激动剂和二肽基肽酶-4(dipeptidyl peptidase-4,DPP-4)抑制剂,这些药物可将TLR4信号通路作为靶点,在HF治疗中发挥作用。
2.2.1 SGLT2i
从目前可获得的证据来看,炎症和氧化应激似乎在各种病因的HF发生和发展中起作用[14],SGLT2i可通过抑制炎症对心脏起到保护作用。NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体是TLR4信号通路中的炎症因子[15]。Byrne等[16]构建了射血分数降低的心力衰竭(heart failure with reduced ejection fraction,HFrEF)和射血分数保留的心力衰竭两种小鼠模型,取小鼠的心脏组织,测量NLRP3、胱天蛋白酶-1和TNF-α的转录水平,在经恩格列净处理的HFrEF小鼠中NLRP3炎症小体表达水平降低。除此之外,AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)也在TLR4信号通路中被发现[17]。Koyani等[18]进行心肌细胞培养、小鼠模型构建,结果表明:恩格列净可刺激心肌细胞AMPK的磷酸化,抑制TNF-α及肌酸激酶同工酶表达,对心肌细胞有保护作用。除此之外,SGLT2i也可抑制TLR4通路中的 CaMK发挥作用,Mustroph等[19]分别取终末期HF患者及HF小鼠中的心肌细胞测定CaMK活性,结果表明CaMK活性显著降低。以上研究均表明TLR4信号通路可作为SGLT2i的作用靶点发挥心脏保护作用。
2.2.2 ARNI
沙库巴曲缬沙坦(LCZ696)是一种新型化合物,它是临床开发中的首创ARNI。沙库巴曲缬沙坦在HF和高血压实验中有显著的益处[20]。一项研究[21]表明SD大鼠心肌梗死后第1天NLRP3、IL-1β和IL-18水平显著增加,而沙库巴曲缬沙坦有效降低了这些炎症因子在血清中的相对水平,提示其可改善心肌梗死引起的心肌损伤,抑制炎症反应。此研究还发现TAK1的蛋白和mRNA水平以及JNK的磷酸化从心肌梗死后第1天开始上调,沙库巴曲缬沙坦抑制了TAK1/JNK通路中关键蛋白的表达。Bunsawat等[22]招募了11例纽约心功能分级Ⅱ~Ⅲ级的HFrEF患者,结果显示沙库巴曲缬沙坦改善了患者的血管功能和6分钟步行距离,外周血中TNF-α和IL-18显著减少。
2.2.3 GLP-1R激动剂和DPP-4抑制剂
糖尿病是HF发生的关键且独立的危险因素,在诊断为HF的患者中,糖尿病是一个强有力的不良预后因素。HF也是糖尿病患者住院的主要原因。糖尿病与无症状左心室收缩和舒张功能障碍的发生率较高有关。这也是临床上HF发展较快的原因[14],GLP-1R激动剂和DPP-4抑制剂都是新型降血糖药,经证实具有心血管益处,一些体外研究[23-26]发现GLP-1R激动剂(杜拉鲁肽、艾赛那肽和利拉鲁肽)可通过激活AMPK通路,抑制NLRP3、IL-1β、IL-18等炎症因子及NF-κB信号通路对心肌起到保护作用,而DPP-4抑制剂(曲格列汀)可减少细胞中的ICAM-1、血管细胞黏附分子-1和转录因子激活蛋白-1的产生以及抑制NF-κB通路的参与,起到保护作用。在动物模型[27]中也有发现,对大鼠心肌免疫组染色显示,利拉鲁肽减弱羧甲基赖氨酸、烟酰胺腺嘌呤二核苷酸磷酸氧化酶2、ICAM-1和血管细胞黏附分子-1炎症因子在心脏微脉管系统中的积累,为HF的治疗提供了新的方向。
除了上述药物外,还有许多中药如根皮素、姜黄素也能通过抑制TLR4信号通路发挥作用,从而改善HF患者的预后,延缓疾病进程。
3 小结
HF是各种心血管疾病的终末阶段,合并其他疾病会加重病情,而TLR4信号通路在其中发挥着重要的作用,已有许多学者通过细胞培养、动物模型及临床试验来检测HF及其合并症中TLR4信号通路不同分子的表达量及分析其相关性,进而对疾病进行预测并将通路中的炎症因子作为药物靶点来阻碍疾病的进程,从而改善HF患者的症状及预后。TLR4信号通路在HF中还有很多应用价值有待研究,以期为HF的预测、防治,新的药物的开发等科学研究带来新的思路和突破。
参考文献
[1]Savarese G,Becher PM,Lund LH,et al.Global burden of heart failure:a comprehensive and updated review of epidemiology[J].Cardiovasc Res,2023,118(17):3272-3287.
[2]李晓洁,许泽鹏,黄玉婷,等.Toll样受体4信号通路在糖尿病视网膜病变中的研究进展[J].中国中医眼科杂志,2023,33(1):73-79.
[3]Deguchi A,Maru Y.Inflammation-associated premetastatic niche formation[J].Inflamm Regen,2022,42(1):22.
[4]Zhang S,Chen F,Zhai F,et al.Role of HMGB1/TLR4 and IL-1β/IL-1R1 signaling pathways in epilepsy[J].Front Neurol,2022,13:904225.
[5]Sumneang N,Apaijai N,Chattipakorn SC,et al.Myeloid differentiation factor 2 in the heart:bench to bedside evidence for potential clinical benefits?[J].Pharmacol Res,2021,163:105239.
[6]Ciesielska A,Matyjek M,Kwiatkowska K.TLR4 and CD14 trafficking and its influence on LPS-induced pro-inflammatory signaling[J].Cell Mol Life Sci,2021,78(4):1233-1261.
[7]Xiao Z,Kong B,Yang H,et al.Key player in cardiac hypertrophy,emphasizing the role of Toll-like receptor 4[J].Front Cardiovasc Med,2020,7:579036.
[8]Zhang Y,Liang X,Bao X,et al.Toll-like receptor 4 (TLR4) inhibitors:current research and prospective[J].Eur J Med Chem,2022,235:114291.
[9]梁魏昉.心力衰竭病人TLR4/NF-κB信号通路、vWF、D-二聚体水平变化及其与心力衰竭程度、LVEF的相关性分析[J].中西医结合心脑血管病杂志,2022,20(5):887-892.
[10]文仙仙,张娜,王兴兴,等.Toll样受体4信号通路对慢性心力衰竭患者心血管事件的预测[J].心肺血管病杂志,2023,42(6):547-552.
[11]章敬玉,李志华,陈健.上呼吸道感染伴急性心力衰竭患者外周血HMGB1和TLR4水平与心脏功能的关系[J].热带医学杂志,2023,23(7):964-968.
[12]王国玉,王淼,李彤,等.慢性心力衰竭合并社区获得性肺炎患者血清TLR4表达及与PCT、NT-proBNP、氧化应激指标的相关性分析[J].中国现代医学杂志,2023,33(7):60-65.
[13]Tamargo J,Caballero R,Delpon E.New drugs in preclinical and early stage clinical development in the treatment of heart failure[J].Expert Opin Investig Drugs,2019,28(1):51-71.
[14]Dutka M,Bobinski R,Ulman-Wlodarz I,et al.Sodium glucose cotransporter 2 inhibitors:mechanisms of action in heart failure[J].Heart Fail Rev,2021,26(3):603-622.
[15]Yang J,Wise L,Fukuchi KI.TLR4 cross-talk with NLRP3 inflammasome and complement signaling pathways in Alzheimers disease[J].Front Immunol,2020,11:724.
[16]Byrne NJ,Matsumura N,Maayah ZH,et al.Empagliflozin blunts worsening cardiac dysfunction associated with reduced NLRP3(nucleotide-binding domain-like receptor protein 3) inflammasome activation in heart failure[J].Circ Heart Fail,2020,13(1):e6277.
[17]Eiringhaus J,Wünsche CM,Tirilomis P,et al.Sacubitrilat reduces pro-arrhythmogenic sarcoplasmic reticulum Ca2+ leak in human ventricular cardiomyocytes of patients with end-stage heart failure[J].ESC Heart Fail,2020,7(5):2992-3002.
[18]Koyani CN,Plastira I,Sourij H,et al.Empagliflozin protects heart from inflammation and energy depletion via AMPK activation[J].Pharmacol Res,2020,158:104870.
[19]Mustroph J,Wagemann O,Lucht CM,et al.Empagliflozin reduces Ca/calmodulin-dependent kinase Ⅱ activity in isolated ventricular cardiomyocytes[J].ESC Heart Fail,2018,5(4):642-648.
[20]Kang H,Zhang J,Zhang X,et al.Effects of sacubitril/valsartan in patients with heart failure and chronic kidney disease:a meta-analysis[J].Eur J Pharmacol,2020,884:173444.
[21]Shen J,Fan Z,Sun G,et al.Sacubitril/valsartan (LCZ696) reduces myocardial injury following myocardial infarction by inhibiting NLRP3-induced pyroptosis via the TAK1/JNK signaling pathway[J].Mol Med Rep,2021,24(3):676.
[22]Bunsawat K,Ratchford SM,Alpenglow JK,et al.Sacubitril-valsartan improves conduit vessel function and functional capacity and reduces inflammation in heart failure with reduced ejection fraction[J].J Appl Physiol (1985),2021,130(1):256-268.
[23]Luo X,Hu Y,He S,et al.Dulaglutide inhibits high glucose-induced endothelial dysfunction and NLRP3 inflammasome activation[J].Arch Biochem Biophys,2019,671:203-209.
[24]Fu Z,Mui D,Zhu H,et al.Exenatide inhibits NF-κB and attenuates ER stress in diabetic cardiomyocyte models[J].Aging (Albany NY),2020,12(9):8640-8651.
[25]Ma G,Liu Y,Wang Y,et al.Liraglutide reduces hyperglycemia-induced cardiomyocyte death through activating glucagon-like peptide 1 receptor and targeting AMPK pathway[J].J Recept Signal Transduct Res,2020,40(2):133-140.
[26]Meng J,Zhang W,Wang C,et al.The dipeptidyl peptidase (DPP)-4 inhibitor trelagliptin inhibits IL-1β-induced endothelial inflammation and monocytes attachment[J].Int Immunopharmacol,2020,89(Pt B):106996.
[27]Baylan U,Korn A,Emmens RW,et al.Liraglutide treatment attenuates inflammation markers in the cardiac,cerebral and renal microvasculature in streptozotocin-induced diabetic rats[J].Eur J Clin Invest,2022,52(9):e13807.