CTRP2与主动脉夹层发生的相关性研究
2024-06-26李旭王志维
李旭 王志维

【摘要】目的 检测C1q肿瘤坏死因子相关蛋白2(CTRP2)在患者主动脉、小鼠主动脉以及小鼠主动脉血管平滑肌细胞中的表达水平,分析其与主动脉夹层(AD)发病之间的相关性。方法 利用GEO数据库分析CTRP2在AD患者和非AD患者中的表达差异。选择2021年6月—2022年12月在武汉大学人民医院的6例确诊为急性Stanford A型AD患者的主动脉标本作为夹层组,6例心脏移植患者的主动脉作为对照组,通过Western blot法检测夹层组与对照组的CTRP2表达差异。将24只C57BL/6雄性3周龄野生型小鼠随机分为对照组和夹层组,夹层组用含有0.25%β-氨基丙腈的饲料喂养4周,取主动脉组织用石蜡包埋,标本切片后用免疫组织化学法检测CTRP2表达差异。细胞实验分为对照组和夹层组,分别用磷酸盐缓冲溶液和不同浓度的血管紧张素Ⅱ处理小鼠主动脉血管平滑肌细胞后提取细胞,用Western blot法检测CTRP2表达水平。结果 免疫组织化学和Western blot法检测结果显示CTRP2在夹层组的患者主动脉、小鼠主动脉以及小鼠主动脉血管平滑肌细胞中的表达均显著升高。结论 CTRP2蛋白表达水平在对照组和夹层组中的表达存在差异,与AD的发生具有相关性,有望成为治疗AD的新靶点。
【关键词】主动脉夹层;C1q肿瘤坏死因子相关蛋白2;治疗靶点
【DOI】10.16806/j.cnki.issn.1004-3934.2024.05.020
The Correlation Between CTRP2 and Occurrence of Aortic Dissection
【Abstract】Objective To detect the expression level of C1q tumor necrosis factor-related protein 2 (CTRP2) in the aorta of patients,aorta of mouse and mouse aortic vascular smooth muscle cells,and to analyze its correlation with the pathogenesis of aortic dissection (AD).Methods The GEO database analyzed the difference in expression of CTRP2 in patients with and without AD.The aortic specimens of patients diagnosed with acute Stanford type A AD in Renmin Hospital of Wuhan University from June 2021 to December 2022 were selected as the dissection group (n=6),and the aorta of heart transplant patients was used as the control group (n=6),and the difference in CTRP2 expression between the dissection group and the control group was detected by Western blot method.Twenty-four C57BL/6 male 3-week-old wild-type mice were randomly classified into control group and dissection group,and the dissection group was fed with feed containing 0.25% β-aminopropionitrile for 4 weeks.The aorta tissue was embedded with paraffin,and the specimens were sectioned and detected the difference in CTRP2 expression by immunohistochemistry.The cells were divided into control group and dissection group,and mouse aortic vascular smooth muscle cells were extracted after treating with PBS and different concentrations of angiotensin Ⅱ.The expression level of CTRP2 was detected by Western blot method.Results The results of immunohistochemistry and Western blot showed that the expression of CTRP2 in the aorta of patients,aorta of mouse and mouse aortic vascular smooth muscle cells in the dissected group were significantly increased.Conclusion There are differences in the expression level of CTRP2 protein in the control group and the dissection group,which is correlated with the occurrence of AD,and is expected to become a new therapeutic target for AD.
【Keywords】Aortic dissection;C1q tumor necrosis factor-related protein 2;Therapeutic target
主动脉夹层(aortic dissection,AD)是指血液通过主动脉内膜的裂口进入主动脉壁,并沿着主动脉长轴方向向下延伸,使主动脉内膜与中膜分离形成夹层,是一种致死率极高的心血管疾病。据统计,急性AD的发病率占急性主动脉综合征的80%~90%,为2.65~3.50/10万人年[1]。主动脉壁由动态变化的细胞群和细胞外基质构成,以适应人体血流动力学变化,当主动脉壁发生应激和损伤时,会导致平滑肌细胞迁移和减少,细胞外基质降解,炎症发生,构成AD发生的病理基础[2]。截至目前,手术治疗仍是AD患者唯一的治疗方式,尚无有效的药物治疗,因此寻找具有针对性的治疗靶点更为急迫。
通过利用GEO (Gene Expression Omnibus)数据库对AD患者主动脉数据集GSE57691分析发现,C1q肿瘤坏死因子相关蛋白(C1q tumor necrosis factor-related protein,CTRP)2在AD患者主动脉中的表达显著高于正常主动脉。CTRP是一类由脂肪组织分泌的激素,在结构上与脂联素极为相似。CTRP参与糖类、脂类代谢和血管扩张等生理病理过程[3],与心血管疾病和代谢性疾病,如糖尿病的发生发展密切相关[4-5]。有研究[6]显示,CTRP2在冠状动脉疾病患者中的表达明显高于健康人,并且与疾病严重程度呈正相关,表明其可能是心血管疾病发生的危险因素。尚未有研究涉及CTRP2与AD之间的联系,本研究主要通过检测CTRP2在夹层组与对照组之间的表达差异,探讨CTRP2与AD发生之间的相关性,为AD的治疗寻找新的靶点。
1 材料与方法
1.1 CTRP2在AD患者主动脉中的表达分析
通过GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)提取与AD相关的数据集GSE57691,通过GEO2R功能分析CTRP2在49例AD患者和10例非AD患者中的表达差异。
1.2 人体组织样本
随机选取2021年6月—2022年12月在武汉大学人民医院的6例确诊为急性Stanford A型AD患者的主动脉标本作为夹层组,6例心脏移植患者的主动脉标本作为对照组。纳入标准:经CT血管造影检查确诊为AD,且夹层的撕裂口位于升主动脉。排除标准:(1)合并冠心病等其他血管疾病;(2)合并肝肾等重要脏器疾病。本方案经武汉大学人民医院临床研究伦理委员会批准(审批号:20201107)。本试验中所涉及的临床标本获得了所有患者和捐赠者的同意,并签署知情同意书。
1.3 实验试剂
CTRP2抗体(Santa Cruz,美国)、
α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(塞维尔,中国) 、β-actin抗体(塞维尔,中国) 、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(三鹰,中国)、抗兔二抗(Cell Signaling Technology,美国)和抗鼠二抗(Cell Signaling Technology,美国)。
1.4 动物模型
24只3周龄野生型C57BL/6雄性小鼠均由武汉大学动物实验中心提供,饲养期间室温控制在20~25 ℃,期间小鼠均可自由进食饮水。将小鼠采用数字表法随机分入夹层组(n=12)和对照组(n=12)。夹层组小鼠用含有0.25%β-氨基丙腈的饲料喂养,对照组用正常的维持饲料喂养。期间观察小鼠的生存情况,对于死亡的小鼠立即进行解剖,将发生夹层的局部主动脉组织用4%多聚甲醛固定过夜,石蜡包埋后进行切片。造模时间达到4周后,将所有存活小鼠统一取材。动物实验通过了武汉大学人民医院实验动物福利伦理审查(审批号:20201107)。
1.5 细胞模型
将小鼠主动脉血管平滑肌细胞(mouse aortic vascular smooth muscle cells,MOVAS)放置在37 ℃、5%CO2的培养箱中,用含10%胎牛血清的DMEM培养基进行培养。显微镜下观察到细胞密度为70%时,用不含血清的培养基饥饿处理细胞12 h后,将细胞分为4组进行处理:磷酸盐缓冲溶液(phosphate buffered saline,PBS),血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)(1 μmol·L-1),Ang Ⅱ(2 μmol·L-1)和Ang Ⅱ(4 μmol·L-1)。处理36 h后收集细胞提取蛋白。
1.6 Western blot检测
将组织或细胞用PBS洗涤后,加入用蛋白酶抑制剂和放射免疫沉淀法裂解缓冲液按1:100配好的裂解液,在冰上裂解,液氮研磨仪研磨组织。在4 ℃和12 000 r/min的条件下离心20 min。将收集的上清液用二喹啉甲酸法测定蛋白浓度,剩余蛋白加入适量Loading Buffer (5×)加样缓冲液。将蛋白用10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳进行电泳,然后转印到聚偏二氟乙烯膜上,用5%的脱脂牛奶封闭2 h。加入一抗(CTRP2,1:200)并在4 ℃孵育过夜。次日,磷酸盐吐温缓冲液洗涤3次后加入相对应的抗兔IgG或抗鼠IgG,室温下孵育1 h。磷酸盐吐温缓冲液洗涤3次后用化学发光仪(Bio-Rad,美国)对膜进行显影,检测CTRP2蛋白表达信号,并用Image J软件对检测结果进行半定量分析。
1.7 免疫荧光检测
将切片在65 ℃的烘箱中烘烤2 h后,在二甲苯、无水乙醇、95%酒精、85%酒精、75%酒精和50%酒精中水化以溶解剩余石蜡,磷酸盐吐温缓冲液洗涤后用0.2%Triton溶液破膜15 min,然后在枸橼酸缓冲溶液中进行微波煮沸进行修复。自然冷却2 h后,滴加山羊血清封闭30 min,滴加一抗[CTRP2,1:50;
α-SMA,1:200],4 ℃孵育过夜。室温下复温1 h,磷酸盐吐温缓冲液洗涤3次后滴加二抗孵育1 h,磷酸盐吐温缓冲液洗涤3次。4,6-二脒基-2-苯基吲哚染核5 min,滴加抗荧光淬灭封片剂后封片,于荧光显微镜下观察。
1.8 实时荧光定量聚合酶链反应
采用TRIzol法提取各组细胞的信使RNA(messenger RNA,mRNA),并用逆转录试剂盒将提取的mRNA逆转录为互补脱氧核糖核酸,实时荧光定量聚合酶链反应(real-time fluorescent quantitative PCR,qRT-PCR)检测CTRP2 mRNA的表达水平。CTRP2的上游引物为5-GACAGGCAACCGTGGAAAAC-3,下游引物为5-AGGGTCGTAGAAGAGGCCAT-3。α-SMA的上游引物为5-GGACGTACAACTGGTATTGTGC-3,下游引物为5-TCGGCAGTAGTCACTAAGGA-3。
GAPDH的上游引物为5-AGGTCGGTGTGAACGGATTTG-3,下游引物为5-GGGGTCGTTGATGGCAACA-3。
1.9 统计学方法
采用Graghpad软件进行统计学分析,至少取3次独立实验结果。两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CTRP2在人体主动脉组织中的生物信息学表达结果
通过对GEO数据库相关数据集中49例AD患者和10例非AD患者的分析,结果显示CTRP2在AD患者的主动脉中表达较非AD患者的主动脉中表达显著增高,差异具有统计学意义(P<0.01),见图1。
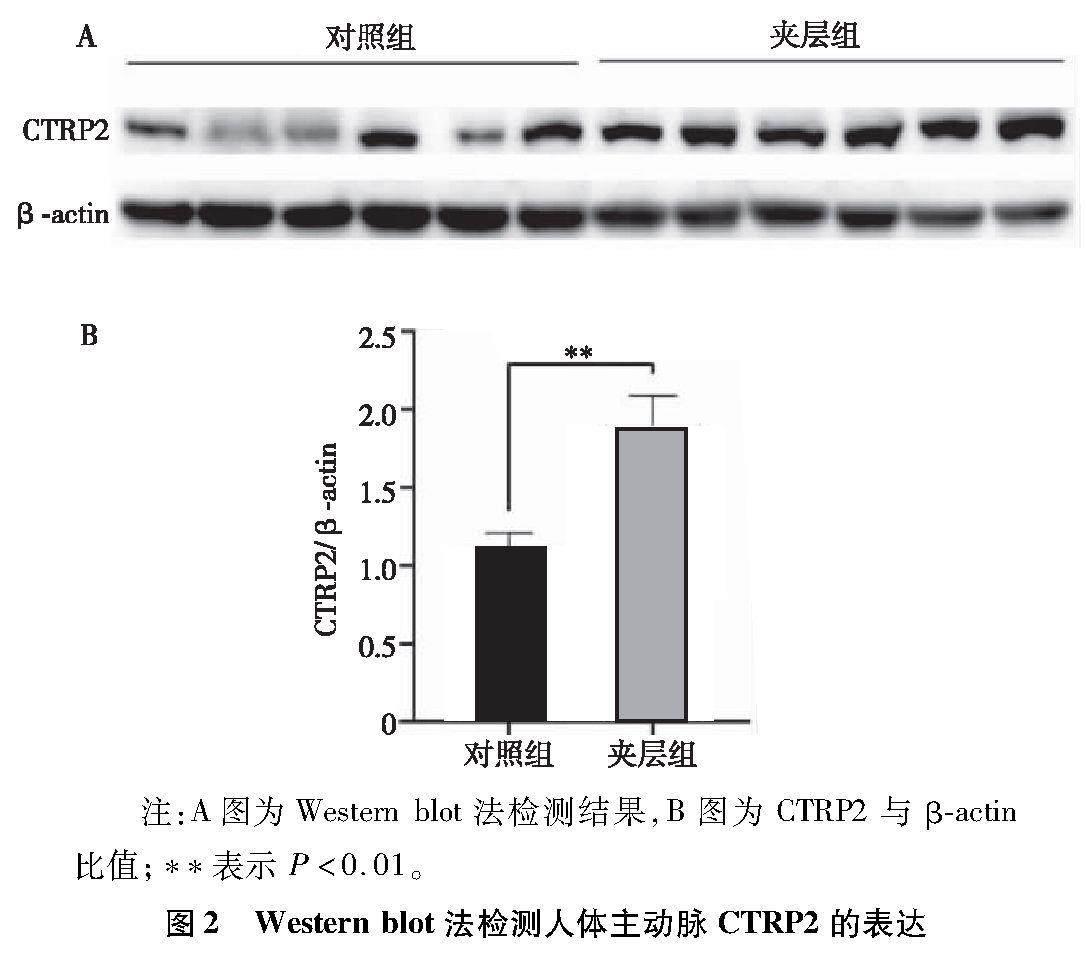
2.2 CTRP2在人体主动脉组织中的表达
通过Western blot法检测CTRP2在人体主动脉的表达水平,结果显示CTRP2在夹层组的表达显著高于对照组,通过Image J软件对结果进行半定量分析,差异有统计学意义(P<0.01),见图2。
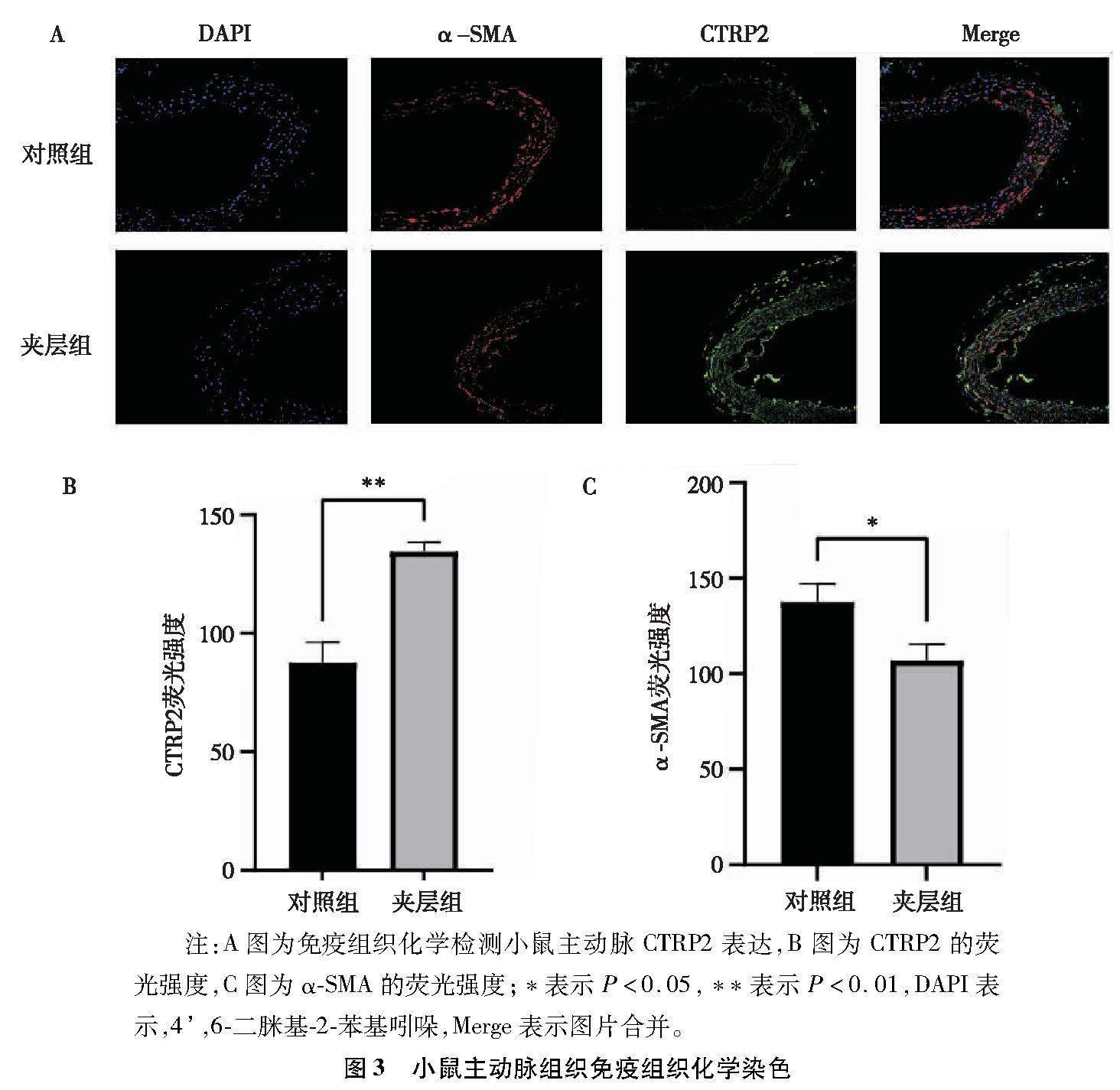
2.3 CTRP2在小鼠主动脉组织中的表达
通过免疫荧光染色反映CTRP2在小鼠主动脉的表达,结果显示夹层组的小鼠主动脉中α-SMA荧光强度较对照组减弱(P<0.05),表明夹层组MOVAS发生了从收缩型向合成型的转化。与此同时,夹层组CTRP2的荧光强度较对照组明显增强,表明CTRP2在夹层组小鼠主动脉中表达较对照组明显增高,差异有统计学意义(P<0.01),见图3。
2.4 CTRP2在MOVAS中的表达
Western blot法检测不同浓度AngⅡ处理下的CTRP2表达情况,结果显示实验组的CTRP2表达量均较对照组明显增高,并且随AngⅡ浓度升高而增高,见图4。
2.5 CTRP2 mRNA在MOVAS中的表达
qRT-PCR法检测CTRP2在MOVAS中mRNA的表达水平,结果显示与对照组相比,实验组的CTRP2 mRNA表达水平增高(P<0.01),并随着AngⅡ浓度升高而增高。同时α-SMA在MOVAS中mRNA的表达水平随着AngⅡ浓度升高而逐渐降低,表明AngⅡ可诱导MOVAS从收缩型向合成型转变,见图5。
3 讨论
AD作为病死率极高的急性心血管疾病,其病因及发病机制至今仍未明确。平滑肌细胞是主动脉中层的重要组成部分,当其发生表型转化、凋亡、迁移等,会导致主动脉中层退变,引发AD的发生。本文通过生物信息学的方法发现CTRP2在夹层患者主动脉中的表达明显升高,继而通过人体主动脉标本、动物模型以及细胞模型进行验证,进一步证实CTRP2在夹层组的表达明显高于对照组。因此推断,CTRP2与AD的发生发展存在紧密的联系。
CTRP在人体不同器官内的分布具有特异性,如在心肌组织中CTRP9表达含量较多[7],在骨骼肌中CTRP15分布最多[8]。截至目前,CTRP家族已陆续发现15个成员,结构上均具有4个共同结构域,并且其中一个与脂联素同源[9]。而脂联素主要通过增强肌肉和肝脏的胰岛素敏感性来控制全身能量代谢[10-11],这让最初针对CTRP的研究主要集中在代谢异常相关疾病,如CTRP2参与脂肪组织的分解和肝脏脂质的代谢[12],CTRP3在腺苷酸活化蛋白激酶信号通路下,可通过改善内皮细胞功能来改善糖尿病微血管病变[13]。但越来越多的研究显示CTRP家族与心血管疾病存在关联,Lu等[14]在冠状动脉疾病患者的血清、动脉内膜切除标本、主动脉粥样硬化斑块中的检测结果显示,与对照组相比,冠状动脉疾病患者的样本中CTRP1的表达量显著增高,并与疾病严重程度正相关。将小鼠CTRP1基因敲除后,小鼠的促动脉粥样硬化作用明显降低。
但目前CTRP2的具体生物学功能尚不明确,并且尚未有研究探讨CTRP2与AD发病之间是否存在联系。试验数据表明人的体重指数与CTRP2的蛋白表达量呈正相关,肥胖人群的CTRP2表达会上调。当敲除CTRP2后,小鼠脂肪组织中主要的脂溶酶在mRNA和蛋白水平上的表达增强,同时增强蛋白激酶A底物的磷酸化,促进甘油三酯等脂肪组织的分解[12]。这些结果表明CTRP2表达量增多会导致脂质代谢紊乱。而脂质代谢紊乱在AD中起着重要作用。研究[15]表明,氧化型低密度脂蛋白会诱导血管平滑肌细胞形成泡沫细胞样表型,继而通过激活核因子κB通路诱导细胞发生炎症反应,并通过活性氧和蛋白水解酶对血管壁造成损伤。所以研究推测CTRP2可能通过调控脂质代谢的方式对血管平滑肌造成损伤,进而导致AD的发生。Li等[16]在实验中发现,CTRP2可诱导心肌细胞腺苷酸活化蛋白激酶和丝氨酸/苏氨酸激酶磷酸化,增强心肌细胞对葡萄糖的摄取。因此,CTRP2在AD患者中的高表达可能与主动脉平滑肌细胞的葡萄糖摄取和能量代谢异常有关。
综上所述,本研究表明了CTRP2与AD的相关性,但其在AD发生发展中所发挥的作用尚不清楚,具体机制有待进一步研究。AD作为死亡率极高的心血管疾病,亟需新的早期诊断方法和治疗手段,本研究旨在为AD提供新的研究方向和治疗靶点。
参考文献
[1]Bossone E,Eagle KA.Epidemiology and management of aortic disease:aortic aneurysms and acute aortic syndromes[J].Nat Rev Cardiol,2021,18(5):331-348.
[2]Shen YH,Lemaire SA,Webb NR,et al.Aortic aneurysms and dissections series[J].Arterioscler Thromb Vasc Biol,2020,40(3):e37-e46.
[3]Peterson JM,Seldin MM,Tan SY,et al.CTRP2 overexpression improves insulin and lipid tolerance in diet-induced obese mice[J].PLoS One,2014,9(2):e88535.
[4]Bai B,Ban B,Liu Z,et al.Circulating C1q complement/TNF-related protein (CTRP) 1,CTRP9,CTRP12 and CTRP13 concentrations in type 2 diabetes mellitus:in vivo regulation by glucose[J].PLoS One,2017,12(2):e0172271.
[5]Si Y,Fan W,Sun L.A review of the relationship between CTRP family and coronary artery disease[J].Curr Atheroscler Rep,2020,22(6):22.
[6]Ilbeigi D,Khoshfetrat M,Afrisham R,et al.Serum C1q/TNF-related protein-2 (CTRP2) levels are associated with coronary artery disease[J].Arch Med Res,2020,51(2):167-172.
[7]Appari M,Breitbart A,Brandes F,et al.C1q-TNF-related protein-9 promotes cardiac hypertrophy and failure[J].Circ Res,2017,120(1):66-77.
[8]Seldin MM,Wong GW.Regulation of tissue crosstalk by skeletal muscle-derived myonectin and other myokines[J].Adipocyte,2012,1(4):200-202.
[9]Schffler A,Buechler C.CTRP family:linking immunity to metabolism[J].Trends Endocrinol Metab,2012,23(4):194-204.
[10]Fang H,Judd L.Adiponectin regulation and function[J].Compr Physiol,2018,8(3):1031-1063.
[11]Khoramipour K,Chamari K,Hekmatikar AA,et al.Adiponectin:structure,physiological functions,role in diseases,and effects of nutrition[J].Nutrients,2021,13(4):1180.
[12]Lei X,Wong GW.C1q/TNF-related protein 2 (CTRP2) deletion promotes adipose tissue lipolysis and hepatic triglyceride secretion[J].J Biol Chem,2019,294(43):15638-15649.
[13]Yan Z,Cao X,Wang C,et al.C1q/tumor necrosis factor-related protein-3 improves microvascular endothelial function in diabetes through the AMPK/eNOS/NO· signaling pathway[J].Biochem Pharmacol,2022,195:114745.
[14]Lu L,Zhang RY,Wang XQ,et al.C1q/TNF-related protein-1:an adipokine marking and promoting atherosclerosis[J].Eur Heart J,2016,37(22):1762-1771.
[15]Chen Z,Xue Q,Cao L,et al.Toll-like receptor 4 mediated oxidized low-density lipoprotein-induced foam cell formation in vascular smooth muscle cells via Src and Sirt1/3 pathway[J].Mediators Inflamm,2021,2021:6639252.
[16]Li L,Aslam M,Siegler BH,et al.Comparative analysis of CTRP-mediated effects on cardiomyocyte glucose metabolism:cross talk between AMPK and Akt signaling pathway[J].Cells,2021,10(4):905.
