基于网络药理学探讨钩藤.桑寄生治疗原发性高血压的作用机制
2024-06-24吴雯丹陈洪黄桂琼
吴雯丹 陈洪 黄桂琼

摘要 目的: 基于网络药理学探讨钩藤.桑寄生治疗原发性高血压的潜在作用机制。 方法: 通过中药系统药理学数据库与分析平台(TCMSP)检索并筛选出钩藤、桑寄生药对的药物活性成分及作用靶点。利用基因名片数据库(GeneCards)及DisGeNET数据库筛选原发性高血压的疾病靶点。利用韦恩平台(Venny)取活性成分作用靶点和疾病靶点交集,得到共同靶点。通过Cytoscape 3.9.1软件构建“药物.活性成分.靶点.疾病”网络。通过STRING数据库构建蛋白质相互作用(PPI)网络;利用Cytoscape CentisCape 2.2插件提取核心靶点进行分析,并构建“有效成分.核心靶点”网络图。利用DAVID数据库对核心靶点进行基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析,并将富集结果可视化。 结果: 共筛选出钩藤.桑寄生的活性成分32个,作用于原发性高血压的主要靶点有丝氨酸/苏氨酸蛋白激酶B1(AKT1)、白细胞介素(IL).6、肿瘤坏死因子(TNF)、血管内皮生长因子A(VEGFA)等;主要集中于晚期糖基化终末产物(AGE)/糖基化终末产物受体(RAGE)信号通路、脂质与动脉粥样硬化通路、流体剪切应力和动脉粥样硬化通路、TNF信号通路、IL.17信号通路等。 结论: 钩藤.桑寄生药对可通过调节AKT1、IL.6、TNF、VEGFA等核心靶点调控AGE/RAGE、脂质和动脉粥样硬化、流体剪切应力和动脉粥样硬化、TNF、IL.17等多条信号通路,发挥治疗原发性高血压的作用。
关键词 原发性高血压;钩藤;桑寄生;网络药理学;作用机制
doi: 10.12102/j.issn.1672.1349.2024.09.001
Mechanism of Uncaria and Mulberry Parasitism for the Treatment of Essential Hypertension Based on Network Pharmacology
WU Wendan, CHEN Hong, HUANG Guiqiong
Huizhou Hospital, Guangzhou University of Chinese Medicine, Huizhou 516000, Guangdong, China
Corresponding Author HUANG Guiqiong, E.mail: hgqiong2005@126.com
Abstract Objective: To explore the potential mechanism of action of uncaria and mulberry parasitism for treating essential hypertension based on network pharmacology. Methods: Traditional Chinese medicine(TCM) system pharmacological database(TCMSP) was used to retrieve and screen the active drug components and targets of uncaria and mulberry parasitism.GeneCards and DisGeNET databases were used to search for disease targets of essential hypertension.The intersection of active ingredient components and disease targets were selected by Vennny platform.The “drug.active ingredient.target.disease” network diagram was constructed using Cytoscape 3.9.1 software.The protein interaction(PPI) network was constructed through the STRING online platform.Cytoscape CentisCape 2.2 plug.in was used to extract core targets for analysis and then constructed the “active ingredient.core target” network diagram.The DAVID database was used to perform Gene Ontology(GO) and the Kyoto Encyclopedia of Genes and Genomes(KEGG) enrichment analysis of core targets,and the enrichment results were visualized. Results: A total of 32 active ingredients of uncaria and mulberry parasitism were screened,and the main targets of essential hypertension were serine/threonine protein kinase B1(AKT1),interleukin(IL).6,tumor necrosis factor(TNF) and vascular endothelial growth factor A(VEGFA),which mainly focused on advanced glycation end product(AGE)/receptor for advanced glycation end products(RAGE) signaling pathway,lipid and atherosclerosis pathway,fluid shear stress and atherosclerosis pathway,TNF signaling pathway,IL.17 signaling pathway,etc. Conclusion: Uncaria and mulberry parasitism can regulate AGE/RAGE,lipid and atherosclerosis,fluid shear stress,atherosclerosis,TNF,IL.17,and other signaling pathway by regulating AKT1,IL.6,TNF VEGFA and other core targets,and play some role in the treatment of essential hypertension.
Keywords essential hypertension; uncaria; mulberry parasitism; network pharmacology; mechanism
原发性高血压(essential hypertension,EH)为体循环动脉血压持续升高的心血管综合征,同时也属于 代谢性疾病范畴。《中国心血管健康与疾病报告2021》指出高血压患病率呈逐年上升趋势,目前我国高血压患病人数大约有2.45亿人,而原发性高血压患病率占全部高血压人群的90%~95% [1] 。因其患病率高、控制率低、患心血管病风险高等特点,已经成为世界范围内心脑血管疾病及过早死亡的高风险因素之一 [2] 。血压的不断增高往往会使许多重要的组织器官如心、脑、肾、视网膜及血管的功能和结构发生变化,同时也会造成代谢功能紊乱。临床上主要通过西药控制血压,长期服用易产生一系列问题。中医药在平稳控制原发性高血压病人的血压,改善其临床症状,防止心、脑、肺、肾等重要脏器受损,提高生活质量方面发挥着重要作用。刘巍等 [3] 认为肝肾阴虚为高血压发病之本,标为“痰浊”“瘀血”等瘀阻脉络,故滋养肝肾降压是治疗原发性高血压的关键。钩藤归肝经,桑寄生属肾经,二者在平肝降压的同时,又起到了补益肝肾、活血化瘀的作用。钩藤.桑寄生药对是惠州市中医医院陈洪教授临床治疗原发性高血压的常用药对之一,其长期的临床观察发现该药对辅助西药治疗可平稳降压,同时也可改善头晕、头痛、腰膝酸软等临床症状。王心意等 [4] 分析国医大师治疗高血压用药规律发现,钩藤.桑寄生的用药频次为131次,频率为58.91%。现代药理学研究表明
,桑寄生具有一定的抗炎镇痛、降血压、降血脂、抗氧化、保护神经等药理作用,在治疗炎症、心脑血管系统疾病方面具有较好的临床应用前景,值得进一步研究 [5] 。研究发现,钩藤主要活性成分钩藤碱、异钩藤碱、钩藤总碱均有降压作用,降压原理可能是通过抑制血管运动中枢,扩张周围血管,降低心排血量,减小阻力以达到降低血压、减慢心率的目的 [6] 。
近年来,中药单药及复方多成分、多靶点、多途径治疗高血压病及其并发症的机制被逐渐揭示,但是钩藤.桑寄生治疗原发性高血压的作用机制尚未明确。本研究在现代药理学研究结果的基础上,运用网络药理学方法在分子水平揭示钩藤.桑寄生与原发性高血压之间的关系,挖掘药物的有效活性成分,预测其治疗原发性高血压的主要靶点及通路,为后续研究提供理论依据。
1 资料与方法
1.1 钩藤.桑寄生主要活性成分筛选及对应靶点预测
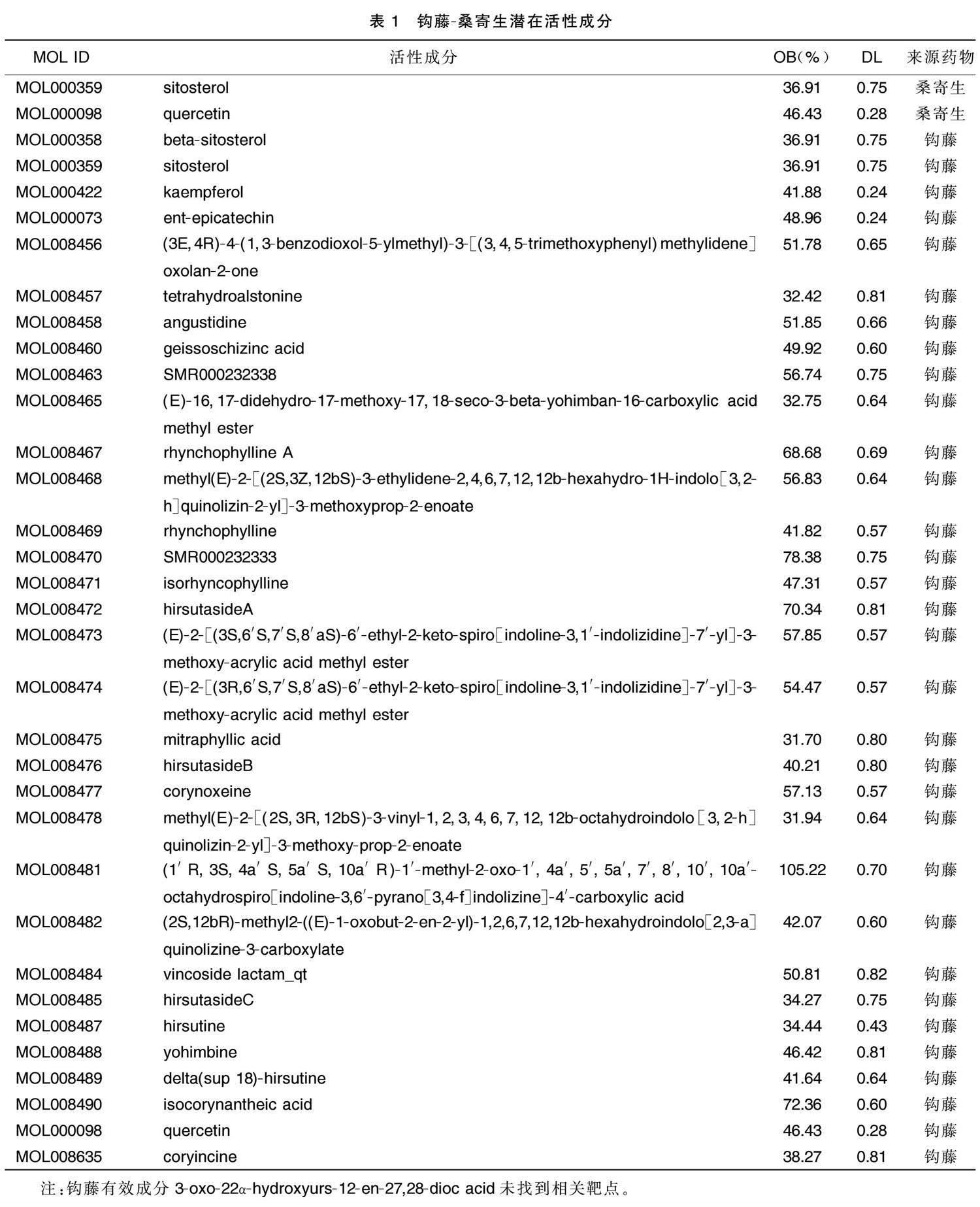
分别以钩藤、桑寄生为检索词,以口服生物利用度(OB)≥30%和药物相似性(DL)≥0.18为筛选条件,在中药系统药理学数据库与分析平台(TCMSP)数据库中检索主要活性成分。然后利用MOL ID号在TCMSP数据库中预测对应靶点,剔除未检索出相关靶蛋白的成分。借助UniProt蛋白质数据库检索人类相关基因,检索条件限定为“Reviewed”“Human”。将上述得到的靶点蛋白与人类相关基因相映射,获得药物的相关靶点基因。
1.2 疾病相关靶点的获取
以“essential hypertension”为检索词,检索基因名片数据库(GeneCards)和DisGeNET数据库中原发性高血压的相关靶点,然后以Score值大于中位数为临界值,分别对结果进行筛选合并、去重,获得原发性高血压相关靶点。
1.3 交集靶点筛选及韦恩图的绘制
在Venn 2.1.0平台上传药物和疾病相关靶点基因名称,将药物与疾病相关靶点取交集,并绘制韦恩图。
1.4 药物.有效活性成分.靶点.疾病网络图的构建
将交集靶点与药物的主要活性成分相映射,获得有效活性成分;将有效活性成分与交集靶点导入Cytoscape 3.9.1软件,构建“药物.有效活性成分.靶 点.疾病”网络图,并利用“Network Analyzer”进行 分析。
1.5 交集靶点蛋白互作网络关系及“有效活性成分.核心靶点”网络图的构建
将交集靶点导入STRING在线分析平台,限定物种为“Homo sapiens”,互作蛋白评分>0.4,得到蛋白 质相互作用(PPI)关系,将所得数据导入Cytoscape 3.9.1 软件构建交集靶点PPI网络图,并进行可视化分析。利用CentisCape 2.2插件计算各节点的度值(Degree),并以Degree值大于平均值为筛选标准,得到钩藤.桑寄生治疗原发性高血压的核心靶点,并构建“有效活性成分.核心靶点”网络。
1.6 基因本体(GO)功能富集分析与京都基因和基因组百科全书(KEGG)通路富集分析
利用DAVID数据库对交集靶点进行GO功能与KEGG通路富集分析,将物种限定为“Homo sapiens”。以 P <0.05为筛选标准对GO结果进行筛选,并分别将生物过程(BP)、细胞组成(CC)、分子功能(MF)3个条目的前20条结果导入微生信在线平台(www.bioinformatics.com.cn)绘制成气泡图展示;同时以 P <0.05且错误发现率(FDR)<0.5为限定条件对KEGG结果进行筛选,并选取相关通路前20条,同样通过微生信在线绘图网站进行可视化展示。
2 结 果
2.1 钩藤.桑寄生药对有效活性成分及靶点预测结果
在TCMSP数据库共检索到111个活性成分,其中钩藤65个、桑寄生46个。以OB≥30%、DL≥0.18为筛选标准,剔除未预测到相关靶点的有效活性成分(MOL ID:MOL008455),筛选获得钩藤有效活性成分32个、桑寄生有效活性成分2个,合并去重后,共获得32个主要的活性成分。详见表1。通过TCMSP数据库预测有效活性成分的靶点,检索到钩藤对应的靶点792个,桑寄生相关靶点157个,相对应靶点共949个。利用UniProt数据库将获得的949个靶点蛋白,转换成基因名称,得到943个主要靶点基因(6个靶蛋白未能找到基因名称),去除重复项后得到药物最终目标靶点209个。
2.2 原发性高血压相关靶点
通过检索GeneCards和DisGeNET数据库,分别检索获得9 132、445个靶点,以Score大于中位数为界值,筛选合并,删除重复靶点后共获得4 581个疾病相关靶点。
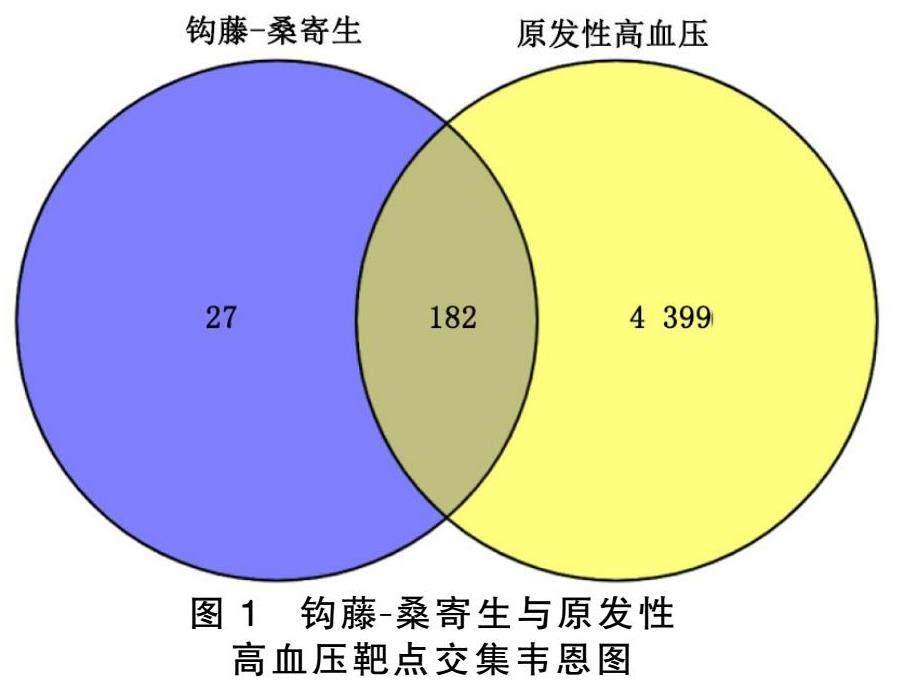
2.3 钩藤.桑寄生与原发性高血压靶点交集韦恩图
分别将钩藤.桑寄生209个相关靶点基因、原发性高血压的4 581个疾病靶点导入至Venny 2.1.0数据库进行分析,获得182个交集靶点,并制成Venn图展示(见图1)。说明钩藤.桑寄生可能通过这些靶点参与治疗原发性高血压。
2.4 药物.有效活性成分.靶点.疾病调控网络的构建
基于所得数据,运用Cytoscape 3.9.1软件构建药物.有效活性成分.靶点.疾病网络关系(见图2)。该网络关系图中共包含216个节点、867条边,节点分别代表钩藤、桑寄生、有效活性成分、疾病及其共同靶点,而边则表示相互作用关系;设置红色菱形代表疾病,紫色三角形代表钩藤.桑寄生,绿色六边形代表有效活性成分,蓝色圆形代表靶点基因。β.谷甾醇、槲皮素为钩藤与桑寄生共有的活性成分,其中,槲皮素对应140个靶点,山柰酚对应54个靶点。说明钩藤.桑寄生是通过多种成分、多种靶点来发挥平稳降压作用,其中槲皮素、山柰酚、β.谷甾醇可能是核心成分。
2.5 PPI网络图的构建与核心靶点的筛选
将获得的182个交集靶点上传至STRING 11.5 数据库,限定物种为“Homo sapiens”,互作蛋白评 分>0.4,剔除游离节点,将所得数据导入至Cytoscape 3.9.1软件,构建PPI网络(见图3)。网络中包括180个节点、6 640条边;利用CentisCape 2.2插件进行分析,得出Degree值,节点越大,颜色越深,Degree值越高。以Degree值>36.89为筛选条件,获得钩藤.桑寄生治疗原发性高血压的78个核心靶点(见图4),并构建“有效活性成分.核心靶点”网络(见图5)。78个核心靶点中,苏氨酸蛋白激酶1(AKT1)、肿瘤蛋白p53(TP53)、白细胞介素(IL).6、肿瘤坏死因子(TNF)、血管内皮生长因子(VEGFA)、半胱氨酸蛋白酶3(CASP3)位居前列,其Degree值分别为125,113,111,111,106,100,提示这些靶点可能为钩藤.桑寄生治疗原发性高血压的关键靶点。
2.6 GO功能富集分析与KEGG通路富集分析
将182个交集靶点导入至DAVID数据库进行GO功能和KEGG通路富集分析。结果显示,GO共富集到1 134个结果,以 P <0.05为筛选标准,得到BP条目697条,CC条目79条,MF条目136条;其中BP主要涉及对药物的反应、基因表达的正向调控、RNA聚合酶Ⅱ对转录的正向调节、对细胞外刺激的反应等;CC主要涉及细胞外间隙、含蛋白质复合物、质膜等;MF主要涉及酶结合、蛋白质结合和相同的蛋白质结合等。分别选取BP、CC、MF条目前20条制成气泡图展示(见图6~图8)。KEGG通路富集得到172条结果,筛选 P <0.05且FDR<0.5的主要通路,共有161条,将前20条通路绘制成气泡图展示(见图9)。进一步分析数据发现,钩藤.桑寄生治疗原发性高血压的靶点主要富集在
糖基化终末产物/糖基化终末产物受体 (AGE/RAGE)、丝裂原活化蛋白激酶(MAPK)、TNF、IL.17 等信号通路;疾病相关通路如脂质和动脉粥样硬 化(lipid and atherosclerosis)、流体剪切应力和动脉粥样硬化(fluid shear stress and atherosclerosis)等,提示钩藤.桑寄生可能通过以上通路发挥治疗原发性高血压的作用。
3 讨 论
原发性高血压归属于中医学“眩晕”“头痛”等范畴,由于部分原发性高血压病人无任何不适,仅以血压升高为主,故有学者认为也可归属于“脉胀”范畴 [7] 。因情志失调、饮食失节、久病过劳、年老体虚等引起肝肾阴虚、肝阳上亢、痰瘀互结而发为眩晕、头痛 [8.9] 。其病位多在肝、肾,病机特点为本虚标实。因此,钩藤、桑寄生二者配伍,共奏滋肾养肝之功,可有效调节机体阴阳,控制血压。
本研究分析显示,钩藤.桑寄生治疗原发性高血压的有效活性成分主要为槲皮素、β.谷甾醇和山柰酚等,说明这些有效活性成分可能是核心成分。临床研究发现,高血压与氧化应激、血管内皮功能障碍、慢性炎症、胰岛素抵抗、糖脂代谢紊乱密切相关 [10.11] 。其中,氧化应激和慢性炎症是引起血管内皮损伤和血管重构硬化的主要原因 [12] 。内皮受损、炎症与氧化应激三者密切相关。研究证实,抗氧化应激能够减轻血管内皮损伤,促进血管重塑,减少高血压病的发生 [13] 。血管内皮细胞通过合成和释放血管平滑肌舒张因子一氧化氮(NO)或收缩因子内皮素.1(ET.1)从而维持血管舒缩平衡,而内皮功能障碍引起血管舒缩失常是高血压的重要特征。还原型辅酶Ⅱ(NADPH)氧化酶(NOX)是体内促进氧自由基(ROS)生成的底物,王敏等 [14] 研究发现,槲皮素及其代谢产物可通过抑制血管NOX活性,减少ROS生成,抵抗氧化损伤,从而抑制血管内皮氧化刺激,提高血管抗氧化能力,预防和治疗高血压引起的血管肥厚性重构。与此同时,可有效下调抑制性κB激酶β(IKKβ)与核因子.κB(NF.κB)的磷酸化水平,降低IL.6和TNF.α的蛋白合成,从而发挥抑制内皮炎性反应的功能。因此,槲皮素可能通过抗炎、抗氧化应激从而改善内皮功能等多种生物活性过程参与治疗高血压病。研究发现,β.谷甾醇可通过抗炎、调节脂质代谢等途径调节血压 [15] ,这可能与β.谷甾醇抑制MAPK等炎症信号相关通路的活化,降低IL.6、TNF.α等炎性细胞因子的分泌和表达水平 [16] ,从而影响原发性高血压发生发展的病理过程有关。山柰酚具有广泛的药理活性,包括抗氧化、抗炎、心脏保护、改善血脂和葡萄糖耐量等 [17.18] ,其可通过降低炎性因子如TNF.α、IL.1β和细菌内毒素对血管内皮细胞的刺激,减少血管细胞黏附分子.1(VCAM.1)、细胞间黏附分子.1(ICAM.1)和内皮细胞选择素等黏附分子的表达,阻止动脉粥样硬化斑块的形成和进一步发展 [19] 。进一步证实钩藤.桑寄生药对可能通过槲皮素、β.谷甾醇和山柰酚等有效活性成分参与治疗原发性高血压。
本研究发现,钩藤.桑寄生调控原发性高血压的核心靶点主要是AKT1、IL.6、TNF、VEGFA、TP53等,这些靶点主要涉及细胞增殖与凋亡、炎症应答、血管内皮生长因子,与目前研究发现的原发性高血压发病机制密切相关。慢性炎症通过损伤血管内皮,引起内皮功能障碍,最终导致血管重塑阻力增加而血压升高 [20] 。AKT1参与代谢、增殖、细胞存活和凋亡等多种生物学过程,对炎症反应的激活至关重要 [21] 。也有研究认为高血压的发生机制与巨噬细胞极化相关 [22] 。脂多糖(LPS)等外来因素激活Toll样受体4(TLR4)信号转导途径,刺激巨噬细胞表达并向M1转化,使更多的TNF、IL.17等炎性细胞因子,促进血管炎症反应,对高血压的发展起促进作用 [23] 。而研究发现,磷脂酰肌醇3激酶(PI3K)/AKT1信号通路可通过影响巨噬细胞极化 [24] 、脂质代谢 [25] 、自噬 [26] 等多种功能参与治疗原发性高血压。
通过分析GO条目可以发现,钩藤.桑寄生在氧化应激的反应、细胞外刺激的反应、基因表达的正向调控、RNA聚合酶Ⅱ对转录的正向调节等方面具有特异性作用。这些生物过程均与氧化应激、炎症应答及代谢调节相关。对182个交集靶点进行KEGG通路分析,在剔除不相关的信号通路后,发现钩藤.桑寄生主要可能通过脂质和动脉粥样硬化通路、流体剪切应力和动脉粥样硬化通路以及一些炎症相关通路,包括AGE/RAGE信号通路、MAPK、TNF信号通路、IL.17信号通路等途径发挥对原发性高血压的作用。
脂质和动脉粥样硬化、流体剪切应力和动脉粥样硬化两条信号通路主要参与动脉粥样硬化斑块的形成与发展。血流剪切应力代表血液流动在血管壁内皮表面施加的摩擦力,在血管生物学中起着核心作用,并有助于动脉粥样硬化的进展。研究表明,在血流紊乱的动脉区域,低血流剪切应力通过激活PI3K/AKT信号通路,抑制内皮型一氧化氮合酶(eNOS)的合成来降低NO的生物利用度,从而诱导内皮细胞分泌内皮素、血管紧张素转换酶、炎症介质等,促进细胞增生、脂质蓄积和白细胞黏附,使内皮细胞受损,导致动脉粥样硬化的发生。因此,低血流剪切应力可诱导内皮细胞功能紊乱,分泌内皮素、炎性介质等因子,促使动脉粥样硬化的发生及斑块形成。另外,低的和振荡的内皮剪切应力还可通过复杂的机械接收和机械转导过程激活细胞因子介导的NF.κB信号通路,从而诱导促动脉粥样硬化基因的表达,致动脉粥样硬化内皮表型和早期动脉粥样硬化斑块的形成 [27] 。低血流剪切应力同时可导致内质网结合的转录因子固醇调节元件结合蛋白(SREBPs)持续激活,上调编码低密度脂蛋白(LDL)受体、胆固醇合成酶和脂肪酸合成酶的基因表达,导致内皮细胞对LDL的参与和合成增加,最终促进LDL在内皮下蓄积。活化的SREBPs还能诱导IL.18,在局部炎症过程中发挥额外的作用 [28] 。氧化型低密度脂蛋白(ox.LDL)是导致动脉粥样硬化、高血压病的危险因素 [29] 。脂质和动脉粥样硬化通路可促进LDL的摄取、合成以及渗入内膜下,并促进氧化应激增加ox.LDL的产生。因此,脂质和动脉粥样硬化通路、流体剪切应力和动脉粥样硬化通路可通过抑制内皮炎症、调节脂质代谢等抑制动脉粥样硬化斑块的形成,从而发挥抗高血压的作用。
AGE/RAGE、MAPK、TNF、IL.17信号通路主要参与炎症反应。研究表明,AGE/RAGE信号通路可激活NOX氧化酶,减少内皮eNOS表达和NO生成,使体内活性氧产生增多,诱导内皮细胞释放多种炎性因子,从而引发血管内皮炎症反应和氧化应激;还可激活 MAPK信号通路,使NF.κB磷酸化,导致ET.1、 ICAM.1、E.选择素和组织因子等的表达增加,上调氧化应激与炎症反应,诱发内皮功能障碍 [30] 。研究表明,AGEs可通过激活巨噬细胞中CD 36 分子介导ox.LDL内吞,减少胆固醇向高密度脂蛋白转化,进而影响脂质代谢的动态平衡,最终导致巨噬细胞在内脂质大量蓄积,形成泡沫细胞,进而引发血管炎症和血管内皮细胞增殖,导致动脉粥样硬化和血管功能障碍 [31] 。AGEs与受体RAGE结合,相互作用激活下游信号转导通路,如细胞 内氧自由基、MAPK和细胞外信号调节激酶(ERK)1/2, 促使相关基因表达及细胞内ROS大量生成,导致炎症反应、氧化应激的发生 [32] 。TNF、IL.17在参与炎症反应的调控过程中能够引起血管内皮细胞炎症性病理损害,进而直接或间接地导致血压升高。
胰岛素抵抗引起的血管内皮细胞受损、脂质代谢紊乱等病理变化与高血压的发生发展密切相关。研究发现,Janus激酶(JAK)/信号转导和转录激活因子(STAT)信号通路在全身炎症反应和胰岛素抵抗过程 中发挥重要作用 [33] 。JAK/STAT信号通路是AGE/RAGE 的下游通路,其可调控体内各种细胞因子、激素和生长因子的下游介质,可调节能量消耗、胰岛素敏感性等多种代谢过程,是治疗代谢综合征、糖尿病的有效靶点。AGE/RAGE信号通路的激活可导致炎症反应、氧化应激、血管平滑肌的细胞代谢。于嘉祥等 [34] 研究证明,通过抑制AGE/RAGE通路中的AGEs、RAGE等相关蛋白的表达,可以发挥抗炎、抑制氧化应激的作用,进而改善胰岛素抵抗,起到预防高血压的作用。上述研究表明,钩藤.桑寄生中的有效活性成分可能通过以上途径调控炎症反应、抗氧化应激、调节内皮功能、改善糖脂代谢等方面参与治疗原发性高血压。
4 小 结
综上所述,本研究推测钩藤.桑寄生可能通过槲皮素、β.谷甾醇和山柰酚等核心成分,作用于AKT1、IL.6、TNF、TP53等核心靶点,通过脂质和动脉粥样硬化、流体剪切应力和动脉粥样硬化、AGE/RAGE、MAPK、TNF、IL.17等核心通路,发挥治疗原发性高血压的作用。本研究基于网络药理学揭示了钩藤.桑寄生多成分、多靶点、多通路联合作用调控血压的潜在机制,为后续研究钩藤.桑寄生提供一定的理论依据。
参考文献:
[1] 马丽媛, 王增武,樊静,等.《中国心血管健康与疾病报告2021》关于中国高血压流行和防治现状[J].中国全科医学,2022,25(30):3715.3720.
[2] YIN R Y, YIN L S,LI L, et al. Hypertension in China:burdens,guidelines and policy responses:a state.of.the.art review[J].Journal of Human Hypertension,2022,36:126.134.
[3] 刘巍, 熊兴江,王阶.论六味地黄丸在高血压病治疗中的运用[J].中华中医药杂志,2013,28(11):3329.3333.
[4] 王心意, 鞠建庆,徐璇,等.基于数据挖掘的国家级名老中医治疗高血压用药规律研究[J].中西医结合心脑血管病杂志,2020,18(17):2753.2758.
[5] 管俊, 崔瑛.桑寄生药理作用及临床应用研究进展[J].河北中医,2017,39(3):460.463.
[6] 谢林虎, 王华东,宋丹华,等.钩藤碱对心血管系统的药理作用研究进展[J].科技视界,2017(1):65.66.
[7] 王清海, 陶军.创新中医脉胀理论,推动高血压中西医结合防治[J].中华高血压杂志,2018,26(2):123.125.
[8] 孟醒, 熊兴江.《高血压中医诊疗专家共识》解读[J].中国实验方剂学杂志,2022,28(11):192.205.
[9] 刘如松, 严萍.从肝肾阴虚论治高血压性眩晕[J].中外医学研究,2022,20(29):173.176.
[10] 万基伟, 樊小农,王舒,等.氧化应激与高血压发病机制研究[J].中医学报,2015,30(1):101.104.
[11] 丁存涛, 周亚群,孙希鹏,等.糖脂代谢对原发性高血压病人血管内皮功能的影响[J].首都医科大学学报,2017,38(3):401.405.
[12] FRANCO C, SCIATTI E,FAVERO G, et al. Essential hypertension and oxidative stress:novel future perspectives[J].International Journal of Molecular Sciences,2022,23(22):14489.
[13] SINHA N, DABLA P K.Oxidative stress and antioxidants in hypertension..a current review[J].Current Hypertension Reviews,2015,11(2):132.142.
[14] 王敏, 刘保林,国旭丹.槲皮素及其代谢物抑制氧化应激与炎症[J].食品科学,2013,34(15):256.260.
[15] 肖志彬, 刘小雷,成日青,等.β.谷甾醇对阿司匹林致胃黏膜损伤副作用及其药理作用的影响[J].中国实验方剂学杂志,2016,22(1):148.152.
[16] 陈元堃, 曾奥,罗振辉,等.β.谷甾醇药理作用研究进展[J].广东药科大学学报,2021,37(1):148.153.
[17] OCHIAI A, BEN OTHMAN M,SAKAMOTO K.Kaempferol ameliorates symptoms of metabolic syndrome by improving blood lipid profile and glucose tolerance[J].Bioscience,Biotechnology,and Biochemistry,2021,85(10):2169.2176.
[18] ASHRAFIZADEH M ,TAVAKOL S,AHMADI Z, et al. Therapeutic effects of kaempferol affecting autophagy and endoplasmic reticulum stress[J].Phytotherapy Research,2020,34(5):911.923.
[19] CRESPO I, GARCA.MEDIAVILLA M V,GUTIRREZ B, et al. A comparison of the effects of kaempferol and quercetin on cytokine.induced pro.inflammatory status of cultured human endothelial cells[J].The British Journal of Nutrition,2008,100(5):968.976.
[20] 徐腾飞, 刘巍.高血压与炎症反应的关系[J].国际免疫学杂志,2013,36(5):347.350.
[21] 张玉洁, 裴丽霞,周俊灵,等.电针调节AKT/NF.κB信号通路炎症反应 修复受损肠黏膜屏障的机制研究[J].中医药信息,2021,38(7):9.17.
[22] 陈达. 高血压发病机制研究进展[J].医学理论与实践,2020,33(22):3722.3724.
[23] 张群辉, 马骏,郭琰,等.巨噬细胞极化在心血管疾病中的作用及应用研究进展[J].现代免疫学,2020,40(1):52.56.
[24] 阮静瑶, 陈必成,张喜乐,等.巨噬细胞M1/M2极化的信号通路研究进展[J].免疫学杂志,2015,31(10):911.917.
[25] 王晓卿. PI3K/AKT信号通路对动脉粥样硬化的调节作用及其机制的研究[D].大连:大连医科大学,2015.
[26] 柳鹏, 陈祺,葛嘉媛,等.自噬对巨噬细胞极化的影响及其与慢性炎症性疾病的关系[J].临床急诊杂志,2018,19(10):719.722.
[27] 张焰, 马虹,郑振声.血管内皮细胞的剪切应力信号转导机制与动脉粥样硬化[J].中国动脉硬化杂志,2005,13(4):513.516.
[28] CHATZIZISIS Y S, COSKUN A U,JONAS M, et al. Role of endothelial shear stress in the natural history of coronary atherosclerosis and vascular remodeling:molecular,cellular,and vascular behavior[J].Journal of the American College of Cardiology,2007,49(25):2379.2393.
[29] 樊碧娆, 姚伟娟.氧化型低密度脂蛋白受体在动脉粥样硬化发病机制中的作用[J].中国病理生理杂志,2020,36(10):1897.1901.
[30] KAY A M, SIMPSON C L,JR STEWART J A.The role of AGE/RAGE signaling in diabetes.mediated vascular calcification[J].Journal of Diabetes Research,2016,2016:6809703.
[31] ISODA K, FOLCO E J,SHIMIZU K, et al. AGE.BSA decreases ABCG1 expression and reduces macrophage cholesterol efflux to HDL[J].Atherosclerosis,2007,192(2):298.304.
[32] MANIGRASSO M B, JURANEK J,RAMASAMY R, et al. Unlocking the biology of RAGE in diabetic microvascular complications[J].Trends in Endocrinology and Metabolism,2014,25(1):15.22.
[33] 王冠怡, 许岚.胰岛素抵抗与高血压的关系[J].国际内分泌代谢杂志,2013,33(1):36.39.
[34] 于嘉祥, 张瀚文,杨宇峰,等.基于AGEs.RAGE信号通路研究中药复方益糖康改善大鼠骨骼肌胰岛素抵抗的作用机制[J].中华中医药学刊,2022,40(6):25.30.
(收稿日期:2023.04.25)
(本文编辑 邹丽)
