侵染苘麻的菜豆金色黄花叶病毒的鉴定及基因组结构分析
2024-06-08杜江马振男崔丽艳王德富牛颜冰
杜江 马振男 崔丽艳 王德富 牛颜冰


摘要
为明确引起我国山西晋中地区苘麻葉片表现皱缩和花叶症状的病原物及其基因组分子特征,本研究利用双生病毒简并引物扩增获得病毒基因组部分序列,经测序、比对后设计
特异性引物扩增病毒基因组序列,进而通过生物信息学方法构建系统发育树并进行序列分析。结果表明:引起苘麻叶片皱缩、花叶的病原物为番茄黄化曲叶病毒(tomato yellow leaf curl virus,TYLCV),将该分离物命名为TYLCVAbu,GenBank登录号为OP293347,但未扩增到β卫星。该病毒DNAA基因组全长为2 782 bp,含有6个开放阅读框。TYLCVAbu分离物与TYLCV茄子分离物KSQ13(GenBank登录号KC428753)的核苷酸序列一致性最高,为9899%,其中C4和V2编码的蛋白变异较大。重组结果分析显示,分离物TYLCVAbu是由TYLCVF(GenBank登录号KY971326)和TYLCVKSQ13重组得到,重组区域为其基因组2 617-2 782 nt区域。这是首次从苘麻样品中扩增到TYLCV全基因组序列并进行分析。
关键词
苘麻; 菜豆金色黄花叶病毒属; 序列分析
中图分类号:
S 43241
文献标识码: A
DOI: 10.16688/j.zwbh.2022706
Molecular identification and genome sequence analysis of begomoviruses infecting Abutilon theophrasti
DU Jiang1, MA Zhennan1, CUI Liyan2, WANG Defu1, NIU Yanbing1*
(1. College of Life Science, Shanxi Agricultural University, Taigu 030801, China; 2. College of Grassland Science,
Shanxi Agricultural University, Taigu 030801, China)
Abstract
In order to clarify the pathogen and the genomic sequence characteristics that causing leaf wrinkling and mosaic of Abutilon theophrasti. The samples with typical symptoms were collected from Jinzhong area of Shanxi province, the genome sequence of the virus was amplified using geminivirus degenerate primers and then designed specific primers. The phylogenetic tree was constructed and the virus genomic sequence was analyzed using bioinformatics methods. The results showed that the pathogen causing the leaf wrinkling and mosaic symptoms of A.theophrasti was tomato yellow leaf curl virus (TYLCV), named TYLCVAbu (GenBank acc. noOP293347), but no beta satellite amplification was obtained. The viral DNAA genome was 2 782 bp in length and contained six open reading frames. The TYLCVAbu sequence shared the highest identity (9899%) with that of the TYLCV eggplant isolate KSQ13 (KC428753), but the proteins encoded by its C4 and V2 genes shared low identities with those of the other virus isolates in GenBank. The results of recombination analysis showed that the TYLCVAbu isolate was recombined from the TYLCVF isolate (KY971326) and the TYLCVKSQ13 isolate. The recombination region was from 2 617 nt to 2 782 nt in TYLCVAbu genome. To our knowledge, this is the first report of the whole genome sequence of TYLCV from A.theophrasti plants.
Key words
Abutilon theophrasti; Begomovirus; sequence analysis
双生病毒科Geminiviridae病毒是一类具有孪生颗粒形态的单链环状DNA病毒,按基因组可分为单组分和双组分病毒,单组分病毒只包含大小约为28 kb的DNAA,而双组分病毒则包含大小为25~28 kb的DNAA和DNAB两个组分[1]。依据国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)最新的分类报告, Geminiviridae被划分为14个属,其中菜豆金色黄花叶属Begomovirus是包含种类最多、危害最为严重、分布最为广泛的一个属,已在世界范围内对多种植物造成了重大经济损失,我国的云南、新疆、海南、台湾和广东等地的番茄、棉花、烟草、水茄、南瓜、锦葵、凤仙花等植物上相继发现了该属病毒。该属病毒主要通过烟粉虱传播,并且大多数的单组分病毒通常都伴有卫星分子,进而形成复合体侵染寄主植株[29]。
苘麻Abutilon theophrasti是锦葵科Malvaceae一年生草本植物。已有研究表明,苘麻茎、叶、根和花中含有黄酮类、有机酸、酚类、多糖类等多种重要化学成分,具有清热解毒,利湿的作用,可以用来治疗痢疾、痈肿等症[1011]。笔者2022年5月进行药用植物病害调查时,发现山西晋中地区多株苘麻叶片表现出皱缩、花叶等典型的病毒病症状。病毒的侵染有时不仅会影响植物的表型,还会导致寄主有效成分的变化。因此鉴定侵染山西晋中苘麻的病毒种类对于苘麻的病毒病防控具有重要意义。
1 材料与方法
1.1 材料
供试样品:2022年5月采集于山西省祁县自然发病的苘麻叶片,保存于-80℃冰箱备用。
试剂:DNA凝胶回收试剂盒,OMEGA公司;PrimeSTAR HS,宝日医生物技术(北京)有限公司;2×Taq PCR Mix,pEASYT1载体,pEASY Blunt載体,Trans1T1感受态细胞,北京全式金生物技术股份有限公司;其他试剂均为国产分析纯。
仪器:T100梯度PCR仪,GelDoc XR凝胶成像仪,伯乐生命医学产品(上海)有限公司;Eppendorf 5424R型冷冻离心机,德国Eppendorf公司;DYY6C电泳仪,北京六一生物科技有限公司。
1.2 苘麻样品中菜豆金色黄花叶病毒属病毒检测
健康的苘麻叶片平展(图1a),而苘麻病株叶片具有典型皱缩、花叶症状(图1b)。采集健康和患病植株叶片,采用CTAB法提取苘麻叶片的总DNA[12]。利用双生病毒简并引物(SPG1/SPG2)[13]以及beta卫星分子通用引物(β01/β02)[14](表1)对苘麻样品进行PCR检测。PCR反应体系为:2×Taq PCR Mix 10 μL,上、下游引物(10 μmol/L)各1 μL,约50 ng植物总DNA,加超纯水至20 μL。PCR扩增程序:94℃预变性2 min;94℃变性30 s,55℃退火30 s,72℃延伸60/90 s,30个循环;72℃延伸10 min。PCR产物于10%琼脂糖凝胶中检测,目标条带使用琼脂糖凝胶回收试剂盒回收后与pEASYT1载体连接。热激转化到大肠杆菌Trans1T1,随机挑选3个阳性克隆送至生工生物工程(上海)股份有限公司测序。
1.3 苘麻样品中菜豆金色黄花叶病毒属病毒全基因组扩增
根据12中获得的病毒基因组部分序列(900 bp)设计扩增病毒全长序列的引物TYLCVF/TYLCVR(表1)。PCR反应体系如下:PrimeSTAR HS 10 μL,10 μmol/L TYLCVF/TYLCVR各1 μL,约50 ng植物总DNA,加超纯水至20 μL。扩增程序:98℃变性10 s,55℃退火5 s,72℃延伸3 min,30个循环;72℃延伸5 min。PCR产物于10%琼脂糖凝胶中电泳,目标条带割胶回收后与pEASY Blunt载体连接,连接产物转化大肠杆菌经菌液PCR筛选后,随机挑取3个阳性克隆,送至生工生物工程(上海)股份有限公司测序。
1.4 番茄黄化曲叶病毒苘麻分离物(TYLCVAbu)生物信息学分析
利用NCBI中的BLAST检索功能(https:∥blast.ncbi.nlm.nih.gov/Blast.)进行基因序列同源性分析,采用DNAMAN 80软件及SDT version软件进行基因序列相似性比较分析,使用MEGA 70软件中的邻接法(neighborjoining)构建系统进化树,bootstrap 为1 000,最后使用RDP 4软件对获得的分离物进行重组分析。
2 结果与分析
2.1 苘麻样品中菜豆金色黄花叶病毒属病毒的鉴定及全基因组扩增
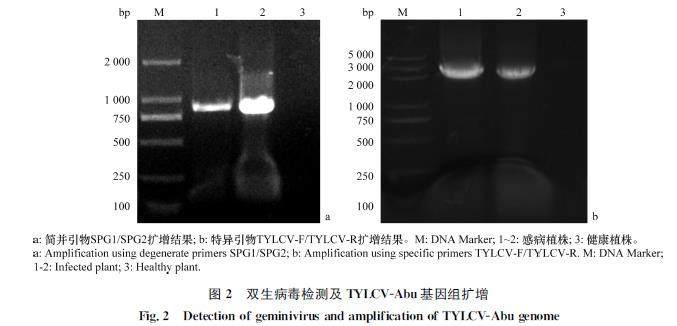
利用双生病毒简并引物SPG1/SPG2对苘麻样品进行PCR检测,扩增到约900 bp的特异性条带(图2a),测序结果在NCBI数据库中进行BLAST检索后发现,其与番茄黄化曲叶病毒(tomato yellow leaf curl virus,TYLCV)山东辣椒分离物SDWF73(GenBank登录号KU760890)的相似性最高,达到9933%,推测苘麻样品是被TYLCV所侵染。当利用beta卫星分子通用引物(β01/β02)对苘麻样品进行PCR检测时未检到条带,说明苘麻样品并未伴随有beta卫星分子的侵染。
以提取的苘麻样品总DNA为模板,利用TYLCV的特异引物(TYLCVF/TYLCVR)进行PCR扩增,得到一条大小约2 800 bp的目的条带(图2b),经测序拼接后该病毒序列全长为2 782 bp,将获得的TYLCV全长序列命名为TYLCVAbu(GenBank登录号OP293347)。分析发现,TYLCVAbu共编码6个开放阅读框,C1(1 543-2 616 nt)、C2(1 227-1 634 nt)、C3(1 082-1 486 nt)、C4(2 172-2 465 nt)、V1(309-1 085 nt)和V2(149-499 nt)。
2.2 TYLCVAbu与其他菜豆金色黄花叶病毒属病毒的相似性分析
利用SDT version软件将扩增获得的序列与多种菜豆金色黄花叶病毒属病毒进行比对,发现分离物TYLCVAbu与TYLCV的相似性均在98%以上,其中与分离物TYLCVKSQ13(GenBank登录号KC428753)的相似性最高,达到9899%(图3,表2)。按照菜豆金色黄花叶病毒属病毒分类标准,当DNAA组分的核苷酸相似性大于91%时,则被认为是同一种病毒;当同种成员之间其核苷酸相似性低于94%的时候,则认为这些成员属一种病毒的不同株系;而当大于94%时则被认为是同一株系。对照该标准,本研究从苘麻样品中分离到的病毒是TYLCV的1个分离物。
进一步利用DNAMAN 80软件对获得的分离物TYLCVAbu与其他菜豆金色黄花叶病毒属病毒进行相似性分析,发现TYLCVAbu不同编码区与其他菜豆金色黄花叶病毒属病毒的相似性有所不同(表2)。其中TYLCVAbu分离物C1氨基酸序列与TYLCV分离物1906相似性最高,为9944%,核苷酸序列与TYLCV分离物KSQ13同源性最高,为9953%;C2氨基酸和核苷酸序列均与TYLCV分离物KSQ13相似性最高,为10000%;C3氨基酸、核苷酸序列与TYLCV分离物1906、KSQ13相似性最高,分别为9925%和9975%;C4氨基酸、核苷酸序列与TYLCV分离物KSQ13、1906、Homra相似性最高,分别为9794%和9932%;V1氨基酸、核苷酸序列與TYLCV分离物1906相似性最高,分别为9884%和9871%;V2氨基酸、核苷酸序列与TYLCV分离物1906相似性最高,分别为9914%和9915%。
2.3 TYLCVAbu与其他双生病毒全基因组的进化及重组分析
利用MEGA 70软件构建分离物TYLCVAbu与菜豆金色黄花叶病毒属其他病毒的系统进化树(图4),马铃薯X病毒(potato virus X,PVX)为属外分离物,结果发现TYLCVAbu与其他3个TYLCV分离物聚集于1个大分支中,而与TYLCV分离物KSQ13聚集于1个小分支,与TYLCV分离物KSQ13亲缘关系更为接近,说明TYLCVAbu是TYLCV的一个分离物。
采用RDP 4软件对分离物TYLCVAbu和其他双生病毒进行重组分析。以RDP、GENECONV、MaxChi、Chimaera、Bootscan、3Seq和SiScan这7种方法进行重组分析,发现LARD、GENECONV、Bootscan和3Seq的P值分别为1740×10-50、1992×10-13、9734×10-8和4106×10-4。预测结果显示TYLCVAbu是重组病毒,其主要亲本为TYLCVF(GenBank登录号KY971326),次要亲本为TYLCVKSQ13(GenBank登录号KC428753),其发生重组的区域为基因组的2 617-2 782 nt区域(表3)。
3 结论与讨论
近年来,双生病毒的危害越来越严重,已在许多经济作物、粮食作物、花卉、中药材等诸如苹果、大豆、凤仙花、蜀葵等植物上检测到双生病毒的侵染[1517]。本研究从山西苘麻样品中鉴定到菜豆金色黄花叶病毒属番茄黄化曲叶病毒的一个分离物TYLCVAbu,其与TYLCVKSQ13(GenBank登录号KC428753)核苷酸相似性最高。
TYLCV是一种单组分双生病毒,是全球最具破坏性的植物病原物之一。番茄黄化曲叶病毒最初于1950年代在以色列约旦河谷的番茄上被发现[18]。迄今我国已经鉴定出约415个具有全长核苷酸序列的TYLCV分离物,遍布于中国大部分省份。同时TYLCV的寄主范围也尤为广泛,目前已在16科49种植物中检测到该病毒[19]。番茄、辣椒、豇豆、烟草、南瓜、棉花、秋葵、茄子和藿香等多种经济作物相继检测到被该种病毒侵染[20]。本研究是首次对中国苘麻TYLCV分离物(TYLCVAbu)进行全基因组序列分析的报道。
目前,已在多种锦葵科植物上检测到双生病毒,如Azeem等发现蜀葵被木尔坦棉花曲叶病毒(cotton leaf curl Multan virus, CLCuMuV)侵染[21];董迪等在广东采集的黄秋葵样品上[22],毛明杰等在广州朱槿样品上[23],高国龙等在新疆棉花样品上[24],汤亚飞等在广州垂花悬铃花样品上均检测到了CLCuMuV[25];张婧发现中国番茄黄化曲叶病毒(tomato yellow leaf curl China virus, TYLCCNV)和云南赛葵黄脉病毒(malvastrum yellow vein Yunnan virus, MYVYNV)能够侵染四川锦葵[26];李文红等在云南采集的圆叶锦葵上检测到MYVYNV[9]。张升等虽然在新疆苘麻上检测到了TYLCV的侵染,但是并未对TYLCV的全基因组进行扩增和序列分析[27]。本研究发现山西晋中地区表现皱缩、花叶症状的苘麻为TYLCV所侵染,并扩增获得了TYLCV苘麻分离物的全长序列(GenBank登录号OP293347)。经RDP软件分析发现,其潜在的亲本分别为TYLCVF(GenBank登录号KY971326)和TYLCVKSQ13。本文是首次对中国苘麻TYLCV分离物(TYLCVAbu)进行全基因组序列分析,为下一步病毒病害有效防控提供了一定的科学依据。
参考文献
[1] YANG Xiuling, GUO Wei, LI Fangfang, et al. Geminivirusassociated betasatellites: exploiting chinks in the antiviral arsenal of plants [J]. Trends in Plant Science, 2019, 24(6): 519529.
[2] HARRISON B, ROBINSON D. Natural genomic and antigenic variation in whiteflytransmitted geminivirus (begomoviruses) [J]. Annual Review of Phytopathology, 1999, 37(1): 369398.
[3] QIU Yuanjian, ZHANG Song, YU Haodong, et al. Identification and characterization of two novel geminiviruses associated with paper mulberry (Broussonetia papyrifera) leaf curl disease [J]. Plant Disease, 2020, 104(11): 30103018.
[4] VARSANI A, ROUMAGNAC P, FUCHS M, et al. Capulavirus and Grablovirus: two new genera in the family Geminiviridae [J]. Archives of Virology, 2017, 162(6): 18191831.
[5] NAWAZUIREH M S, MANSOOR S, BRIDDON R W, et al. Maintenance of an Old World betasatellite by a New World helper begomovirus and possible rapid adaptation of the betasatellite [J]. Journal of Virology, 2009, 83(18): 93479355.
[6] JIAO Xiaoyang, GONG Huanran, LIU Xuejian, et al. Etiology of ageratum yellow vein diseases in south China [J]. Plant Disease, 2013, 97(11): 14971503.
[7] 趙丽玲, 钟静, 施章吉, 等. 复合侵染水茄的两种菜豆金色花叶病毒属病毒基因组结构特征分析[J]. 植物保护学报, 2020, 47(2): 355364.
[8] ALMUSA A, ANFOKA G, MISBEH S, et al. Detection and molecular characterization of squash leaf curl virus (SLCV) in Jordan [J]. Journal of Phytopathology, 2010, 156(5): 311316.
[9] 李文红, 卢训, 方琦, 等. 侵染圆叶锦葵的双生病毒全基因组结构特征[J]. 西南农业学报, 2014, 27(3): 10861090.
[10]施昆明, 李春英, 李朝, 等. 苘麻化学成分研究进展[J]. 黑龙江医药, 2015, 28(2): 223227.
[11]潘穗生. 苘麻子和冬葵子的薄层色谱比较[J]. 中国医药导报, 2010, 7(22): 7980.
[12]TELZUR N, ABBO S, MYSLABODSKI D, et al. Modified CTAB procedure for DNA isolation from epiphytic cacti of the genera hylocereus and selenicereus (Cactaceae) [J]. Plant Molecular Biology Reporter, 1999, 17(3): 249254.
[13]LI Ruhui, SALIH S, HURRT S. Detection of geminiviruses in sweetpotato by polymerase chain reaction [J]. Plant Disease, 2004, 88(12): 13471351.
[14]BRIDDON R W, BULL S E, MANSOOR S, et al. Universal primers for the PCRmediated amplification of DNA beta: a molecule associated with some monopartite begomoviruses [J]. Molecular Biotechnology, 2002, 20(3): 315318.
[15]LIANG Pengbo, NAVARRO B, ZHANG Zhixiang, et al. Identification and characterization of a novel geminivirus with a monopartite genome infecting apple trees [J]. Journal of General Virology, 2015, 96(8): 24112420.
[16]CHENG Ruixiang, MEI Ruoxin, YAN Rong, et al. A new distinct geminivirus causes soybean staygreen disease [J]. Molecular Plant, 2022, 15(6): 927930.
[17]鐘静, 赵丽玲, 李婷婷, 等. 侵染凤仙花的菜豆金色花叶病毒的鉴定及基因组结构分析[J]. 园艺学报, 2022, 49(5): 11361144.
[18]COHEN S, HARPAZ I. Periodic, rather than continual acquisition of a new tomato virus by its vector, the tobacco whitefly (Bemisia tabaci Gennadius) [J]. Entomologia Experimentalis et Applicata, 1964, 7(2): 155166.
[19]PAPAYIANNIS L C, KATIS N I, IDRIS A M, et al. Identification of weed hosts of tomato yellow leaf curl virus in Cyprus [J]. Plant Disease, 2011, 95(2): 120125.
[20]LI Fangfang, QIAO Rui, YANG Xiuling, et al. Occurrence, distribution, and management of tomato yellow leaf curl virus in China [J/OL]. Phytopathology Research, 2022, 4: 28. DOI: 101186/s42483022001331.
[21]AZEEM H, PERVEEN R, TAHIR M N, et al. Prevalence, transmission and molecular characterization of cotton leaf curl Multan virus infecting hollyhock plants in Pakistan [J]. Molecular Biology Reports, 2022, 49(6): 56355644.
[22]董迪, 何自福, 柴兆祥. 广东黄秋葵黄脉曲叶病样中检测到烟粉虱传双生病毒[J]. 植物保护, 2010, 36(1): 6568.
[23]毛明杰, 何自福, 虞皓, 等. 侵染朱槿的木尔坦棉花曲叶病毒及其卫星DNA全基因组结构特征[J]. 病毒学报, 2008, 24(1): 6468.
[24]高国龙, 张兴旺, 姜子健, 等. 木尔坦棉花曲叶病毒在新疆的发生分布及烟粉虱带毒检测[J]. 植物保护, 2022, 48(3): 254262.
[25]汤亚飞, 何自福, 杜振国, 等. 侵染垂花悬铃花的木尔坦棉花曲叶病毒分子特征研究[J]. 植物病理学报, 2013, 43(2): 120127.
[26]张婧. 四川锦葵(Malva parviflora)上双生病毒的鉴定及变异分析[D]. 重庆: 西南大学, 2012.
[27]張升, 何伟, 杨华, 等. 新疆发生番茄黄化曲叶病毒病[J]. 新疆农业科学, 2012, 49(1): 105107.
(责任编辑:杨明丽)
