植原体引起雪花木小叶病在中国的首次报道
2024-06-08宋晓兵黄峰汤亚飞崔一平凌金锋陈霞
宋晓兵 黄峰 汤亚飞 崔一平 凌金锋 陈霞


摘要
2022年首次在廣州市发现园林植物雪花木小叶病病株,采用分子生物学技术对其进行植原体的种类鉴定。以雪花木叶片总DNA为模板,利用植原体16S rRNA通用引物P1/P7进行PCR扩增,获得广东雪花木小叶病植原体(BLLGD2022)16S rRNA基因片段(1 811 bp,GenBank登录号为OQ625536)。16S rRNA序列相似性显示,BLLGD2022与16SrVI组植原体株系的相似性最高,为97.05%~99.83%,其中与隶属于16SrVID亚组的10个植原体株系相似性为99.21%~99.83%。系统进化分析显示,BLLGD2022与16SrVI组各植原体株系聚类在一个大分支,其中与16SrVID亚组成员聚类在一个小分支,亲缘关系最近。基于16S rRNA序列的iPhyClassifier限制性内切酶虚拟RFLP分析表明,BLLGD2022与16SrVID亚组的参考株系Brinjal little leaf phytoplasma (GenBank登录号为X83431)的酶切图谱一致,相似系数为1.00。基于上述研究结果,明确广州市雪花木小叶病植原体隶属16SrVID亚组成员。本研究首次在园林植物雪花木上检测到植原体,通过16S rRNA序列分析明确为16SrVID亚组成员,为开展16SrVID亚组植原体在蔬菜、花卉和园林植物的发生监测及病害防控提供科学依据。
关键词
雪花木小叶病; 植原体; 16S rRNA; 分子鉴定
中图分类号:
S 436.85
文献标识码: A
DOI: 10.16688/j.zwbh.2023159
First report of little leaf disease caused by phytoplasma on Breynia disticha in China
SONG Xiaobing*, HUANG Feng, TANG Yafei, CUI Yiping, LING Jinfeng, CHEN Xia
(Institute of Plant Protection, Guangdong Academy of Agricultural Sciences, Key Laboratory of Green Prevention
and Control on Fruits and Vegetables in South China, Ministry of Agriculture and Rural Affairs, Guangdong Provincial
Key Laboratory of High Technology for Plant Protection, Guangzhou 510640, China)
Abstract
In 2022, the garden plant Breynia disticha exhibiting little leaf symptom was firstly observed in Guangzhou. The related phytoplasma was identified using molecular technology. The 16S rRNA fragment (1 811 bp, GenBank accession no.OQ625536) of phytoplasma associated with Breynia disticha little leaf disease in Guangdong province (BLLGD2022) was amplified from total DNA of diseased plants using universal primers P1/P7. Sequence similarity analysis based on 16S rRNA sequence showed that BLLGD2022 shared the higher similarity with 16SrVI group phytoplasma strains, which was 97.05%-99.83%, and the highest similarity (99.21% to 99.83%) with 10 phytoplasma strains belonging to the 16SrVID subgroup. Phylogenetic analyses showed that BLLGD2022 clustered with the 16SrVI group phytoplasmas in a large branch and with the 16SrVID subgroup phytoplasmas in a small branch. This result revealed that BLLGD2022 had the closest genetic relationship to the 16SrVID subgroup phytoplasmas. Based on the 16S rRNA sequence, virtual restriction fragment length polymorphism analysis using iPhyClassifier revealed that BLLGD2022 and the reference strain Brinjal little leaf phytoplasma (GenBank Registration no.X83431) of the 16S rVID subgroup were consistent, with a similarity coefficient of 1.00. Based on the above results, the phytoplasma of Breynia disticha little leaf disease in Guangzhou is a strain of 16SrVID subgroup. Phytoplasma was detected firstly on the garden plant B.disticha, and BLLGD2022 was identified to belong to the 16SrVID subgroup. The result provides scientific basis for monitoring the occurrence and disease prevention and control of 16SrVID subgroup phytoplasma in vegetables, flowers and garden plants.
Key words
Breynia disticha little leaf disease; phytoplasma; 16S rRNA; molecular identification
植原体(phytoplasma)原称类菌原体,为专性寄生于昆虫和植物韧皮部细胞内的细菌[1]。植原体无细胞壁,属细菌界Bacteria柔膜菌纲Mollicutes植原体暂定属Candidatus genus Phytoplasma[2],主要通过取食韧皮部的刺吸式口器昆虫以持续增殖的方式传播。植原体在世界范围内引起98科1 000多种植物发病[34],常引起植株表现丛枝、畸形、花变叶、小叶、黄化等典型症状,严重影响世界各地的农林业生产[57]。由于植原体迄今还不能在人工培养基上分离培养,目前主要依据其16S rRNA序列差异,以及rp、secY等保守基因序列、媒介昆虫、天然植物寄主等进行鉴定与分类[8]。植原体暂定属下的分类单元有种(species)、组(group)和亚组(subgroup),截至2019年6月,已鉴定命名的植原体种共有52个,归属34个组[9]。
雪花木Breynia disticha,为叶下珠科(原大戟科)黑面神属Breynia常绿灌木,叶色鲜明,叶缘有白色斑点或乳白色斑纹,同一植株有绿白两色叶,又称彩叶山漆茎,起源于玻利维亚,喜高温,能适应我国南方省市栽培。雪花木是一种常绿彩叶植物,具有较高的观赏价值,在现代园林建设中越来越受到重视[1011],在我国岭南地区作为园林植物广泛栽培。2022年,在广东省广州市天河区市政绿化道发现表现为小叶、节间缩短、叶片聚生等症状的雪花木小叶病病株,疑似由植原体侵染所导致。本文采用分子生物学方法,对疑似病样进行检测,进一步对相关植原体的16S rRNA进行克隆和序列分析,明确其分类地位,为防治该病害提供科学依据。
1 材料与方法
1.1 试验材料和试剂
雪花木小叶病的病样于2022年9月采集自广东省广州市天河区市政绿化道。植物基因组DNA提取试剂盒(Easypure Plant Genomic DNA Kit)和大肠杆菌Escherichia coli T1感受态细胞购自北京全式金生物技术有限公司;Premix TaqTM、pMD 19T Vector购自宝生物工程(大连)有限公司。
1.2 病样总DNA的提取
取雪花木病样约100 mg,利用植物DNA提取试剂盒提取其总DNA,具体步骤参照试剂盒说明书。所获总DNA溶解于50 μL ddH2O中,-20℃冰箱保存备用。
1.3 16S rRNA基因的扩增
利用扩增植原体16S rRNA的通用引物P1(5′AAGAGTTTGATCCTGGCTCAGGATT3′)/P7(5′CGTCCTTCATCGGCTCTT3′)[12],对疑似病样总DNA进行PCR检测,预期扩增目的片段大小为1.8 kb。反应体系30.0 μL:待测样品总DNA 1.0 μL, Ex TaqTM Premix 15.0 μL,引物P1/P7(10 μmol/L)各1.0 μL,ddH2O 12.0 μL。反应程序:95℃ 预变性4 min;95℃ 1 min,55℃ 1 min,72℃ 90 s,35个循环;72℃ 延伸10 min。PCR产物进行1%琼脂糖凝胶电泳检测。
1.4 基因克隆與测序
将所获目的片段进行纯化,连接至pMD19T载体,采用热激法将其转化到大肠杆菌T1感受态细胞,吸取80 μL菌液涂布在含100 μg/mL Amp、40 μL/mL Xgal的LB固体培养基平板上,37℃倒置培养过夜;挑取阳性单菌落送至生工生物工程(上海)股份有限公司进行测序。
1.5 序列分析
利用DNAStar的SeqMan对序列拼接,将所获得的完整序列在GenBank数据库中进行BLASTn搜索,确定是否为植原体基因序列;利用在线分析工具MUSCLE (https:∥www.ebi.ac.uk/Tools/msa/muscle/)将所获得的16S rRNA序列与已报道的相关序列进行相似性分析。采用MEGA 6.0的最大似然法(maximum likelihood,ML)[13]构建基于16S rRNA的系统进化树,Bootstrap值设置为1 000。进一步将16S rRNA序列通过植原体在线分类软件iPhyClassifier(https:∥plantpathology.ba.ars.usda.gov/cgibin/resource/iphyclassifier.cgi)进行虚拟RFLP分析和计算相似系数,确定其分类地位[14]。
2 结果与分析
2.1 田间症状
雪花木小叶病病株主要表现为小叶、节间缩短、叶片聚生,多数叶片边缘向内皱缩,与正常植株差异明显(图1)。该病害影响雪花木的光合作用,导致植株抗逆性逐步减弱,后期造成植株早衰,叶片易脱落。
2.2 PCR检测结果
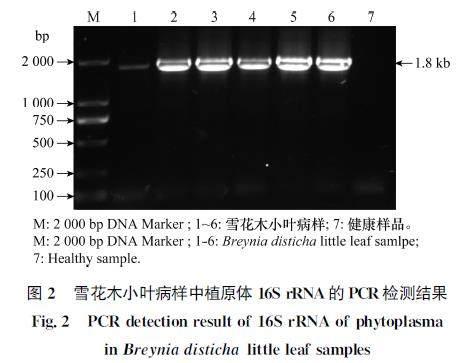
利用扩增植原体16S rRNA的引物P1/P7对6份雪花木小叶病病样进行PCR检测,电泳结果显示(图2),所有病样中均扩增出约1.8 kb大小的条带,而健康植株中未扩增出相应条带。这一结果表明,所采集的6份雪花木疑似病样中存在植原体,并命名为广东雪花木小叶植原体(BLLGD2022)。
2.3 16S rRNA序列分析
利用扩增植原体16S rRNA序列的通用引物P1/P7,从广东雪花木小叶病样总DNA中PCR扩增获得该基因片段,大小为1 811 bp (GenBank登录号为OQ625536),该片段包含16S rRNA基因(1~1 530 nt)、含有rRNA Ile的16S23S rRNA间区(1 531~1 781 nt)和部分23S rRNA基因序列(1 782~1 811 nt)。BLAST分析结果显示,BLLGD2022与隶属于16SrVI组(苜蓿增生植原体组,Clover proliferation group)植原体株系的相似性较高。进一步利用在线MUSCLE软件对BLLGD2022与其他32个植原体相关序列进行核苷酸相似性分析,结果表明(表1),BLLGD2022与16SrVI组各植原体株系的相似性最高,为97.05%~99.83%,与其他组植原体的相似性较低,为89.19%~96.56%;其中与来自印度的隶属于16SrVID亚组的木豆植原体clone 62株系以及茄子小叶植原体BLL25、LLB_MKS3、LLB_MKS5和LLB_MKS6株系相似性最高,均为99.83%;其次,与印度、孟加拉国和加拿大报道的16SrVID亚组的茄子植原体和茄子小叶植原体其他5个株系的16S rRNA序列相似性为99.28%~99.82%;与中国报道的隶属于16SrVI组的芥菜花变叶植原体OM1株系、芥菜丛枝植原体OM3株系相似性均为98.89%。
以柑橘黄龙病菌亚洲种(Candidatus Liberibacter asiaticus isolate B4)(MH368771)的16S rRNA序列为外群,利用MEGA 6.0的最大似然法对BLLGD2022与32个植原体株系进行系统进化分析,结果显示(图3),BLLGD2022与隶属16SrVI组的25个植原体株系聚类在一个大分支,亲缘关系较近;进一步与隶属16SrVID亚组的茄子小叶植原体8个株系及木豆、印楝树植原体相关株系聚类在一个小分支,亲缘关系更近;而与隶属于16SrVII、16SrIX、16SrI、16SrII组的7個植原体株系亲缘关系较远。
2.4 16S rRNA序列的iPhyClassifier在线分析
利用植原体在线分类软件iPhyClassifier对BLLGD2022的16S rRNA序列进行虚拟RFLP分析,结果显示(图4):基于Taq I、Ssp I、Rsa I、Mse I、Sau3A I、Kpn I、Hpa II、Hpa I、Hinf I、Hha I、Hae III、EcoR I、Dra I、BstU I、Bfa I、BamH I和Alu I共17种限制性内切酶的虚拟RFLP图谱,BLLGD2022与16SrVID亚组的参考株系Brinjal little leaf phytoplasma(GenBank登录号为X83431)的酶切图谱一致,相似系数为1.00,表明BLLGD2022属于16SrVID亚组成员。
3 结论与讨论
植原体的分类鉴定是植原体研究和防控病害的基础,植原体组和亚组的划分标准基于17种限制性内切酶对16S rRNA序列进行多态性对比分析。通过与所有已发表的植原体16S rRNA序列比较,相似系数F>0.97,划分为已有16Sr亚组的不同株系或变种;相似系数F介于0.85~0.97,划分为一个新的16Sr亚组;相似系数F≤0.85,划分为一个新的植原体16Sr组[1516]。截至2019年6月,已鉴定出植原体为52个暂定种、34个组和100多个亚组[9]。16SrVI组为苜蓿增生植原体组(clover proliferation group),于2004年被正式命名,包括引起苜蓿丛枝、甜菜绿化、茄子小叶、三叶草增生、马铃薯丛枝、马铃薯黄化、番茄巨芽、百香果丛枝、柳树丛枝等症状的植原体[1719]。2022年,本团队在广东省广州市首次发现了雪花木小叶病,PCR检测表明该病样感染了植原体,命名为广东雪花木小叶植原体(BLLGD2022),通过16S rRNA序列分析明确与广东雪花木小叶病相关的植原体属于16SrVID亚组。本研究首次在雪花木上检测到植原体,并鉴定该株系为16SrVID亚组植原体,为研究植原体群体多样性、病害监测以及防控提供了基础数据。
据报道,16SrVID亚组植原体在印度广泛侵染茄子、生菜、芹菜、甘蓝、莴苣等蔬菜,尤其是茄子小叶病已造成了严重经济损失[2021],在我国16SrVID亚组植原体病害尚未见报道。植原体大量存在于寄主植物的韧皮部筛管细胞中,自然条件下植原体大多依赖于通过取食韧皮部汁液的半翅目媒介昆虫以持久性传播的方式在其宿主间实现高效的传播,主要植原体媒介昆虫有叶蝉科、飞虱科和木虱科等植食性昆虫[22]。例如茶树小绿叶蝉Empoasca flavescens传播花生丛枝植原体[23],拟帕小绿叶蝉Empoasca (Matsumurasca) paraparvipenis传播喜树丛枝植原体[24],异沙叶蝉Psammotettix alienus传播小麦蓝矮植原体[25]等。在感染茄子小叶病的菜场采集到已知的5种叶蝉,只有1种叶蝉Hishimonas phycitis的唾液腺中检测到16SrVID亚组植原体,表明其是16SrVID亚组植原体的重要媒介昆虫[21]。16SrVID亚组植原体借助媒介昆虫传播的范围更广,具有更为广泛的宿主范围和传播能力,因此对该亚组植原体株系的研究具有重要的流行病学意义。
广东省地处热带和亚热带地区,常年高温高湿,物种资源丰富,植物和介体昆虫周年可生长与繁殖,为植原体引发的植物病害发生提供了有利条件[26]。本研究首次在雪花木上鉴定到16SrVID亚组植原体侵染引起的雪花木小叶病,该病害的病原与广泛发生在印度的茄子小叶病的病原分类地位一致,均为16SrVID亚组植原体。据报道,16SrVID亚组植原体还侵染芝麻、多种观赏植物和药用植物等[2728],由此推测,该亚组植原体病害未来极有可能通过介体昆虫在广东地区蔓延,引起多种蔬菜、园林植物植原体病害,因此需要重点关注。由于目前还缺乏有效防治植原体病害的药剂,防治传病介体昆虫对防控该类病害的扩散和发生至关重要。因此,下一步亟须开展传菌介体昆虫种类鉴定、介体昆虫的带菌情况监测等研究工作,为16SrVID亚组植原体病害的防控提供科学依据。
参考文献
[1] OSHIMA K, KAKIZAWA S, NISHIGAWA H, et al. Reductive evolution suggested from the complete genome sequence of a plant pathogenic phytoplasma [J]. Nature Genetics, 2004, 36(1): 2729.
[2] RAZIN S, YOGEV D, NAOT Y. Molecular biology and pathogenicity of mycoplasmas [J]. Microbiology Molecular Biology Reviews, 1998, 62(4): 10941156.
[3] GASPARICH G E. Spiroplasmas and phytoplasmas: microbes associated with plant hosts [J]. Biologicals, 2010, 38(2): 193203.
[4] 李继东, 陈鹏, 倪静, 等.植原体致病分子机理研究進展[J]. 园艺学报, 2019, 46(9): 16911700.
[5] 杨毅, 车海彦, 曹学仁, 等. 植原体基因组学研究进展[J]. 植物保护, 2014, 40(6): 16.
[6] 耿显胜, 舒金平, 王浩杰, 等. 植原体病害的传播、流行和防治研究进展[J]. 中国农学通报, 2015, 31(25): 164170.
[7] 李丰, 赖刚刚, 赵志慧, 等. 新疆柳树花变叶植原体分子鉴定[J]. 西北农业学报, 2022, 31(10): 13741380.
[8] 卢恒宇, 魏辉, 杨广. 植原体病害研究进展[J]. 福建农业学报, 2016, 31(3): 326332.
[9] 杨毅, 姜蕾, 李世访. 植原体分类鉴定研究进展[J]. 植物检疫, 2020, 34(5): 1320.
[10]黄阿凤, 罗德超, 郑涛, 等. 雪花木扦插繁殖试验初报[J]. 福建热作科技, 2012, 37(4): 2627.
[11]魏燕雄. 珠三角地区现代植物墙的调查与分析[D]. 广州: 仲恺农业工程学院, 2017.
[12]GUNDERSEN D E, LEE I M. Ultrasensitive detection of phytoplasmas by nestedPCR assays using two universal primer pairs [J]. Phytopathologia Mediterranea, 1996, 35(3): 144151.
[13]TAMURA K, STECHER G, PETERSON D, et al. MEGA6: Molecular evolutionary genetics analysis version 6.0 [J]. Molecular Biology and Evolution, 2013, 30(12): 27252729.
