HBeAg诱导的免疫激活和免疫抑制在慢性乙型肝炎中的作用
2024-06-06李欣阳涂正坤
李欣阳 涂正坤
摘要: HBV感染诱导的慢性乙型肝炎是导致肝硬化和肝癌的重要危险因素。半个世纪前, HBeAg在HBV感染者血清中首次被发现, 尽管HBeAg并不参与HBV在肝细胞中的感染或复制, 但其已被证实可干扰宿主先天性和适应性免疫反应, 在慢性HBV感染的过程中发挥着重要的免疫激活和免疫抑制作用。HBV对于感染的肝细胞并没有细胞毒性, 免疫应答介导的抗病毒作用和炎症反应决定HBV是否被清除或者诱导肝脏炎症相关疾病。因此, 本文对HBeAg的形成及其在慢性HBV感染中引起的免疫激活和免疫抑制机制进行综述, 重点论述HBeAg对先天免疫和适应性免疫细胞所引起的不同免疫效应, 阐述了其诱导免疫反应的两面性, 并探讨HBeAg在慢性HBV感染不同阶段间的转换作用。
关键词: 乙型肝炎, 慢性; 乙型肝炎e抗原; 免疫激活; 免疫抑制
基金项目: 吉林省科技发展计划项目自然科学基金 (20190201245JC)
Role of HBeAg-induced immune activition and immunosuppression in chronic hepatitis B
LI Xinyang, TU Zhengkun. (Laboratory of Tumor Immunology, The First Hospital of Jilin University, Changchun 130021, China
Corresponding author: TU Zhengkun, tuzhengkun@hotmail.com (ORCID: 0000-0001-6803-2015)
Abstract: Chronic hepatitis B induced by HBV infection is a significant risk factor leading to liver cirrhosis and liver cancer. Half a century ago, HBeAg was first discovered in the serum of HBV infected individuals, and although HBeAg does not participate in HBV infection or replication in hepatocytes, studies have shown that it can interfere with the innate and adaptive immune responses of the host and play an important role in immune activation and immunosuppression during chronic HBV infection. HBV has no cytotoxicity to the infected hepatocytes, and the antiviral action and inflammatory response mediated by immune response determine whether HBV is cleared or induces liver inflammation-related diseases. Therefore, this article reviews the formation of HBeAg and its immune activation and immunosuppression mechanisms in chronic HBV infection, with a focus on the different immune effects caused by HBeAg on innate immune and adaptive immune cells, and this article also elaborates on the dual role of HBeAg in inducing immune responses and explores the conversion role of HBeAg in different stages of chronic HBV infection.
Key words: Hepatitis B, Chronic; Hepatitis B e Antigens; Immune Activation; Immune Suppressive
Research funding: Jilin Province Science and Technology Development Plan Project Natural Science Foundation Project (20190201245JC)
慢性HBV感染如今仍然是全球健康領域一项具有挑战性的问题。目前, 全球约有2. 57亿人慢性持续性感染HBV, 每年造成近100万人死亡。慢性HBV感染是导致肝纤维化、 肝硬化和肝细胞癌 (HCC) 的主要危险因素[1-2] 。HBeAg是HBV复制过程中表达的一种非结构性蛋白, 具有免疫抑制作用, 可干扰先天性和适应性免疫反应, 导致免疫逃逸行为, 从而促进HBV的持续性感染[3] 。与此同时, HBeAg还具有免疫激活作用, 并在多项研究中发现与慢性乙型肝炎 (CHB) 期间的肝损伤相关[4-5] 。然而, HBeAg导致这些截然相反免疫功能的确切机制目前尚未完全阐明。
1 HBeAg的形成
HBV是属于嗜肝病毒科的一种双链DNA病毒, 其基因组 DNA 是一种松弛环状 DNA(relaxed circular DNA,rcDNA), rcDNA在复制过程中被转化为共价闭合环状DNA (covalently closed circular DNA, cccDNA), cccDNA产生不同长度的HBV RNA, 这些RNA是从HBV基因组中的不同启动子开始转录的, 病毒基因组编码4个重叠的开放阅读框, 病毒编码蛋白主要包括C、 P、 S和X蛋白。其中, 3. 5 kb RNA主要负责合成前核心蛋白、 核心蛋白以及Pol蛋白[6] 。HBeAg主要是通过前核心蛋白 (p25) 在分泌途径中经过两次蛋白酶切割转化而来的。第一次切割发生在p25蛋白转位到内质网腔内的过程中, 主要通过信号肽酶去除p25的N端信号肽, 从而导致p22的产生;随后进入高尔基体, p22的C端结构域被进一步切割后形成HBeAg, 并被分泌到细胞外[7-8]。尽管HBeAg并不是HBV的结构成分, 也不参与其复制过程, 但是它仍然可以影响细胞的天然和适应性免疫反应, 在HBV的持续性感染中发挥着重要作用[9] 。
2 HBeAg与CHB分期
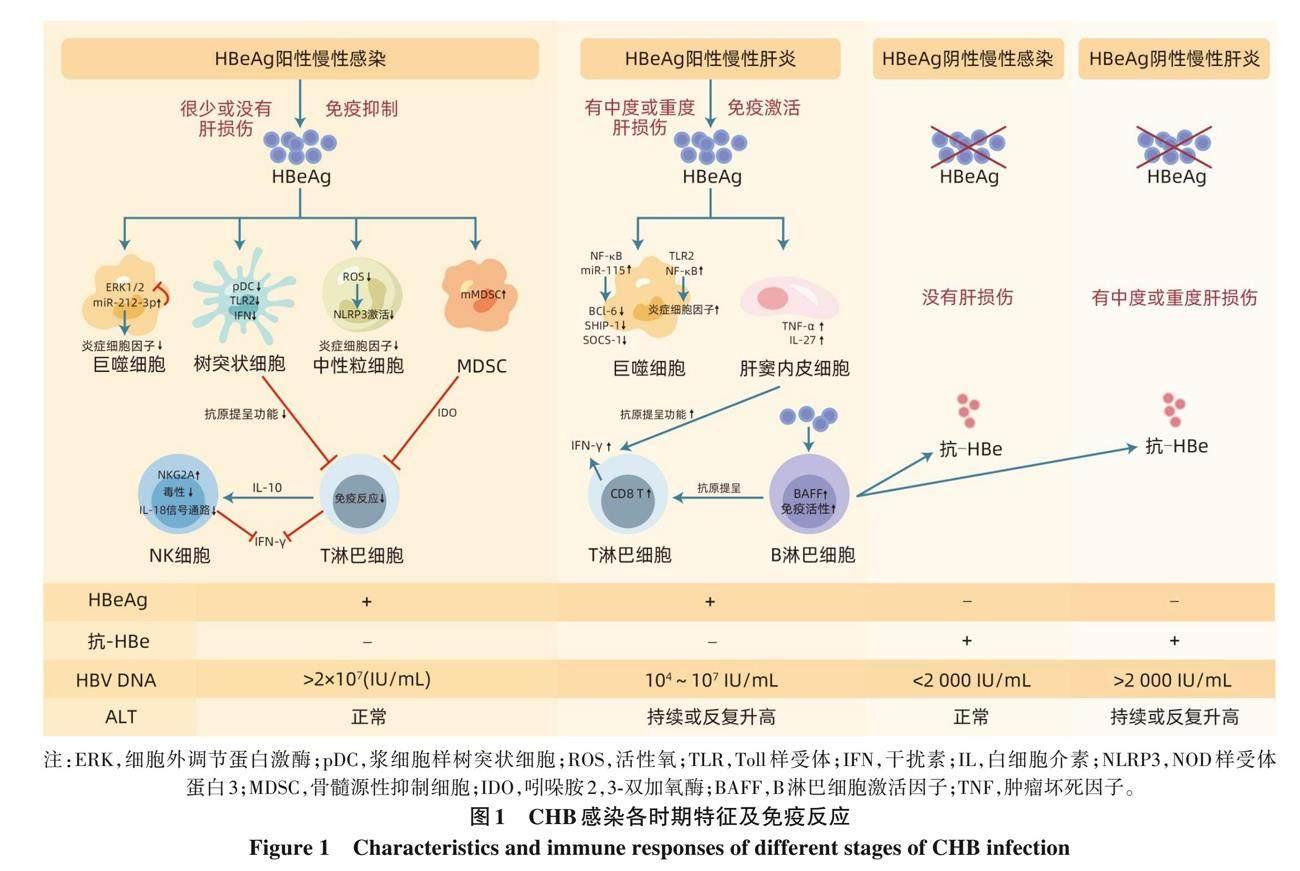
慢性HBV感染主要涉及HBV、 感染的肝细胞和患者免疫系统之间的动态相互作用, 因此, 慢性HBV感染的自然病程可划分为不同的阶段, 传统上将CHB分为4个阶段——免疫耐受期、 免疫清除期、 非活动或低复制期和再活动期。在对传统术语进行更新时, 为了更准确地反映潜在的疾病活动, 欧洲肝病学会依据HBeAg的表达以及是否发生肝脏炎症损伤对CHB患者进行了分期, 主要包括HBeAg阳性慢性感染、 HBeAg阳性慢性肝炎、 HBeAg阴性慢性感染和HBeAg阴性慢性肝炎 (图1) [10] 。
HBeAg阳性慢性感染期HBeAg的自发清除率很低。HBeAg阳性慢性肝炎期可能会持续数周到数年, HBeAg的自发清除率较 HBeAg 阳性慢性感染期有所提高。HBeAg阴性慢性感染期由于免疫应答控制了病毒感染,因此, 在大多数患者中, 这种状态对于良好长期结果的维持非常有益, 出现肝硬化或肝癌的风险非常低。HBeAg阴性慢性肝炎期免疫应答周期性再激活。该阶段的患者无HBeAg表达, 并且在前核心和/或基本核心启动子区域存在核苷酸被替换的HBV变异体[11] 。
在CHB上述分期中的重要转折点是HBeAg的血清转化, 即HBeAg消失并伴随抗-HBe出现。有研究[12-13]表明, HBeAg的血清转化可使HBV DNA水平持续降低,肝纤维化消退, 肝硬化和HCC风险降低。此外, 早期HBeAg的血清转化或较短的HBeAg阳性期会抑制肝脏疾病进展, 甚至会增加HBsAg的血清清除率[14] 。这些发现进一步凸显了HBeAg在CHB发展中的关键作用[14] 。
3 HBeAg诱导的免疫激活及机制
3. 1 巨噬细胞 巨噬细胞是重要的天然免疫细胞, 在肝脏中尤其丰富。在感染过程中, 巨噬细胞通过模式识别受体识别HBV病原体相关分子模式, 分泌大量的炎症细胞因子, 进而介导炎症反应。研究[5] 发现, HBeAg主要通过影响巨噬细胞表面TLR的表达以及其信号转导通路,从而介导巨噬细胞的天然免疫应答反应。HBeAg主要与巨噬细胞表面的TLR-2受体结合并通过TLR-2/NF-κB信号通路激活巨噬细胞。此外, 巨噬细胞还能有效地促进适应性免疫应答, 辅助诱导T淋巴细胞介导的毒性反应和B淋巴细胞介导的抗体分泌[15] 。另一方面, NF-κB信号通路的激活可以上调巨噬细胞中miR-155的表达水平,miR-155可以通过抑制炎症因子负向调节蛋白如BCL-6、SHIP-1和SOCS-1的表达来增强HBeAg诱导的炎症因子的释放[15] 。上述一系列现象和机制证明了HBeAg在调控巨噬细胞炎症和免疫反应中发挥着重要作用。
3. 2 肝窦内皮细胞(liver sinusoidal endothelial cell,LSEC)LSEC是肝脏中数量最多的非实质细胞, 其产生的凝集素可触发CD8+T淋巴细胞耐受, 在维持肝脏微环境的动态平衡中发挥重要作用[16] 。然而, 在炎症条件下, LSEC可以由免疫耐受转换为免疫应答状态, 并触发CD8+T淋巴细胞的激活[17] 。
机制方面, 有研究[18] 显示, 从小鼠体内纯化的LSEC,在接受HBeAg刺激24 h后, 培养上清液中TNF-α和IL-27的表达显著增加, 表明HBeAg通过与LSEC结合, 促进TNF-α和IL-27的分泌, 从而诱导肝内HBV特异性T淋巴细胞的激活。该发现进一步强调了HBeAg在调节LSEC免疫活性中的关键作用, 为理解肝脏免疫微环境中HBeAg所扮演的角色提供了新的见解。
3. 3 B淋巴细胞 众所周知, B淋巴细胞可以通过产生抗-HBe, 完成HBeAg的血清学转化, 进而抑制病毒的传播。与此同时, B淋巴细胞还可以充当抗原提呈细胞的作用, 影响T淋巴细胞的免疫应答反应[19] 。在自身免疫性疾病、 感染和癌症的相关研究中, B淋巴细胞已经被确定为诱导T淋巴细胞免疫应答反应的有效调节细胞[20] 。此外, 有研究[21] 表明, HBeAg可以刺激单核细胞分泌BAFF。BAFF又称为BLyS或TNFSF13B, 属于TNF家族, 是激活B淋巴细胞的关键细胞因子[22]。这一系列机制展示了HBeAg在调控B淋巴细胞免疫功能方面的重要作用。
3. 4 T淋巴细胞 作为免疫细胞的重要组成部分, T淋巴细胞具有多种生物学功能, 如直接杀伤靶细胞, 辅助或抑制B淋巴细胞产生抗体等。有研究[18] 表明, HBeAg可以作為一种刺激因子, 通过促进LSEC的成熟, 进而协助抗HBV细胞毒性T淋巴细胞发挥其效应功能。如前所述, 识别HBeAg的LSEC可以作为抗原提呈细胞, 并且以浓度依赖性的方式上调LSEC中TNF-α和IL-27的水平来激活HBV特异性T淋巴细胞[23] , 激活的T淋巴细胞产生大量IFN-γ。IFN-γ是一种具有抗病毒、 抗肿瘤和免疫调节作用的多功能细胞因子[24] , 且能够触发广泛的级联反应, 放大炎症过程[25] , 促进肝内CD8+T淋巴细胞免疫应答和HBV的清除[18, 26]。在HBV复制的小鼠模型中, 阻断TNF-α会导致HBV特异性CD8+T淋巴细胞功能降低以及延缓HBV的清除[26] , 这进一步证明HBeAg刺激LSEC释放的TNF-α对于HBV特异性CD8+T淋巴细胞的重要作用。
4 HBeAg诱导的免疫抑制及机制
4. 1 巨噬细胞 HBeAg不仅可以诱导巨噬细胞的免疫激活, 还可以诱导其免疫抑制作用以逃避宿主免疫。有研究[27]显示, HBeAg通过激活ERK2蛋白促进炎性细胞因子IL-6和TNF-α的产生, 与此同时, ERK2又可以上调人和小鼠巨噬细胞中miR-212-3p的表达。而激活的miR-212-3p又可以通过负反馈调节抑制ERK2的表达, 从而抑制巨噬细胞炎症因子的产生, 发挥免疫抑制功能。此外, 在一项以小鼠为模型的研究[28]中发现, 从雌性HBV转基因的子代小鼠中分离出的Kupffer细胞, 如果使用HBeAg进行处理, 巨噬细胞主要向M2型极化并产生大量IL-10。相比之下, 从非转基因雌鼠的子代小鼠中分离出的Kupffer细胞则会向M1型极化并产生TNF-α和IL-1β。该结果表明, Kupffer细胞对于HBeAg的免疫应答反应主要取决于其初次接触到HBeAg的时间点。然而, HBeAg是如何与Kupffer细胞相互作用并影响它们的活性仍有待进一步研究。
4. 2 树突状细胞 (DC)DC是宿主免疫系统的哨兵, 其可大致分为髓系树突状细胞 (mDC) 和浆细胞样树突状细胞 (pDC) 两类。pDC的形态类似于浆细胞, 主要通过分泌大量的IFN-α和IFN-β来抵御病毒攻击。有研究[29]表明, HBeAg主要通過抑制NF-κB信号通路来抑制粒细胞-巨噬细胞集落刺激因子诱导DC的生成, 同时在DC分化过程中, HBeAg可以下调其TLR-2的表达。此外,HBeAg也抑制DC发挥生理功能的相关蛋白质 (主要组织相容性复合物Ⅱ、 组织蛋白酶S、 神经节苷脂GM2激活蛋白) 的表达水平。而在HBeAg存在的条件下, Ca2+结合蛋白S100A8和S100A9的表达水平均有所增加, 二者的上调可进一步抑制DC的分化[30] 。
在病毒感染过程中, pDC还可以通过分泌大量IFN,进一步激活mDC、 T淋巴细胞、 NK细胞和B淋巴细胞,pDC通过连接先天性免疫和适应性免疫应答反应, 进一步激活和调节抗病毒免疫反应, 因此, 它们在HBV感染的控制过程中起着至关重要的作用[31]。有研究[29]表明, HBeAg可以抑制慢性HBV感染者体内pDC的数量及其功能, 导致pDC的抗原提呈功能受损。HBeAg对pDC的抑制作用也间接抑制了宿主通过免疫反应对于HBV的清除, 使得病毒得以持续复制。此外, HBeAg还可以抑制骨髓祖细胞中DC的生成。这些研究证明了HBeAg在调节DC功能和免疫抑制方面的复杂作用。
4. 3 中性粒细胞 中性粒细胞不仅可以影响NK细胞和DC的成熟, 还可以影响T淋巴细胞向辅助性T淋巴细胞 (Th) 1或Th17细胞的增殖和极化[32] 。在接受刺激后,中性粒细胞通过NADPH氧化酶产生大量的ROS, ROS不仅可以直接杀死被摄取的病原微生物, 而且还可以作为信号分子进一步介导信号通路的激活, 从而触发包括转录激活和凋亡在内的许多生理反应。有研究[33] 表明,虽然HBeAg促进了中性粒细胞的存活, 但同时抑制了中性粒细胞的迁移以及ROS的产生, 从而抑制了NLRP3炎性小体的激活和炎症因子的产生。此外, HBeAg可能通过干扰中性粒细胞的功能来间接削弱Th1细胞和NK细胞对于病毒的清除。机制上讲, HBeAg可以通过影响磷脂酰肌醇3-激酶(PI3K)、 磷脂酶C、 Ras、 Rac和Rho小GTPase等细胞内蛋白分子的激活来抑制中性粒细胞的激活和迁移, 从而阻止中性粒细胞与DC或NK细胞的相互作用, 最终影响DC的成熟、 NK细胞的功能和Th1细胞的反应[32] 。这些发现说明HBeAg可以诱导中性粒细胞的免疫抑制作用。
4. 4 骨髓源性抑制细胞 (MDSC)MDSC是天然免疫细胞的一个组成成分, 可以改变适应性免疫应答并诱导免疫调节作用, 对于T淋巴细胞的免疫抑制至关重要。MDSC在健康人外周血单个核细胞 (PBMC) 中所占的比例仅为0. 5%, 但是, 其在慢性炎症和IL-1β、 IL-6、 IL-10、TNF-α、 GM-SCF和IL-12等细胞因子的作用下会大量增殖。根据细胞表面CD14的表达与否, MDSC可分为单核细胞 MDSC(mMDSC)和粒细胞 MDSC(gMDSC)。针对CHB患者的分析显示, HBeAg阳性患者的mMDSC水平显著高于HBeAg阴性患者。从健康供体分离得到的PBMC暴露于HBeAg后, IL-6和IL-1β的表达增加, mMDSC通过依赖这两种细胞因子的途径进行增殖[34] 。上述研究揭示了HBeAg对MDSC的扩增和免疫抑制功能的重要作用。
4. 5 NK细胞 NK细胞是肝脏中主要的淋巴细胞亚群, 占肝内淋巴细胞的31%, 肝脏中的NK细胞主要通过分泌IFN-γ、 TNF-α和IL-10等细胞因子, 快速应对病毒感染[35] 。有研究[9] 表明, 与健康对照组相比, 慢性HBV感染者NK细胞产生抗病毒细胞因子的能力明显受损。
NK细胞的活化与否是由细胞表面的抑制性和活化性受体之间的博弈所控制的, 在慢性HBV感染者中能够观察到NK细胞表面抑制性受体NKG2A表达的上调[36] 。近期的一项研究[37]表明, HBeAg阳性的慢性HBV携带者中NKG2A+NK细胞和IL-10+调节性T淋巴细胞 (Treg)水平高于HBeAg阴性的慢性HBV携带者。进一步的研究[9] 发现, HBeAg可以诱导Treg产生IL-10, 进而增加NK细胞中NKG2A的表达水平, 从而抑制NK细胞的活化。
此外, 另有研究[38] 表明, 分别使用HBeAg阳性和阴性CHB患者的血清刺激健康人的PBMC, 并检测NK细胞中IFN-γ的表达水平, 结果显示HBeAg阳性CHB患者的血清能够显著降低NK细胞中IFN-γ的表达水平, IL-18介导的信号通路可能是HBeAg抑制NK细胞中IFN-γ释放的中间媒介。HBeAg抑制NK细胞产生IFN-γ的作用有利于HBV的持续性感染, 这些研究结果阐明了HBeAg
对NK细胞免疫功能和抗病毒能力的抑制作用。4. 6 T淋巴细胞 HBV特异性CD8+T淋巴细胞的免疫应答在病毒清除和肝脏疾病的发病机制中发挥着重要作用。相较于急性乙型肝炎患者, CHB患者的外周血中CD8+T淋巴细胞的免疫反应较为低下。这些患者的肝脏中虽然存在病毒特异性CD8+T淋巴细胞, 但由于功能缺陷或数量短缺而无法清除病毒, 从而导致病毒的慢性持续性感染[25] 。
有研究[4, 34]表明, HBeAg诱导的mMDSC能够抑制CD4+和CD8+T淋巴细胞的增殖, 从而导致T淋巴细胞无法产生大量的抗病毒因子和免疫激活因子。另外一项针对小鼠的实验[28]表明, 亲代HBeAg主要通过上调肝脏巨噬细胞程序性死亡受体配体-1 (PD-L1) 的表达来破坏子代的CD8+T淋巴细胞对HBV的免疫应答。从机制上讲, PD-L1能够与PD-1结合, 抑制T淋巴细胞增殖以及细胞因子的分泌, 从而导致HBV的持续性感染。此外,PD-L1表达的上调也会导致慢性HBV感染者的T淋巴细胞衰竭和细胞毒性T淋巴细胞反应的损伤[39] 。在HBeAg阳性CHB患者中, 自体T淋巴细胞的增殖和IFN-γ的分泌被纯化的mMDSC显著抑制[34] 。其中, MDSC通过PD-L1的表达、 ROS的产生以及IDO的诱导和分泌等多种抑制机制损害T淋巴细胞的功能[40] 。IDO是一种限速酶, 催化色氨酸转化为犬尿氨酸。色氨酸的耗尽和犬尿氨酸的积聚都会导致T淋巴细胞抑制和凋亡[41] 。IDO在HBeAg诱导的mMDSC中显著升高, 进而损害T淋巴细胞功能,这对CHB的建立有重要影响, 表明HBeAg-mMDSC-IDO轴可能作为CHB的免疫治疗靶点[34] 。
5 总结在临床上, HBeAg是一个衡量病毒复制、 传染性、 炎症、 疾病的严重程度和对抗病毒治疗反应的重要蛋白分子[42] 。HBeAg诱导的截然相反的免疫模式, 即免疫激活和免疫抑制, 决定了其与宿主之间的相互作用是复杂且多面的。HBeAg既可以诱导免疫细胞放任HBV感染肝细胞, 以确保免疫逃逸从而进行大量复制[4] , 助力HBeAg阳性慢性感染的发生; 又可以激活各类免疫细胞, 而激活的免疫细胞彼此产生级联反应进一步放大免疫应答,促进HBeAg阳性慢性肝炎的进展。HBeAg阳性慢性感染期向HBeAg阳性慢性肝炎期转化的具体机制尚不明确。一般认为, 针对HBeAg的免疫应答能够清除HBV感染的肝细胞, 进入HBeAg阳性慢性肝炎期。已知HBeAg既具有免疫激活功能也具有免疫抑制功能, 考虑可能是由于HBV不断复制, HBeAg水平逐渐积累, 诱导的免疫激活反应逐渐增强, 使其在宿主中的主要作用由免疫抑制向诱导免疫应答倾斜。肝损伤通常在HBeAg血清转化之前发生, 而且HBV携带者的肝损伤越严重, HBeAg血清转化的时间则越短。有研究[25] 表明, 当激活的HBV特异性CD8+T淋巴细胞进入肝脏, 识别抗原, 杀死感染细胞并分泌IFN-γ时, HBV的感染可以被控制。年龄是决定HBeAg血清转化的一个关键因素。与<10岁的患者相比,10~20岁患者的HBeAg血清转化率增加了近2倍, 年龄>50岁增加了4倍[43] 。此外, 也有证据表明HBV的基因型可能影响HBeAg的血清转化率。在一项纵向研究[14]中发现, HBV B型患者比C型患者具有更早和更高的HBeAg血清转化率, 与C型患者相比, B基因型患者在免疫清除期有更高的Th1和更低的Th2免疫应答。这种现象也暗示了HBeAg的清除与T淋巴細胞及IFN-γ的重要联系。因此了解T淋巴细胞是何时以何种方式在慢性HBV感染中恢复抗病毒功能, 也将有助于更好地理解CHB中HBeAg阳性慢性感染期如何向HBeAg阳性慢性肝炎期转化, 以及HBeAg血清学转化的深层机制。
HBeAg的血清转化是慢性HBV感染自然病程中的一个重要转折点, 并且是证明IFN治疗有效的主要指标[44] 。HBeAg血清转化有利于改善患者预后, 包括持续降低HBV DNA水平, 减轻纤维化程度, 提高无并发症生存率等[45] 。因此, 对于HBeAg如何调控宿主免疫功能并助力HBV感染持续存在的相关研究和探索显得尤为重要。此外, HBeAg血清转化也会导致HBsAg的血清清除, 这也是最接近功能治愈的理想终点。综上所述, 由于CHB导致的严重后果及HBeAg在CHB中的复杂作用, 对HBeAg的结构和免疫学特性的深入理解将会为预防HBV转变为CHB以及为CHB患者的治疗提供新的研究思路。利益冲突声明: 本文不存在任何利益冲突。
作者贡献声明: 李欣阳负责查阅文献, 撰写文章; 涂正坤负责拟定文章思路, 指导撰写文章并最后定稿。
参考文献:
[1] TANG LSY, COVERT E, WILSON E, et al. Chronic hepatitis B infec?tion: A review[J]. JAMA, 2018, 319(17): 1802-1813. DOI: 10.1001/jama.2018.3795.
[2] CHANG ML, LIAW YF. Hepatitis B flare in hepatitis B e antigen-nega?tive patients: A complicated cascade of innate and adaptive immune responses[J]. Int J Mol Sci, 2022, 23(3): 1552. DOI: 10.3390/ijms23031552.
[3] MILICH DR. Is the function of the HBeAg really unknown? [J]. Hum Vaccin Immunother, 2019, 15(9): 2187-2191. DOI: 10.1080/21645515.2019.1607132.
[4] PADARATH K, DEROUBAIX A, KRAMVIS A. The complex role of HBeAg and its precursors in the pathway to hepatocellular carci?noma[J]. Viruses, 2023, 15(4): 857. DOI: 10.3390/v15040857.
[5] XIE XY, LV HR, LIU CX, et al. HBeAg mediates inflammatory func?tions of macrophages by TLR2 contributing to hepatic fibrosis[J]. BMC Med, 2021, 19(1): 247. DOI: 10.1186/s12916-021-02085-3.
[6] TSUKUDA S, WATASHI K. Hepatitis B virus biology and life cycle[J]. Antiviral Res, 2020, 182: 104925. DOI: 10.1016/j.antiviral.2020.104925.
[7] ITO K, KIM KH, LOK ASF, et al. Characterization of genotype-specific carboxyl-terminal cleavage sites of hepatitis B virus e anti?gen precursor and identification of furin as the candidate enzyme[J]. J Virol, 2009, 83(8): 3507-3517. DOI: 10.1128/JVI.02348-08.
[8] KRAMVIS A, CHANG KM, DANDRI M, et al. A roadmap for serum biomarkers for hepatitis B virus: Current status and future outlook[J]. Nat Rev Gastroenterol Hepatol, 2022, 19(11): 727-745. DOI: 10.1038/s41575-022-00649-z.
[9] TSAI KN, OU JH J. Hepatitis B virus e antigen and viral persistence[J]. Curr Opin Virol, 2021, 51: 158-163. DOI: 10.1016/j.coviro.2021.10.003.
[10] European Association for the Study of the Liver. EASL 2017 clinical prac?tice guidelines on the management of hepatitis B virus infection[J]. J Hepatol, 2017, 67(2): 370-398. DOI: 10.1016/j.jhep.2017.03.021.
[11] European Association for the Study of the Liver. EASL clinical prac?tice guidelines: Management of chronic hepatitis B virus infection[J]. J Hepatol, 2012, 57(1): 167-185. DOI: 10.1016/j.jhep.2012.02.010.
[12] HSU YS, CHIEN RN, YEH CT, et al. Long-term outcome after sponta?neous HBeAg seroconversion in patients with chronic hepatitis B[J]. Hepatology, 2002, 35(6): 1522-1527. DOI: 10.1053/jhep.2002.33638.
[13] NI YH, CHANG MH, CHEN PJ, et al. Viremia profiles in children with chronic hepatitis B virus infection and spontaneous e antigen sero?conversion[J]. Gastroenterology, 2007, 132(7): 2340-2345. DOI: 10.1053/j.gastro.2007.03.111.
[14] LIAW YF, LAU GKK, KAO JH, et al. Hepatitis B e antigen seroconver?sion: A critical event in chronic hepatitis B virus infection[J]. Dig Dis Sci, 2010, 55(10): 2727-2734. DOI: 10.1007/s10620-010-1179-4.
[15] WANG WW, BIAN HJ, LI FF, et al. HBeAg induces the expression of macrophage miR-155 to accelerate liver injury via promoting pro?duction of inflammatory cytokines[J]. Cell Mol Life Sci, 2018, 75(14): 2627-2641. DOI: 10.1007/s00018-018-2753-8.
[16] THOMSON AW, KNOLLE PA. Antigen-presenting cell function in the tolerogenic liver environment[J]. Nat Rev Immunol, 2010, 10(11): 753-766. DOI: 10.1038/nri2858.
[17] LIU J, JIANG M, MA ZY, et al. TLR1/2 ligand-stimulated mouse liver endothelial cells secrete IL-12 and trigger CD8+ T cell immunity in vi?tro[J]. J Immunol, 2013, 191(12): 6178-6190. DOI: 10.4049/jimmu?nol.1301262.
[18] XIE XH, LUO JZ, BROERING R, et al. HBeAg induces liver sinusoi?dal endothelial cell activation to promote intrahepatic CD8 T cell im?munity and HBV clearance[J]. Cell Mol Immunol, 2021, 18(11): 2572-2574. DOI: 10.1038/s41423-021-00769-7.
[19] YANG CL, LI N, WANG YW, et al. Serum levels of B-cell activating factor in chronic hepatitis B virus infection: Association with clinical diseases[J]. J Interferon Cytokine Res, 2014, 34(10): 787-794. DOI: 10.1089/jir.2014.0032.
[20] LI HJ, ZHAI NC, SONG HX, et al. The role of immune cells in chronic HBV infection[J]. J Clin Transl Hepatol, 2015, 3(4): 277-283. DOI: 10.14218/JCTH.2015.00026.
[21] LU BR, ZHANG BC, WANG LC, et al. Hepatitis B virus e antigen regu?lates monocyte function and promotes B lymphocyte activation[J]. Viral Immunol, 2017, 30(1): 35-44. DOI: 10.1089/vim.2016.0113.
[22] M?CKEL T, BASTA F, WEINMANN-MENKE J, et al. B cell activating factor (BAFF): Structure, functions, autoimmunity and clinical impli?cations in Systemic Lupus Erythematosus (SLE) [J]. Autoimmun Rev, 2021, 20(2): 102736. DOI: 10.1016/j.autrev.2020.102736.
[23] WANG L, ZENG XQ, WANG ZD, et al. Recent advances in under?standing T cell activation and exhaustion during HBV infection[J]. Virol Sin, 2023, 38(6): 851-859. DOI: 10.1016/j.virs.2023.10.007.
[24] JORGOVANOVIC D, SONG MJ, WANG LP, et al. Roles of IFN-γ in tumor progression and regression: A review[J]. Biomark Res, 2020, 8: 49. DOI: 10.1186/s40364-020-00228-x.
[25] CHISARI FV, ISOGAWA M, WIELAND SF. Pathogenesis of hepatitis B virus infection[J]. Pathol Biol (Paris), 2010, 58(4): 258-266. DOI: 10.1016/j.patbio.2009.11.001.
[26] XIE XH, LUO JZ, ZHU D, et al. HBeAg is indispensable for inducing liver sinusoidal endothelial cell activation by hepatitis B virus[J]. Front Cell Infect Microbiol, 2022, 12: 797915. DOI: 10.3389/fcimb.2022.797915.
[27] CHEN WJ, BIAN HJ, XIE XY, et al. Negative feedback loop of ERK/CREB/miR-212-3p inhibits HBeAg-induced macrophage activation[J]. J Cell Mol Med, 2020, 24(18): 10935-10945. DOI: 10.1111/jcmm.15723.
[28] TIAN YJ, KUO CF, AKBARI O, et al. Maternal-derived hepatitis B vi?rus e antigen alters macrophage function in offspring to drive viral persistence after vertical transmission[J]. Immunity, 2016, 44(5): 1204-1214. DOI: 10.1016/j.immuni.2016.04.008.
[29] HATIPOGLU I, ERCAN D, ACILAN C, et al. Hepatitis B virus e anti?gen (HBeAg) may have a negative effect on dendritic cell genera?tion[J]. Immunobiology, 2014, 219(12): 944-949. DOI: 10.1016/j.imbio.2014.07.020.
[30] SIOUD M, FL?ISAND Y. TLR agonists induce the differentiation of human bone marrow CD34+ progenitors into CD11c+ CD80/86+ DC capable of inducing a Th1-type response[J]. Eur J Immunol, 2007, 37(10): 2834-2846. DOI: 10.1002/eji.200737112.
[31] WANG FC, SONG MY, HU YH, et al. The relation of the frequency and functional molecules expression on plasmacytoid dendritic cells to postpartum hepatitis in women with HBeAg-positive chronic hepatitis B virus infection[J]. Front Immunol, 2022, 13: 1062123. DOI: 10.3389/fimmu.2022.1062123.
[32] LEU CM, LU YC, PENG WL, et al. The hepatitis B virus e antigen suppresses the respiratory burst and mobility of human monocytes and neutrophils[J]. Immunobiology, 2014, 219(11): 880-887. DOI: 10.1016/j.imbio.2014.07.008.
[33] YANG SS, LIAN GJ. ROS and diseases: Role in metabolism and en?ergy supply[J]. Mol Cell Biochem, 2020, 467(1-2): 1-12. DOI: 10.1007/s11010-019-03667-9.
[34] YANG FF, YU XP, ZHOU CL, et al. Hepatitis B e antigen induces the expansion of monocytic myeloid-derived suppressor cells to dampen T-cell function in chronic hepatitis B virus infection[J]. PLoS Pathog, 2019, 15(4): e1007690. DOI: 10.1371/journal.ppat.1007690.
[35] RACANELLI V, REHERMANN B. The liver as an immunological or?gan[J]. Hepatology, 2006, 43(2 Suppl 1): S54-S62. DOI: 10.1002/hep.21060.
[36] SUN C, FU BQ, GAO YF, et al. TGF-β1 down-regulation of NKG2D/DAP10 and 2B4/SAP expression on human NK cells contributes to HBV persistence[J]. PLoS Pathog, 2012, 8(3): e1002594. DOI: 10.1371/journal.ppat.1002594.
[37] MA QQ, DONG XY, LIU SY, et al. Hepatitis B e antigen induces NKG2A+ natural killer cell dysfunction via regulatory T cell-derived interleukin 10 in chronic hepatitis B virus infection[J]. Front Cell Dev Biol, 2020, 8: 421. DOI: 10.3389/fcell.2020.00421.
[38] JEGASKANDA S, AHN SH, SKINNER N, et al. Downregulation of in?terleukin-18-mediated cell signaling and interferon gamma expres?sion by the hepatitis B virus e antigen[J]. J Virol, 2014, 88(18): 10412-10420. DOI: 10.1128/JVI.00111-14.
[39] FERRANDO-MARTINEZ S, HUANG K, BENNETT AS, et al. HBeAg seroconversion is associated with a more effective PD-L1 blockade during chronic hepatitis B infection[J]. JHEP Rep, 2019, 1(3): 170-178. DOI: 10.1016/j.jhepr.2019.06.001.
[40] PARKER KH, BEURY DW, OSTRAND-ROSENBERG S. Myeloid-derived suppressor cells: Critical cells driving immune suppression in the tu?mor microenvironment[J]. Adv Cancer Res, 2015, 128: 95-139. DOI: 10.1016/bs.acr.2015.04.002.
[41] MUNN DH, MELLOR AL. IDO in the tumor microenvironment: Inflam?mation, counter-regulation, and tolerance[J]. Trends Immunol, 2016, 37(3): 193-207. DOI: 10.1016/j.it.2016.01.002.
[42] KRAMVIS A, KOSTAKI EG, HATZAKIS A, et al. Immunomodulatory function of HBeAg related to short-sighted evolution, transmissibility, and clinical manifestation of hepatitis B virus[J]. Front Microbiol, 2018, 9: 2521. DOI: 10.3389/fmicb.2018.02521.
[43] LEE WM, KING WC, JANSSEN HLA, et al. Hepatitis B e antigen loss in adults and children with chronic hepatitis B living in North America: A prospective cohort study[J]. J Viral Hepat, 2021, 28(11): 1526-1538. DOI: 10.1111/jvh.13591.
[44] TSAI SL, CHEN PJ, LAI MY, et al. Acute exacerbations of chronic type B hepatitis are accompanied by increased T cell responses to hepatitis B core and e antigens. Implications for hepatitis B e antigen seroconversion[J]. J Clin Invest, 1992, 89(1): 87-96. DOI: 10.1172/JCI115590.
[45] YANG HC, KAO JH. Revisiting the natural history of chronic HBV in?fection[J]. Curr Hepatol Rep, 2016, 15(3): 141-149. DOI: 10.1007/s11901-016-0304-z.
收稿日期:2024-01-25; 录用日期:2024-02-22
本文编辑:王莹
