高频不可逆电穿孔消融猪胰腺组织的效果观察
2024-06-06幸嵘杜霁儒翁原驰王峰刘超
幸嵘 杜霁儒 翁原驰 王峰 刘超


摘要: 目的 探索高頻不可逆电穿孔 (H-FIRE) 消融猪胰腺组织的效果。方法 采用开腹手术, 借助针式电极对12只猪释放电脉冲, 按照场强数值小、 中、 大设置三组参数 (1 000 V/cm、 1 500 V/cm、 2 500 V/cm) 进行消融。通过比较各组术后恢复情况、 消融面积、 组织病理学表现等数据验证H-FIRE消融猪胰腺组织的安全性、 有效性。计量资料两组间比较使用配对t检验。结果 所有实验猪均存活, 且获得明确的消融效果, 各组组织病理学均提示, 消融有效彻底, 消融区与正常组织区分界明显, 小场强组、 中场强组、 大场强组平均消融面积分别为(30. 96±3. 73)mm2、(51. 93±25. 26)mm2、(108. 90±55. 23) mm2, 大、 中场强组消融面积均显著大于小场强组 (P值均<0. 05), 中场强组与大场强组消融面积差异无统计学意义 (P>0. 05)。结论 在特定的消融参数下, 对猪胰腺进行H-FIRE消融安全、 有效。
关键词: 胰腺肿瘤; 电穿孔; 消融技术; 动物实验
基金项目: 山东省自然科学基金面上项目 (ZR2023MH111)
Effect of high-frequency irreversible electroporation in the ablation of porcine pancreatic tissue
XING Rong , DU Jiru , WENG Yuanchi , WANG Feng , LIU Chao . (1. School of Medical Devices, Shanghai University of Medicine & Health Sciences, Shanghai 201318, China;
2. Department of Dermatology, Tongren Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200336, China;
3. Department of Pancreatic Surgery, Ruijin Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China;
4. Liver Disease Center, The Affiliated Hospital of Qingdao University, Qingdao, Shandong 266003, China)
Corresponding author: LIU Chao, liuchao2311@126.com (ORCID: 0009-0002-9203-5800)
Abstract: Objective To investigate the effect of high-frequency irreversible electroporation (H-FIRE) in the ablation of pig pancreatic tissue. Methods Laparotomy was conducted in this study, and needle electrodes were used to release electric pulses in 12 pigs. Three sets of parameters were established for ablation at the low, medium, and high values of field strength (1 000 V/cm, 1 500 V/cm, and 2 500 V/cm) . The groups were compared in terms of the data including postoperative recovery, ablation area, and histopathological features to validate the safety and efficacy of H-FIRE in the ablation of porcine pancreatic tissue. The paired t-test was used for comparison of continuous data between two groups. Results All pigs in the experiment survived and showed a good effect of ablation. The histopathological analysis of all groups showed thorough and effective ablation, with a clear boundary between the ablated area and the normal tissue area. The mean ablation area in the low, medium, and high field strength groups was 30.96±3.73 mm2, 51.93±25.26 mm2, and 108.90±55.23 mm2, respectively, and the high and medium field strength groups had a significantly larger ablation area than the low field strength group (both P<0.05), while there was no significant difference in ablation area between the medium and high field strength groups (P>0.05) . Conclusion H-FIRE ablation is safe and effective for porcine pancreatic tissue under specific ablation parameters.
Key words: Pancreatic Neoplasms; Electroporation; Ablation Techniques; Animal Experimentation
Research funding: Shandong Provincial Natural Science Foundation Project (ZR2023MH111)
胰腺癌作为一种高度恶性的肿瘤, 大多数患者在发现时即不可切除[1] , 化疗与放疗是该病主要治疗方法, 但在过去数十年间其疗效并不理想[2 - 4] 。近年来, 微创疗法为胰腺癌患者提供了新的治疗选择, 如射频消融、 微波消融、不可逆电穿孔 (irreversible electroporation, IRE) 消融等。
IRE是一种适用于实体肿瘤的局部消融技术, 尤其可用于消融不适合手术或因特定的解剖位置而不适合热消融的肿瘤病灶[5] 。IRE作为一种能有效消融肿瘤的非热技术, 其通过在细胞膜施加高压电脉冲, 导致细胞膜磷脂双分子层产生不可逆的电穿孔, 细胞内外失去平衡, 进而引起靶细胞死亡[6] 。虽然IRE不可逆地损伤靶组织内所有细胞的膜结构, 但细胞外大分子和结缔组织成分的保存使得组织的结构完整性得以保留, 这一特性使IRE可用于大血管、 肠道、 胆道或尿路等重要结构附近的肿瘤消融, 而不对这些邻近重要组织结构造成损伤[5] 。然而, 传统IRE为单极性脉冲, 且脉宽较大, 造成消融效率较低、 需要较多脉冲数量以及消融不彻底[7-9] , 同时术中容易引起比较强烈的肌肉收缩等[10] 。目前临床上所使用的IRE消融多为上述传统的单脉冲IRE技术, 需要进一步改进。高频不可逆电穿孔 (high-frequency irreversible electroporation,H-FIRE) 是一种采用短脉宽双极复合脉冲进行消融的技术,相对于传统IRE的较宽脉宽以及单极性脉冲, H-FIRE理论上可能具有消融更彻底、 消融效率更高、 安全性更好、 肌肉收缩程度更轻等优势, 但是其安全性和有效性还需要进一步验证, 并且因为目前指南对胰腺消融参数的推荐均以传统IRE为参考, 需要探索出安全有效的H-FIRE胰腺消融参数范围。本研究首次利用国产H-FIRE设备对白猪胰腺进行消融, 探讨其对白猪胰腺组织消融的安全性和有效性, 为后续的深入研究包括合适的胰腺消融参数的确定等提供参考依据。
1 材料与方法
1. 1 高压电脉冲发生装置和电极针 本实验所用高压电脉冲发生装置和电极针 (上海诺生医疗科技有限公司,HFMP-02) 可提供脉宽2~50 ?s、 输出电压500~3 000 V、脉冲串外频率1~5 Hz的电脉冲; 电极为18G实心不锈钢双极电极针, 针尖裸露端长5~50 mm, 本实验选用裸露端长度为10 mm电极针。
1. 2 参数设置 基于相关文献[11] 及前期已开展研究, 本实验设置消融参数如下: 针间距10 mm、 针深度10 mm、 场强1 000~2 500 V/cm、 脉宽5 ?s、 脉冲个数100个。
1. 3 实验动物 白猪是国内外较理想的模式动物之一,体型适中, 性情温顺, 已广泛用于评估IRE消融胰腺、 肾脏以及肝脏等组织[12-15] , 可恰当模拟实验器械的临床使用,因而本实验选择白猪进行复合陡脉冲治疗用于胰腺消融的进一步研究。12只白猪, 4雌8雄, 体质量均在45~50 kg,以其胰腺组织为消融对象, 按照场强数值小、 中、 大设置三组参数 (1 000 V/cm, 1 500 V/cm, 2 500 V/cm), 每组随机选取4只白猪, 小场强组白猪编号为P01~P04, 中场强组白猪编号为P05~P08, 大场强组白猪编号为P09~P12。
1. 4 胰腺开腹IRE消融术 术前所有实验猪均应禁水、禁食12 h。实验猪行静脉注射替来他明和唑拉西泮, 待其镇静后转运至手术台, 采取仰卧位。连接呼吸麻醉系统、心电监护仪。对腹部剃毛清洁消毒后, 铺设创巾。打开腹部, 完全暴露出胰腺实质。之后, 电极针连接设备在盐水中放电, 检测设备。设备检测正常后, 将两根电极沿垂直于胰腺表面的方向插入胰头进行消融, 两根针保持平行,接着, 按照所设置的参数进行放电。治疗完成后, 拔出電极针并进行缝合, 注射抗生素预防术后感染, 实验猪苏醒后, 将其转移至无菌动物实验房继续饲养护理, 术后每天注射抗生素抗感染。术后第7天取材前需禁水、 禁食12 h。
1. 5 实验室检查 在术前及消融后第7天取材前, 于实验猪颈部采集血液进行血常规 (红细胞、 血红蛋白、 白细胞、 血小板) 与血淀粉酶检查。
1. 6 影像学检查 在大、 中、 小场强组中各随机选取一只实验猪, 在消融术后第7天麻醉下行MRI检查。
1. 7 病理学评估 在消融术后第7天处死所有实验猪并取材胰腺组织观察, 组织取样后, 进行石蜡包埋。沿与电极针道垂直的方向进行连续切片5~10张, 切片厚度为4 ?m,选取1~2张组织完整、 切片薄厚均匀、 平坦, 无刀痕、 裂隙,无褶皱, 折叠的蜡膜行苏木精-伊红 (HE) 染色, 显微镜下观察消融情况。基于相关文献[14] , 有效IRE消融标准: 消融区表现为间质水肿, 胰腺实质细胞凋亡坏死, 伴出血, 消融区与正常胰腺组织之间存在明显的边界。
1. 8 统计学方法 采用SAS 9. 4软件分析数据。计量资料以x ˉ±s表示, 两组间比较使用配对t检验。P<0. 05为差异有统计学意义。
2 结果
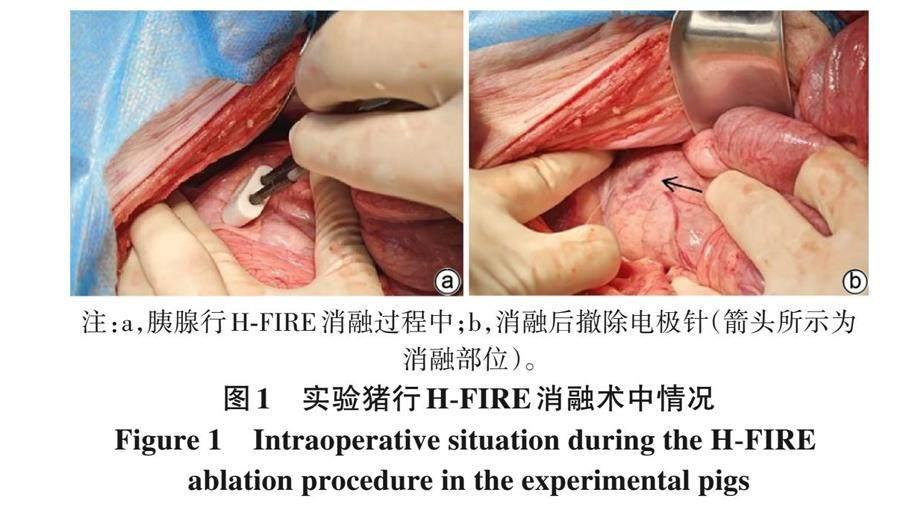
2. 1 IRE术中与术后情况 所有实验猪开腹手术均顺利开展, 消融过程中, 所有实验猪均出现与脉冲频率相伴的轻度肌肉收缩 (图1)。术后, 所有实验猪均存活, 伤口均无红肿、 异常渗血等症状, 未发现进食、 饮水、 排便以及其他行为异常。
2. 2 实验室检查结果 IRE消融后, 实验猪红细胞、 血红蛋白、 血清淀粉酶及血小板术前与术后7天比较差异均无统计学意义 (P值均>0. 05); 术后7天白细胞明显高于术前 (P<0. 001)(表1)。
2. 3 病理学表现 所有实验猪胰腺组织可见消融灶,消融灶中心见坏死及出血, 其周围胰腺组织变性, 纤维组织增生, 炎细胞浸润, 提示消融有效。各个消融切片中, 消融灶中心区、 边缘区以及电极针周围区域HE染色均匀, 同质性较好 (图2)。对各组参数的消融区域面积进行统计分析, 结果显示小场强组、 中场强组、 大场强组平均消融面积分别为(30. 96±3. 73) mm2、(51. 93±25. 26) mm2、(108. 90±55. 23) mm2,大、 中场强组消融面积均显著大于小场强组 (P值均<0. 05), 中场强组与大场强组消融面积差异无统计学意义 (P>0. 05)(图3)。
2. 4 影像学变化 实验猪胰腺组织行MRI平扫加增强,观察IRE消融胰腺组织的效果。结果显示, 所有胰腺组织均可见消融灶, 增强扫描病灶无强化, 边界较清晰 (图4)。
3 讨论
胰腺癌是消化系统常见的恶性肿瘤之一, 早期诊断较困难, 大多数患者基本没有手术切除指征[16-17] 。对于无法手术的胰腺癌患者, 放疗与化疗是标准疗法, 但数据显示中位生存期为5~14个月[18-19]。局部消融作为指南[20] 推荐的治疗胰腺癌的手段之一, 可实现局部控制, 进而减轻肿瘤负荷, 可使部分患者获得二次手术机会。射频消融、 微波消融以及高能聚焦超声是常见局灶治疗手段, 然而这些技术是基于温度效应, 可能受到热沉效应的影响, 进而导致不完全消融, 并且可能对非靶向组织造成热损伤[21] 。
IRE利用高压电脉冲使细胞膜上产生纳米级微孔,不可逆地打破细胞内外的平衡, 进而引起细胞死亡[7] 。其主要具有以下特点[21-23] :(1) 非热的消融方式, 无热沉效应;(2) 组织选择性, 在消融肿瘤靶病灶时不易损伤区域内以及邻近的大血管、 胆管和神经等重要组织结构;(3) 消融边界清晰, 可准确评估疗效。目前, IRE已被用于临床治疗肝癌[24] 、 胰腺癌[25] 、 肾癌[26] 等, 是一种可有效实现肿瘤消融的技术, 其对肿瘤的消融效果已在动物实验和临床研究中得到证实[7] 。
尽管IRE显示出具有消融肿瘤的优势, 但传统IRE仍面临消融效率不高、 消融不彻底、 融形状不规则[7-9] 、 肌肉收缩较强烈[10] 等挑战。H-FIRE是一种采用短脉宽双极性 (即交替极性) 复合脉冲进行消融的技术, 已被用于前列腺肿瘤等治疗[27] , 并取得了很好的治疗效果。相对于传统IRE的较宽脉宽以及单极性脉冲, H-FIRE理论上可能具有消融效率更高、 安全性更好、 肌肉收缩程度更轻等优势。因此, 本实验利用基于H-FIRE的复合陡脉冲治疗设备与电极针对白猪胰腺进行消融, 评估其对白猪胰腺组织消融的安全性和有效性。本实验采取的H-FIRE 参数分别为: 场强 1 000~2 500 V/cm, 脉宽为5 ?s, 脉冲数为100个脉冲, 与专家共识[28] 推荐以及其他研 究[29]中 应 用 的 传 统 IRE 消 融 参 数 相 比(场 强1 500 V/cm, 脉宽70~90 ?s, 数百至上千个脉冲), 脉宽更小, 脉冲数量更少。结果显示术后7天仅白细胞明显增高 (P<0. 05), 可能与手术操作相关, 提示H-FIRE消融未对实验猪产生严重不良影响, 安全性良好; 猪胰腺组织行H-FIRE消融后, HE染色切片可见消融灶内部消融彻底, 边界清晰, 且消融区较规则, 提示消融有效彻底;通过MRI观察猪胰腺组织影像学变化, 结果显示胰腺组织经H-FIRE消融后的消融灶均边界清晰, 且增强扫描病灶无强化, 进一步证明H-FIRE消融有效且可被影像学检测。此外, 实验猪消融过程中出现与脉冲频率相伴的轻度肌肉收缩, 提示H-FIRE可以减轻与传统IRE脉冲相关的肌肉收缩, 后续可以进一步进行实验量化比较H-FIRE和传统IRE两者术中肌肉震颤程度。
综上所述, 结合一般情况、 实验室检查、 组织病理学以及影像学检查等, 动物实验中, 场强1 000~2 500 V/cm、脉宽5 ?s、 脉冲数100参数下的H-FIRE可實现比较彻底的消融效果, 具有较高消融效率和良好的安全性, 可为进一步的动物及临床研究提供参考依据。伦理学声明: 本实验中的所有操作均遵守动物福利法规, 且已通过上海甲干生物科技有限公司伦理委员会批准, 批号: JGLL-20210316002。利益冲突声明: 本文不存在任何利益冲突。
作者贡献声明: 幸嵘负责实验设计和操作, 资料分析, 撰写论文; 杜霁儒负责资料分析, 撰写论文; 翁原驰负责动物实验操作; 王峰参与实验设计及修改论文; 刘超负责拟定写作思路, 指导撰写文章并最后定稿。幸嵘、 杜霁儒对本文贡献等同, 同为第一作者。
参考文献:
[1] TORRE LA, SIEGEL RL, WARD EM, et al. Global cancer incidence and mortality rates and trends: An update[J]. Cancer Epidemiol Biomarkers Prev, 2016, 25(1): 16-27. DOI: 10.1158/1055-9965.EPI-15-0578.
[2] KWON W, THOMAS A, KLUGER MD. Irreversible electroporation of locally advanced pancreatic cancer[J]. Semin Oncol, 2021, 48(1): 84-94. DOI: 10.1053/j.seminoncol.2021.02.004.
[3] ZHANG ZH, HE SL, WANG P, et al. The efficacy and safety of gem?citabine-based combination therapy vs. gemcitabine alone for the treatment of advanced pancreatic cancer: A systematic review and meta-analysis[J]. J Gastrointest Oncol, 2022, 13(4): 1967-1980. DOI: 10.21037/jgo-22-624.
[4] SPRINGFELD C, J?GER D, B?CHLER MW, et al. Chemotherapy for pancreatic cancer[J]. Presse Med, 2019, 48(3 Pt 2): e159-e174. DOI: 10.1016/j.lpm.2019.02.025.
[5] GEBOERS B, SCHEFFER HJ, GRAYBILL PM, et al. High-voltage electrical pulses in oncology: Irreversible electroporation, electro?chemotherapy, gene electrotransfer, electrofusion, and electroimmu?notherapy[J]. Radiology, 2020, 295(2): 254-272. DOI: 10.1148/ra?diol.2020192190.
[6] LIU CP, YE P, ZHANG MY. Research progress in irreversible electro?poration ablation for tumors[J]. J Interv Radiol, 2023, 32(5): 498-502. DOI: 10.3969/j.issn.1008-794X.2023.05.018.
刘春苹, 叶萍, 张明悦. 不可逆电穿孔对肿瘤消融的研究进展[J]. 介入放射学杂志, 2023, 32(5): 498-502. DOI: 10.3969/j. issn.1008-794X.2023.05.018.
[7] GARCIA PA, KOS B, ROSSMEISL JH Jr, et al. Predictive therapeutic planning for irreversible electroporation treatment of spontaneous ma?lignant glioma[J]. Med Phys, 2017, 44(9): 4968-4980. DOI: 10.1002/mp.12401.
[8] LATOUCHE EL, SANO MB, LORENZO MF, et al. Irreversible electro?poration for the ablation of pancreatic malignancies: A patient-specific methodology[J]. J Surg Oncol, 2017, 115(6): 711-717. DOI: 10.1002/jso.24566.
[9] QASRAWI R, SILVE L, BURD?O F, et al. Anatomically realistic simula?tions of liver ablation by irreversible electroporation: Impact of blood vessels on ablation volumes and undertreatment[J]. Technol Cancer Res Treat, 2017, 16(6): 783-792. DOI: 10.1177/1533034616687477.
[10] MARTIN RC, SCHWARTZ E, ADAMS J, et al. Intra-operative anesthesia management in patients undergoing surgical irreversible electro?poration of the pancreas, liver, kidney, and retroperitoneal tumors[J]. Anesth Pain Med, 2015, 5(3): e22786. DOI: 10.5812/aapm.22786.
[11] MEROLA G, FUSCO R, DI BERNARDO E, et al. Design and charac?terization of a minimally invasive bipolar electrode for electroporation[J]. Biology (Basel), 2020, 9(9): 303. DOI: 10.3390/biology9090303.
[12] LEE EW, SHAHROUKI P, PETERSON S, et al. Safety of irreversible electroporation ablation of the pancreas[J]. Pancreas, 2021, 50(9): 1281-1286. DOI: 10.1097/MPA.0000000000001916.
[13] AGNASS P, van VELDHUISEN E, VOGEL JA, et al. Thermodynamic profiling during irreversible electroporation in porcine liver and pan?creas: A case study series[J]. J Clin Transl Res, 2020, 5(3): 109-132.
[14] SOROKIN I, CANVASSER N, JOHNSON B, et al. Irreversible electro?poration for renal ablation does not cause significant injury to adjacent ureter or bowel in a porcine model[J]. J Endourol, 2021, 35(6): 873-877. DOI: 10.1089/end.2020.0856.
[15] MA XY, XIAO YY, ZHANG X, et al. Comparison of irreversible elec?troporation with cryotherapyablation in porcine liver tissue[J]. Chin J Interv Imag Ther, 2015, 12(5): 267-270. DOI: 10.13929/j.1672-8475.2015.05.004.
马旭阳, 肖越勇, 张欣, 等. 不可逆电穿孔与冷冻治疗消融猪肝脏组织对比分析[J]. 中国介入影像与治疗学, 2015, 12(5): 267-270. DOI: 10.13929/j.1672-8475.2015.05.004.
[16] MIZRAHI JD, SURANA R, VALLE JW, et al. Pancreatic cancer[J]. Lancet, 2020, 395(10242): 2008-2020. DOI: 10.1016/S0140-6736(20)30974-0.
[17] GUGENHEIM J, CROVETTO A, PETRUCCIANI N. Neoadjuvant therapy for pancreatic cancer[J]. Updates Surg, 2022, 74(1): 35-42. DOI: 10.1007/s13304-021-01186-1.
[18] ZHANG BL, ZHOU FY, HONG JZ, et al. The role of FOLFIRINOX in metastatic pancreatic cancer: A meta-analysis[J]. World J Surg On?col, 2021, 19(1): 182. DOI: 10.1186/s12957-021-02291-6.
[19] PASSARDI A, RAPPOSELLI IG, SCARPI E, et al. Multimodal treatment with GEMOX plus helical tomotherapy in unresectable locally ad?vanced pancreatic cancer: A pooled analysis of two phase 2 studies[J]. Biomolecules, 2021, 11(8): 1200. DOI: 10.3390/biom11081200.
[20] General Office of National Health Commission. Standard for diagno?sis and treatment of pancreatic cancer(2022 edition) [J]. J Clin Hepatol, 2022, 38(5): 1006-1030. DOI: 10.3969/j. issn. 1001-5256.2022.05.007.
国家卫生健康委办公厅. 胰腺癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38(5): 1006-1030. DOI: 10.3969/j.issn.1001-5256.2022.05.007.
[21] TASU JP, TOUGERON D, ROLS MP. Irreversible electroporation and electrochemotherapy in oncology: State of the art[J]. Diagn Interv Imaging, 2022, 103(11): 499-509. DOI: 10.1016/j.diii.2022.09.009.
[22] LIANG B, NIU LZ, ZENG JY, et al. Irreversible electroporation abla?tion of the hepatic region close to the gallbladder: Pathological ob?servation in experimental rabbits[J]. J Interv Radiol, 2014, 23(4): 320-324. DOI: 10.3969/j.issn.1008-794X.2014.04.012.
梁冰, 牛立志, 曾健滢, 等. 不可逆电穿孔消融兔胆囊侧肝脏病理学观察[J]. 介入放射学杂志, 2014, 23(4): 320-324. DOI: 10.3969/j. issn.1008-794X.2014.04.012.
[23] NIU LZ, ZENG JY, ZHANG YS, et al. Irreversible electroporation ab?lation therapy for pancreatic adenocarcinoma: Observation of its safety and short-term effect[J]. J Interv Radiol, 2016, 25(3): 225-230.
牛立志, 曾健滢, 张怡湜, 等. 不可逆电穿孔消融治疗胰腺癌的安全性及近期疗效观察[J]. 介入放射学杂志, 2016, 25(3): 225-230.
[24] MEIJERINK MR, RUARUS AH, VROOMEN LGPH, et al. Irreversible electroporation to treat unresectable colorectal liver metastases (COLDFIRE-2): A phase II, two-center, single-arm clinical trial[J]. Radiology, 2021, 299(2): 470-480. DOI: 10.1148/radiol.2021203089.
[25] RUARUS AH, VROOMEN LGPH, GEBOERS B, et al. Percutaneous irreversible electroporation in locally advanced and recurrent pan?creatic cancer (PANFIRE-2): A multicenter, prospective, single-arm, phase II study[J]. Radiology, 2020, 294(1): 212-220. DOI: 10.1148/radiol.2019191109.
[26] WAH TM, LENTON J, SMITH J, et al. Irreversible electroporation (IRE) in renal cell carcinoma (RCC): A mid-term clinical experience[J]. Eur Radiol, 2021, 31(10): 7491-7499. DOI: 10.1007/s00330-021-07846-5.
[27] WANG HF, XUE W, YAN WG, et al. Extended focal ablation of localized prostate cancer with high-frequency irreversible electroporation: A nonrandomized controlled trial[J]. JAMA Surg, 2022, 157(8): 693-700. DOI: 10.1001/jamasurg.2022.2230.
[28] Chinese Society of Interventional and Minimally Invasive Therapy, China Medicine Education Association. Expert consensus on image-guided irreversible electroporation ablation for pancreatic cancer (2018)[J]. J Clin Hepatol, 2019, 35(2): 299-302. DOI: 10.3969/j.issn.1001-5256.2019.02.011.
中国医药教育协会介入微创治疗专业委员会. 影像学引导胰腺癌不可逆电穿孔消融治疗专家共识2018版[J]. 临床肝胆病杂志, 2019, 35(2): 299-302. DOI: 10.3969/j.issn.1001-5256.2019.02.011.
[29] RASHID MF, HECHT EM, STEINMAN JA, et al. Irreversible electro?poration of pancreatic adenocarcinoma: a primer for the radiologist[J]. Abdom Radiol (NY), 2018, 43(2): 457-466. DOI: 10.1007/s00261-017-1349-3.
收稿日期:2023-08-30; 錄用日期:2023-10-27
本文编辑:王莹
