妊娠期急性胰腺炎的临床特征及危险因素分析
2024-06-06吴迪代大华梁文美付豹傅小云
吴迪 代大华 梁文美 付豹 傅小云


摘要: 目的 分析妊娠期急性胰腺炎(APIP)的臨床特征及母婴结局, 探讨病情加重的危险因素并试图建立预测模型。方法 选取2017年1月—2022年12月遵义医科大学附属医院收治的52例APIP患者, 按病情严重程度分为轻型急性胰腺炎(MAP, n=32)、 中度重症胰腺炎 (MSAP, n=8) 和重症胰腺炎 (SAP, n=12), 并进行回顾性分析。对各组临床资料进行Logistic回归分析, 绘制受试者工作特征曲线 (ROC曲线) 评估危险因素对APIP病情严重程度的预测价值。符合正态分布计量资料多组间比较采用单因素方差分析, 进一步两两比较采用LSD-t检验; 非正态分布的计量资料多组间比较采用Kruskal-Wallis H检验, 进一步两两比较采用Wilcoxon检验。计数资料组间比较采用χ2检验。结果 52例APIP患者按病因分组: 26例(50. 0%) 患者为高脂性胰腺炎、 20例 (38. 5%) 患者为胆源性胰腺炎、 6例 (11. 5%) 患者为特发性胰腺炎。依据孕周分组:1例 (1. 9%) 患者处在妊娠早期、 25例 (48. 1%) 患者处在妊娠中期、 26例 (50. 0%) 患者处在妊娠晚期。10例 (19. 2%) 患者并发急性呼吸窘迫综合征 (ARDS), 其中9例 (90%) 使用了呼吸机支持。不同严重程度APIP患者间AST、 ALT、 尿素氮、 血糖、CRP、 INR、 是否肺炎、 是否ARDS、 是否脓毒症、 是否肝功能不全和是否凝血功能不全的组间差异均有统计学意义 (P值均<0. 05)。单因素分析显示, APIP严重程度与血糖、 尿素氮、 CRP和肺炎有相关性 (P值均<0. 05), 肺炎是APIP病情加重的危险因素 (OR=18. 938, 95%CI: 1. 020~351. 747, P=0. 048)。CRP、 血糖、 尿素氮、 INR联合预测APIP严重程度的ROC曲线下面积 (0. 954) 高于CRP、 血糖、 尿素氮、 INR的单独检测值 (0. 778、 0. 796、 0. 721、 0. 801)。结论 肺炎是APIP病情加重的危险因素, CRP、 血糖、 尿素氮、 INR可联合预测APIP严重程度。
关键词: 胰腺炎; 孕妇; 预后; 危险因素
基金项目: 贵州省卫生健康委科学基金项目 (gzwk2022-015)
Clinical features of acute pancreatitis in pregnancy and related risk factors
WU Di, DAI Dahua, LIANG Wenmei, FU Bao, FU Xiaoyun. (Department of Critical Care Medicine, Affiliated Hospital of Zunyi
Medical University, Zunyi, Guizhou 563003, China)
Corresponding author: FU Xiaoyun, zyyxyfxy@163.com (ORCID: 0009-0000-8967-0518)
Abstract: Objective To investigate the clinical features and maternal and fetal outcomes of acute pancreatitis in pregnancy (APIP) and the risk factors for disease aggravation, and to establish a predictive model. Methods A retrospective analysis was performed for 52 APIP patients who were admitted to Affiliated Hospital of Zunyi Medical University from January 2017 to December 2022, and according to disease severity, they were divided into mild acute pancreatitis (MAP) group with 32 patients, moderate-severe acute pancreatitis (MSAP) group with 8 patients, and severe acute pancreatitis (SAP) group with 12 patients. The logistic regression analysis was performed for the clinical data of each group, and the receiver operating characteristic (ROC) curves were plotted to assess the value of risk factors in predicting the severity of APIP. A one-way analysis of variance was used for comparison of normally distributed continuous data between multiple groups, and the least significant difference t-test was used for further comparision between two groups. The Kruskal-Wallis H test was used for comparison of non-normally distributed continuous data between multiple groups, and the Wilcoxon rank-sum test was used for further comparision between two groups; the chi-square test was used for comparison of categorical data between groups. Results Of all patients in terms of etiology,26 (50%) had hyperlipidemic pancreatitis,20 (38.4%) had biliary pancreatitis, and 6 (11.5%) had idiopathic pancreatitis. In terms of gestational week, 1 patient (1.9%) was in early pregnancy, 25 (48.1%) were in mid-pregnancy, and 26 (50.0%) were in late pregnancy. A total of 10 patients (19.2%) had acute respiratory distress syndrome (ARDS), among whom 9 (90%) required respiratory support. There were significant differences between the patients with different severities of APIP in aspartate aminotransferase, alanine aminotransferase, blood urea nitrogen, blood glucose, C-reactive protein (CRP), international normalized ratio (INR), pneumonia, ARDS, sepsis, hepatic insufficiency, and coagulation dysfunction (all P<0.05) . The univariate analysis showed that the severity of APIP was associated with blood glucose, blood urea nitrogen, CRP, and pneumonia (all P<0.05), and pneumonia was a risk factor for the aggravation of APIP (odds ratio=18.938, 95% confidence interval: 1.020 — 351.747, P=0.048) . CRP, blood glucose, blood urea nitrogen, and INR used in combination had a larger area under the ROC curve than each index used alone (0.954 vs 0.778/0.796/0.721/0.801) . Conclusion Pneumonia is a risk factor for the aggravation of APIP, and the combination of CRP, blood glucose, blood urea nitrogen, and INR can be used to predict the severity of APIP.
Key words: Pancreatitis; Pregnant Women; Prognosis; Risk Factors
Research funding: Guizhou Provincial Health Commission Scientific Research Fund Project (gzwk2022-015)
妊娠期急性胰腺炎 (acute pancreatitis in pregnancy,APIP) 是妊娠期间少见的并发症之一, 病情进展迅速, 可能出现胰腺囊肿、 坏死、 急性呼吸窘迫综合征甚至多器官功能衰竭等不良并发症, 严重威胁着母婴的生命健康。近些年由于早期诊断的改进和对孕产妇以及新生儿的重症监护水平的提高, 病死率已经有所降低[1-2]。然而,APIP的发生会严重威胁妊娠期女性的母婴健康, 需要临床医生高度重视。本研究通过收集APIP患者的相关资料, 描述APIP的临床类型, 分析病因、 严重程度、 并发症、实验室指标和预后, 探讨病情加重的危险因素并试图建立预测模型, 以期为APIP的诊疗提供临床依据。
1 资料与方法
1. 1 研究对象 选取遵义医科大学附属医院2017年1 月—2022年12月收治的APIP患者进行单中心、 回顾性研究。纳入标准是入院48 h内诊断的APIP患者, 排除标准包括慢性胰腺炎和病史不全的患者。
1. 2 诊断标准和分类 AP的诊断是基于修订的Atlanta标准[3] , 至少包括以下3项标准中的2项:(1) 急性上腹部疼痛;(2) 血清淀粉酶和脂肪酶高于正常值上限的3倍;(3) 典型的影像学表现。APIP定义[4] 为怀孕期和生产后42天内发生AP。APIP的严重程度根据修订的Atlantic标准分为3种:(1) 轻型急性胰腺炎 (MAP) 是指不会出现器官衰竭和局部并发症;(2) 中度重症胰腺炎 (MSAP) 是指出现持续时间小于48 h的短暂性器官衰竭或并发症;(3) 重症胰腺炎 (SAP) 是指持续性器官衰竭或局部/全身并发症超过48 h。APIP按不同的病因[5] 进行分类, 包括高甘油三酯性胰腺炎、 急性胆源性胰腺炎和特发性胰腺炎。当血液中甘油三酯>11. 3 mmol/L (1 000 mg/dL) 或甘油三酯为5. 65~11. 3 mmol/L, 排除其他致病因素, 且血清呈现乳糜状可考虑诊断为高甘油三酯性胰腺炎[6-7] 。特发性胰腺炎是指经体格检查、 实验室及影像学检查仍然无法明确病因。妊娠时期分为妊娠早期 (1~3个月)、妊娠中期 (4~6个月) 和妊娠晚期 (7~10个月)。器官功能障碍基于Ranson评分系统[8] 和APACHE Ⅱ系统进行评估。局部并发症包括急性胰周积液、 胰腺假性囊肿、 急性坏死和包膜坏死。全身并发症包括脓毒症、 急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS)、器官功能衰竭、 腹腔内高压和腹腔间隔综合征[9] 。
1. 3 数据收集 从电子病例中收集纳入APIP患者的一般信息、 临床资料及预后。一般信息包括孕妇年龄、 孕育史、 病因、 发病孕龄。临床资料包括病理分型、 严重程度、临床症状、 住院时间、 剖宫产或者引产、 是否进入ICU及ICU停留时间、 进入ICU时的APACHE Ⅱ评分、 入院时Ranson评分、 入院24 h内的检验指标 [血尿淀粉酶、 白细胞计数、 中性粒细胞分类、 淋巴细胞比例、 中性粒细胞/淋巴细胞比值 (NLR)、 血小板计数、 钾、 钠、 钙、 ALT、 AST、 白蛋白、 尿素氮、 肌酐、 血糖、 甘油三酯、 胆固醇、 CRP、 国际标准化比率 (INR)、 PT、 部分活化凝血酶原时间 (APTT)]、影像学检查 [超声、 CT、 磁共振胰胆管成像 (MRCP)]、 并发症。此外, 干预措施和母婴结局也被详细收集。
1. 4 统计学分析 采用SPSS 26. 0软件对数据资料进行统计分析。符合正态分布且方差齐的计量资料以x ˉ±s表示, 多组间比较采用单因素方差分析, 进一步两两比较采用LSD-t检验; 非正态分布的计量资料以M (P25~P75) 表示, 多组间比较采用Kruskal-Wallis H检验, 进一步两两比较采用Wilcoxon检验。计数资料的组间比较采用χ2检验。对单因素Logistic回归分析组间有统计学意义的变量进行多因素Logistic回归分析。绘制受试者工作特征曲线 (ROC曲线), 利用曲线下面积 (AUC) 衡量危险因素对APIP病情严重程度的预测价值。P<0. 05为差异有统计学意义。
2 结果
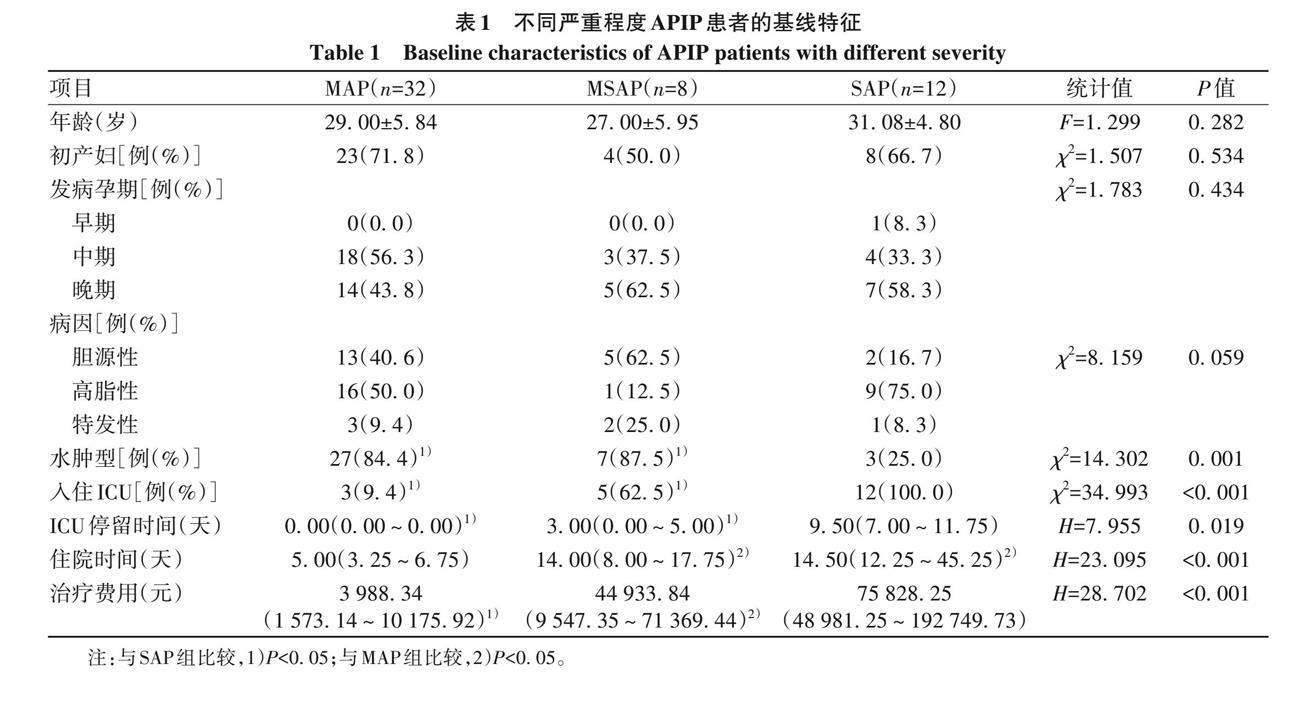
2. 1 一般资料 本院在2017年1月—2022年12月共收治妊娠期妇女26 255例, 根据纳入和排除标准, 52例APIP患者被纳入本研究, APIP发病率为1. 9/1 000。纳入患者的人口统计学和临床特征如表1所示, 年龄18~43岁, 平均 (29. 17±5. 67) 岁。17例 (32. 7%) 患者为初产妇, 35例 (67. 3%) 患者为经产妇。依据发病孕周分组:1例(1. 9%)妊娠早期、 25例(48. 1%)妊娠中期、 26例(50. 0%)妊娠晚期。依据疾病严重程度分组: 32 例(61. 5%) 患者为MAP、 8例 (15. 4%) 患者为MSAP、 12例(23. 1%) 患者为SAP。按病因分组: 26例 (50. 0%) 患者为高脂性胰腺炎、 20例 (38. 5%) 患者为胆源性胰腺炎、6 例(11. 5%) 患者为特发性胰腺炎。依据疾病病理类型分组: 37例 (71. 2%) 患者为水肿型胰腺炎、 15例 (28. 8%)患者为坏死性胰腺炎。腹痛和呕吐是APIP患者最主要的两种临床症状, 有51例 (98. 1%) 患者存在腹痛症状、25例 (48. 1%) 患者同时存在腹痛伴呕吐、 1例 (1. 9%) 患者仅表现出呕吐症状。患者中位住院时间为6. 5 (4. 0~13. 8) 天。20例 (38. 4%) 患者因病情变化入住ICU, ICU停留时间为7 (5~11) 天。52例患者中位住院费用為10 086. 27 (2 684. 86~49 095. 19) 元。
不同严重程度APIP患者的年龄、 病因、 孕育史和发病孕期的组间差异无统计学意义 (P值均>0. 05)。但是在病理类型、 是否入住ICU、 ICU停留时间、 总住院时间和治疗费用方面均存在显著差异, 进一步组内比较显示: 在病理类型、 是否入住ICU和ICU停留时间方面,SAP组与其他两组差异均有统计学意义 (P值均<0. 05)。同时病情越重, ICU停留时间越长 (P=0. 019)(表1)。
2. 2 不同严重程度APIP患者生化指标比较 不同严重程度APIP患者的ALT、 AST、 尿素氮、 血糖、 CRP、 INR和NLR组间差异均有统计学意义 (P值均<0. 05)。进一步组内比较显示: 与SAP组比较, MSAP组的ALT和AST水平明显升高 (P值均<0. 05), MAP组的尿素氮、 血糖、CRP、 INR和NLR明显降低 (P值均<0. 05)。而三组间的血淀粉酶、 尿淀粉酶、 白细胞计数、 白蛋白、 肌酐、 甘油三酯和PT未见明显差异 (P值均>0. 05)(表2)。
2. 3 不同严重程度APIP的临床特征及预后 在合并症方面, 2例 (3. 8%) 患者合并妊娠期糖尿病。在并发症方面, 6例 (11. 5%) 患者合并脓毒症, 5例 (9. 6%) 患者存在肝功能不全, 2例 (3. 8%) 患者存在肾功能不全, 16例(30. 8%) 患者合并肺炎, 10例 (19. 2%) 患者并发ARDS,2例 (3. 8%) 患者存在凝血功能不全, 7例 (13. 5%) 患者合并腹腔感染。在干预措施上, 并发ARDS的10例患者中有9例使用了呼吸机。有2例 (3. 8%) 患者仅接受血液透析, 1例 (1. 9%) 患者仅接受血浆置换, 2例 (3. 8%)患者接受血液透析联合血浆置换。在妊娠晚期的26例患者中有19例选择剖宫产或顺产, 有1例选择提前引产, 6例选择继续妊娠。不同严重程度APIP患者并发肺炎、 ARDS、 脓毒症、 肝功能不全和凝血功能不全组间比较差异均有统计学意义 (P值均<0. 05)。进一步组内比较显示: MAP组和MSAP组比较, 肝功能不全、 ARDS发生率差异具有统计学意义 (P值均<0. 05); MSAP组和SAP组比较, 脓毒症、 肝功能不全发生率差异具有统计学意义 (P值均<0. 05); MAP组和SAP组比较, 肺炎、 腹腔感染、 脓毒症、 凝血功能不全和ARDS发生率差异具有统计学意义 (P值均<0. 05)。
入院后23例(44. 2%)患者行剖宫产或顺产, 1例(1. 9%) 引产, 28例 (53. 8%) 未终止妊娠, 三组间产科干预方式差异无统计学意义 (P>0. 05)。随访52例患者,44例 (84. 6%) 母婴存活, 7例 (13. 5%) 胎儿丢失, 无APIP患者死亡事件发生。其中妊娠早期1例胎儿丢失, 妊娠中期5例患胎儿丢失, 妊娠晚期1例胎儿丢失。在随访胎儿丢失率方面, 三组患者的差异无统计学意义 (P>0. 05)。不同严重程度APIP患者的APACHEⅡ评分比较差异有统计学意义 (P<0. 05), 组内比较显示: SAP组显著高于MAP组和MSAP组。而Ranson评分在三组间差异无统计学意义 (P>0. 05)(表3)。
2. 4 APIP严重程度危险因素的Logistic分析 对不同严重程度APIP患者间存在统计学意义的变量进行单因素回归分析显示, APIP严重程度与血糖、 尿素氮、 CRP、肺炎具有相关性 (P值均<0. 05)。对单因素回归分析中存在统计学意义的变量采取多因素有序Logistic回归分析, 结果显示, 肺炎是影响APIP严重程度的危险因素(P= 0. 048)(表4)。
2. 5 APIP严重程度预判的ROC曲线分析 ROC曲线分析结果显示CRP、 血糖、 尿素氮、 INR对病情严重程度预测值AUC分别为0. 778、 0. 796、 0. 721、 0. 801。将四种指标联合检测预测 APIP 严重程度的 AUC 值最大(0. 954), 具有更高的诊断效能 (表5, 图1)。
3 讨论
妊娠期胰腺炎是指在妊娠期间发生的AP, 是一种相对罕见但严重的疾病, 可能导致母亲和胎儿出现严重的并发症。既往研究[10-11] 显示APIP发病率高达1/1 000~1/10 000, 而普通人群中胰腺炎的发病率为 30~40/100 000[12] , 可见妊娠期间胰腺炎发病率高于普通人群。本研究中APIP发病率1. 9/1 000, 意味着遵义地区APIP发生率符合既往研究。APIP患者的腹痛、 腹胀临床表现由于妊娠状态的特殊性, 可能会被误诊, 若未能及时干预, 容易进展为SAP, 可引起多器官功能障碍、 ARDS、 全身炎症反应综合征等并发症, 严重者可危及母婴的生命安全[13] 。伴随着APIP发病率的逐年增加, 早期有效的診断和去重症化是改善APIP患者预后的难点。在APIP患者发病过程中, 由于漏诊甚至误诊, 在分娩前未能明确诊断, 只有在产后早期通过CT的辅助下才被诊断出来, 因此产后42天内诊断的AP也被纳入本次研究。
APIP可在任一妊娠期发病, 但更常见于妊娠中期及晚期[14] , 本研究52例患者中妊娠晚期患者占比50. 0%,妊娠中期占比48. 1%。随着孕期的增加, 子宫增大会压迫胰腺和胆囊, 胆胰管受压阻力增加, 直接影响胆汁和胰酶的分泌, 同时妊娠晚期孕妇的BMI较前明显增加,高水平的甘油三酯也会影响胰腺功能。在妊娠早期由于疾病和药物的使用可能会影响胎儿的发育甚至造成畸形, 一些患者选择早期人工流产。本研究中仅有1例孕妇在妊娠早期发病, 样本量较小, 同时研究也显示在妊娠中期和妊娠晚期胎儿结局未见明显差异。在初产妇和经产妇方面, 既往的研究[15] 显示发生APIP中大约三分之一的患者是初产妇。本研究中也观察到了类似的比例, 初产妇占32. 7%, 经产妇占67. 3%。
既往西方的研究[16] 发现引起APIP的最常见病因是胆结石, 然而已发表的多项国内临床研究[17-18] 中显示我国APIP发病的最常见病因是高甘油三酯血症, 这表明APIP的病因在我国和西方之间存在差异。在妊娠的过程中, 为了合成胎儿生长发育所需的营养物质, 血液中脂类物质的合成会增加, 降解减少[19] 。我国孕妇受传统理念影响, 少有孕期饮酒, 但膳食结构比例不均衡, 肉源性食物占比偏高, 导致脂肪堆积和剩余能量过多。在多种原因下妊娠期甘油三酯水平增高, 然而胰脂肪酶分解甘油三酯时生成的游离脂肪酸可能对胰腺细胞造成损伤, 同时较大的乳糜微粒亦可能阻塞胰腺毛细血管, 导致局部缺血情况产生[20] 。在本研究中, 高脂血症 (50. 0%)是APIP患者最常见的病因, 其次为胆源性 (38. 5%), 无酒精性胰腺炎。研究结果与既往对于我国APIP病因的研究结论类似。一些研究[19-20] 发现甘油三酯>11. 03 mmol/L与APIP病情严重程度相关, 本研究SAP组中所纳入的高脂性占比75. 0%, 然而研究中APIP病情严重程度与不同病因之间的差异无显著意义 (P=0. 059)。
本研究中对多项检验指标进行了统计, 其中血糖、 尿素氮、 CRP和NLR在不同严重程度APIP患者间差异有统计学意义。对单因素回归分析中存在统计学意义的变量采取多因素有序 Logistic回归分析显示: 肺炎是影响APIP严重程度的危险因素 (OR=18. 938, P=0. 048)。彭容等[21] 研究展现了肺炎与AP严重程度的关系, 发现肺炎累及肺叶数目能预测AP严重程度, 这与本研究中肺炎是影响APIP严重程度危险因素一致。我国台湾的一项研究[22] 发现糖尿病与AP的严重程度增加相关, 并且在女性患者中这种关系更加明显。此外, 日本一项观察性研究[23] 显示糖尿病患者发生AP的风险增加。多项证据提示血糖与胰腺炎严重程度相关。本研究中血糖水平在不同严重程度APIP患者间差异有统计学意义。CRP是炎症性疾病使用最广泛的非特异性标志物, 已被广泛运用于AP严重程度分层[24] 。本研究中CRP在不同严重程度APIP患者间差异有统计学意义。CRP是APIP严重程度的危险因素之一, 其对APIP严重程度具有良好的预测价值, AUC为0. 778, 敏感度为66. 7%, 特异度为83. 3%,验证了CRP与APIP严重程度密切相关。NLR与中性粒细胞和淋巴细胞之间的平衡相关, 包含炎症和免疫系统,被用于预测脓毒症、 炎性肠病、 AP等相关炎性疾病的严重程度[25] 。Kong等[26] 发现, NLR具有预测AP严重程度的诊断价值。本研究显示, NLR在SAP组水平显著高于MAP组, 差异具有统计学意义。临床研究中单一指标的检测敏感度往往低于多个指标联合检测, 本研究中多种临床指标预测APIP严重程度的ROC曲线分析显示, 联合指标 (尿素氮、 血糖、 CRP、 INR) 预测APIP严重程度的AUC、 准确度和敏感度, 均高于各项指标单独检测值。此外, 本研究显示不同严重程度APIP患者间的甘油三酯水平未见差异, 究其原因发现在胰腺损伤的发生与发展过程中高血脂是重要但不是唯一因素, 同时存在其他多种重要因素的参与。患者出现肺炎、 ARDS、 肝肾功能不全、脓毒症等多种并发症除了与胰腺损伤程度相关, 还与患者基础疾病、 免疫状态、 感染程度等多种因素相关, 而胰腺炎重症化的关键原因是过度的炎症反应引发的机体免疫调节紊乱。
AP的严重程度受器官衰竭的影响, 可通过评分系统进行病情评估。包括Ranson评分、 BISAP评分、 APACHEⅡ评分、 SOFA 评分和 Balthazar CT 评分等评分系统。APACHEⅡ评分是被普遍应用于重症监护病房的具权威性的病情评估系统, 目前在临床实践中得到广泛的使用。Ranson评分是一种用于评估胰腺炎严重程度和预测预后的评分系统, 指导治疗决策。以上两种评分系统已被应用于胰腺炎的临床实践, 但在APIP患者中实用效能的临床研究较少。本研究中发现APIP病情越严重, APACHE Ⅱ评分越高 (P=0. 010)。而对于Ranson评分不同APIP严重程度未发现显著差异。AP中肺部是最常受累的器官之一, 肺损伤是胰腺炎病情加重的主要表现。胰腺损伤产生多种细胞因子和炎症介质的释放, 这些细胞因子和炎症介质介导了全身炎症反应综合征的发展, 最终产生ARDS等多种器官衰竭 27。肺炎可加重炎症的级联反应, 过度激活炎症细胞及炎症因子造成肺血管内皮破坏[28] , 此外病原菌可造成直接损害。凝血和纤溶过程与ARDS的进程息息相关, 纤维蛋白在肺泡腔中堆积可损伤肺组织。此外, 合并有弥散性血管内凝血者, 肺小动脉血栓可进一步加重ARDS的进程。妊娠期糖尿病血糖控制不佳可降低机体免疫力, 增加对病原菌的易感性[29] , 从而加重胰腺损伤和肺炎的發生, 进而引发ARDS。本研究中有10例患者并发ARDS, 其发生率为19. 2%, 且有9例使用了呼吸机辅助呼吸。意味着APIP患者并发ARDS风险较高, 并增加了呼吸机使用率和结局风险。
APIP的诊断通过实验室检测和影像学检查进行。实验室检测包括血常规、 血尿淀粉酶、 脂肪酶、 甘油三酯等, 而影像学检查包括腹部超声、 CT、 MRCP和内镜超声等, 早期完善辅助检验及检查是明确APIP病因的必要条件。然而CT对胎儿存在辐射限制了它的使用, 而腹部超声及MRCP则不存在辐射风险, 更易被患者接受。本研究中有46例 (88. 5%) 患者在入院时选择腹部超声等影像学方法诊断胰腺炎并住院治疗, 这表明我国大部分孕妇更愿选择相对安全的检查方法。妊娠期MAP多采取保守支持治疗, 包括住院治疗、 静脉输液、 镇痛等, 而MSAP和SAP按病因应接受血浆置换、 内镜甚至手术干预。此外, 妊娠期MAP的住院天数和住院费用远小于MSAP和SAP, 意味着早期明确诊断和及时干预的重要性。
综上, AP可能会危及母婴的生命, 需多学科协助。高甘油三酯血症是最常见的病因, 并且APIP严重程度与血糖、 尿素氮、 CRP、 肺炎具有相关性。故应当早期诊断, 尽早干预, 避免并发症, 去重症化。同时在诊断和治疗过程中应考虑干预措施对胎儿的副作用, 加强对胎儿的监测, 适时终止妊娠, 从而改善母婴预后。伦理学声明: 本研究方案于2023年4月11日经由遵义医科大学附属医院伦理委员会审批, 批号: KLL-2023-491。利益冲突声明: 本文不存在任何利益冲突。作者贡献声明: 吴迪负责病例资料采集、 分析以及论文的撰写; 代大华负责病例筛选, 数据评分; 梁文美负责病例采集, 统计数据; 付豹负责监督研究过程, 修改稿件;傅小云负责拟定研究方向, 研究设计。
参考文献:
[1] DATE RS, KAUSHAL M, RAMESH A. A review of the management of gallstone disease and its complications in pregnancy[J]. Am J Surg, 2008, 196(4): 599-608. DOI: 10.1016/j.amjsurg.2008.01.015.
[2] HUANG CL, LIU J, LU YY, et al. Clinical features and treatment of hypertriglyceridemia-induced acute pancreatitis during pregnancy: A retrospective study[J]. J Clin Apher, 2016, 31(6): 571-578. DOI: 10.1002/jca.21453.
[3] BANKS PA, BOLLEN TL, DERVENIS C, et al. Classification of acute pancreatitis: 2012: Revision of the Atlanta classification and defini?tions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI: 10.1136/gutjnl-2012-302779.
[4] WEI P, ZHAO XL, HOU WH, et al. Clinical characteristics and mater?nal and fetal outcomes of 166 patients with acute pancreatitis in pregnancy[J]. Chin J Pract Gynecol Obstet, 2022, 38(7): 756-759. DOI: 10.19538/j.fk2022070119.
魏鹏, 赵先兰, 侯文汇, 等. 妊娠合并急性胰腺炎166例临床特征及母儿结局分析[J]. 中国实用妇科与产科杂志, 2022, 38(7): 756-759. DOI: 10.19538/j.fk2022070119.
[5] DUCARME G, MAIRE F, CHATEL P, et al. Acute pancreatitis during pregnancy: A review[J]. J Perinatol, 2014, 34(2): 87-94. DOI: 10.1038/jp.2013.161.
[6] TSUANG W, NAVANEETHAN U, RUIZ L, et al. Hypertriglyceridemic pancreatitis: Presentation and management[J]. Am J Gastroen?terol, 2009, 104(4): 984-991. DOI: 10.1038/ajg.2009.27.
[7] JIANG X, YAN YF, ZHONG R, et al. Clinical features of biliary acute pancreatitis versus hypertriglyceridemic acute pancreatitis[J]. J Clin Hepatol, 2020, 36(9): 2050-2055. DOI: 10.3969/j. issn. 1001-5256.2020.09.028.
蒋鑫, 严永峰, 钟瑞, 等. 胆源性急性胰腺炎与高甘油三酯血症性急性胰腺炎临床特点对比分析[J]. 临床肝胆病杂志, 2020, 36(9): 2050-2055. DOI: 10.3969/j.issn.1001-5256.2020.09.028.
[8] ONG Y, SHELAT VG. Ranson score to stratify severity in acute pancre?atitis remains valid-old is gold[J]. Expert Rev Gastroenterol Hepatol, 2021, 15(8): 865-877. DOI: 10.1080/17474124.2021.1924058.
[9] Chinese Society for Emergency Medicine, Beijing-Tianjin-Hebei Alliance of Emergency Treatment and First Aid, Emergency Medicine Branch, Beijing Medical Association, et al. Expert consensus on emergency diagnosis and treatment of acute pancreatitis[J]. J Clin Hepatol, 2021, 37(5): 1034-1041. DOI: 10.3969/j.issn.1001-5256.2021.05.012.
中华医学会急诊分会, 京津冀急诊急救联盟, 北京医学会急诊分会, 等. 急性胰腺炎急诊诊断及治疗专家共识[J]. 临床肝胆病杂志, 2021, 37(5): 1034-1041. DOI: 10.3969/j.issn.1001-5256.2021.05.012.
[10] PITCHUMONI CS, YEGNESWARAN B. Acute pancreatitis in pregnancy[J]. World J Gastroenterol, 2009, 15(45): 5641. DOI: 10.3748/wjg.15.5641.
[11] GARG PK, SINGH VP. Organ failure due to systemic injury in acute pancreatitis[J]. Gastroenterology, 2019, 156(7): 2008-2023. DOI: 10.1053/j.gastro.2018.12.041.
[12] SZATMARY P, GRAMMATIKOPOULOS T, CAI WH, et al. Acute pan?creatitis: Diagnosis and treatment[J]. Drugs, 2022, 82(12): 1251-1276. DOI: 10.1007/s40265-022-01766-4.
[13] TANG SJ, RODRIGUEZ-FRIAS E, SINGH S, et al. Acute pancreatitis during pregnancy[J]. Clin Gastroenterol Hepatol, 2010, 8(1): 85-90. DOI: 10.1016/j.cgh.2009.08.035.
[14] KMN V, SHEELA CN, BANKA S, et al. Maternal and perinatal out?come of acute pancreatitis during pregnancy: A 5 year experience at a tertiary care centre[J]. Int J Reprod Contracept Obstet Gyne?col, 2016: 4041-4045. DOI: 10.18203/2320-1770.ijrcog20163886.
[15] GENG YX, LI WQ, SUN LQ, et al. Severe acute pancreatitis during pregnancy: Eleven years experience from a surgical intensive care unit[J]. Dig Dis Sci, 2011, 56(12): 3672-3677. DOI: 10.1007/s10620-011-1809-5.
[16] PAPADAKIS EP, SARIGIANNI M, MIKHAILIDIS DP, et al. Acute pan?creatitis in pregnancy: An overview[J]. Eur J Obstet Gynecol Reprod Biol, 2011, 159(2): 261-266. DOI: 10.1016/j.ejogrb.2011.07.037.
[17] ZHANG TT, WANG GX, CAO Z, et al. Acute pancreatitis in preg?nancy: A 10-year, multi-center, retrospective study in Beijing[J]. BMC Pregnancy Childbirth, 2022, 22(1): 414. DOI: 10.1186/s12884-022-04742-8.
[18] YANG ZY, GUO GY, LI H. Predicting fetal loss in severe acute pan?creatitis during pregnancy: A 5-year single-tertiary-center retrospec?tive analysis[J]. Postgrad Med, 2020, 132(5): 473-478. DOI: 10.1080/00325481.2020.1752010.
[19] RAUSCHERT S, G?ZQUEZ A, UHL O, et al. Phospholipids in lipo?proteins: Compositional differences across VLDL, LDL, and HDL in pregnant women[J]. Lipids Health Dis, 2019, 18(1): 20. DOI: 10.1186/s12944-019-0957-z.
[20] RUSSI G. Severe dyslipidemia in pregnancy: The role of therapeutic apheresis[J]. Transfus Apher Sci, 2015, 53(3): 283-287. DOI: 10.1016/j.transci.2015.11.008.
[21] PENG R, ZHANG XM, ZHANG L, et al. CT findings of acute pancreatitis with pneumonia and its clinical correlation analysis[J]. Radiol Pract, 2020, 35(1): 68-73. DOI: 10.13609/j.cnki.1000-0313.2020.01.013.彭容, 张小明, 张凌, 等. 急性胰腺炎伴肺炎的CT表现及其与临床相关性分析[J]. 放射学实践, 2020, 35(1): 68-73. DOI: 10.13609/j.cnki.1000-0313.2020.01.013.
[22] SHEN HN, CHANG YH, CHEN HF, et al. Increased risk of severe acute pancreatitis in patients with diabetes[J]. Diabet Med, 2012, 29(11): 1419-1424. DOI: 10.1111/j.1464-5491.2012.03680.x.
[23] URUSHIHARA H, TAKETSUNA M, LIU Y, et al. Increased risk of acute pancreatitis in patients with type 2 diabetes: An observational study using a Japanese hospital database[J]. PLoS One, 2012, 7(12): e53224. DOI: 10.1371/journal.pone.0053224.
[24] SCH?TTE K, MALFERTHEINER P. Markers for predicting severity and progression of acute pancreatitis[J]. Best Pract Res Clin Gas?troenterol, 2008, 22(1): 75-90. DOI: 10.1016/j.bpg.2007.10.013.
[25] ZHOU HJ, MEI X, HE XH, et al. Severity stratification and prognostic prediction of patients with acute pancreatitis at early phase: A retro?spective study[J]. Medicine (Baltimore), 2019, 98(16): e15275. DOI: 10.1097/MD.0000000000015275.
[26] KONG WH, HE YY, BAO HR, et al. Diagnostic value of neutrophil-lymphocyte ratio for predicting the severity of acute pancreatitis: A meta-analysis[J]. Dis Markers, 2020, 2020: 9731854. DOI: 10.1155/2020/9731854.
[27] LIU DL, WEN LL, WANG ZD, et al. The mechanism of lung and intes?tinal injury in acute pancreatitis: A review[J]. Front Med (Laus?anne), 2022, 9: 904078. DOI: 10.3389/fmed.2022.904078.
[28] GE JH. Risk factors for development of acute respiratory distress syndrome in septic patients[J]. Zhejiang Med J, 2017, 39(20): 1789-1792. DOI: 10.12056/j.issn.1006-2785.2017.39.20.2017-1141.
葛建辉. 脓毒症患者并发ARDS的早期危险因素分析[J]. 浙江医学, 2017, 39(20): 1789-1792. DOI: 10.12056/j. issn.1006-2785.2017.39.20.2017-1141.
[29] CASQUEIRO J, CASQUEIRO J, ALVES C. Infections in patients with diabetes mellitus: A review of pathogenesis[J]. Indian J Endocrinol Metab, 2012, 16(Suppl1): S27-S36. DOI: 10.4103/2230-8210.94253.
收稿日期:2023-08-13; 录用日期:2023-09-19
本文编辑:王莹
