邻苯二甲酸二(2-乙基己基)酯(DEHP)诱发小鼠胆汁淤积和肝损伤的作用机制
2024-06-06张佳怡余芸赵凡叶露王建青
张佳怡 余芸 赵凡 叶露 王建青


摘要: 目的 探讨邻苯二甲酸二 (2-乙基己基) 酯 (DEHP) 诱发小鼠胆汁淤积和肝损伤机制研究。方法 体内实验: 将成年雌性ICR小鼠随机分为对照组 (玉米油)、 DEHP组 (200 mg·kg?1·d?1), 共灌胃4周, 建立胆汁淤积模型。收集所有小鼠血液与肝组织, 生化仪检测血清、 肝脏总胆汁酸 (TBA) 水平, 酶标仪检测ALP、 GGT; HE染色观察肝组织病理变化; 实时定量PCR检测肝脏炎症因子IL-1β、 IL-6和TNF-α的表达水平; 液相色谱-三重四级杆质谱仪 (LC-MS/MS) 检测小鼠肝脏胆汁酸谱。体外实验: 培养小鼠肝细胞AML-12, 使用DEHP(250 ?mol/L)以及去氧胆酸(DCA)(125 ?mol/L)和鹅去氧胆酸(CDCA)(125 ?mol/L) 处理细胞24 h, 实时定量PCR檢测细胞炎性因子IL-1β、 IL-6和TNF-α的mRNA水平。计量资料两组间比较采用成组t检验, 多组间比较采用单因素方差分析, 进一步两两比较采用LSD-t检验。结果 体内实验显示: 与对照组相比,DEHP组小鼠肝体比, 血清TBA、 ALP、 GGT及肝脏TBA均显著升高 (t值分别为?4. 396、 ?5. 109、 ?8. 504、 ?3. 792和?7. 974, P值均<0. 05)。与对照组相比, 肝脏胆汁酸谱中胆酸 (CA)、 CDCA、 牛磺鹅去氧胆酸 (TCDCA)、 DCA及熊去氧胆酸 (UDCA) 均显著升高 (t值分别为?2. 802、 ?3. 177、 ?2. 633、 ?2. 874和?2. 311, P值均<0. 05)。DEHP组小鼠肝脏HE染色显示为汇管区扩大、 胆管变形、 胆管周围伴有炎性细胞浸润, 且肝脏炎症因子IL-1β、 IL-6和TNF-α mRNA水平均显著升高(t值分别为?2. 539、 ?2. 823和?4. 636, P值均<0. 05)。体外实验显示: 0~1 000 ?mol/L DEHP处理后肝细胞活力实际数值相差不超过15%, 分别使用125、 250以及500 ?mol/L的DEHP刺激后, 肝细胞的炎症因子IL-1β、 IL-6和TNF-α mRNA水平均明显升高 (P值均<0. 05)。与单独使用DEHP刺激相比, CDCA联合DEHP刺激上调了细胞炎症因子IL-1β mRNA水平 (P<0. 01); DCA与DEHP联合刺激可显著增加细胞炎症因子IL-1β和IL-6的mRNA水平 (P值均<0. 01)。结论 DEHP暴露导致小鼠胆汁淤积肝病的发生并诱发肝脏炎症, 这可能与其促进有毒胆汁酸的产生进而加剧炎性因子分泌有关。
关键词: 邻苯二甲酸二 (2-乙基己基) 酯; 环境污染物; 胆汁淤积; 胆汁酸类
基金项目: 国家自然科学基金 (82073566); 安徽省高校优秀青年人才支持计划资助项目 (gxyq2019014); 临床药学与药理学共建项目 (2020); 安徽省公共卫生临床中心安徽医科大学第一附属医院北区科研培育基金资助项目 (2023YKJ14, 2023YKJ06, 2023YKJ11)
Mechanism of bis (2-ethylhexyl) phthalate in inducing cholestasis and liver injury in mice
ZHANG Jiayi1, YU Yun2, 3, ZHAO Fan1, YE Lu1, WANG Jianqing1, 2, 3.
(1. Department of Pharmacy, Anhui Medical University, Hefei 230032, China;
2. Department of Pharmacy, The First Affiliated Hospital of Anhui Medical University, Hefei 230012, China; 3. Anhui Public Health Clinical Center, Hefei 230012, China)
Corresponding author: WANG Jianqing, jianqingwang81@126.com (ORCID: 0000-0002-7935-9520)
Abstract: Objective To investigate the mechanism of bis(2-ethylhexyl) phthalate (DEHP) in inducing cholestasis and liver injury in mice. Methods In the in vivo experiment, adult female ICR mice were randomly divided into control group (corn oil) and DEHP group (200 mg/kg/d), and a model of cholestasis was established by intragastric administration for 4 weeks. After blood and liver tissue samples were collected from all mice, a biochemical analyzer was used to measure the level of total bile acid (TBA) in serum and the liver, and a microplate reader was used to measure alkaline phosphatase (ALP) and gamma-glutamyl transpeptidase (GGT); HE staining was used to observe the pathological changes of the liver; RT-PCR was used to measure the mRNA expression levels of the inflammatory factors interleukin-1β (IL-1β), interleukin-6 (IL-6), and tumor necrosis factor-α (TNF-α) in the liver; liquid chromatography/triple quadrupole mass spectrometry was used to measure the bile acid profile in the liver of mice. In the in vitro experiment, AML-12 mouse hepatocytes were cultured and treated with DEHP (250 ?mol/L), DCA (125 ?mol/L), and CDCA (125 ?mol/L) for 24 hours, and RT-PCR was used to measure the mRNA expression levels of the inflammatory cytokines IL-1β, IL-6, and TNF- α. The independent-samples t test was used for comparison of continuous data between two groups; a one-way analysis of variance was used for comparison between multiple groups, and the LSD-t test was used for further comparison between two groups. Results The in vivo experiment showed that compared with the control group, the DEHP group had significant increases in the serum levels of TBA, ALP, and GGT and the level of TBA in the liver (the t values are respectively ?4.396, ?5.109, ?8.504, ?3.792 and ?7.974, all P<0.05,) . Compared with the control group, the DEHP group had significant increases in cholic acid, chenodeoxycholic acid, taurocholic acid, deoxycholic acid, and ursodeoxycholic acid (the t values are respectively ?2.802, ?3.177, ?2.633, ?2.874 and ?2.311, all P<0.05) . HE staining of the liver showed that the mice in the DEHP group had enlargement of the portal area, bile duct deformation, inflammatory cell infiltration around the bile duct, and significant increases in the mRNA expression levels of the inflammatory factors IL-1β, IL-6, and TNF-α in the liver (the t values are respectively ? 2.539, ? 2.823 and ? 4.636, all P<0.05) . The in vitro experiment showed that the actual difference in hepatocyte viability after 0-1 000 ?mol/L DEHP treatment does not exceed 15%, but there were significant increases in the mRNA expression levels of the inflammatory cytokines IL-1β, IL-6, and TNF-α after treatment with DEHP at different concentrations of 125 ?mol/L, 250 ?mol/L, and 500 ?mol/L (all P<0.05) . Compared with DEHP stimulation alone, the combined stimulation of CDCA and DEHP upregulates the cytokine in hepatocyte IL-1β mRNA levels (P<0.01); the combined stimulation of DCA and DEHP can significantly increase the cytokine in hepatocyte IL-1β and IL-6 mRNA levels (all P<0.01) . Conclusion DEHP exposure can cause cholestasis and induce liver inflammation in mice, possibly by promoting the production of toxic bile acids and the secretion of inflammatory factors.
Key words: Di- (2-Ethylhexyl) Phthalate; Environmental Pollutants; Cholestasis; Bile Acid
Research funding:
National Natural Science Foundation of China (82073566); The Program of Excellent Young Talents in Universities of Anhui Province (gxyq2019014); Clinical Pharmacy and Pharmacology (2020); Anhui Public Health Clinical Center Supported by North District Scientific Research and Cultivation Foundation of the First Affiliated Hospital of Anhui Medical University (2023YKJ14, 2023YKJ06, 2023YKJ11)
胆汁淤积性肝病是各种原因引起胆酸盐循环发生障碍, 蓄积于肝细胞而引起肝细胞毒性[1] , 并可导致肝内慢性炎症反应, 损伤胆管细胞和肝细胞, 最终可发展为肝衰竭和恶性转化[2] 。胆汁淤积的发生涉及雌激素、遗传及环境等多种因素。
环境污染物邻苯二甲酸二(2-乙基己基)酯(di-2-ethylhexyl phthalate, DEHP)是邻苯二甲酸酯增塑剂之一, 生活中被广泛应用于各种塑料制品中[3]。已有研究[4] 报道DEHP在输液管中浸出造成的毒性增加胆汁淤积的风险。此外, 动物研究[5] 也发现DEHP可导致小鼠肝脏DNA损伤可能促进胆汁淤积的发生, 本课题组前期研究[6] 已证实DEHP暴露可诱导小鼠发生胆汁淤积, 但DEHP对胆汁淤积性肝病炎症反应的作用尚未完全阐明。因此, 本研究探索DEHP暴露导致胆汁淤积性肝病和炎症损伤的机制, 为临床发现新的药物治疗靶点奠定基础。
1 材料与方法
1. 1 实验动物 8周龄 (26~30 g) 雌性ICR小鼠购买于北京维通利华实验动物技术有限公司, 生产许可证编号: SCXK (京) 2019-0010, 使用许可证编号: SYXK (皖)2020-001。小鼠饲养在适宜的环境中: 温度 (25±1) ℃, 湿度55%±5%, 適应性饲养7天进行实验。
1. 2 试剂 总胆汁酸 (TBA) 试剂盒购买于浙江伊利康生物技术有限公司, ALP和GGT购买于南京建成生物工程研究所; DEHP、 胆酸 (cholic acid, CA)、 甘氨胆酸 (glycocholicacid, GCA)、 牛磺胆酸 (taurocholic acid, TCA)、 牛磺鹅去氧胆酸(taurochenodesoxycholic acid, TCDCA)、 鹅去氧胆酸(chenodeoxycholic acid, CDCA)、 去氧胆酸(deoxycholicacid, DCA)、 熊去氧胆酸 (ursodeoxycholic acid, UDCA)、甘 氨 鹅 去 氧 胆 酸(glycine chenodeoxycholic acid,GCDCA)、 牛磺熊去氧胆酸(tauroursodeoxycholic acid,TUDCA)、 甘氨石胆酸 (glycine cholic acid, GLCA) 和甘氨猪去氧胆酸(glycine hyodeoxycholic acid, GHDCA)购买于美国默克公司; 玉米油购自上海阿拉丁生化有限公司; CCK-8溶液、 DMSO购买于上海碧云天生物技术有限公司; 血清购买于浙江天杭生物科技股份有限公司; 胰酶细胞消化液购买于Biosharp生物科技公司; DMEM培养基购买于Hyclone; 实时定量PCR扩增试剂盒购买于翌圣生物科技 (上海) 股份有限公司; 实时定量PCR引物购买于北京擎科生物科技股份有限公司。
1. 3 动物分组与处理 将雌性ICR小鼠随机分为对照组、 DEHP组 (200 mg·kg?1·d?1), 每组8只, 共灌胃4周。取材前禁食6 h, 收集血液和肝组织用于后续实验。
1. 4 生化检测 使用生化分析仪检测血清中TBA以及肝脏TBA的含量。
1. 5 肝组织病理学观察 将小鼠新鲜肝组织放入4%多聚甲醛溶液中浸泡处理, 室温放置摇床固定24 h。进行脱水包埋并切片固定后, 用苏木精-伊红 (HE) 染色, 在显微镜下观察并拍照。
1. 6 液相色谱-三重四级杆质谱 使用液相色谱-三重四级杆质谱仪(liquid chromatography-triple quadrupole mass spectrometer, LC-MS/MS)(AB SCIEX 公司, 型号:TRIPLE QUAD? 4500 SYSTEM) 检测小鼠中胆汁酸组分水平。色谱柱: 100 mm×3. 0 mm(Phenomenex公司, 型号: 00D-4462-Y0、 2. 6 ?m C18 100A); 流动相: A相为含有0. 1%冰乙酸的4 mmol/L乙酸铵溶液, B相为甲醇; 柱温为40 ℃; 流速为0. 4 mL/min; 进样量为10 ?L。
1. 7 细胞培养 小鼠肝细胞系AML-12细胞来源于中国科学院典型培养物保藏委员会细胞库。AML-12细胞培养在含有10%胎牛血清、 5 ?g/mL胰岛素-转铁蛋白-亚硒酸钠、 地塞米松40 ng/mL, 青霉素100 U/mL, 链霉素100 ?g/mL的DMEM-F12完全培养基中, 并放置于恒温培养箱中 (37 ℃, 5% CO2) 培养。当细胞密度达到80%~90%时, 使用胰酶消化细胞后进行传代。
1. 8 CCK-8实验检测细胞增殖 将处于对数生长期的肝细胞接种于96孔板, 每孔1×104个细胞。按实验设计进行分组并给药。培养24 h后, 弃掉上清, 向每孔中添加CCK-8工作溶液110 ?L (CCK-8试剂∶细胞培养基=1∶10), 继续孵育0. 5~4 h后使用酶标仪测定450 nm处的光密度 (OD) 值, 计算细胞存活率。细胞存活率 (%) = (处理组细胞OD值-阴性对照组OD值) / (对照组细胞OD值-阴性对照组OD值) ×100%。
1. 9 实时定量PCR检测相关基因 采用TRlzol法提取RNA, 将所有提取的RNA样品的浓度定量在1 000 ng/?L,逆转录成cDNA, 之后进行扩增反应, 选取18S (18S ribosomal RNA) 作为内参基因, 计算相应基因的相对表达水平。相关引物信息见表1。
1. 10 统计学方法 采用SPSS 25. 0软件进行统计分析。计量资料以x ˉ±s表示, 两组间比较采用成组t检验,多组间比较采用单因素方差分析, 进一步两两比较采用LSD-t检验, P<0. 05为差异有统计学意义。
2 结果
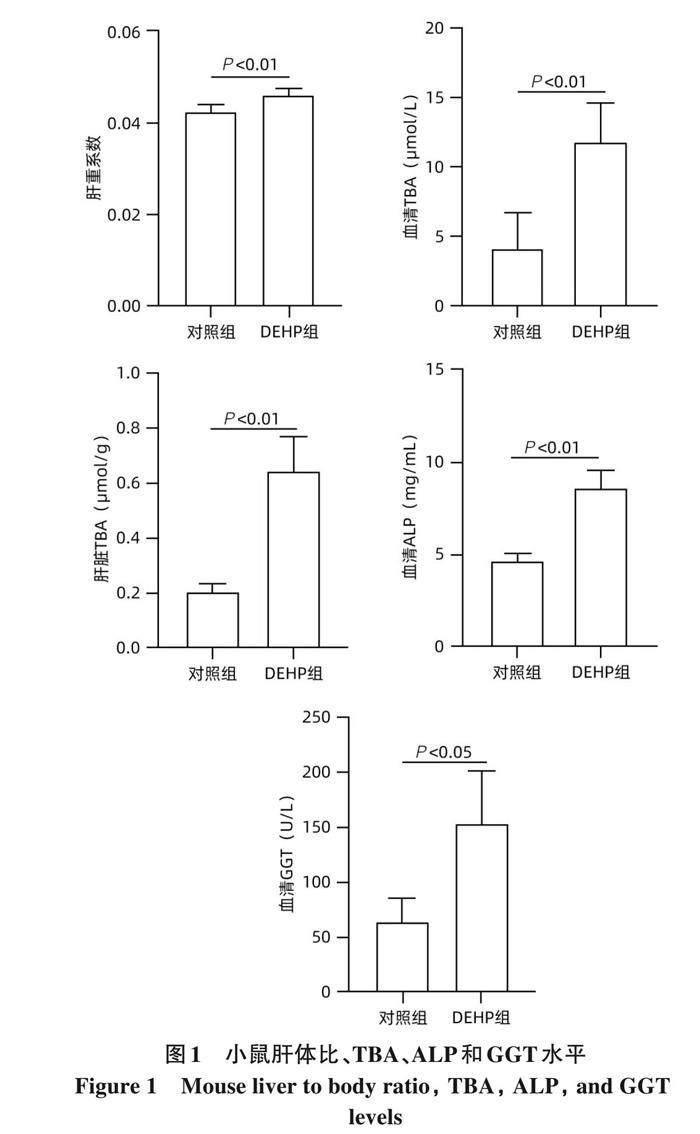
2. 1 DEHP暴露导致小鼠胆汁淤积的发生 与对照组相比, DEHP组小鼠肝体比显著增加 (t=?4. 396, P<0. 01); 血清与肝脏TBA水平显著升高 (t值分别为?5. 109、 ?7. 974,P<0. 01); 血清ALP和GGT水平显著升高(t值分别为?8. 504、 ?3. 792, P值均<0. 05)(图1)。
2. 2 DEHP暴露对小鼠肝脏胆汁酸组分的影响 LC-MS/MS结果显示与对照组相比, CA、 CDCA、 TCDCA、 DCA及UDCA均显著升高 (t值分别为?2. 802、 ?3. 177、 ?2. 633、?2. 874和?2. 311, P值均<0. 05)。其余肝脏胆汁酸组分无明显变化 (图2)。
2. 3 DEHP暴露对肝脏炎症因子的影响 肝组织HE染色结果显示, 对照组小鼠肝组织完整, DEHP组小鼠肝组织可见汇管区扩大、 胆管变形, 胆管周围并伴有炎性细胞浸润。进一步对肝脏炎症因子进行检测发现, DEHP组小鼠炎性因子IL-1β、 IL-6和TNF-α mRNA水平较对照组显著升高 (t值分别为?2. 539、 ?2. 823和?4. 636, P值均<0. 05)(图3)。
2. 4 DEHP暴露对肝细胞的影响 结合肝脏HE染色的结果, DEHP暴露导致肝脏發生损伤, 本研究进一步在体外探究DEHP暴露对肝细胞的影响, 不同浓度的DEHP处理24 h对肝细胞存活率与0 ?mol/L相比有显著性差异 (F=29. 575, P<0. 01)(图4a); 进一步检测肝细胞炎性因子的表达情况, 发现DEHP处理后IL-1β、 IL-6和TNF-α mRNA水平均显著升高 (P值均<0. 05)(图4b), 这与体内结果相一致; 同时选择250 ?mol/L浓度进行后续实验。
2. 5 DEHP联合胆汁酸共培养对肝细胞的影响 结合LC-MS/MS检测结果DEHP暴露导致不同组分胆汁酸发生改变, 进一步探究某一种组分改变对于肝细胞的影响, 选用CDCA和DCA与DEHP进行联合刺激肝细胞, 观察炎性因子表达的情况。肝细胞的存活率随着CDCA和DCA浓度的增加而降低, 当浓度为125 ?mol/L时, 细胞存活率均达到80%以下 (图5a、 b), 因此选择125 ?mol/L的CDCA和DCA分别与DEHP共同培养肝细胞, 结果发现与DEHP组相比, CDCA联合DEHP刺激上调了细胞炎症因子IL-1β mRNA水平 (P<0. 01), 对IL-6和TNF-α的表达有促进作用, 但无统计学差异 (图5c); DCA联合DEHP刺激可显著增加细胞炎症因子IL-1β和IL-6的mRNA水平 (P值均<0. 01), 同样可上调TNF-α的表达, 但无统计学差异 (图5d)。
3 讨论
DEHP作为邻苯二甲酸酯的一种, 可通过饮食、 吸入、医疗设备与生物液体等多种途径直接接触摄入体内[7-8] ,引起生殖毒性、 神经损伤、 炎症、 过敏和内分泌紊乱等危害[9] 。因此, 研究DEHP暴露对于人体所造成的危害具有重要的意义。胆汁淤积性肝病是因胆汁生成、 分泌及排泄障碍导致肝内外胆汁淤积的临床常见疾病, 血清胆汁酸浓度升高是诊断的必要条件, 其中TBA>10 ?mol/L可作为胆汁淤积的诊断标准[10] 。因此, 针对DEHP诱导胆汁淤积动物模型对于深入研究环境因素与胆汁淤积性肝病之间的关系和机制研究具有重要意义。
本研究发现, DEHP给小鼠灌胃28天后, DEHP组小鼠肝体比明显增加且血清TBA、 ALP和GGT水平显著升高, 表明DEHP暴露可导致胆汁淤积性肝病的发生。
Gourlay等[11] 发现DEHP在人和大鼠的血液中具有促炎作用, 在本研究中也发现DEHP暴露组小鼠肝脏出现明显病理变化并伴有炎性细胞浸润且肝脏中的炎症因子表达显著性升高; 体外DEHP处理肝细胞后也上调了肝细胞中炎症因子的表达。胆汁酸具有促进营养物质和脂溶性维生素吸收和代谢的重要功能, 还具有调节机体糖、脂、 能量代谢、 内分泌以及解毒作用。本研究发现DEHP暴露小鼠肝脏中CA、 CDCA、 TCDCA、 DCA以及UDCA等代谢发生紊乱。有研究[12] 表明, 不同的胆汁酸成分损害肝脏的能力存在差异, 本研究中升高的天然胆汁酸成分对小鼠肝脏毒性强弱程度依次为DCA>CDCA>CA>UDCA。
体外实验进一步探讨了胆汁酸是否影响DEHP的促炎作用, 选用DCA和CDCA分别与DEHP联合作用于肝细胞, 结果显示, 相较于单独DEHP暴露, DCA和CDCA分别与DEHP共同刺激可导致肝细胞炎症因子IL-1β、 IL-6和TNF-α的转录水平显著升高, 这提示毒性胆汁酸可促进DEHP的促炎作用。
DEHP作为一种被广泛使用的塑化剂, 对人体健康的危害不容忽视。在既往研究[9] 中, 通过临床出生队列分析发现DEHP暴露增加了胆汁淤积发生的风险但并未进一步在小鼠模型中进行验证。本课题组前期研究[6]首次构建DEHP暴露导致小鼠胆汁淤积性肝病的模型,而本研究中进一步探究DEHP诱发小鼠胆汁淤积和肝损伤机制研究。综上所述, DEHP暴露可导致小鼠胆汁淤积肝病的发生并诱发肝脏炎症, 这可能与DEHP暴露引起毒性胆汁酸生成进而加剧炎性因子分泌有关。本课题组后续将进一步探究临床药物对于DEHP导致胆汁淤积性肝病的治疗效果, 为临床治疗胆汁淤积性肝病提供更多的实验依据。
伦理学声明: 本研究于2020年5月23日经由安徽医科大学动物伦理委员会审批, 批号: 202000523, 符合实验室动物管理与使用准则。
利益冲突声明: 本文不存在任何利益冲突。
作者贡献声明: 王建青、 余芸、 张佳怡负责课题设计, 资料分析; 张佳怡、 余芸、 赵凡、 叶露参与收集数据, 修改论文;王建青负责拟定写作思路, 指导撰写文章并最后定稿。
参考文献:
[1] CHIANG JYL, FERRELL JM. Discovery of farnesoid X receptor and its role in bile acid metabolism[J]. Mol Cell Endocrinol, 2022, 548: 111618. DOI: 10.1016/j.mce.2022.111618.
[2] FANG D, LI PY. The treatment of cholestasis[J]. J Crit Care Intern Med, 2020, 26(1): 22-24. DOI: 10.11768/nkjwzzzz20200106.
方丹, 黎培員. 胆汁淤积的治疗[J]. 内科急危重症杂志, 2020, 26(1): 22-24. DOI: 10.11768/nkjwzzzz20200106.
[3] LI X, HAN XX, VOGT RD, et al. Polyethylene terephthalate and di-(2-ethylhexyl) phthalate in surface and core sediments of Bohai Bay, China: Occurrence and ecological risk[J]. Chemosphere, 2022, 286(Pt 3): 131904. DOI: 10.1016/j.chemosphere.2021.131904.
[4] BAGEL S, DESSAIGNE B, BOURDEAUX D, et al. Influence of lipid type on bis (2-ethylhexyl)phthalate (DEHP) leaching from infusion line sets in parenteral nutrition[J]. JPEN J Parenter Enteral Nutr, 2011, 35(6): 770-775. DOI: 10.1177/0148607111414021.
[5] GAITANTZI H, HAKENBERG P, THEOBALD J, et al. Di (2-ethyl?hexyl) phthalate and its role in developing cholestasis: An in vitro study on different liver cell types[J]. J Pediatr Gastroenterol Nutr, 2018, 66(2): e28-e35. DOI: 10.1097/MPG.0000000000001813.
[6] QU MC, ZHAO F, ZHANG C, et al. Protective effect of obeticholic acid on cholestasis induced by subacute exposure to DEHP in mice[J]. Acta Univ Med Anhui, 2022, 57(10): 1608-1613. DOI: 10.19405/j.cnki.issn1000-1492.2022.10.018.
屈明超, 赵凡, 张程, 等. 奥贝胆酸对DEHP亚急性暴露导致小鼠胆汁淤积的保护作用[J]. 安徽医科大学学报, 2022, 57(10): 1608-1613. DOI: 10.19405/j.cnki.issn1000-1492.2022.10.018.
[7] PREECE AS, SHU H, KNUTZ M, et al. Indoor phthalate exposure and contributions to total intake among pregnant women in the SELMA study[J]. Indoor Air, 2021, 31(5): 1495-1508. DOI: 10.1111/ina.12813.
[8] ZHANG YX, HUANG B, HE H, et al. Urinary phthalate metabolites among workers in plastic greenhouses in Western China[J]. Envi?ron Pollut, 2021, 289: 117939. DOI: 10.1016/j.envpol.2021.117939.
[9] ZHANG JY, WANG JQ. Research advances in the impact of phthal?ates on cholestatic liver disease[J]. J Clin Hepatol, 2023, 39(1): 226-230. DOI: 10.3969/j.issn.1001-5256.2023.01.035.
张佳怡, 王建青. 邻苯二甲酸酯对胆汁淤积性肝病影响的研究进展[J]. 临床肝胆病杂志, 2023, 39(1): 226-230. DOI: 10.3969/j.issn.1001-5256.2023.01.035.
[10] Chinese Society of Hepatology, Chinese Medical Association, Chi?nese Society of Gastroenterology, Chinese Medical Association, Chi?nese Society of Infectious Diseases, Chinese Medical Association. Consensus on the diagnosis and treatment of cholestasis liver dis?eases(2015)[J]. J Clin Hepatol, 2015, 31(12): 1989-1999.
中华医学会肝病学分会, 中华医学会消化病分会, 中华医学会感染病学分会. 胆汁淤积性肝病诊断和治疗共识(2015)[J]. 临床肝胆病杂志, 2015, 31(12): 1989-1999.
[11] GOURLAY T, SAMARTZIS I, STEFANOU D, et al. Inflammatory re?sponse of rat and human neutrophils exposed to di-(2-ethyl-hexyl)-phthalate-plasticized polyvinyl chloride[J]. Artif Organs, 2003, 27(3): 256-260. DOI: 10.1046/j.1525-1594.2003.07107.x.
[12] SONG PZ, ZHANG YC, KLAASSEN CD. Dose-response of five bile acids on serum and liver bile Acid concentrations and hepatotoxicty in mice[J]. Toxicol Sci, 2011, 123(2): 359-367. DOI: 10.1093/tox?sci/kfr177.
收稿日期:2023-08-09; 录用日期:2023-09-11
本文编辑:王莹
