血清胱抑素C、β2微球蛋白与缺血性脑小血管病的相关性研究
2024-06-03丁联斌方麒林刘团结王博沈滔毛蕾徐玉萍吉莉苏云楠
丁联斌 方麒林 刘团结 王博 沈滔 毛蕾 徐玉萍 吉莉 苏云楠
[摘要] 目的 探究血清胱抑素C(cystatin C,Cys C)、beta-2微球蛋白(beta-2 microglobulin,β2-MG)水平與缺血性脑小血管病 (cerebral small vessel disease,CSVD)及其亚组的相关性。方法 选取2019年1月至2021年12月笔者医院神经内科收治的缺血性CSVD患者234例作为研究组,同期同年龄头颅核磁共振检查正常的体检者92例为对照组。研究组进一步分为腔隙性梗死(lacunar infarction,LI)组、白质病变(white matter lesions,WML)组及LI+WML组,分别比较各组患者Cys C、β2-MG水平;并进行危险因素回归分析。结果 缺血性CSVD组与对照组比较,CYS-C、β2-MG差异有统计学意义(P<0.05);亚组危险因素分析显示:WML及LI+WML组与正常对照组比较Cys C、β2-MG差异有统计学意义(P<0.05)。采用多因素Logistics回归分析显示,血清CYS- C、β2-MG是WML亚组与WML+LI亚组的独立危险因素。结论 Cys C、β2-MG是缺血性CSVD人群尤其WML和WML+LI人群的独立危险因素。
[关键词] 脑小血管病;血清胱抑素C;β2-微球蛋白
[中图分类号] R743 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.11.008
Study on the correlation between cystatin C, microglobulin and ischemic cerebral small vessel disease
DING Lianbin, FANG Qilin, LIU Tuanjie, WANG Bo, SHEN Tao, MAO Lei, XU Yuping, JI Li, SU Yunnan
Department of Neurology, Wusong Hospital of Zhongshan Hospital Affiliated to Fudan University, Shanghai 200940, China
[Abstract] Objective To explore the the correlation between cystatin C (Cys C), beta-2 microglobulin (β2-MG) and ischemic cerebral small vessel disease (CSVD) and its subgroups. Methods Totally 234 patients with CSVD were assigned to the study group,and 92 elderly people with no abnormal findings in head MRI were selected as controls.The CSVD patients were further divided into the subgroups of lacunar infarction (LI),white matter lesion (WML) and LI+WML. Each group was compared risk factors include the blood level of Cys C and β2-MG. Results There were statistically significant differences between CSVD group and control group in cystatin C (Cys C) and β2-MG (P<0.05). Cystatin C (Cys C) and β2-MG there were statistically significant differences between WML group and control group (P<0.05), and also between WML+LI group and control group (P<0.05). Logistic regression analysis and comparison across subgroups showed Cys C and β2-MG to be the common risk factors for WML group and WML+LI group inpatients with ischemic cerebral small vessel disease. Conclusion Cys C and β2-MG are the common risk factors for WML group and WML+LI group inpatients with ischemic cerebral small vessel disease.The risk factors vary across different CSVD subgroups.
[Key words] Cerebral small vessel disease; Cystatin C; β2-microglobulin
脑小血管病(cerebral small vessel disease,CSVD)是由各种因素影响脑内小动脉、微动脉、毛细血管、微静脉和小静脉导致的一系列临床、影像、病理综合征。急性缺血性CSVD表现为特定的腔隙综合征,慢性CSVD早期可无临床症状,但随着病情发展,患者可出现认知障碍、运动障碍、情感障碍和二便障碍等症状。同时CSVD患者的缺血性脑卒中复发风险增加,脑出血和溶栓后出血风险增加,并且容易发生脑出血后血肿扩大[1]。
CSVD是老年人群高发病,早期诊断困难,主要依靠磁共振成像。脑和肾具有相似的解剖和血流动力学特点,将肾作为CSVD的外周观测窗是近年研究热点之一。血清胱抑素C(cystatin C,Cys C)、beta-2 微球蛋白(beta-2 microglobulin,β2-MG)是评估肾小球血管早期损伤的敏感内源性标志物[2-3],它们是否也能成为CSVD早期诊断的预警标志及病情进展和疗效评估的观测指标,值得扩大样本及研究人群进一步研究证实。
1 资料与方法
1.1 一般资料
选取2019年1月至2021年12月笔者医院神经内科收治的缺血性CSVD患者234例为CSVD组,分为三个亚组,腔隙性梗死(lacunar infarction,LI)组59例,白质病变(white matter lesions,WML)组62例,LI+WML组113例,同期同年龄段头颅MRI检查无异常的中老年体检者92例为对照组。纳入标准:①患者符合《中国脑小血管病诊治共识》[1]中CSVD诊断标准;②年龄55~85岁。排除标准:①MRI检查有禁忌或不能配合者;②患有肾脏疾病或肾小球滤过率(glomerular filtration rate,GFR)≤60ml/(min.1.73m2);③炎性或免疫介導的小血管病;遗传性小血管病;或存在其他已知病因导致的脑白质病变;④伴有其他神经系统疾病或其他系统严重疾病者;⑤影像学提示曾经有最大直径≥20mm脑出血或脑梗死;⑥颅内和(或)颅外存在≥50%的大血管狭窄;⑦有甲状腺疾病或长期/近期应用糖皮质激素治疗的患者;⑧认知量表评定存在痴呆者。本研究经笔者医院伦理委员会批准(伦理审批号:2019-Y-11)。
1.2 研究方法
收集所有受试者年龄、性别、脑卒中病史、高血压病史、糖尿病史等详细信息;清晨空腹静脉血采集常规生化指标、Cys C、β2-MG及甲状腺相关激素水平;受试者行头颅MRA/CTA和颈部、上肢及下肢血管超声检查评定大动脉狭窄及动脉硬化情况,诊断标准参照《中国高血压防治指南(2018年修订版)》[4]中对靶器官损害的定义;认知水平评定由神经内科医生应用蒙特利尔认知量表(Montreal cognitive assessment,MoCA)和简易智能精神状态检查量表(mini-mental state examination,MMSE)完成;磁共振由放射科医生和神经内科医生严格按照《中国脑小血管病诊治共识》[1]影像学特点进行阅片,WML严重程度按照Fazekas方法评分分级,LI严重程度按数量评分[5]。
1.3 统计学方法
采用SPSS 26.0统计软件对数据进行处理分析,计量资料以均数±标准差(![]() )表示,组间比较采用 t 检验;数资料以例数(百分率)表示,组间比较采用χ2检验,亚组间比较采用方差分析或Kruskal-Wallis检验(资料不符合正态分布);采用多因素Logistic回归模型分析CSVD及其亚组的危险因素。P<0.05为差异有统计学意义。
)表示,组间比较采用 t 检验;数资料以例数(百分率)表示,组间比较采用χ2检验,亚组间比较采用方差分析或Kruskal-Wallis检验(资料不符合正态分布);采用多因素Logistic回归模型分析CSVD及其亚组的危险因素。P<0.05为差异有统计学意义。
2 结果
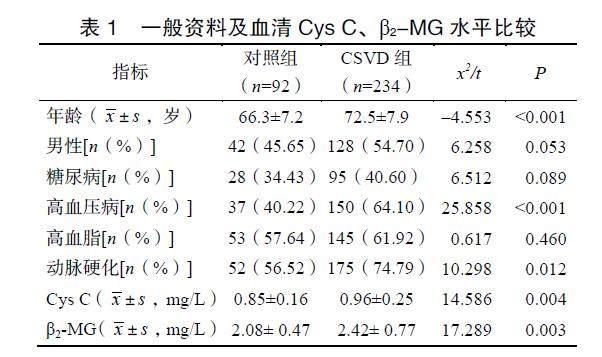
2.1 一般资料及血清Cys C、β2-MG水平比较
CSVD组与对照组比较,两组年龄、动脉硬化、Cys C和β2-MG差异有统计学意义(P<0.05),见表1。
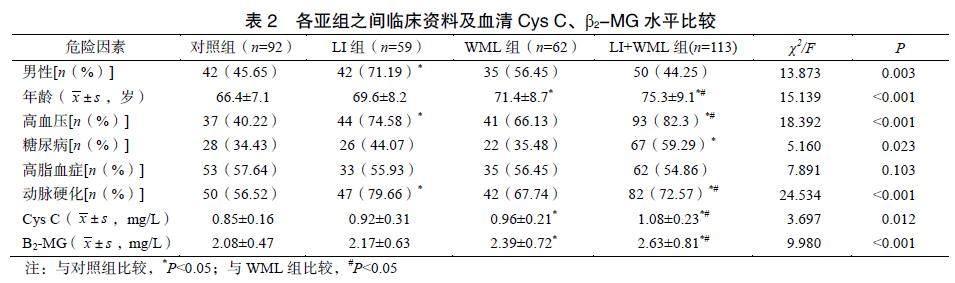
2.2 各亚组指标间的结果比较
性别、年龄、高血压、动脉硬化、Cys C以及β2-MG组间差异有统计学意义(P<0.05)。LI组与对照组比较,性别(男性)、高血压和动脉硬化差异有统计学意义(P<0.05)。WML组与对照组比较,年龄、Cys C、β2-MG差异有统计学意义(P<0.05)。LI+WML组与对照组比较年龄、高血压及糖尿病比率、动脉硬化、Cys C及β2-MG显著性升高(P<0.05)。LI+WML组与LI组及WML组比较,年龄、高血压比率、Cys C和β2-MG均显著升高(P<0.05),见表2。
2.3 缺血性CSVD及其亚组危险因素的二元Logistic回归分析
对差异有统计学意义的危险因素进行多因素Logistic回归分析,结果显示:年龄、高血压是缺血性CSVD的独立危险(r=1.076,P=0.003;r=2.643,P=0.008;)。WML组与年龄、Cys C、β2-MG独立相关(r=1.115,P=0.003;r=2.908,P=0.023;r=3.772,P=0.004;);LI组与性别(男性)、高血压、动脉硬化独立相关(r=3.084,P=0.013;r=1.074,P=0.005;r=4.195,P=0.012;)。LI+WML组则与年龄、高血压、糖尿病、动脉硬化、Cys C以及β2-MG均具有独立相关性(r=1.129,P=0.000;r=3.049,P=0.014;r=3.020,P=0.016;r=2.168,P=0.029;r=10.398,P=0.028;r=3.214,P=0.034;)。
3 讨论
CSVD是在年龄、高血压等危险因素共同作用下,血管发生内皮细胞损伤、平滑肌增生、小血管壁的基底膜增厚,引起慢性、进行性的局部甚至是弥漫性亚临床缺血,导致神经细胞脱髓鞘、少突胶质细胞丢失、轴索损伤,此阶段没有临床症状,核磁共振检查显示为脑白质病变。如继续发展不仅表现为脑白质病变加重,同时会出现脑微出血(cerebral microbleed,CMB)和LI[1]。
肾脏和脑血管具有相似的解剖及血流动力学特点,国内外多项研究证实:慢性肾病(chronic kidney disease,CKD)是CSVD的独立危险因素,其严重程度随着GFR的下降而增加[6-7]。GFR是诊断CKD最主要指标。评估GFR最准确的方法是检测同位素51铬标记的乙二胺四乙酸、碘肽酸或菊粉清除率,但因方法复杂费时,难以常规用于临床及大型研究。近年推出了多种GFR估算方法,但对预后风险的估计存在差异[2]。
Cys C是一种半胱氨酸蛋白酶抑制剂,体内浓度恒定,不受年龄、饮食、炎症、肌肉量、药物等因素的影响(除大劑量糖皮质激素或甲状腺功能异常外)。血清Cys C 能更迅速反映GFR的变化,而血肌酐只有在GFR降至50%以下时才会开始升高。Cys C 在“肌酐盲区”所表现出的准确性能够帮助临床医生更早的发现肾功能异常,是评估早期肾功能损伤的敏感内源性标志物[2]。β2-MG广泛存在于脑脊液、血清、唾液等体液中,人体内β2-MG的合成速率及释放量相对稳,不受年龄、饮食、肌肉量的影响,可从肾小球自由滤过,血清β2-MG 浓度升高提示肾小球滤过功能受损或负荷增加。血清β2-MG 含量,也是评价肾小球滤功能的敏感指标[3,8]。
目前为止,国内外多项研究提示血清Cyc-C、β2-MG与CSVD的形成密切相关:在急性脑梗死患者中,血清Cys C水平与CMB独立相关,Cys C水平增高,则CMB数量增加[9-10]。在急性LI患者中,血清Cys C水平与CSVD影像总负荷独立相关,是CSVD的独立危险因素[11]。陆冰等[12]研究了不同级别WML患者血清Cys C水平,结果显示:血清Cys C水平是WML严重程度的独立危险因素,对评估不同分级WML具有一定价值。血清β2-MG水平与基底结区扩大的血管周围间隙等级呈正相关,血清β2-MG水平越高,基底结区扩大的血管周围间隙越严重[13]。但以上研究没有注明患者肾功能情况,其研究结果究竟是肾功能不全后Cys C和β2-MG堆积所致还是CSVD同步发展的结果尚需证实。此外,这些研究多是在脑卒中患者中进行,无法排除急性脑血管病及大血管病变对Cys C及β2-MG的干扰。
本研究选择无脑卒中史、无肾脏疾病且GFR≥60ml(min1.73m2)的中老年人,结果发现:在这些中老年人群中,缺血性CSVD尤其WML和WML+LI的发生发展除了与年龄、高血压、动脉硬化密切相关外,与血清Cyc-C与β2-MG水平也显著相关,与以往研究结果一致。说明Cyc-C与β2-MG并非仅通过肾脏途径损伤小血管,而是参与了CSVD的发生、发展过程。同时,本研究中年龄、血清Cys C及β2-MG水平与WML独立相关,LI的独立危险因素则是男性、高血压和动脉硬化;LI+WML组与以上因素均显著相关,而且年龄更大,说明这组病人的病程更长,各项病理改变均已形成。
愈来愈多的临床研究证据支持炎症反应是CSVD的最主要的发病机制之一:在静止性LI患者中,血浆IL-6、细胞间黏附分子-1以及血管细胞黏附蛋白-1水平升高;在CSVD患者血浆中von Willebrand因子表达上调,这些都提示脑组织中存在炎症介导的内皮细胞损伤[14]。目前Cys C、β2-MG在CSVD中的作用机制尚不完全清楚。Cys C作为一种在生物体中广泛表达的半胱氨酸蛋白酶抑制剂,参与各种生理病理过程。Cys C能够在细胞和分子水平上参与免疫调节作用,包括抗原呈递、细胞因子分泌、一氧化氮合成以及细胞凋亡,其中包括炎症反应的调节[15]。而血清β2-MG是全身小动脉硬化的早期标志物,也是心血管死亡风险的增加危险因素[16-17]。CSVD患者血清Cyc-C与β2-MG显著升高,结合其与冠心病及动脉硬化的相关性,考虑其可能参与了小血管动脉硬化和内皮细胞炎症损伤过程,导致小血管内膜破损、脂质沉积、血栓形成,最终导致CSVD的发生发展[16-18]。而二者在缺血性CSVD各亚组又存在差异,提示LI和WML在发病机制上还存在不同机制,值得进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] 中华医学会神经病学分会脑血管病学组. 中国脑小血管病诊治共识[J]. 中华神经科杂志, 2015, 48(10): 838–844.
[2] 许戎. 血肌酐与胱抑素C对慢性肾脏病患者诊断及预后评估的临床价值[J]. 中华检验医学杂志, 2014, 37(6): 415–419.
[3] WONG J, S RI DHARAN S, B ERDERADO J, et al. Predicting residual kidney function in hemodialysis patients using serum beta-trace protein and beta2- microglobulin [J]. Kidney Int, 2016, 89(5): 1090–1098.
[4] 中国高血压防治指南修订委员会. 中国高血压防治指南(2018年修订版)[J]. 中国心血管杂志, 2019, 24(1) : 24–56.
[5] 高中宝, 赵杏丽, 王振福, 等. 脑微出血与脑白质病变及腔隙性脑梗死关系研究[J]. 中国卒中杂志, 2015, 10(10): 822–826.
[6] STEPHEN D J, COOK F A, MARTIN S D, et al. cerebral small vessel disease and renal function: Systematic review and Meta-analysis[J]. Cerebrovasc Dis, 2015, 39(1): 39–52.
[7] VEMURI P, KNOPMAN D S, JACK C R, et al. Association of kidney function biomarkers with brain MRI findings: The Brink study[J]. J Alzheimers Dis, 2017, 55(3): 1069–1082.
[8] LI L, DONG M, WANG X G. The impiications and significance of beta 2-microglobulin: A conservative multifunctional regulator[J]. Chin Med J (Engl), 2016, 129(4): 448–455.
[9] 楊松, 魏宁, 吴坚, 等. 缺血性脑卒中患者血清胱抑素C与脑微出血的关系[J]. 中华老年心脑血管病杂志, 2016, 18(5): 535–536.
[10] 成帅, 丁长霞. 血清CysC与脑梗死患者脑微出血的关系[J]. 中国实用神经疾病杂志, 2016, 19(19): 89–90.
[11] YANG S, CAI J, LU R, et al. Association between serum cystatin C level and total magnetic resonance imaging burden of cerebral small vessel disease in patients with acute lacunar stroke[J]. J Stroke Cerebrovasc Dis, 2017, 26(1): 186–191.
[12] 陆冰, 刘洲, 王俊贤, 等. 不同分级脑白质疏松症患者血清胱抑素C水平的临床意义[J]. 浙江医学, 2018, 40(10): 1091–1093, 1098.
[13] 张洁, 张敏, 曹音, 等. β2微球蛋白与小动脉闭塞型卒中患者血管周围间隙扩大的相关性研究[J]. 中国脑血管病杂志, 2021, 18(9): 599–605.
[14] EVANS L E, TAYLOR J L, SMITH C J, et al. Cardiovascular comorbidities, inflammation and cerebral small vessel disease[J]. Cardiovasc Res, 2021, 117(13): 2575–2588.
[15] MENGTING Z I, YUEKANG X U. Involvement of cystatin C in immunity and apoptosis[J]. Immunol Lett, 2018, 196(4): 80–90.
[16] JOOSTEN M M, PAI J K, BERTOIA M L, et al. Beta 2-microglobulin Cystatin C and creatinine and risk of symptomatic peripheral artery disease[J]. J Am Heart Assoc, 2014, 3(4): e000803.
[17] FOSTER M C, INKER L A, LEVEY A S, et al. Novelfiltration markers as predictors of all-cause and cardiovascular mortality in US adults[J]. Am J Kidney Dis, 2013, 62(1): 42–51.
[18] HONGXIAN W U, QIUNA D U, QIUYAN DAI, et al. Cysteine protease cathepsins in atherosclerotic cardiovascular diseases[J]. J Atheroscler Thromb, 2018, 25(2): 111–123.
(收稿日期:2023–07–01)
(修回日期:2024–02–19)
歡迎订阅,欢迎赐稿
