植物病原丝状真菌中糖苷水解酶的研究进展
2024-06-03肖会韩长志
肖会 韩长志

摘要:植物病原丝状真菌中的糖苷水解酶是碳水化合物活性酶中的一类,在植物病原真菌侵染植物的过程中通过分解其细胞壁中的碳水化合物组分从而实现真菌对植物免疫防卫反应的进一步操控。前期对植物病原丝状真菌中碳水化合物活性酶展开了综述性评价,近年来,随着生物技术和生物信息学、分子生物学等试验方法的发展,以及基因组学、代谢组学、蛋白质组学、转录组学等组学的不断发展,研究者对糖苷水解酶的研究不断深入和完善。旨在对糖苷水解酶进行综述性评价,重点关注其分类、功能及研究方法。在分类方面,主要涉及底物特异性、结构相似性、催化作用机制和水解位置。在功能方面,重点研究其在稻瘟病菌菌、禾谷炭疽病病菌和希金斯炭疽病病菌等病原丝状真菌侵染过程中的作用。此外,还探究了分离和鉴定、生物学特性及基因克隆和表达分析等方面的研究方法。研究的最终目标是深入分析上述研究成果,系统梳理糖苷水解酶在上述真菌中的功能,以期为今后解析病原丝状真菌中糖苷水解酶的功能提供重要理论支撑,并对今后学术界的研究重点、难点及热点进行展望,为未来开展糖苷水解酶功能解析、互作蛋白找寻及加工应用提供研究思路。
关键词:植物病原;丝状真菌;糖苷水解酶;功能;碳水化合物活性酶;研究进展
中图分类号:S188+.3;S432.4+4 文献标志码:A
文章编号:1002-1302(2024)08-0001-07
收稿日期:2023-05-22
基金项目:云南省“兴滇英才支持计划”青年人才专项(编号:YNWR-QNBJ-2020-188);国家自然科学基金(编号:31960314);云南省研究生导师团队建设项目(编号:2022100)。
作者简介:肖 会(1979—),女,四川巴中人,硕士研究生,研究方向为资源利用与植物保护。E-mail:719637908@qq.com。
通信作者:韩长志,博士,教授,研究方向为经济林木病害生物防治与真菌分子生物学。E-mail:hanchangzhi2010@163.com。
丝状真菌是一类具有丝状菌丝的真菌,广泛分布于自然界的土壤、水、植物及动物等中,其在自然界中发挥着重要作用并对人类的生产生活产生了巨大影响,如分解作用、食品加工及生物材料生产等[1]。然而,一些植物病原丝状真菌如稻瘟病菌、禾谷炭疽菌、希金斯炭疽菌及镰刀菌属真菌等对植物造成了各种危害和威胁,严重影响了经济发展和生态环境[2]。前人研究发现,植物病原丝状真菌在感染和侵入植物体的过程中,充分利用各种真菌毒素和分泌蛋白来破坏植物细胞壁和组织结构,从而导致植物生长受损或死亡。作为分泌蛋白的一类,碳水化合物活性酶在植物病原丝状真菌操控寄主植物方面发挥着重要作用。
糖苷水解酶则作为碳水化合物活性酶中重要的一类蛋白,可以降解植物细胞壁中的各种糖苷键,促进真菌从植物细胞间隙中进入细胞内部,进而引起植物疾病。糖苷水解酶广泛存在于细菌、真菌、植物种子和动物器官中[3]。因此,通过研究丝状真菌中的糖苷水解酶,可以更好地理解它们在植物病原中的作用机制和致病途径,为农业生产中的植物保护提供更多有效的防治措施和策略。
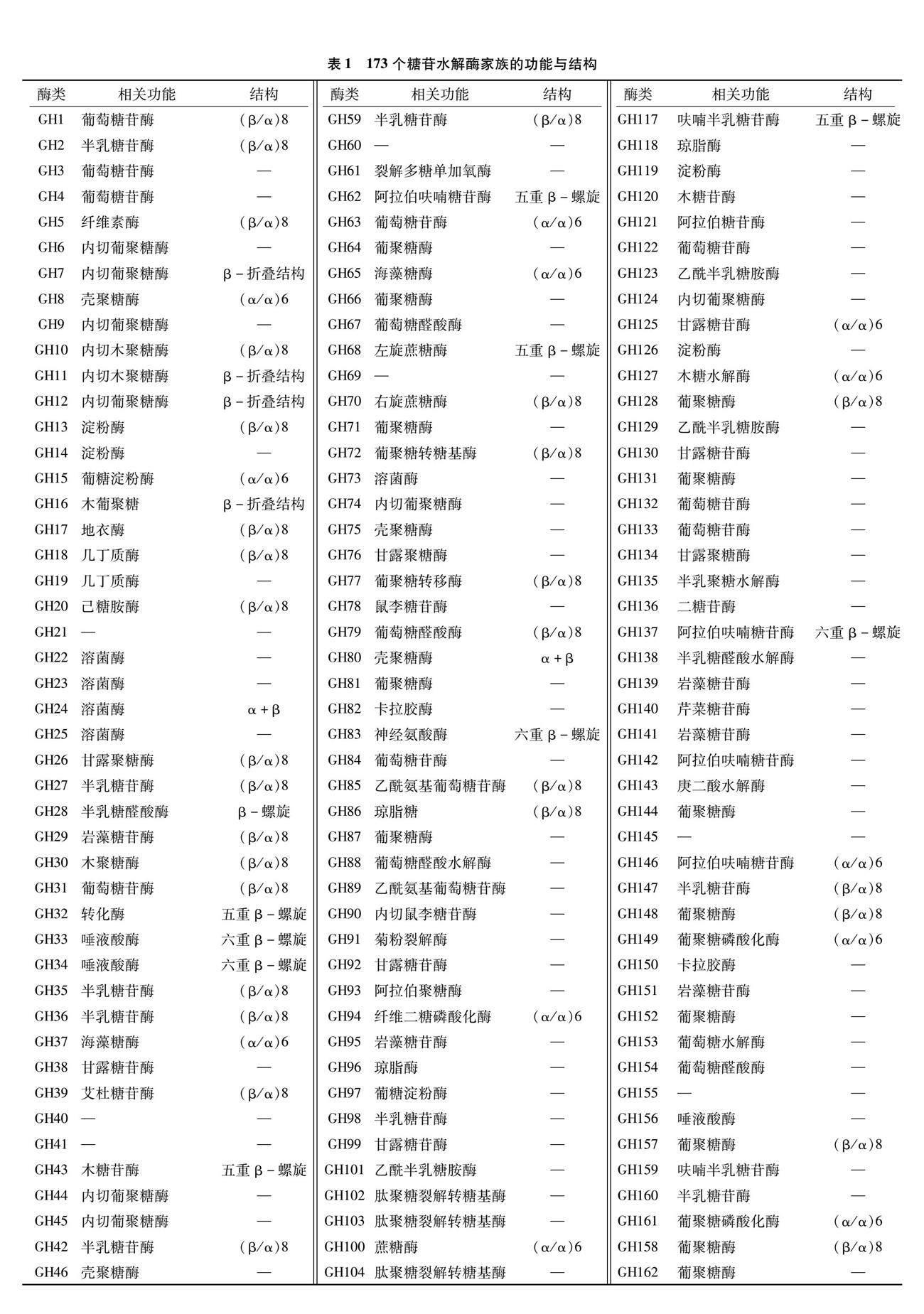
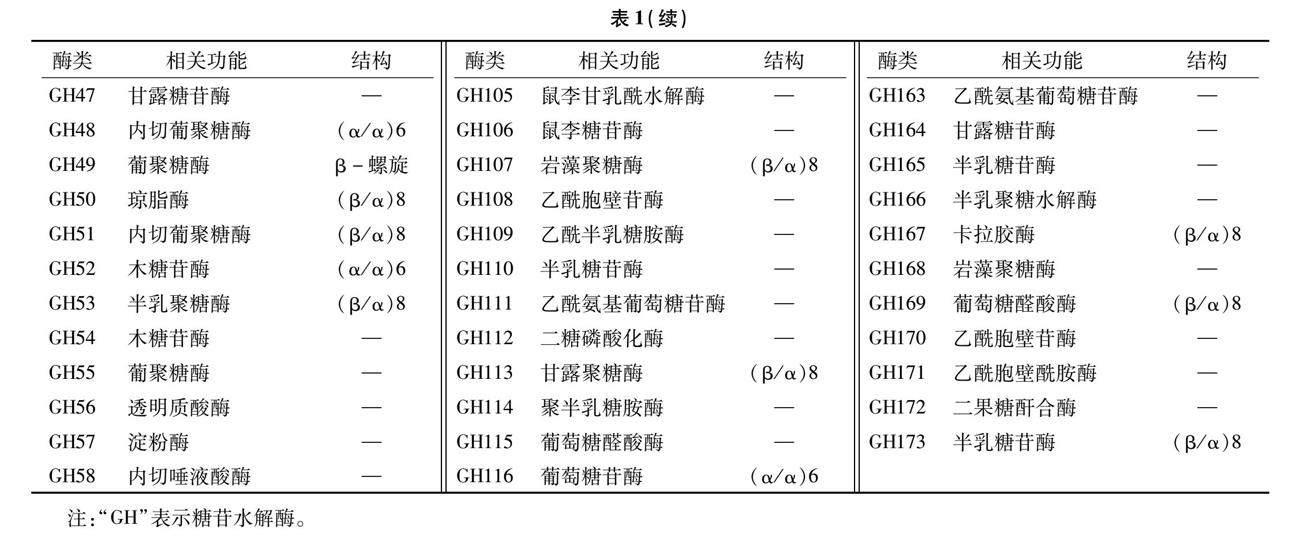
目前,根据序列相似性的差异程度,有173个糖苷水解酶家族被报道[4-5](表1)。这些酶具有特异性,对不同类型的糖苷底物具有不同的催化能力,表现出致病菌不同的寄生特性,在生物学中发挥着重要作用。有研究发现,糖苷水解酶的特异性、催化效率与其氨基酸序列、三维结构密切相关[6-7]。通过基因克隆技术,可以从各种生物体中克隆出糖苷水解酶的基因序列,并进一步进行序列分析和结构预测[8]。这些基因序列的分析有助于理解糖苷水解酶的结构和功能,为其工程改造提供依据。前人利用表达系统表达糖苷水解酶,并进行表达分析,通过对不同表达系统的比较和优化,实现了高效表達和纯化糖苷水解酶[9]。同时,表达分析还可以揭示酶的催化机制和底物特异性等方面的信息。糖苷水解酶在医药、食品、生物燃料等领域具有广泛的应用前景[10-11]。例如,α-糖苷酶可以用于制备低卡路里食品、转化葡萄糖和淀粉为生物燃料;β-糖苷酶可以用于制备低乳糖乳制品、去除食品中的苦味物质。上述研究为进一步探究糖苷水解酶相关的生化和分子机制提供了有力支持,为其在工业和生物领域的应用提供了广阔的发展前景。
笔者前期对植物病原丝状真菌中碳水化合物活性酶展开了综述性评价,近年来,随着生物技术和生物信息学、分子生物学等试验方法的发展,以及基因组学、代谢组学、蛋白质组学、转录组学等组学的不断发展,学术界对糖苷酶的研究也得到了不断深入和完善,本研究选择糖苷水解酶进一步展开综述性评价,从分类和功能、研究方法入手,深入分析稻瘟菌、禾谷炭疽菌、希金斯炭疽菌在侵染过程中糖苷水解酶的功能研究成果,系统梳理上述植物病原丝状真菌中糖苷水解酶的功能,以期为今后解析植物病原丝状真菌中糖苷水解酶的功能提供重要的理论支撑。
1 糖苷水解酶的分类和功能
1.1 糖苷水解酶的分类
糖苷水解酶的分类依据及类别[12]见表2。根据序列相似性,使用算法方法将糖苷水解酶分为100多个家族[13]。目前,糖苷水解酶的水解机制主要包括反转机制、保留机制、亲核氨基酸激活机制、外源碱性氨基酸催化机制、邻近基团亲核机制及烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)依赖机制6种,其中反转机制、保留机制为常见催化作用机制,催化作用机制、分子机制对于绝大多数糖苷酶家族及糖苷键周围的几何形状都是保守的。外切、内切是糖苷水解酶在末端或链中间切割底物的能力[14-18]。例如,大多数纤维素酶是内作用的,而来自大肠杆菌的β-半乳糖苷酶(LacZ)是外作用的。
1.2 糖苷水解酶的功能
糖苷水解酶广泛存在于各种生物体内,参与多个生命过程,如代谢、消化、免疫等[19-20]。糖苷水解酶能够分解糖苷键,从而实现糖分离和糖纯化,因此在糖业上有广泛的应用。此外,在食品工业中,它们可以用于食品风味改良,并增加食品的营养价值[21-22]。在医药工业中,糖苷水解酶可以用于制备药物,如具有祛风湿、抑菌、免疫调节抗肿瘤、抗炎症等作用的药物[5]。在生物技术中,糖苷水解酶可以用于研究糖苷键的生物学功能,并在糖生物学、蛋白组学等领域有广泛应用。在生物制药中,糖苷水解酶可用于制备生物制剂,如细胞壁蛋白酶、细胞膜蛋白酶等。因此,糖苷水解酶在能源、食品、纺织、洗涤剂、造纸等许多领域都有着广泛的应用前景[10-11]。
前人利用X-射线晶体学、核磁共振等技术确定糖苷水解酶的三维结构,揭示其催化机理和底物特异性[6]。糖苷水解酶被广泛应用于制药、食品、饲料等领域,前人对其在这些方面的应用进行了深入研究[23]。通过基因工程技术,前人成功克隆了多种糖苷水解酶基因,并将其表达于大肠杆菌等宿主中,从而实现大规模的酶生产[24]。有研究发现,糖苷水解酶的活性受多种因素影响,包括温度、pH值、金属离子等,通过对这些调控因素的深入研究,为提高酶的活性和稳定性提供了理论和试验基础[25-26]。对于糖苷水解酶功能的研究涉及多个方面,为研究人员深入探究其作用机制和应用打下了坚实基础。
2 糖苷水解酶在植物病原丝状真菌中的功能
2.1 稻瘟病菌
糖苷水解酶是一种在植物病原丝状真菌侵染、代谢中起重要作用的酶类,其在植物病原丝状真菌中的功能见表3。糖苷水解酶的作用机制主要是通过水解植物细胞壁中的糖类物质,如纤维素、半纤维素、木质素等来释放营养物质并加强菌丝的渗透性,从而促进病原菌对宿主植物的侵染[27]。在植物病原真菌与寄主的互作中,糖苷水解酶的表达和分泌受到多种因素的调节,如病原真菌与寄主植物之间的信号传递、环境因素的调控等[28-29]。病原真菌通过诱导表达和分泌糖苷水解酶等相关酶类,从而增强其在寄主植物中的营养吸收能力,同时也会加重寄主植物受到的危害。糖苷水解酶还可通过消减植物细胞壁、木质素等化合物,释放一些植物生长因子和调节物质如乙烯等,这些物质可影响宿主植物的生长和发育,并为病原真菌的侵染和繁殖提供必要的营养和环境条件[30-32]。稻瘟病是稻谷的一种重要病害,稻瘟病菌中存在多种糖苷水解酶,其中一些具有重要的生物学功能[33]。有研究发现,稻瘟病菌中的糖苷水解酶可以分解宿主中的水解纤维素、低聚果糖、低聚葡萄糖、低聚半乳糖等多种复杂的碳水化合物,从而为菌体提供能量和營养物质。同时,糖苷水解酶还可以使稻瘟病菌释放出一些细胞毒素和酸性代谢产物,进一步破坏宿主细胞,并引发病害症状[34]。因此,糖苷水解酶在稻瘟病菌中的侵染和代谢具有非常重要的作用,其与病原菌及其宿主植物之间相互作用密切[4]。了解糖苷水解酶的作用机制和相互作用,有助于深入了解其致病机制,为控制稻瘟病菌的感染提供更有效的方法和策略。
2.2 禾谷炭疽病菌
禾谷炭疽病菌是炭疽菌属中重要的植物病原真菌,可导致玉米、小麦、蓝草、黑麦草和羊茅等多种禾本科作物的感染与腐烂[2,35-38]。糖苷水解酶是该真菌体内一种重要的酶类,其主要作用是水解糖苷键,将多糖分解为单糖,为真菌提供能量和碳源。禾谷炭疽病菌中糖苷水解酶功能不仅局限于有机物分解和代谢,更重要的是参与生物膜和生物胶的合成、细胞分裂和感染等过程。在生物膜的合成过程中,糖苷水解酶可以参与多糖的合成和降解,影响菌体生长和附着。在细胞分裂过程中,糖苷水解酶可以参与细胞壁成分的合成和降解,从而促进胞壁的重组和细胞分裂。有研究发现,在感染过程中,糖苷水解酶可以介导禾谷炭疽病菌的侵染,并且参与禾谷炭疽病菌及其寄主植物细胞的相互作用,影响病菌在植物体内的生长和繁殖。因此,深入研究禾谷炭疽病菌中糖苷水解酶的功能,有助于理解该菌的致病机制、寻找新的抗病毒策略和开发新的防治措施,从而有效遏制禾谷炭疽病的传播和发展。
2.3 希金斯炭疽病菌
希金斯炭疽病菌是一种重要的植物病原真菌,可引起十字花科蔬菜发生严重的炭疽病,对蔬菜生产造成很大影响[39-40]。糖苷水解酶是一种水解酶,能够水解糖苷键。有研究发现,糖苷水解酶在希金斯炭疽病菌中起着重要的生物学作用。具体而言,糖苷水解酶在希金斯炭疽病菌中能够水解多种糖苷类物质,包括淀粉、半乳糖和蔗糖等,这些物质是希金斯炭疽病菌生长所必需的营养物质,糖苷水解酶的活性可以促进希金斯炭疽病菌对这些物质的利用。此外,研究还发现,糖苷水解酶可能在希金斯炭疽病菌的致病机制中发挥作用。希金斯炭疽病菌的细胞壁上有一种聚葡萄糖胶囊,这种聚葡萄糖胶囊能够保护细菌免受宿主的免疫系统攻击。糖苷水解酶能够水解聚葡萄糖胶囊中的葡萄糖基团,破坏聚葡萄糖胶囊的完整性,可能有助于希金斯炭疽病菌侵入宿主组织并引发疾病。总的来说,糖苷水解酶在希金斯炭疽病菌的生长、致病过程中都扮演着重要角色。对糖苷水解酶的功能研究有助于深入理解希金斯炭疽菌的生物学特性,为炭疽病的防治提供理论依据。
3 有关糖苷水解酶的研究方法
3.1 分离和鉴定
采用病原真菌酶的分离纯化、酶学特性研究方法,涉及样本采集、酶提取、酶活性测定、酶纯化和酶学特性研究等,用于深入了解病原真菌的酶学特性和功能,可为进一步探索其在病害发生中的作用提供理论基础。选择适合病原真菌生长的培养基,如马铃薯蔗糖琼脂。可采用以下步骤开展糖苷水解酶的分离:从病害的患处收集带有病原丝状真菌的样本,避免样本被外界污染;将收集到的样本切碎后,加入适量的缓冲液,在4 ℃条件下冷藏过夜,用无菌棉球或滤纸过滤提取酶液;采用标准糖苷水解反应体系,观察糖苷水解酶产生的酶活性;将测定出有酶活性的培养物采用离心、电泳、柱层析等方法进一步分离和纯化,最终得到单一的纯化酶;对得到的纯化酶进行酶学特性(如酶的相对分子量、pH值和温度稳定性等性质)研究。通过以上鉴定分离方法可以对植物病原丝状真菌糖苷水解酶进行分离纯化并了解其性质,有助于深入研究它们在植物病害中的作用机制。
3.2 生物学特性
植物病原丝状真菌糖苷水解酶在植物体内能够降解植物的细胞壁和组织,从而导致植物的基本生理功能障碍,引发植物病害[41]。在近年的研究中,植物病原真菌糖苷水解酶的生物学特性得到了广泛关注。该酶类蛋白的生物学特性包括相对分子量、结构、活性、半衰期等,其分子量差异较大,分子量为30 u以上时比较常见[42-44]。该酶类蛋白通常由多个亚基组成,其结构形式多为四聚体、五聚体及六聚体等多聚体结构。糖苷水解酶的活性与其结构、基质和pH值等有关[21]。此外,糖苷水解酶的半衰期较短,多数不会超过几个小时,这也是其在植物病害发生过程中起到重要作用的主要原因之一。因此,对植物病原真菌糖苷水解酶的生物学特性研究,对于深入了解植物病害的发生机制、制定遏制措施等都有十分重要的意义。
3.3 基因的克隆和表达分析
植物病原丝状真菌糖苷水解酶基因的克隆和表达分析是研究这类真菌的分子机制及病害防治的重要基础。这类糖苷水解酶基因的克隆通常采用RT-PCR、普通PCR等方法,利用已知病原真菌的其他物种和同源酶的保守序列,设计寡核苷酸引物进行扩展。经过克隆后,利用序列比对和系统发育分析等方法确定新得到的序列。该类基因的克隆,对揭示病原真菌的分类、特征及生物学意义有极大帮助。除了克隆基因,研究表达水平是了解病菌致病性和防治的重要手段。在真菌的生命周期中,酶类基因在特定时期被表达,糖苷水解酶基因的表达是引起植物病变的重要因素之一。因此,了解在真菌的生长过程中糖苷水解酶基因的表达情况,能够为相应的防控策略和治疗方法提供依据。
目前,采用实时定量PCR技术可以快速、高效地检测真菌基因的表达情况,引用内部标准产生标准曲线或计算相对表达水平。通过分析表达水平的变化,可以了解在不同环境条件下,真菌的糖苷水解酶基因的表达,为疾病防控提供依据。综上所述,植物病原丝状真菌糖苷水解酶基因的克隆和表达分析,是深入研究植物真菌病害致病机制以及寻找相应防治措施和药物的重要手段。
4 展望
4.1 糖苷水解酶功能解析是开展植物病原丝状真菌的重点
糖苷水解酶作为一类存在于许多生物体中的酶,可以通过水解生物的糖苷键将糖苷化合物分解为糖和非糖基团。在植物病原丝状真菌中,糖苷水解酶参与病原菌在寄主植物中的营养吸收、组织侵染、代谢适应等多个关键生物学过程。笔者所在团队前期利用CRISPR-cas技术对核桃炭疽病菌中的部分糖苷水解酶开展了功能解析(数据未发表),然而对于糖苷水解酶功能的解析尚不全面,严重影响了对于植物病原丝状真菌侵染机制的解析及后续植物病原菌防控的研究。因此,深入解析糖苷水解酶的功能,有助于進一步明确植物病原丝状真菌侵染植物作用机制,并深入拓展对糖苷水解酶功能的认知,从而更好地在工农业生产上应用。随着生物大分子结构解析技术的成熟,以及生物信息学分析技术的不断发展,针对植物病原丝状真菌中的糖苷水解酶功能解析,有助于对植物与病原菌互作机制的理解,推进对植物免疫防卫反应机制的认知。同时,通过对重要农林植物病原丝状真菌中糖苷水解酶功能的研究,可以进一步揭示植物病原丝状真菌在寄主植物中的代谢适应和生物学功能,并为研究病原菌-寄主互作机制、开发新的生物农药和抗真菌药物提供理论基础和试验依据。
4.2 糖苷水解酶互作蛋白找寻是理解植物病原丝状真菌侵染机制的难点
关于糖苷水解酶在植物病原丝状真菌侵染寄主植物过程中,是否存在同种糖苷水解酶蛋白寡聚化方式作用于植物免疫系统、不同种糖苷水解酶蛋白协同作用危害植物、同一亚类糖苷水解酶蛋白寡聚化或协同作用植物生长发育与抗病作用等问题,均有待进一步明确。前期笔者所在研究小组通过生物信息学分析及分子对接技术,开展了禾谷炭疽病菌、希金斯炭疽病菌及核桃炭疽病菌中糖苷水解酶互作蛋白的找寻工作,明确同种糖苷水解酶蛋白、不同种糖苷水解酶蛋白及同一亚类糖苷水解酶蛋白存在互作关系,推测在植物病原丝状真菌侵染寄主过程中,不同类别糖苷水解酶蛋白、同一类别不同亚类糖苷水解酶蛋白发挥着协同作用。尽管如此,学术界对于植物病原丝状真菌中糖苷水解酶互作蛋白的找寻尚不够深入,当前对于病原菌效应分子或致病基因的互作蛋白找寻大多停留于从寄主植物找寻受体蛋白,缺乏对于植物病原丝状真菌中效应分子或致病基因“群体蛋白”的找寻,严重制约着对植物病原丝状真菌致病机制的理解。不同类别的糖苷水解酶及“群体蛋白”能够协同作用,降解寄主植物细胞壁的主要成分(包括纤维素和半纤维素)。可以协同发挥作用降解寄主植物细胞壁的主要成分(纤维素、半纤维素),从而破坏植物细胞壁的完整性,使真菌能够穿过细胞壁,侵入植物细胞内部。然而,准确找寻糖苷水解酶互作蛋白仍然存在很多难点,如生物信息学分析识别和筛选方法尚不完善、生物学试验花费较大等。
4.3 糖苷水解酶改造应用是未来植物病害防治中的热点
植物病原丝状真菌糖苷水解酶在实现其操控寄主植物方面发挥着重要作用,推测该蛋白可作为未来植物病害防控药剂的重要靶标,进而开发相应的化学药剂,实现对农林重要植物病原丝状真菌的防控。当前化学农药在防控农林重要植物病害方面发挥着重要作用,化学防治发挥着其他方法不可替代的作用。然而,随着化学药剂的不断施用,植物病原丝状真菌耐药性情况被不断报道,耐药性菌株不断出现,严重影响着化学药剂的防控效果,急需开发出具有新的作用靶标的新型化学农药。因此,深入解析植物病原丝状真菌中糖苷水解酶特性及功能,挖掘针对性作用靶标,有助于未来更好地改造应用糖苷水解酶,并推进植物病原丝状真菌糖苷水解酶在植物病害防治的应用前景。植物病原丝状真菌糖苷水解酶的应用可以提高植物的免疫力,降低作物受到病害的概率,提高作物产量和品质。同时,深入探索和优化不同植物病原丝状真菌中同类糖苷水解酶的找寻及应用技术,根据共同特征找寻共同靶标,从而有助于开发广谱性化学农药,促进植物病害防治技术的进一步发展。
参考文献:
[1]张浩东,赵清梅,薛佳祺,等. 丝状真菌的转录调控启动子及其功能研究进展[J]. 农业科学研究,2021,42(4):56-64,9.
[2]Dean R,van Kan J A L,Pretorius Z A,et al. The Top 10 fungal pathogens in molecular plant pathology[J]. Molecular Plant Pathology,2012,13(4):414-430.
[3]Cantarel B L,Coutinho P M,Rancurel C,et al. The carbohydrate-active enzymes database (CAZy):an expert resource for glycogenomics[J]. Nucleic Acids Research,2009,37(Suppl1):D233-D238.
[4]陈泉冰,曹伟洁,李 春,等. GH79家族糖苷水解酶分子进化关系和蛋白结构研究[J]. 生物技术通报,2023,39(1):104-114.
[5]原 野,胡彦波,周义发. 糖苷水解酶:生物转化制备活性糖苷与苷元的有效工具[J]. 微生物学报,2017,57(8):1219-1234.
[6]陆 璐,陶雅军,罗学娅,等. 糖苷水解酶32家族结构与功能的研究进展[J]. 中国酿造,2019,38(8):14-19.
[7]Chen W,Jiang X,Yang Q. Glycoside hydrolase family 18 chitinases:the known and the unknown[J]. Biotechnology Advances,2020,43:107553.
[8]周林芳,江 波,張 涛,等. 糖苷水解酶第3家族β-葡萄糖苷酶的研究进展[J]. 食品工业科技,2017,38(14):330-335.
[9]刘国芳,任沛东,叶文新,等. 十字花科黑腐病菌中转录因子HpaR1与Clp调控一个糖苷水解酶基因表达的分析[J]. 遗传,2021,43(9):910-920.
[10]Jrgensen H,Vibe-Pedersen J,Larsen J,et al. Liquefaction of lignocellulose at high-solids concentrations[J]. Biotechnology & Bioengineering,2010,96(5):862-870.
[11]Shanmugam S,Krishnaswamy S,Chandrababu R,et al. Optimal immobilization of Trichoderma asperellum laccase on polymer coated Fe3O4-SiO2 nanoparticles for enhanced biohydrogen production from delignified lignocellulosic biomass[J]. Fuel,2020,273:117777.
[12]Vasella A,Davies G J,Bhm M. Glycosidase mechanisms[J]. Current Opinion in Chemical Biology,2002,6(5):619-629.
[13]Henrissat B. A classification of glycosyl hydrolases based on amino acid sequence similarities[J]. Biochemical Journal,1991,280(2):309-316.
[14]Davies G,Henrissat B. Structures and mechanisms of glycosyl hydrolases[J]. Structure,1995,3(9):853-859.
[15]Gebler J,Gilkes N R,Claeyssens M,et al. Stereoselective hydrolysis catalyzed by related beta-1,4-glucanases and beta-1,4-xylanases[J]. The Journal of Biological Chemistry,1992,267(18):12559-12561.
[16]Henrissat B,Callebaut I,Fabrega S,et al. Conserved catalytic machinery and the prediction of a common fold for several families of glycosyl hydrolases[J]. Proceedings of the National Academy of Sciences,1995,92(15):7090-7094.
[17]White A,Rose D R. Mechanism of catalysis by retaining β-glycosyl hydrolases[J]. Current opinion in structural biology,1997,7(5):645-651.
[18]Withers S. Mechanisms of glycosyl transferases and hydrolases[J]. Carbohydrate Polymers,2001,44(4):325-337.
[19]Rudd P M,Wormald M R,Dwek R A. Glycosylation and the immune system[J]. Journal of Protein Chemistry,1998,17(6):519.
[20]Kytidou K,Artola M,Overkleeft H S,et al. Plant glycosides and glycosidases:a treasure-trove for therapeutics[J]. Frontiers in Plant Science,2020,11:357.
[21]李 聪,王 允. 棘孢木霉糖苷水解酶3基因家族的生物信息学及表达模式分析[J]. 微生物学通报,2023,50(1):1-12.
[22]周庆新,戴炳业,陈蕾蕾,等. 瑞氏木霉中β-葡萄糖苷酶基因功能研究进展[J]. 中国农业科技导报,2014,16(2):74-78.
[23]Sharma A,Tewari R,Rana S S,et al. Cellulases:classification,methods of determination and industrial applications[J]. Applied Biochemistry and Biotechnology,2016,179:1346-1380.
[24]Kim E S,Lee H J,Bang W G,et al. Functional characterization of a bacterial expansin from Bacillus subtilis for enhanced enzymatic hydrolysis of cellulose[J]. Biotechnology and Bioengineering,2010,102(5):1342-1353.
[25]Cantarel B L,Coutinho P M,Rancurel C,et al. The carbohydrate-active ENZYMES database (CAZy):an expert resource for glycogenomics[J]. Nucleic Acids Research,2008,37(1):D233-D238.
[26]Crennell S J,Hreggvidsson G O,Karlsson E N. The structure of Rhodothermus marinus Cel12A,a highly thermostable family 12 endoglucanase,at 1.8 resolution[J]. Journal of Molecular Biology,2002,320(4):883-897.
[27]韓长志,许 僖. 植物病原丝状真菌分泌蛋白及CAZymes的研究进展[J]. 南京林业大学学报(自然科学版),2017,41(5):152-160.
[28]Larrucea S,Butta N,Arias-Salgado E G,et al. Expression of podocalyxin enhances the adherence,migration,and intercellular communication of cells[J]. Experimental Cell Research,2008,314(10):2004-2015.
[29]Okuyama M. Function and structure studies of GH family 31 and 97 α-glycosidases[J]. Bioscience,Biotechnology and Biochemistry,2011,75(12):2269-2277.
[30]Burnaugh A M,Frantz L J,King S J. Growth of Streptococcus pneumoniae on human glycoconjugates is dependent upon the sequential activity of bacterial exoglycosidases[J]. Journal of Bacteriology,2008,190(1):221-230.
[31]杨利艳,郭晓娣,张玉荣,等. 外源乙烯利对禾谷炭疽菌生物学特性的影响及转BtACO基因植物的抗病性评价[J]. 中国农业大学学报,2022,27(3):33-40.
[32]Sharon A,Fuchs Y,Anderson J D. The elicitation of ethylene biosynthesis by a Trichoderma xylanase is not related to the cell wall degradation activity of the enzyme[J]. Plant Physiology,1993,102(4):1325-1329.
[33]陈 龙,洪永河,吴晓贤,等. 稻瘟病菌NUDIX水解酶家族的生物信息学及表达特性研究[J]. 分子植物育种,2016,14(5):1075-1081.
[34]周 洁,郑祥梓,兰 斓,等. 稻瘟病菌假定的糖基水解酶62家族初步研究[J]. 中国农业科学,2009,42(8):2754-2762.
[35]Torres M F,Ghaffari N,Buiate E a S,et al. A Colletotrichum graminicola mutant deficient in the establishment of biotrophy reveals early transcriptional events in the maize anthracnose disease interaction[J]. BMC Genomics,2016,17(1):202.
[36]韩长志,任文来. 禾谷炭疽菌GPCR蛋白生物信息学分析[J]. 西南林业大学学报,2016,36(4):82-87.
[37]刘 涵,孟成真,刘玉青,等. 禾谷炭疽菌CgRab5A的亚细胞定位研究[J]. 安徽农学通报,2019,25(22):99-102.
[38]覃 悦,韩长志. 禾谷炭疽菌内吞相关蛋白找寻及其生物信息学[J]. 科学技术与工程,2021,21(13):5287-5295.
[39]祝一鸣,刘艳潇,何九卿,等. 希金斯炭疽菌效应子基因ChEP085的功能研究[J]. 华北农学报,2022,37(2):192-200.
[40]陳光建,覃 悦,韩长志. 希金斯炭疽菌中NPFxD基序蛋白找寻及其生物信息学分析[J]. 江苏农业科学,2022,50(5):35-40.
[41]Robb M,Hobbs J K,Woodiga S A,et al. Molecular characterization of N-glycan degradation and transport in Streptococcus pneumoniae and its contribution to virulence[J]. PLoS Pathogens,2017,13(1):e1006090.
[42]Addala M S,Gudipati M. Purification and characterization of a novel α-D-glucosidase from Lactobacillus fermentum with unique substrate specificity towards resistant starch[J]. Journal of General & Applied Microbiology,2017,63(6):355-361.
[43]Masuda Y,Okuyama M,Iizuka T,et al. Purification and characterization of a chloride ion-dependent α-glucosidase from the midgut gland of Japanese scallop (Patinopecten yessoensis)[J]. Bioscience,Biotechnology,and Biochemistry,2016,80(3):479-485.
[44]Okuyama M,Tanimoto Y,Ito T,et al. Purification and characterization of the hyper-glycosylated extracellular α-glucosidase from Schizosaccharomyces pombe[J]. Enzyme & Microbial Technology,2005,37(5):472-480.
