基于网络药理学和分子对接探讨党参防治免疫性血小板减少症的分子机制
2024-06-03朱瑞芳陈雨露王倩张珺张淑文吕亚茹韩世范王宏伟
朱瑞芳 陈雨露 王倩 张珺 张淑文 吕亚茹 韩世范 王宏伟
Molecular mechanism of Codonopsis pilosula in the prevention and treatment of immune thrombocytopenia based on network pharmacology and molecular docking
ZHU Ruifang, CHEN Yulu, WANG Qian, ZHANG Jun, ZHANG Shuwen, LYU Yaru, HAN Shifan, WANG Hongwei
First Hospital of Shanxi Medical University, Shanxi 030001 China
Corresponding Author WANG Hongwei, E?mail: wanghw68@hotmail.com; HAN Shifan, E?mail: shifan.han@sxmu.edu.cn
Abstract Objective:To preliminarily elucidate the molecular mechanism of Codonopsis pilosula in the treatment of immune thrombocytopenia (ITP) through network pharmacology,differential gene analysis,and molecular docking.Methods:The main components and corresponding protein targets of Codonopsis pilosula were searched in the TCMSP,TCMID and ETCM.The targets of ITP were collected from the GeneCards,OMIM,and DisGeNET databases.A Venn diagram was constructed to obtain the intersection targets between the compound targets and disease targets,and the qualified targets were imported into the STRING database.The PPI network was constructed using Cytoscape 3.9.1.Subsequently,GO and KEGG enrichment analyses were performed on the intersection targets to explore the relevant signaling pathways of ITP and Codonopsis pilosula.Finally,molecular docking studies were conducted on the key targets and active compounds.Results:A total of 84 potential active compounds,2 354 ITP related targets,257 interaction targets,and 86 intersection targets of Codonopsis pilosula were collected.Through PPI network analysis,15 key targets were identified, with the top five targets ranked by Degree values including VEGFA,SRC,IL2,PPARG,and EGFR.GO and KEGG analyses indicated that Codonopsis's treatment of ITP mainly involves biological processes such as positive regulation of the ERK1 and ERK2 cascade,signal transduction,and protein phosphorylation.The signaling pathways mainly include the PI3K?AKT,cancer, and T?cell signaling pathways.Molecular docking results showed that SRC and PPARG exhibited high binding activity with 1?hydroxyrankinidine.Myristic acid,ethyl α?d?fructofuranoside,and glycitein are important active compounds and were verified through molecular docking simulations.Conclusion:This study clarifies from multiple perspectives that Codonopsis pilosula may exert therapeutic effects on ITP by regulating multiple targets and pathways,providing a scientific basis for further investigating the effects of Codonopsis pilosula on ITP.
Keywords immune thrombocytopenia; Codonopsis pilosula; network pharmacology; molecular docking; molecular mechanisms
摘要 目的:采用网络药理学、差异基因分析、分子对接方法初步阐明党参治疗免疫性血小板减少症(ITP)的分子机制。方法:在传统中药系统药理学数据库(TCMSP)、传统中药综合数据库(TCMID)和中医药百科全书数据库(ETCM)中检索党参的主要成分和相应的蛋白质靶标。在GeneCards、OMIM、DisGeNET数据库收集ITP的靶点,构建韦恩图获得复合靶标和疾病的交集靶点,并将靶标导入STRING数据库,使用Cytoscape3.9.1构建PPI网络。接着对交集靶点进行基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析,以探索ITP与党参的相关信号通路,最后对关键靶点和活性化合物进行分子对接研究。结果:共获得党参的84种潜在活性化合物、2 354个疾病靶点与257个药物靶点,并得到86个交集靶点。通过蛋白互相作用网络图(PPI)分析确定了15个关键靶点,Degree值排名前5位的靶点包括血管内皮生长因子A(VEGFA)、Src原癌基因(SRC)、白细胞介素2(IL2)、过氧化物酶体增殖激活受体γ(PPARG)、表皮生长因子受体(EGFR)。GO和KEGG分析表明,党参治疗ITP主要涉及ERK1和ERK2级联的正向调控、信号转导、蛋白质磷酸化等生物学过程,信号通路主要包括PI3K/Akt、癌症通路、T细胞信号通路。分子对接结果表明,SRC、PPARG与11?hydroxyrankinidine具有较高的结合活性。肉豆蔻酸、乙基α?d果糖呋喃糖苷、黄豆黄素是重要的活性化合物并通过分子对接模拟进行验证。结论:本研究从多个角度阐明党参可能通过调节多个靶点和多条途径对ITP产生治疗作用,可为进一步深入研究党参对ITP的作用提供科学依据。
关键词 免疫性血小板减少症;党参;网络药理学;分子对接;分子机制
doi:10.12102/j.issn.1009-6493.2024.09.001
免疫性血小板减少症(ITP)是一种获得性自身免疫性出血性疾病,由于异常的T细胞反应,特别是由脾滤泡辅助T细胞支持,刺激自身反应性B细胞增殖和分化[1],其特征多以免疫介导的血小板破坏增多与血小板生成减少为主[2],病人出現不同程度的出血倾向,并损害与健康相关的生活质量[3]。ITP的发病率为5/10万~10/10万,男女发病率相近,育龄期女性发病率高于同年龄段男性,60岁以上人群的发病率为60岁以下人群的2倍。近年来,关于ITP的发病机制研究扩展至细胞免疫和血小板生成障碍方面,研究证实细胞免疫和抗血小板抗体介导巨核细胞质量异常在ITP发病机制中也发挥着重要作用[4]。
党参(Codonopsis pilosula)是桔梗科植物党参的干燥根[5],具有补气、健脾、益肺及养血生津的功效[6]。现代药理学研究表明,党参多糖具有调节免疫和促进胃肠道功能的作用[7]。中药网络药理学是根据中药成分、靶点和疾病的相互作用网络识别小分子调节的系统方法。该方法集成了生物信息学、系统生物学和药理学[8],它在系统水平上阐明了中药与疾病的复杂相互作用,符合中医理论的整体和系统观点。近年来,网络药理学作为一门以系统生物学和多方向药理学为基础的新兴学科,可以有效地实现药物作用机制的预测性分析,识别新的药物靶点,更好地解释生物活性分子与细胞通路之间的相互作用机制。分子对接技术是现代化研究的有力工具,可以实现药物的虚拟筛选[9]。
1 资料与方法
1.1 资料来源
分别在传统中药系统药理学数据库(TCMSP)[10]、传统中药综合数据库(TCMID)[11]、中医药百科全书数据库(ETCM数据库)[12]中对党参有效成分进行检索,随后在小分子生物活性数据(PubChem)[13]检索成分的SMILES号或2D结构,并将其输入Swiss Target Prediction数据库筛选党参活性成分及相关的潜在靶点。查阅相关资料后,本研究选择口服生物利用度(oral bioavailability,OB)>30%和药物类药性(drug?likeness,DL)>0.18为活性成分筛选条件。在TCMID数据库中通过关键词检索共获取有效成分187个。在ETCM数据库中,以“DANG SHEN”为关键词进行检索,获得64个党参活性成分。将TCMID和ETCM数据库中获得的党参有效成分输入成分靶点数据库(SWISS ADME)筛选。最后,整合3个数据库中所得活性成分,利用PubChem数据库将获得的药物党参有效活性成分一一输入,点击SEARCH进行检索,从而检索化合物标准名称。去除无法找到的活性成分及非化学成分的物质名称并整合去重后,最终得到药物党参的活性成分共84个。
1.2 收集党参活性成分对应基因靶点
将靶基因输入PubChem数据库,根据成分的SMILES号或2D结构在Swiss Target Prediction数据库中搜索,找到对应的靶蛋白,并在UniProt数据库[14?15]中将靶点蛋白名称转换为标准基因名称。筛选录入排名前10位且probability>0的靶点,按照上述步骤收集党参有效成分的靶点,共获得728个靶点。在Excel表格中完成去重整理后,获得党参靶点共257个。
1.3 ITP靶点基因的获取
在GeneCards数据库 [16]、OMIM数据库[17]、DisGeNET数据库[18]中收集ITP的相关靶点。去除没有靶标的化学成分,删除重复靶标。在基因表达数据库(GEO)中对数据集GSE574进行差异基因分析。将疾病?党参基因靶点及药物?ITP的基因靶点输入韦恩作图工具,构建韦恩图,并寻找党参与ITP的交集靶点基因。
1.4 蛋白互作网络图(PPI)的构建
将党参对ITP的有效靶点基因输入STRING 数据库中,在multiple proteins选项中限定物种为 “Homo sapiens”,获得蛋白互作图,在Cytoscape 3.9.1软件中对PPI网络进行可视化分析[19],根据度值(Degree)大小绘制PPI蛋白互作网络图。
1.5 构建药物?党参潜在化合物?潜在靶点基因可视化网络
在Cytoscape3.9.1软件中导入药物潜在化合物及对应靶点基因,进行可视化分析,构建党参化合物?靶点网络图并对交集靶点进行排名。
1.6 基因本体(GO)和京都基因与基因组百科全书(KEGG)通路富集分析
将共同靶点导入DAVID 数据库(https://david.ncifcrf.gov/)分别进行GO和KEGG通路富集分析,P<0.05为阈值,筛选出前10位的生物过程和信号通路,并将结果收集整理绘图。利用信息化通路分析单体成分作用于核心靶点的通路机制,探讨相互作用。
1.7 分子对接
使用AutoDuck对PPI网络中Degree排名前6位的核心蛋白与对应排名前5位的化合物进行对接,初步验证结合程度。1)配体准备:在PubChem数据库中下载对应化合物的3D结构图。在PyMOL中处理后将pdb格式转换为pdbqt格式。2)受体准备:将靶点基因在PDB数据库[1]中将筛选条件设置为pH 6.5~7.5,分辨率≤2.5,种类为“人类”,获取合适的靶点蛋白结构的sdf格式文件,在Open babel GUI中将SDF格式转化为pdb格式,导入PyMOL中去除杂质后,在AutoDock软件中去水加氢处理后,转化为pdbqt格式。3)对接:利用AutoDock vina依次将潜在化合物成分与关键靶点蛋白进行分子对接并获得对接分数。
2 结果
2.1 筛选党参活性成分及收集基因靶点
从TCMP、TCMID和ETCM数据库中检索党参有效活性成分,经过汇总去重后,最终得到84个有效成分。通过Swiss Target Prediction数据库检索TCMID及ETCM获得的相应靶点,得到党参作用靶点257個有效化学成分,包括黄酮类、甾体类、生物碱类、糖苷类、三萜类等。
2.2 ITP靶点筛选
在GeneCards、OMIM、DisGeNET 及GEO数据库收集ITP靶点。由于GeneCards数据库靶点与疾病关系越密切对应的Relevance score值越高,因此,从结果中留取 Relevance score值≥2倍中位数(即≥4.69)的靶点作为ITP潜在基因靶点,共获得1 117个靶点。在OMIM数据库中获得106个靶点。在DisGeNET 数据库中检索获得186个靶点。将3个数据库所得靶点去重整合得到ITP靶点1 334个靶点。
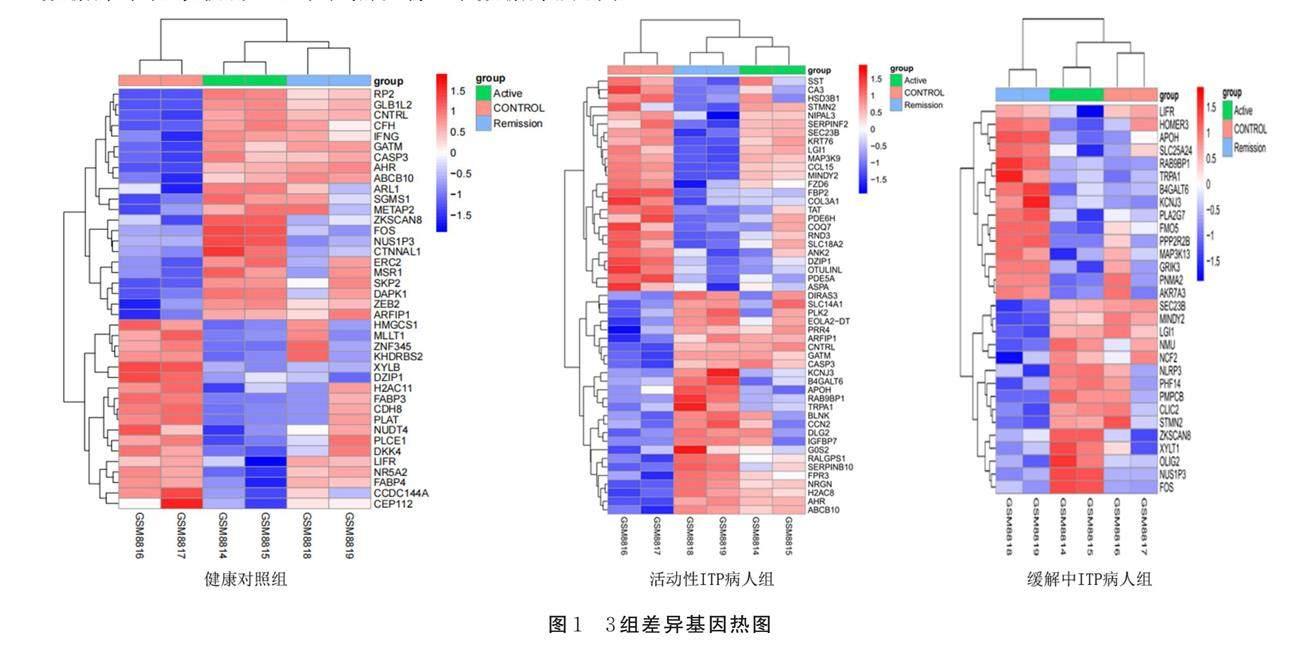
在GEO数据库中对GSE574数据集进行分析,该数据集包含6组样本,分为健康对照组、活动性ITP病人组和缓解中ITP病人组3组。利用R软件对3组进行两两比较,并对3组样本数据进行差异基因分析。对3组DEGs设置筛选条件为P<0.05、|logFC|>3,共得到1 846个差异基因,其中上调基因998个、下调基因848个。使用R4.1.2软件绘制热图(见图1)。将GeneCards数据库、OMIM数据库、DisGeNET 数据库及GEO数据库收集ITP靶点整合去重后,获得ITP靶点2 354个。
2.3 药物?活性成分?疾病的交集靶点
将2 354个疾病靶点与257个药物靶点导入并取交集绘制韦恩图,并得到86个交集靶点(见图2)。
2.4 PPI网络图的构建
2.4.1 蛋白互作网络的构建可视化分析
将获得的86个交集靶点导入STRING数据库对蛋白关系进行可视化分析,并在Cytoscape 3.9.1 软件对Degree值进行计算分析,绘制PPI关系图,去除无关联的节点后有83个节点及498条边。其中节点大小及颜色深浅与Degree值呈正相关,且蛋白间相关性越强则边颜色越深,边的颜色深浅与粗细与Degree值亦呈正相关(见图3)。Degree值排名由高到低依次为血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、Src原癌基因(Src proto?oncogene,SRC)、白细胞介素2(interleukin?2,IL2)、过氧化物酶体增殖激活受体γ(peroxisome proliferator?activated receptor gamma,PPARG)、表皮生长因子受体
(epidermal growth factor receptor,EGFR)、热休克蛋白90 kDa α亚类1(heat shock protein 90 kDa alpha,class A member 1,HSP90AA1)、低氧诱导因子1α亚单位(hypoxia?inducible factor 1,alpha subunit,HIF1A)、前列腺素内过氧化物合酶2(prostaglandin?endoperoxide synthase 2,PTGS2)、Janus激酶2(janus kinase 2,JAK2)、细胞间黏附分子1(intercellular adhesion molecule 1,ICAM1)、Fas相关因子2(fas?associated factor 2,FOF2)、丝裂原活化蛋白激酶14(mitogen?activated protein kinase 14,MAPK14)、血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM1),见图4。VEGFA是一种血管内皮因子A,与血管的通透性、血管内皮细胞转移、增殖及血管形成相关[20]。
使用插件按照Degree、最大团中心性(MCC)、边缘渗透成分(EPC)、最大邻域分量(MNC)和最大邻域分量密度(DMNC)5种方法分别将排名前15位的基因进行筛选和重叠,认为重叠基因为枢纽基因。绘制Venn图可视化后得到核心靶点为5个方法重叠基因是VCAM1,Degree/MCC/MNC/EPC 4个方法的共同基因(次核心靶点)有VEGFA、SRC、PTGS2、PPARG、EGFR、HIF1A、HSP90AA1、IL2、ERBB2、NOS3、ICAM1、FGF2。见图5。
2.4.2 党参?有效成分?治疗靶点可视化分析
将药物潜在化合物及对应靶点基因导入Cytoscape 3.9.1 软件中,绘制药物?有效成分?治疗靶点网络图(见图6),颜色深浅、节点大小与Degree值呈正相关。通过“党参?有效成分?治疗靶点”的网络图发现1个化合物可能对应1个或多个靶点,核心靶点VCAM1对应的靶点为血管细胞黏附蛋白1(Vascular cell adhesion protein 1),对应的化合物为肉豆蔻酸(myristicacid)。次核心靶点(VEGFA、SRC、PTGS2、PPARG、EGFR、HIF1A、HSP90AA1、IL2、PERBB2、NOS3、ICAM1、FGF2)对应的化学成分是:VEGFA和FGF2对应化合物是乙基α?d果糖呋喃糖苷(ethyl?alpha?d?fructofuranoside),SRC 对应化合物是11?羟基兰金断肠草碱(11?Hydroxyrankinidine),PTGS2和PPARG对应的化合物是二十二烯酸甲酯 11,14 二烯酸酯(methyl icosa?11,14?dienoate),EGFR和IL2 对应的化合物是黄豆黄素(glycitein),PERBB2对应化合物是脲基甲酸丁酯(N?butyl allophanate),HSP90AA1对应的化合物是5?甲氧基甲基糠醛(5?methoxymethyl furfural),HIF1A 对应的化合物是DL?丁香树脂酚(dl?syringaresinol),NOS3对应的化合物是吡啶(pyridine),ICAM1对应的化合物是肉豆蔻酸。在查阅文献后在4个方法的重叠基因中选择5个关键靶点合并与5个方法的重叠基因(VCAM1)后,匹配相应的化合物,这些成分可能为党参治疗ITP网络中的重要成分。
2.5 GO富集分析结果
通过GO 富集分析结果初步检验筛选的党参靶点与ITP的相关性。GO富集分析主要包括生物过程(BP)、细胞组分(CC)及分子功能(MF)3个方面,图中的颜色越深代表着显著性越强。柱状图中依据显著性分别按照BP、CC及MF的顺序对富集结果进行排列,横坐标表示富集的基因数目,纵坐标为富集结果名称。BP富集结果可知,靶点主要生物过程包括对药物的反应(response to drug)、脂多糖的反应(response to lipopaolysaccharide)、炎症反应(inflammatory response)、ERK1和ERK2级联的正向调控(positive regulation of ERK1 and ERK2 cascade)、信号转导(signal transduction)、RNA聚合酶Ⅱ启动子对转录的正向调控(intracellular signal transductionpositive regulation of transcription from RNA polymerase Ⅱ promoter)、蛋白质磷酸化(protein phosphorylation)、基因表达的正向调控(positive regulation of gene expression)、细胞分化(cell differentiation)。CC富集结果可知,靶点组成成分包括等离子体膜(plasma membrane)、细胞质(cytoplasm)、质膜的组成部分(integral component of plasma membrane)、胞质(cytosol)、细胞膜(membrane)、细胞外的外来体(extracellular exosome)、细胞核(nucleus)、细胞外空间膜的组成部分(extracellular space integral component of membrane)、核浆(nucleoplasm)。MF富集结果可知,主要靶点功能包括蛋白酪氨酸激酶活性(protein tyrosinekinases activity)、蛋白磷酸酶结合(protein phosphatase binding)、酶结合(enzyme binding)、相同的蛋白质结合(identical protein binding)、蛋白激酶活性(protein kinases activity)、蛋白同二聚体活性(protein homodimerization activity)、ATP结合(ATP binding)、蛋白结合(protein binding)、锌离子结合(zincion binding)、金属离子结合(metal ion binding)。详见图7。
2.6 KEGG富集分析结果
KEGG主要对靶点相关通路进行分析。在DAVID数据库中,显示靶点参与135条KEGG通路,并将Count排名前20条做KEGG富集分析,靶点相关通路包括:EGFR酪氨酸激酶抑制剂耐药性(EGFR tyrosine kinase inhibitor resistance)、化学致癌?受体激活(chemical carcinogenesis?receptor activation)、癌症通路(pathways in cancer)、卡波西肉瘤相关疱疹病毒感染(Kaposi sarcoma?associated herpesvirus infection)、AGE?RAGE信号通路在糖尿病并发症中的作用(AGE?RAGE signaling pathway in diabetic complications)、脂質与动脉粥样硬化(lipid and atherosclerosis)、PD?L1在癌症中的表达及PD?1检查点通路(PD?L1 expression and PD?1 checkpoint pathway in cancer)、松弛蛋白信号通路(relaxin signaling pathway)、癌症中的蛋白聚糖(proteoglycans in cancer)、内分泌的阻力(endocrine resistance)、TRP通道的炎症介质调节(inflammatory mediator regulation of TRP channels)、PI3K/Akt 信号通路(PI3K/Akt signaling pathway)、流体剪切应力和动脉粥样硬化(fluid shear stress and atherosclerosis)、Th17细胞分化(Th17 cell differentiation)、人类巨细胞病毒感染(human cytomegalovirus infection)、钙信号通路(calcium signaling pathway)、黏着斑(focal adhesion)、Rap1信号通路(rap1 signaling pathway)、神经活性配体?受体相互作用(neuroactive ligand?receptor interaction)、代谢途径(metabolic pathways)。详见图8。
2.7 分子对接验证
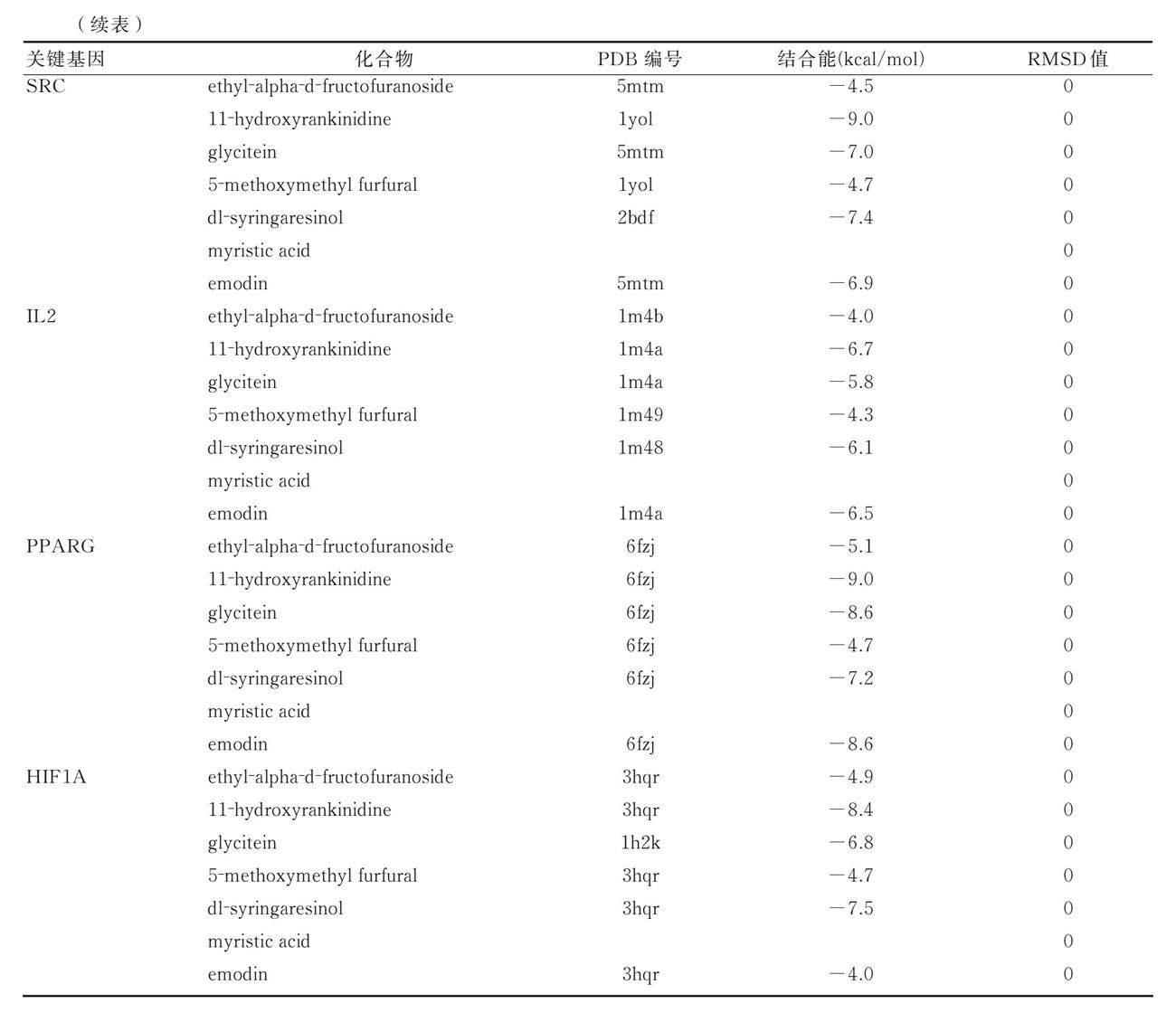
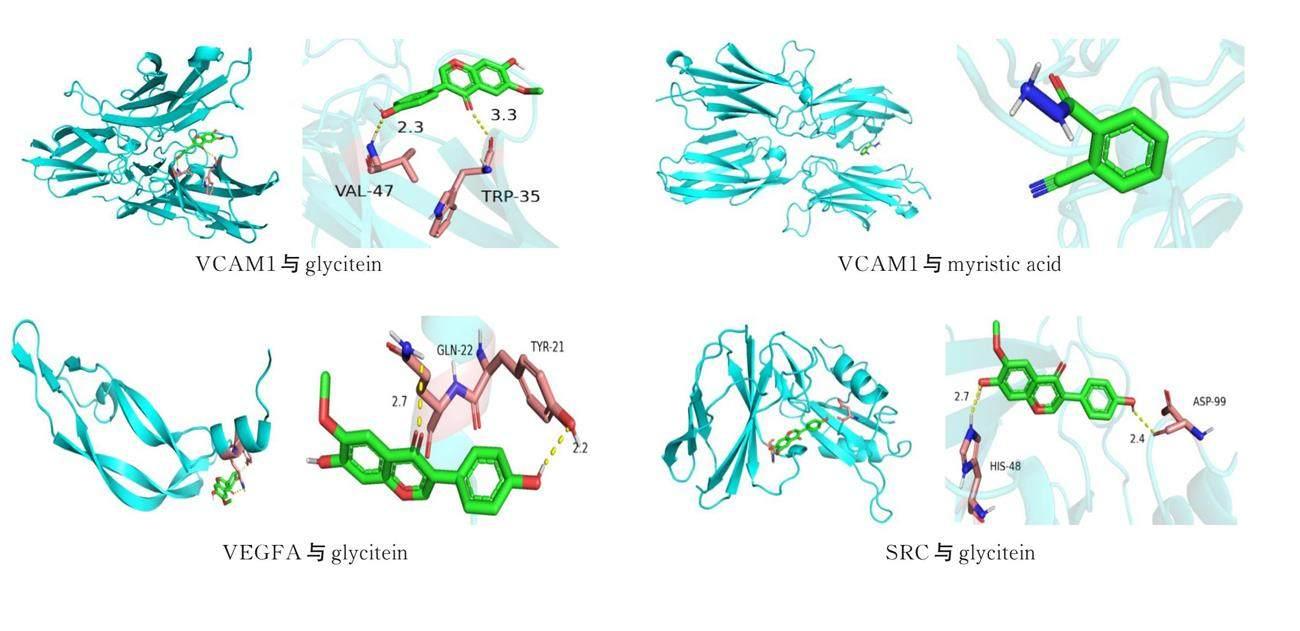
将关键靶点基因(VCAM1、VEGFA、SRC、IL2、PPARG、H1F1A)与对应排名前5位化合物(ethyl?alpha?d?fructofuranoside、11?hydroxyrankinidine、glycitein、methyl icosa?11,14?dienoate、5?methoxymethyl furfural、dl?syringaresinol、myristicacid、emodin)进行分子对接。自由结合能是判断药物分子与靶蛋白结合是否紧密的主要条件,氢键可以显示药物分子与靶蛋白哪些氨基酸残基之间存在相互作用。自由结合能绝对值越大则说明对接越紧密,效果越好。一般认为结合能≤-5.0 kcal/mol的药物分子与靶点具有较好的结合活性。RMSD值<2则说明分子对接结果比较可靠。图中蓝色为化合物,绿色为靶点基因,黄色为残基与靶点基因形成的氢键。其中,SRC、PPARG与11?hydroxyrankinidine具有较高的结合活性。详见表1及图9。
3 讨论
本研究的主要目的是探讨党参治疗免疫性血小板减少症的潜在机制。通过检索TCMSP、TCMID、ETCM数据库共收集到84种化学成分,其中主要化学成分包括肉豆蔻酸、黄豆黄素、乙基α?d果糖呋喃糖苷,这些主要化学成分可以与其他活性成分一起作用于网络中的多个靶标。在GeneCards、OMIM、DisGeNET数据库收集ITP的相关靶点。根据STRING构建的PPI互作图可视化分析后,得到关键靶点VCAM1、VEGFA、SRC、PPARG、HIF1A和IL2。
本研究生物分子功能表明,党参的关键活性成分治疗免疫性血小板疾病的靶点主要参与在对药物的反应、炎症反应、ERK1和ERK2级联的正向调控、信号转导(signal transduction)等,并在蛋白结合、等离子体膜、细胞质等部位中分布较多。BP富集分析可知,生物过程与细胞分化相关,酪氨酸残基上的蛋白质磷酸化(PTP)对正常细胞信号传导至关重要,由于药物刺激、脂多糖、验证而导致细胞或有机体状态或活动(运动、分泌、酶产生、基因表达等)改变,通过信号转导激活或增加由ERK1和ERK2级联介导的信号转导的频率、速率或程度。CC富集分析可知,靶点主要包含离子膜及细胞相关组成部分(细胞膜、细胞质、细胞核等)。MF富集分析可知,主要靶点功能与催化活性的酶结合以及与ITP、离子和蛋白结合有关。通过KEGG富集分析,对这 20 条通路中与ITP关系较为密切的通路,即磷脂酰肌醇3激酶/丝氨酸/苏氨酸激酶B(PI3K?Akt)信号通路和T细胞反应信号通路核因子?kappaB(NF?κB)信号通路进行分析。PI3K/Akt 信号通路是一个重要的细胞内信号通路,它可以参与细胞的生长、增殖、分化和迁移[21]。2023年,Ruan等[22]在ITP病人中发现了几个含有过量罕见破坏性突变的基因:含五聚体结构域蛋白3(PTEN)、胰岛素受体(INSR)和凝血因子C同源性(COCH)。有趣的是,这些基因共同参与了PI3K/Akt信号通路的信号转导,并在血小板活化中发挥了重要的免疫调节作用。
NF?κB异常激活与自身免疫疾病相关,持续性激活的NF?κB能增强血管内皮生长因子(VEGF)基因的转录[23]。T调节细胞(Tregs)有助于维持外周免疫耐受性,其缺陷被认为在各种自身免疫性疾病的发病机制中起作用。在成人和儿童ITP病人中进行的研究发现,Tregs在循环、骨髓和脾脏中的频率降低,Tregs功能受损[24]。通过地塞米松、利妥昔单抗或血小板生成素受体激动剂治疗,血小板计数恢复后,Tregs失调得到改善。此外,Tregs在防止抗血小板自身免疫反應中的关键作用已在缺乏功能性Tregs的小鼠中得到证实。在Tregs缺陷的小鼠中观察到的血小板减少是通过产生IgG抗血小板自身抗体介导的,这与人类ITP类似。进一步研究评估ITP病人Tregs失调的机制是必要的,以阐明ITP的发病机制和开发新的治疗策略,抑制抗血小板自身免疫反应[25]。
IL2是抗肿瘤效应的重要因子,由T细胞在抗原或有丝分裂刺激下产生,是T细胞增殖和调节免疫反应的其他重要活动所必需的,可激活多种效应细胞如细胞毒性T细胞、自然杀伤细胞和先天淋巴样细胞等[26]。研究已证实,IL?2具有维持Tregs细胞控制免疫反应,促进Foxp3+Tregs细胞的生成、存活和功能活性,刺激传统T细胞促进免疫反应的功能[27]。
VEGF家族由6种生长因子(VEGFA?F)组成,通过与其受体VEGFR1?3和神经菌素结合,在血管生成中起着最关键的作用[20]。VEGFA是引导血管生成的关键因子,血管生成过程中VEGFA的主要调节因子是缺氧诱导因子1。血管生成因子通过直接抑制抗原提呈细胞和免疫效应细胞或通过增强Tregs、髓系源性抑制细胞(MDSCs)和肿瘤相关巨噬细胞(TAMs)的作用来驱动免疫抑制[28]。PI3K是血管生成的重要调控因子,VEGFA通过多种途径激活PI3K,包括FAK、Shb、Gab1、IQGAP1和TSAd/Src/Axl,以及通过VEGFR2中PI3K的pY1175直接结合。PI3K/Akt信号通路通过调节下游信号分子的激活,在体内、外调节免疫应答和炎症因子的释放中起着关键作用[29]。
黄豆黄素(glycitein)是一种o ?甲基化异黄酮,占大豆食品中总异黄酮的5%~10%[30]。食用异黄酮可以激活丝裂原活化蛋白激酶(MAPK),抑制信号转导和转录激活因子3(STAT3)和NF?κB信号通路[31]。其诱导的ERK1/2激活部分依赖于与血管内皮生长因子受体(VEGFR)相关的酪氨酸激酶活性[32]。
肉豆蔻化是指将肉豆蔻酸附着在蛋白质的N端甘氨酸上,并对其细胞内的定位和功能产生重大影响,胸腺代表了一个具有突出的N?肉豆蔻化活动的器官[33]。小鼠实验证明N?肉豆蔻化对于早期和远端TCR信号事件如CD3ζ、Zap70和Erk的激活以及细胞因子如干扰素?γ(IFN?γ)和IL?2的释放也是不可缺少的。N?肉豆蔻转移酶(Nmt)耗尽会影响T细胞受体(TCR)信号级联的启动和传播。蛋白质的肉豆蔻化在T细胞的发育和激活中是不可缺少的,对它的抑制可能提供一种新的策略来实现免疫抑制[34]。HIV?1 Nef(Nef)是一种肉豆蔻化的蛋白质对TCR的信号传导有调节作用,导致受刺激的T细胞中IL?2的产生上调作用。肉豆蔻化的、筏定位的Nef通过增加筏内信号分子的水平为静止的T细胞提供激活的动力,并且TCR的激活通过Nef促进筏融合的能力得到加强[35]。
据推测,党参对ITP的治疗作用可能是通过党参中有效成分黄豆黄素、乙基α?d果糖呋喃糖苷通过PI3K/Akt通路IL2靶点对Tregs起到调节作用,并对NF?κB通路的抑制作用,最终对ITP起到缓解作用。
4 小结
党参对ITP作用机制复杂、作用成分多,通过网络药理学分析,其作用机制可能为黄豆黄素、乙基α?d果糖呋喃糖苷、肉豆蔻酸等主要成分通过作用于IL2、VEGFA等核心靶点影响PI3K/Akt、NF?κB等相关通路,进而调控细胞分化、酪氨酸残基上的蛋白质磷酸化(PTP)对正常细胞信号传导等生物过程,参与炎症反应、免疫反应、催化活性的酶结合、ITP/离子和蛋白结合及血管的生成与重塑等,从而实现对ITP的干预。本研究基于差异基因分析、网络药理学及分子对接并查阅文献后进一步提出推测:党参有效成分黄豆黄素、乙基α?d果糖呋喃糖苷通过PI3K/Akt通路IL2靶点对Treg/Th17平衡模式起到调节作用,并对NF?κB通路的抑制作用,最终对ITP起到缓解作用。课题组将会以此为基础进行下一步体内外实验验证。此外,本研究存在以下局限性。首先,党参对抗ITP的潜在机制涉及多种药理作用,需要更多的研究来结合转录组、蛋白质组和代谢组等高通量检测技术来揭示复杂的协同机制。其次,本研究中没有解释活性成分对功效的贡献以及活性成分之间的协同作用,将在这方面进行进一步探索。
参考文献:
[1] AUDIA S,MAH?VAS M,SAMSON M,et al.Pathogenesis of immune thrombocytopenia[J].Autoimmunity Reviews,2017,16(6):620-632.
[2] 李晓靖,鲍计章,朱文伟,等.中医药治疗原发免疫性血小板减少症免疫细胞调节作用的研究进展[J].医学研究杂志,2021,50(12):25-28;59.
LI X J,BAO J Z,ZHU W W,et al.Research progress on the regulation of immune cells in the treatment of primary immune thrombocytopenia with traditional Chinese medicine[J].Journal of Medical Research,2021,50(12):25-28;59.
[3] CUKER A,CINES D B,NEUNERT C E.Controversies in the treatment of immune thrombocytopenia[J].Current Opinion in Hematology,2016,23(5):479-485.
[4] 王兆鉞.免疫性血小板减少性紫癜的发病机制与临床研究进展[J].中国免疫学杂志,2009,25(12):1141-1144.
WANG Z Y.Advances in pathogenetic and clinical research of immune thrombocytopenic purpura[J].Chinese Journal of Immunology,2009,25(12):1141-1144.
[5] 吉姣姣,戴俊利,李建宽,等.党参不同组织化学成分分布及转录组学分析[J].中国实验方剂学杂志,2023,29(18):117-125.
JI J J,DAI J L,LI J K,et al.Chemical components distribution and transcriptome analysis of different tissues from Codonopsis pilosula[J].Chinese Journal of Experimental Traditional Medical Formulae,2023,29(18):117-125.
[6] LUAN F,JI Y F,PENG L X,et al.Extraction,purification,structural characteristics and biological properties of the polysaccharides from Codonopsis pilosula:a review[J].Carbohydrate Polymers,2021,261:117863.
[7] 涂春蕾,廖樹伟.土党参的化学成分及药理作用研究进展[J].药品评价,2022,19(16):1022-1024.
TU C L,LIAO S W.Advances in chemical constituents and pharmacological action from roots of Campanumoea javanica[J].Drug Evaluation,2022,19(16):1022-1024.
[8] JIASHUO W U,ZHANG F Q,ZHUANGZHUANG L I,et al.Integration strategy of network pharmacology in traditional Chinese medicine:a narrative review[J].Journal of Traditional Chinese Medicine,2022,42(3):479-486.
[9] ZHANG B H,LI H,YU K Q,et al.Molecular docking-based computational platform for high-throughput virtual screening[J].CCF Transactions on High Performance Computing,2022,4(1):63-74.
[10] RU J L,LI P,WANG J N,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].Journal of Cheminformatics,2014,6(1):13.
[11] HUANG L,XIE D L,YU Y R,et al.TCMID 2.0:a comprehensive resource for TCM[J].Nucleic Acids Research,2018,46(D1):D1117-D1120.
[12] XU H Y,ZHANG Y Q,LIU Z M,et al.ETCM:an encyclopaedia of traditional Chinese medicine[J].Nucleic Acids Research,2019,47(D1):D976-D982.
[13] KIM S.Getting the most out of PubChem for virtual screening[J].Expert Opinion on Drug Discovery,2016,11(9):843-855.
[14] CONSORTIUM U.UniProt:the universal protein knowledgebase in 2021[J].Nucleic Acids Research,2021,49(D1):D480-D489.
[15] WANG Y,ZHANG Y W,WANG Y J,et al.Using network pharmacology and molecular docking to explore the mechanism of Shan Ci Gu (Cremastra Appendiculata) against non-small cell lung cancer[J].Frontiers in Chemistry,2021,9:682862.
[16] STELZER G,ROSEN N,PLASCHKES I,et al.The GeneCards suite:from gene data mining to disease genome sequence analyses[J].Current Protocols in Bioinformatics,2016,54(1):123.
[17] AMBERGER J S,HAMOSH A.Searching Online Mendelian Inheritance in Man (OMIM):a knowledge base of human genes and genetic phenotypes[J].Current Protocols in Bioinformatics,2017,58(1):D514-D517.
[18] PI?ERO J,BRAVO ?,QUERALT-ROSINACH N,et al.DisGeNET:a comprehensive platform integrating information on human disease-associated genes and variants[J].Nucleic Acids Research,2017,45(D1):D833-D839.
[19] BISHT A,TEWARI D,KUMAR S,et al.Network pharmacology,molecular docking,and molecular dynamics simulation to elucidate the mechanism of anti-aging action of Tinospora cordifolia[J].Molecular Diversity,2023.doi: 10.1007/s11030-023-10684-w.
[20] CLAESSON-WELSH L,WELSH M.VEGFA and tumour angiogenesis[J].Journal of Internal Medicine,2013,273(2):114-127.
[21] ERSAHIN T,TUNCBAG N,CETIN-ATALAY R.The PI3K/AKT/mTOR interactive pathway[J].Molecular BioSystems,2015,11(7):1946-1954.
[22] RUAN J S,SUN R J,WANG J P,et al.Gene mutations in the PI3K/Akt signaling pathway were related to immune thrombocytopenia pathogenesis[J].Medicine,2023,102(7):e32947.
[23] QUE W C,WU Z Y,CHEN M H,et al.Molecular mechanism of Gelsemium elegans (gardner and champ) Benth against neuropathic pain based on network pharmacology and experimental evidence[J].Frontiers in Pharmacology,2022,12:792932.
[24] SEMPLE J W,REBETZ J,MAOUIA A,et al.An update on the pathophysiology of immune thrombocytopenia[J].Current Opinion in Hematology,2020,27(6):423-429.
[25] NISHIMOTO T,KUWANA M.CD4+CD25+Foxp3+ regulatory T cells in the pathophysiology of immune thrombocytopenia[J].Seminars in Hematology,2013,50(Suppl 1):S43-S49.
[26] SPOLSKI R,LI P,LEONARD W J.Biology and regulation of IL-2:from molecular mechanisms to human therapy[J].Nature Reviews Immunology,2018,18:648-659.
[27] NIE J,LI Y Y,ZHENG S G,et al.FOXP3+Treg cells and gender bias in autoimmune diseases[J].Frontiers in Immunology,2015,6:493.
[28] RAHMA O E,HODI F S.The Intersection between tumor angiogenesis and immune suppression [J].Clin Cancer Res,2019,25(18):5449-5457.
[29] XU P,WANG J,YANG Z W,et al.Regulatory roles of the PI3K/Akt signaling pathway in rats with severe acute pancreatitis[J].PLoS One,2013,8(11):e81767.
[30] ZHANG B,SU J P,BAI Y,et al.Inhibitory effects of O-methylated isoflavone glycitein on human breast cancer SKBR-3 cells[J].Int J Clin Exp Pathol,2015,8(7):7809-7817.
[31] ZANG Y Q,FENG Y Y,LUO Y H,et al.Glycitein induces reactive oxygen species-dependent apoptosis and G0/G1 cell cycle arrest through the MAPK/STAT3/NF-κB pathway in human gastric cancer cells[J].Drug Dev Res,2019,80(5):573-584.
[32] CLUBBS E A,BOMSER J A.Glycitein activates extracellular signal-regulated kinase via vascular endothelial growth factor receptor signaling in nontumorigenic (RWPE-1) prostate epithelial cells [J].J Nutr Biochem,2007,18(8):525-532.
[33] RIOUX V,P?DRONO F,LEGRAND P.Regulation of mammalian desaturases by myristic acid:N-terminal myristoylation and other modulations[J].Biochim Biophys Acta,2011,1811(1):1-8.
[34] RAMPOLDI F,BONROUHI M,BOEHM M E,et al.Immunosuppression and aberrant T cell development in the absence of N-myristoylation[J].J Immunol,2015,195(9):4228-4243.
[35] DJORDJEVIC J T,SCHIBECI S D,STEWART G J,et al.HIV type 1 Nef increases the association of T cell receptor(TCR)-signaling molecules with T cell rafts and promotes activation-induced raft fusion[J].AIDS Res Hum Retroviruses,2004,20(5):547-555.
(收稿日期:2024-03-29;修回日期:2024-04-20)
(本文編辑 崔晓芳)
