高中化学工艺流程题的解题策略
2024-05-29王丹丹
王丹丹


摘要:新高考背景下,非常注重对学生的独立思考和发散思维能力的培养.化学工艺流程题在高考中灵活度高,分值大,对学生分析问题、整合信息的能力有很高要求.本文对高中化学工艺流程题的解题策略进行分析研究,并列举两道例题作为讲解引导,以期望培养学生的逻辑思维能力和发散性思维能力,帮助学生在解答这一类问题时可以由此及彼,舉一反三,由会解一道题到会解一类题.
关键词:高中化学;工艺流程;解题策略
中图分类号:G632文献标识码:A文章编号:1008-0333(2024)11-0140-03
新课改后,高考化学的命题特点发生了显著变化,题目更注重将基础知识与工农业生产实际情境相结合.化学工艺流程题与生产生活联系紧密,工艺情境真实,成为近几年高考主流题型之一[1].考查内容包括元素化合物的性质及转化、化学反应原理、物质的分离与提纯等,分值高难度大,要求学生熟练掌握这类题型的解题方法[2].1 高考解题思维
1.1 常用的分析方法
(1)首尾分析法.对一些从原料到产品为一条龙生产工序的线型流程工艺试题,先对比分析流程图中的原料(即第一种物质)与产品(即最后一种物质),从对比分析中找出原料与产品之间的关系,弄清生产过程中原料转化为产品的基本原理,以及包括除杂、分离和提纯产品的化工工艺,然后再结合题设的问题,逐一推敲解答[3].
(2)分段分析法.对于用同样的原料生产多种(2种或2种以上)产品(包括副产品)的工艺流程题,用分段分析法更容易找到解题的切入点.
1.2 常考的制备措施
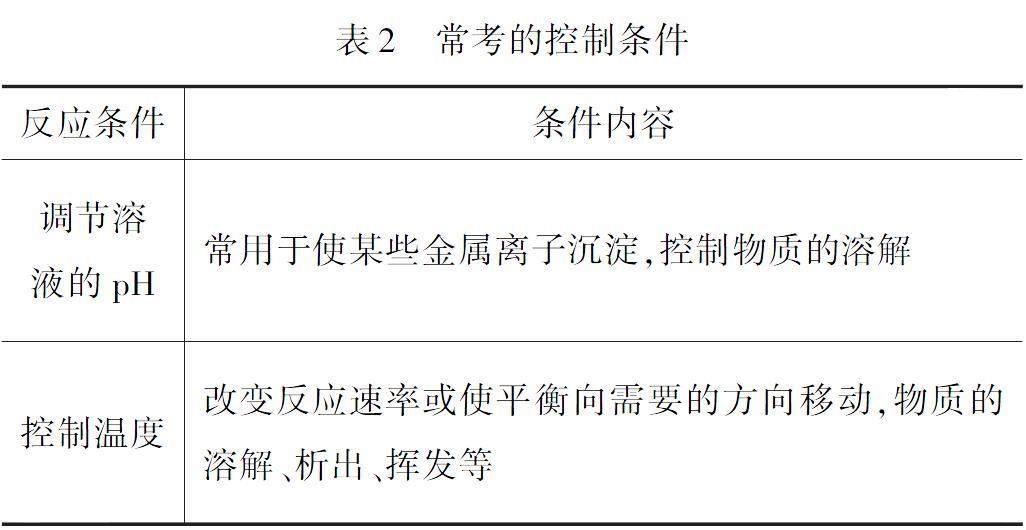
1.3 常考的控制条件
1.4 常用的除杂方法
2 例题剖析
例1如图1所示的工艺流程为某矿物工厂采用软锰矿和辉铋矿提炼ΜnSΟ4和BiOCl的过程.已知:辉铋矿的主要成分为Bi2S3、FeS2、SiO2,软锰矿的主要成分为MnO2,焙烧时MnO2转变为Mn2O3,回答下列问题.(金属活动性:Fe>(H)>Bi>Cu,该工艺条件下溶液中相关金属离子开始/完全沉淀的pH范围如表5)
(1)可以采取以下哪些措施来提高焙烧过程的效率:
A.适当提高通入空气的量
B.将矿石粉碎得更细小
C.降低焙烧温度
(2)在空气中对Bi2S3进行单独焙烧时会生成Bi2O3,写出其反应的化学方程式;
(3)在“酸浸”过程中,加入过量浓盐酸的作用是什么?
(4)“酸浸”完成后会进行过滤,滤渣的主要成分有哪些?
(5)“酸浸”过程中产生气体A是什么,写出其离子方程式;
(6)“转化”步骤中,金属Bi的作用是什么?
解本题考查联合焙烧法制备BiOCl和ΜnSΟ4的工艺流程分析.
(1)联合焙烧时,适当提高通入空气的量有利于矿石充分反应,可以提高焙烧过程的效率,A符合题意;将矿石粉碎得更细小,可以增大矿石与空气的接触面积,能够提高焙烧效率,B符合题意;降低焙烧温度,反应速率减慢,不利于提高焙烧效率,C不符合题意.
(2)在空气中对Bi2S3进行单独焙烧时会生成Bi2O3,根据原子守恒可知还应生成SO2,结合得失电子守恒,反应的化学方程式为:
2Bi2S3+9O22Bi2O3+6SO2
(3)加入浓盐酸后,溶液中含有的离子主要为Bi3+、Fe3+、Mn2+、H+、Cl-,酸浸后取滤液进行转化,因此要加入过量浓盐酸防止金属离子水解生成沉淀,进入滤渣,造成制得的BiOCl产率偏低.
(4)根据(3)并结合辉铋矿和软锰矿的主要成分为Bi2S3、FeS2、SiO2、MnO2,可知滤渣的主要成分为SiO2;
(5)焙烧时MnO2转变为Mn2O3,FeS2转变为Fe2O3,Bi2S3转变为Bi2O3,Mn2O3与盐酸会发生氧化还原反应会生成Mn2+与Cl2,所以气体为Cl2,离子方程式为:
Mn2O3+6H++2Cl-2Mn2++Cl2↑+3H2O
(6)由表1知,将pH调到2.6时,Fe3+会水解生成Fe(OH)3沉淀,但Fe2+还没开始沉淀,故要将Fe3+转化为Fe2+,再调pH后获得含FeCl2的滤液,为了不引入新的杂质,加入Bi作为还原剂.
例2如图2所示的工艺流程为某矿物工厂从铝土矿废料赤泥中提取Sc与TiO2的过程.已知:赤泥的主要成分为Fe2O3、Al2O3、TiO2、Sc2O3,回答下列问题.
(1)写出基态Sc原子的价电子排布式;
(2)在“沉淀转化”过程中,加入过量草酸的作用是什么?
(3)写出“焙烧”过程中生成Sc2O3化学方程式;
(4)常温下+3价Sc的几种存在形式与氟离子浓度的对数[lgc(F-)]~pH的关系如图3所示.已知c(F-)=5×10-4mol/L,“调pH”过程中将pH调至4.0,写出调节pH后+3价Sc的存在形式;
(5)在“脱水除铵”的过程中,复盐3NH4Cl·ScF4·aH2O分解得到ScF3,某固体样品质量与温度的关系如图4所示.加热至380~400 ℃产生白烟,400 ℃以上质量不再改变,求a;
(6)“水解”过程中,加水稀释后,TiOSO4水解为TiO2·xH2O,写出TiOSO4水解的离子方程式.
解(1)Sc为21号元素,因此基态Sc原子的价电子排布式为3d14s2;
(2)“沉淀转化”过程中存在以下平衡:
2Sc(OH)3+3H2C2O4Sc2(C2O4)3+6H2O
该过程中需加入过量的草酸,其原因是草酸与OH-反应,OH-浓度减小,使氢氧化钪转化为草酸钪的平衡正向移动,提高沉淀转化率;
(3)由题给流程图可知,“沉淀转化”过程中Sc2(OH)3转化为Sc2(C2O4)3,“焙烧”过程中Sc2(C2O4)3转化成Sc2O3和CO2,反应中碳元素化合价升高,则空气中氧气参与反应,氧元素化合价降低,化学方程式为:
2Sc2(C2O4)3+3O22Sc2O3+12CO2
(4)已知c(F-)=5×10-4mol/L,则lgc(F-)≈-3.3;“调pH”过程中控制pH为4.0,由题图3可知此时+3价Sc的存在形式为ScF3
(5)由题意可知,加热至380~400 ℃产生白煙,400 ℃以上质量不再改变.复盐3NH4Cl·ScF4·aH2O加热首先失去结晶水,200~300 ℃时减少的质量为结晶水的质量,为7.41 g-5.25 g=2.16 g
则7.41 g262.5+18a=2.16 g18 a
解得a=6
(6)“水解”过程中,TiOSO4水解为TiO2·xH2O同时生成氢离子,离子方程式为:
TiO2++(x+1)H2OTiO2·xH2O↓+2H+
3 结束语
工艺流程题将化学工艺流程进行简化,并与高中化学的理论知识融合,用框图形式将化工生产中的生产流程表示出来,再根据生产流程中有关的化学知识步步设问.要求学生对常用的制备措施、控制条件和除杂方法全面掌握并熟练运用,在分析问题时要沉着冷静,找准工艺设计的目的,明确整个流程的意义,然后结合所学理论知识,细致作答.
参考文献:
[1]王诗涵.基于核心素养的高考化学工艺流程试题分析及教学策略[D].重庆:西南大学,2023.
[2] 董玲,蒋立德.高中化学工艺流程题的解题技巧[J].高中数理化,2023(04):75-76.
[3] 郝凯妮.基于情境教学下的化工流程题教学策略及实践研究[D].呼和浩特:内蒙古师范大学,2021.
[责任编辑:季春阳]
