聚焦盐类水解 破解十大应用
2024-05-26王繁黄玉梅
王繁 黄玉梅

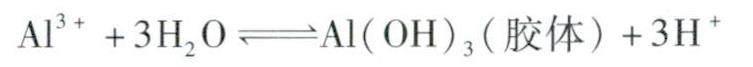

盐类水解广泛应用于生产、生活,总结如下。
一、热的纯碱溶液可去油污
油污属于酯类,难溶于水,纯碱在加热条件下水解:
加热促进CO32-的水解,溶液碱性越强,去污能力增强。因此,产生的OH -促进酯的水解,生成可溶于水的高级脂肪酸钠和甘油。
二、盐溶液的配制和保存
配制FeCl3溶液时,通常将FeCl3晶体溶于较浓的盐酸中,然后再加水稀释至所需的浓度,溶于盐酸的日的是防止F3+发生水解反应;而配制FeSO4溶液时,将固体FeSO4溶于少量稀硫酸,目的也是增大H+浓度,从而抑制Fe2+的水解,再加入少量的铁屑,防止Fe2+被氧化。
三、部分盐可作净水剂
铝盐、铁盐等部分盐一定条件下水解生成胶体,因有较强的吸附性,可吸附水中的悬浮物而达到净水效果。例如,明矾可作净水剂,是因为明矾溶于水后电离产生的铝离子水解:
牛成的Al(OH)3胶体粒子因带正电,可吸附悬浮于水中的泥沙、固体颗粒物等,而从达到净水的效果。
四、泡沫灭火器原理
泡沫灭火器内部有钢瓶和塑料桶2部分构成,分别向钢瓶和塑料桶中加入NaHCO3和Al2(SO4)3溶液,当遇到紧急情况,拔保险并倒立,Al2(SO4)3与NaHCO3溶液因接触而充分反应,喷射出含有Al(OH)3的高压CO2,实现将可燃物表面进行固体覆盖和隔绝空气的目的,从而达到灭火的效果。
五、部分盐为温和的酸碱
通常选用NH4Cl溶液除去钢材表面的铁锈,因NH4+在水溶液中发生水解:
产生的极少量H+和铁锈反应,因酸性较弱不会腐蚀金属材料本身,起到恰到好处的作用。
六、制备胶体
向沸水中滴加FeCl3饱和溶液,并继续煮沸至溶液呈红褐色,加热的目的是为了增大Fe3+的水解程度,从而制备Fe(OH)3胶体。而不能選用Fe2(SO4)3溶液制备Fe(OH)3胶体,是因为水解产生的H2SO4是难挥发性的酸,无法和产生的Fe(OH)3胶体分离,制备不了Fe(OH)3胶体。
七、盐溶液酸碱性的判断
有弱才水解,无弱不水解,描述的是盐类水解的条件,并不是所有的盐溶于水都能发生水解反应,当含有弱离子的盐溶于水时才能够水解。NaCl溶液不能水解,NH4Cl溶液中NH4+是弱离子,故能发生水解。谁强显谁性,指盐类水解的结果,从反应的角度看,形成该盐的酸和碱谁更强显谁性。FeCl3溶液可看作Fe(OH)3与HCl反应制得,Fe3+对应的碱Fe(OH)3是弱碱,HCl是强酸,所以呈酸性。同理,CH3COONa溶液呈碱性。从盐的形成方式可判断能水解盐的酸碱性,即强酸弱碱盐呈酸性;强碱弱酸盐呈碱性。
八、化肥的施用
例如,草木灰与铵态氮肥不能混合施用,否则导致肥效损耗。草木灰的主要成分为K2CO3,和铵态的氮肥混合后,这两种盐发生可逆的互促水解,虽程度不是很大,但是仍然有氨逸出从而导致肥效降低。同时,土壤的酸碱性直接影响农作物的生长,盐碱地通常加石膏,酸性土壤加生石灰来调节,达到增产增收的效果。
九、盐溶液加热蒸干问题
1.氧化物型
对盐溶液加热、蒸干、灼烧后得到对应的氧化物。例如AlCl3溶液蒸干得Al(OH)3固体,灼烧最终得固体Al2O3。这是因为AlCl3溶液在加热时促进Al3+水解得到Al(OH)3和HCl,HCl是易挥发性酸与Al(OH)3悬浊液分离,Al(OH)3固体沉降后受热分解得到氧化铝固体。Fe(NO3)3溶液、MgCl2溶液等易挥发性的强酸弱碱性,加热、蒸干、灼烧都得到对应的氧化物。
2.自身型
对盐溶液加热、蒸干、灼烧后得到原物质。例如,将Na2CO3溶液蒸干得Na2CO3本身,在加热Na2CO3溶液时,虽促进Na2CO3水解得到NaHCO3和NaOH,所得的NaOH溶液在溶液中难挥发,同时抑制HCO3-水解,蒸发到一定程度发生反应:
HCO3-+OH-=CO32-+H2O
所以蒸干后得到原物质Na2CO3。
再如,将CuSO4溶液加热、蒸干、灼烧得到CuSO4本身。在加热CuSO4溶液时,水解得到的H2SO4是难挥发性酸,不会产生和Cu(OH)2分离的情况。即便水解,产生的H2SO2与Cu(OH),反应,重新得到CuSO4固体本身。
所以难挥发性的强酸弱碱盐或强碱弱酸盐加热,蒸干、灼烧后得到盐溶质本身。
3.还原型
部分盐溶液加热蒸干时,溶质会被O2氧化,得不到原溶质。例如,Na2SO3溶液在加热、蒸干后得到其氧化产物Na2SO4。将FeCl2溶液加热、蒸干、灼烧的过程中,首先是溶质被氧化,然后水解产生的弱碱Fe(OH)3分解得到Fe2O3。所有具有易还原性的盐溶质在加热蒸干过程中,首先要考虑盐溶质被氧化,然后再考虑其它的变化。
4.分解型
盐溶液在加热、蒸干、灼烧的过程中还要考虑盐受热时是否易分解,也就是考虑盐溶质的热稳定性。例如,Ca( HCO3)2溶液在加热蒸干的过程中,溶质受热分解得到CaCO3固体,灼烧后得到固体CaO。在加热NaHCO3溶液、KMnO4溶液、NH4Cl溶液时,溶质受热易分解,因此蒸干、灼烧时溶质都会发生热分解。
十、物质的提纯
怎样除去Cu2+溶液中混有的少量Fe3+,因Cu(OH)2、Fe(OH)32种难溶物的溶解度不同,利用盐类水解原理,可以向溶液中加入CuO或Cu(OH)2或CuCO2或Cu2(OH)2C01等固体,因消耗水解平衡体系的H+,溶液pH增大,使Fe3+转化为Fe(OH)3沉淀而除去。除杂试剂本身是难溶物,即便过量也不会影响提纯试剂的纯度,从而达到除杂的日的。
综上所述,分类厘清盐类水解的应用,更有利于学生掌握和灵活运用,提高化学学科素养和分析问题、解决问题的能力。
(收稿日期:2023-12-09)
