IL-22在消化系统疾病中的研究进展
2024-05-23张梦婕隋华朱婧汤庆丰
张梦婕 隋华 朱婧 汤庆丰
白介素22(IL-22)作为炎性过程中的关键细胞因子,自2000年被发现以来,被证实在多种消化道疾病患者中高度上调,并成为热门研究靶点。IL-22具有抗感染,促进组织细胞修复的作用,但是IL-22长期过度表达也可以诱导炎性反应。IL-22在消化系统中的多个脏器和环节中表达,并在不同疾病中通过不同环节产生效应作用。因此,探究IL-22在哪些消化道疾病中产生影响,如何对相应组织和疾病产生作用,显得格外重要。本文通过IL-22的概述、效应作用,其与炎症介导、代谢紊乱、微生物介导的消化系统疾病和消化系统肿瘤的关系,在消化道黏膜修复过程中的作用,与肠道微生物的关系,较全面地阐述IL-22在消化道疾病中的研究进展。
1 IL-22概述
IL-22是一种α-螺旋细胞因子,由6个α-螺旋和连接环组成[1]。IL-22于2000年首次在IL-9刺激的胸腺淋巴瘤中被鉴定出来,因结构与人IL-10有25%的同源性,并且其活性由IL-10Rβ介导,故被命名为“IL-10相关T细胞衍生的诱导因子”[2-3]。除IL-22,IL-19、IL-20、IL-24和IL-26也有与IL-10结构和受体同源性,也是IL-10家族成员[4]。消化系统中,IL-22在肠道、肝脏、胰腺、脾脏中显著表达[5-6],并在溃疡性结肠炎、肝脏和胰腺损伤、某些感染和肿瘤等疾病中产生重要影响[6]。近年来,随着对其研究的不断深入,IL-22已被证实在消化系统疾病的各个环节中发挥重要作用。
IL-22是IL-10细胞因子家族的重要成员之一,其主要来源为T辅助17(Th17)细胞Th22细胞和3型固有淋巴样细胞ILC3[7-9]。IL-22的其他细胞来源主要包括γδT 细胞、CD4+T细胞、中性粒细胞和NKT细胞(CD1d限制性T细胞)[1],以及外周血Th1细胞[10]、CD8+T细胞[11]、女性生殖道黏膜相关不变T细胞(MAIT细胞)[12]、巨噬细胞[13]、树突状细胞[14]、肥大细胞[15]和淋巴组织诱导细胞(LTi细胞)[16]。肠道黏膜稳态期间,IL-22主要由3型固有淋巴样细胞产生[17];感染期间,IL-22可由Th17/Th22细胞扩增而大量产生[18]。此外,有研究表明,在葡聚糖硫酸钠诱导的小鼠急性结肠炎期间,IL-22由结肠CD11c(+)细胞响应Toll样受体刺激而分泌[19]。
2 IL-22的效应作用
2.1 IL-22的作用机制 研究显示,IL-22能够和上皮细胞及基质细胞上的IL-10R2链与IL-22R1链组成的受体复合物相结合[1],进一步激活Janus激酶1和非受体蛋白酪氨酸激酶2,从而使信号转导与转录激活因子3(STAT3)酪氨酸残基磷酸化,诱导细胞核中抗菌肽、黏蛋白和细胞增殖基因的表达[9,18,20]。另有研究显示,IL-22还可以通过诱导STAT3 Ser727磷酸化来激活细胞应激反应、细胞凋亡以及与肠上皮细胞(IEC)中伤口愈合等相关通路[19]。IL-22诱导的其他信号传导通路还包括丝裂原激活蛋白激酶、ERK、MEK、JNK和p38通路[20-21]。当肠类器官(来源于表达Lgr5标志物的肠干细胞离体培养,能够密切复制功能性天然肠上皮的结构和细胞组成的细胞3D簇[22])受到生理刺激后,IL-22能够导致短暂的内质网应激并进一步导致STING依赖性Ⅰ型干扰素信号的激活,放大IL-22下游的上皮TNF生成,促进程序性细胞坏死[23]。见图1。
2.2 与IL-22结合蛋白(IL-22BP,也称IL22RA2)的相互作用 IL-22BP是IL-22的可溶性受体,其在膜表面可与IL-22特异性结合,并通过阻止IL-22与IL-22R1的结合来抑制IL-22信号传导[24-25]。IL-22-IL-22BP轴在调节肠道组织的修复和结肠肿瘤的发生过程中发挥关键作用。研究表明,在稳定状态下,IL-22BP在肠道中高度表达[24];当肠道上皮组织损伤时,IL-22BP表达下降[26]。Huber等[24]在结肠炎相关的结肠癌模型中发现,IL-22BP缺陷的小鼠肿瘤发生速度更快、数量更多、体积更大。Pelczar等[27]研究表明,从炎症性肠病(IBD)患者肠道中分离的CD4+T细胞产生高水平IL-22BP,接受抗肿瘤坏死因子α治疗(已知最有效的治疗IBD方法之一)后, IL-22BP水平下降,使IL-22BP成为IBD的潜在治疗位点。
3 IL-22与炎症介导的消化系统疾病的关系
3.1 IL-22与IBD IBD是一种病因不明的肠道炎症性疾病,主要分为克罗恩病(CD)和溃疡性结肠炎。研究显示,近20%的IBD患者会发展为结肠炎相关癌症,其中约有50%的患者最终死于结肠癌及其并发症[28]。一项20例的临床研究表明,IBD患者内镜下结肠炎症部位黏膜IEC中IL-22的表达比非炎症部位增加1.4~13.6倍(P<0.05)[29];另有一项60例的临床研究表明,对照组比较,溃疡性结肠炎患者结肠活检组织中IL-22和IL-22R1水平明显高于正常结肠组织[30]。内质网应激反应是IBD发病的主要机制之一[31]。IL-22在结肠上皮细胞中协调内质网应激反应转录程序,从而减轻结肠炎的程度[32]。此外,IL-22可诱导STAT3介导的黏液相关蛋白表达和杯状细胞的修复以增强肠道黏液产生,阻止细菌向结肠上皮细胞渗透,进而改善肠道炎症[33]。IL-22还可通过诱导H19在肠上皮细胞中的表达,促进肠上皮增殖和黏膜愈合来改善炎症性肠病[34]。另一方面,过量产生的IL-22可通过诱导上皮细胞产生中性粒细胞化学引诱物,导致中性粒细胞积聚和组织破坏而引起肠损伤,进而加重IBD[35]。
3.2 IL-22与胰腺炎 急性胰腺炎(AP)是胰腺对自身消化的一种急性炎性反应,可引起器官衰竭及继发感染,并具有潜在的致死性[36]。研究表明,AP期间胰腺IL-22表达水平下降,而胰腺上皮细胞中的芳香烃受体的激活可上调IL-22表达,进而诱导胰腺中STAT3基因磷酸化,减少小鼠AP严重程度和相关器官损伤,用低剂量重组鼠 给药可有效治疗AP[37]。Perusina等[38]LANFRANCA研究表明,用重组鼠IL-22治疗重症AP可使受损的胰腺细胞在组织病理学上获得改善,并降低肠黏膜损伤程度[39]。
4 IL-22与代谢紊乱相关的消化系统疾病的关系
非酒精性脂肪性肝炎(NASH)是一种非酒精原因引起的慢性肝脏进行性疾病,其特征是脂肪肝和肝细胞损伤,是临床最为普遍的肝脏疾病之一[40]。Oh等[41]研究表明,IL-22可显著降低NASH小鼠的肝脏重量和三酰甘油水平。IL-22还可抑制肝细胞外囊泡的促炎功能,从而减轻NASH中的肝脏炎症[42]。进一步研究表明,其作用机制可能是通过磷酸肌醇3-激酶介导的JNK信号通路的抑制作用来防止NASH小鼠的肝细胞脂毒性[43]。
5 IL-22与微生物介导的消化系统疾病的关系
IL-22与幽门螺杆菌(H. pylori)引起的胃炎有一定关系。H. pylori是一种螺旋形的、可在胃黏膜中定植的细菌,是诱发胃炎的主要原因之一[44]。一项150例的临床研究表明,感染H. pylori受试者胃窦组织中IL-22表达水平显著高于未受感染的对照组[45]。IL-22可在胃上皮细胞和类胃腺中诱导抗微生物和趋化因子如IL-8、钙卫蛋白、脂质沉积蛋白、β-防御素来抑制H.pylori的生长[46]。IL-22还可通过促进抗微生物肽如再生胰岛衍生蛋白Ⅲβ的表达来杀灭H. pylori,对慢性H. pylori菌感染的小鼠注射IL-22Fc融合蛋白后,其感染程度降低[47]。由此推测IL-22通过抑制胃内H.pylori来改善H.pylori引起的胃炎。
6 IL-22与消化系统肿瘤的关系
IL-22在消化系统肿瘤发生过程中具有双向调节作用,Perez等[48]证实,短期产生的IL-22可在细胞遗传毒性应激中发挥保护作用,而不受控制的IL-22将促进肿瘤生长。在炎症条件下,IL-22通过STAT3依赖性信号传导直接促进肿瘤生长或诱导“干细胞样”癌细胞,为正常和恶性细胞提供促肿瘤信号[49-50],加入STAT3抑制剂可阻断IL-22的促肿瘤作用[51]。此外,IL-22还可在体外诱导肿瘤中新生血管的形成,用中和抗体阻断IL-22可显著抑制与微血管密度相关的肿瘤生长[52]。
6.1 IL-22与肝癌 肝癌是全球范围内的常见癌症,其致死率较高,位居恶性肿瘤中第四位[53]。IL-22在肝细胞癌(HCC)的发生发展中起着双重作用,一方面,IL-22是一种公认的肝脏保护性细胞因子,其通过诱导AMP活化蛋白激酶、AKT和哺乳动物雷帕霉素靶标来改善线粒体功能障碍从而改善肝损伤、促进肝脏的愈合和组织的修复,防止细胞凋亡[54-55];另一方面,IL-22可通过抑制受损肝细胞的凋亡来诱导HCC的发生[56],并且增强肝组织对HCC发展的敏感性以促进肿瘤生长[57]。在HCC微环境中发现过量的IL-22可以导致肿瘤生长,并通过激活STAT3通路从而促进肿瘤转移[58]。Shi等[59]研究表明,血清IL-22水平从慢性乙型肝炎(CHB)、非典型增生到HCC逐步增加。
6.2 IL-22与胰腺癌 胰腺癌是一种侵袭性很强的疾病,几乎没有有效治疗方法。IL-22水平在胰腺癌发展过程中增加,与存活时间缩短有关[38]。胰腺导管腺癌是胰腺癌中最常见的一种形式,在所有癌症中致死率最高[60]。胰腺癌的发生过程中,IL-22通过IL-22RA1/STAT3信号传导能够促进胰腺癌干细胞生成,致使胰腺导管腺癌细胞的自我更新、致瘤性和转移特征更加的明显[61]。
6.3 IL-22与胃癌 研究表明,与健康对照组织相比,在胃癌组织中可以检测到高水平的IL-22和IL-22R1,IL-22通过STAT3和ERK的激活来增强胃癌细胞的侵袭能力[62]。IL-22还可在胃癌细胞系中通过诱导基质金属蛋白酶的表达来增强肿瘤细胞的侵袭性[63]。此外,IL-22通过JNK信号通路调节胃癌细胞的活力,降低MAPK信号通路的激活,促进体外胃癌细胞(AGS细胞)细胞活力[64]。
6.4 IL-22与结直肠癌 在稳态条件下,IL-22可通过保持消化道黏膜屏障完整性来预防癌症[49]。慢性结肠炎情况下,不受限制的IL-22大量产生会导致结直肠肿瘤的发生率增加[65]。研究表明,CD4+T细胞特别是Th17细胞中的TGF-β信号能够促进IL-22的产生,从而促进小鼠的结直肠癌形成[48]。一旦肿瘤形成,IL-22可通过诱导肿瘤细胞增殖和抗凋亡蛋白表达来促进肿瘤生长[51]。在结直肠癌发生过程中,IL-22促进STAT3的磷酸化并抑制Wnt和Notch信号通路[66],加速小鼠结直肠肿瘤发生,并导致侵袭性腺癌形成[67]。在已发展为结直肠癌的情况下,IL-22激活癌细胞中的STAT3磷酸化级联反应并诱导干细胞标志物(SOX2、NANOG和POU5F1)表达,从而增加癌症干细胞特性和致瘤潜力[68]。
7 IL-22在消化道黏膜修复过程中的作用
IL-22在消化道黏膜受病原体入侵期间有助于维持和恢复上皮屏障功能的完整性[69]。IL-22可通过诱导 Lgr5+肠干细胞中STAT3磷酸化,促进上皮干细胞再生和增殖来维持肠道损伤后屏障和器官功能的完整性[70]。在肠道黏膜稳态受到干扰时,如结肠炎和肠道损伤期间,IL-22可激活STAT3以驱动组织再生和保护, IL-22诱导IEC STAT3活化,介导黏膜伤口愈合来促进肠上皮修复和黏膜伤口愈合[19],并促进功能性黏蛋白1产生的能力来增强肠道黏液屏障完整性防止细菌侵入[71]。IL-22基因敲除的小鼠肠道受感染后,肠上皮损伤、全身细菌负荷和病死率增加[72],在结肠感染柠檬酸杆菌的肥胖小鼠中,外源性IL-22可恢复宿主黏膜防御[73]。此外,IL-22还参与DNA损伤反应(DDR)。DDR是消化道黏膜细胞损伤修复过程中不断监测基因组完整性、确保遗传信息完整传递的细胞修复机制[74]。DDR可通过细胞周期阻滞、DNA修复或凋亡来避免细胞突变或癌变,其中,IL-22是肠上皮干细胞中DDR机制有效启动所必需的,缺乏 IL-22并暴露于致癌物的结肠上皮干细胞逃避了DDR,出现更多的基因突变,并更易引起结肠癌[75-76]。见图2。
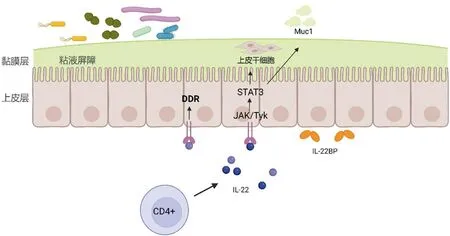
图2 IL-22在消化道黏膜修复过程中的作用
8 IL-22与肠道微生物的关系
高度多样化的微生物群是维持消化道内稳态的重要因素,通过和IL-22通路间的相互作用调节宿主肠道防御、代谢等各个方面[77]。生命初期,肠道环境共生细菌的初始定植触发产生IL-22[78]。而后,微生物群产生的纤维衍生短链脂肪酸和包括GPR43在内的游离脂肪酸受体诱导固有淋巴样细胞介导的IL-22表达可防止微生物入侵,并预防代谢综合征[79]。这种表达由髓样树突细胞间接介导,并且部分依赖于IL-23和IL-1β[80]。Pham等[81]研究表明,IL-22信号促进的上皮岩藻糖基化可防止机会性病原体(如粪肠球菌)的过度定殖,并避免相关致命菌感染和化学诱导的结肠炎。吲哚-3-乙酸是一种微生物群衍生的芳烃受体配体,肠道内正常水平的吲哚-3-乙酸可维持IL-22正常表达,防止炎症和细菌转移到肝脏[82-83]。无菌小鼠和不含特定细菌小鼠肠道中IL-22的水平相当[84],当IL-22缺乏时,小鼠结肠微生物群中的有益菌乳酸杆菌丰度降低,而致病菌如沙门氏菌、螺杆菌的丰度增加[85]。
另一方面,IL-22除了通过限制有害肠道微生物感染发挥保护作用之外,也可能导致病原体在肠道持续定植,并且进一步促进与Th1和Th17细胞因子相关的透壁炎症[86]。此外,如果IL-23-IL-22信号通路失活,将会导致肠道屏障的恶化、稳态失调和病原菌的扩张[87]。
综上所述,近年来,IL-22作为一种可多方面影响上皮、基质细胞、消化道黏膜及肠道微生物的细胞因子,已在消化系统疾病中成为热门研究靶点。通过本综述,可了解IL-22对组织和疾病的作用可因内环境、疾病种类、是否处于炎性或肿瘤状态而不同。IL-22的介导可促进疾病相关环节向正向发展的同时,也可导致疾病的进一步发展。因此,还有待在细胞、动物组织和临床等层面进行更广泛、更精确、更深入的研究来充分了解IL-22在消化系统生理、病理和疾病等各个环节中的效应作用,以便进一步应用于临床,为消化系统疾病的治疗提供新的方向。
