丁酸盐在炎症性肠病中的免疫调节机制研究进展
2024-05-23崔馨月石璠郑丽红王海强
崔馨月 石璠 郑丽红 王海强
炎症性肠病(inflammatory bowel disease,IBD)是一组与肠道慢性炎症相关的异质性疾病[1],常表现为腹痛、腹泻、血便、体重减轻等,在过去的10年里在全球范围内变得越来越普遍[2]。目前IBD的治疗宗旨是诱导病情缓解,常用药物包括皮质类固醇、免疫调节剂和生物制剂[3],然而这些药物都有显著的不良反应,因此需要确定新的IBD治疗靶点,寻找安全有效的IBD治疗方法[4]。IBD发病涉及肠道微生物群失调和肠道免疫功能紊,二者都有一个重要的共同信号因子:短链脂肪酸(short-chain fatty acids,SCFAs)。丁酸盐是短链脂肪酸中研究最多的一种,为上皮细胞的主要燃料来源,能够调节肠道稳态并保持上皮的完整性[4],具有显著的抗炎功能,可以与免疫系统相互作用,调节肠道免疫细胞库中几乎所有类型的免疫细胞的发育和功能[5],调节免疫功能并且防止过度免疫反应发生[6]。已有研究证明丁酸盐在实验中治疗结肠炎具有有益效果[7]。本文就丁酸盐在调节免疫功能方面改善IBD作用机制的研究进展进行综述,旨在为IBD的临床治疗提供新的选择。
1 肠道丁酸盐的来源和吸收
1.1 肠道丁酸盐的来源和分布 丁酸盐是微生物群产生的一种关键代谢物,由大肠腔内的非消化性碳水化合物如纤维素、菊粉和抗性淀粉分解产生[8]。消耗的膳食纤维的数量和类型以及丁酸盐产生菌的存在决定丁酸盐的产生。丁酸盐产生菌大多属于厚壁菌门中的毛螺菌科(Lachnospiraceae)和瘤胃菌科(Ruminococcaceae),一些拟杆菌门成员也可能产生丁酸盐[9],如臭杆菌属Odoribacter 丁酸单胞菌属Butyricimonas 卟啉单胞菌属(Porphyromonas) 另枝菌属(Alistipes)[10]。丁酸盐占人体粪便中SCFAs总量的15%~23%,浓度为10~25 mmol/L,在大多数膳食纤维发酵发生的近端结肠中含量更高[9]。
1.2 肠道丁酸盐的吸收和信号传导 丁酸盐是一种弱酸(pKa=4.8),主要在生理性结肠pH值(5.0~6.5)下以解离形式存在[11]。丁酸盐通过扩散或主动转运蛋白通过结肠细胞的细胞膜[12],这些转运蛋白包括由SLC16A1基因编码的H+耦联的单羧酸盐转运蛋白-1(monocarboxylate transporter 1,MCT1),和由SLC5A8基因编码的Na+耦联的单羧酸盐转运蛋白-1(sodium-coupled monocarboxylate transporter 1,SMCT1)。MCT1是一种低亲和力的转运蛋白,在小肠中弱表达而在近端结肠中强表达,近端结肠丁酸盐浓度更高,pH值更低[11]。SMCT1在远端回肠和结肠表达,运输包括乳酸盐和丙酮酸盐等各种单羧酸盐。SMCT1对丁酸盐具有很高的亲和力(50 μmol/L),在丁酸盐浓度低的远端结肠发挥作用[13]。
丁酸盐通过3个G蛋白耦联受体(G protein-coupled receptor,GPCR)[GPR43、GPR41和GPR109A]发出信号[14],在消化道,GPR41和GPR43在肠内分泌细胞、上皮细胞和平滑肌细胞以及肠道神经元中表达。较低水平的GPR41和GPR43也存在于包括单核细胞、树突状细胞、中性粒细胞和嗜酸性粒细胞在内的免疫细胞中[15]。GPR43和GPR41被乙酸盐、丙酸盐和丁酸盐激活。丁酸盐与GPR41结合优先于与GPR43结合。GPR109A被丁酸盐、β-羟基丁酸和高剂量的烟酸激活。3个GPCR都与Gi/o耦联,因此在激活其他信号通路的同时抑制了cAMP(环磷酸腺苷)依赖性通路。结肠细胞和免疫细胞中这些受体的激活会导致细胞因子水平和各种信号通路的变化,促进抗炎反应[16]。
2 丁酸盐调节免疫细胞
2.1 中性粒细胞 中性粒细胞迁移是炎症的标志[17]。中性粒细胞胞外陷阱(neutrophil extracellular traps,NETs)会损害肠道屏障功能,诱发肠道损伤和血栓形成倾向[18]。丁酸盐能显著抑制脂多糖(Lipopolysaccharide,LPS)诱导的IBD患者中性粒细胞产生促炎细胞因子、趋化因子和钙卫蛋白,减少髓过氧化物酶(myeloperoxidase,MPO)、活性氧(reactive oxygen species,ROS)的释放和NETs的形成,并且抑制中性粒细胞迁移。丁酸盐对IBD中性粒细胞的免疫调节作用涉及白细胞活化、调节先天免疫反应和对氧化应激的反应。口服丁酸盐能够抑制如促炎性介质和NETs的形成等中性粒细胞相关的免疫反应从而改善葡聚糖硫酸钠盐(dextran sulphate sodium,DSS)诱导的小鼠结肠炎的黏膜炎症。丁酸盐调节中性粒细胞的功能、限制促炎潜力,改善IBD的黏膜炎症[17],这为丁酸盐在治疗IBD方面提供了新的治疗途径。
而中性粒细胞在诱导肠道炎症中具有两面性,中性粒细胞能维持黏膜平衡状态、促进结肠炎组织修复,而过度积聚和促炎介质的释放又会加剧结肠炎[17]。中性粒细胞耗尽的小鼠在受到三硝基苯磺酸(trinitro-benzene sulfonic acid,TNBS)损伤后肠道炎症加重[19]。相反,中性粒细胞过度的募集和积累伴随着延迟溶解导致持续的炎症激活和黏膜损伤[20]。有研究证实丁酸盐在炎症诱导的上皮屏障功能丧失中具有有害作用[21]。中性粒细胞被急性募集到炎症黏膜中有助于改善炎症,而慢性浸润则会加剧肠道黏膜炎症。在肠道炎症急性期丁酸盐可作为辅助药物以限制免疫细胞的进一步募集和激活,而在慢性期应用丁酸盐可能会阻碍上皮细胞的增殖和修复。因此需要辩证的看待丁酸盐的作用[17]。
2.2 巨噬细胞 在组织损伤过程中,介导促炎反应的M1巨噬细胞被募集并迅速适应为在组织修复过程中起作用的M2巨噬细胞[22]。丁酸盐增加氧化磷酸化(oxidative phosphorylation,OXPHOS)水平和脂质代谢来调节巨噬细胞功能,从而促进巨噬细胞的替代激活[23],丁酸盐可以直接作为代谢底物本身,通过G蛋白耦联受体信号传导或通过抑制组蛋白脱乙酰酶来塑造肠巨噬细胞的代谢特征,从而抑制炎性细胞因子的产生[12]。丁酸盐有效抑制M1巨噬细胞极化和白细胞介素-18(interleukin-18,IL-18)、IL-1β等炎性细胞因子的分泌[24]。丁酸盐增加CD206和精氨酸酶-1(arginase-1,Arg1)的表达(M2巨噬细胞相关基因)从而促进M2巨噬细胞极化。丁酸盐还以巨噬细胞依赖的方式增加结肠隐窝中黏蛋白的产生,提高分泌黏蛋白的杯状细胞的比例。巨噬细胞衍生的WNT蛋白能够促进损伤后局部组织再生,丁酸盐诱导M2巨噬细胞中WNT蛋白的产生,激活细胞外调节蛋白激酶(extracelluar signal-regulated kinase 1 and 2,ERK)1/2 依赖性杯状细胞的生成和黏液屏障的恢复[25]。因此丁酸盐促进受损组织中产生促愈合巨噬细胞可能是一种独特且有潜力的治疗炎症或肠屏障损伤相关疾病的方法。
2.3 适应性免疫细胞 调节性T细胞(regulatory T cell,Treg)和辅助性T细胞17(T helper cell 17,Th17)的失衡可能导致IBD的发病[26]。过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)在脂质和葡萄糖代谢中起作用并介导抗炎活性,其能促进脂肪组织中Treg细胞的增殖和功能,介导Th17细胞转化为Treg细胞[27]。Treg细胞以氧化磷酸化(OXPHOS)为主要能量来源,而Th17细胞以糖酵解和谷氨酰胺解来维持其增殖、分化和功能[28]。PPARγ表达减少影响线粒体生物能量学,如减少细胞的耗氧率(oxygen consumption rate,OCR)和促进糖酵解。雷帕霉素复合体的机制靶点1(mammalian target of rapamycin complex 1,mTORC1)通过上调缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)的表达来增强糖酵解。HIF-1α直接激活维甲酸相关孤儿受体γt(retinoic acid-related orphan receptor gamma t,RORγt)并增强Th17细胞分化,但通过结合叉头状转录因子P3(forkhead box protein P3,FOXP3)蛋白并靶向其降解来抑制Treg细胞分化[29]。当mTORC1活性被抑制时,HIF-1α表达下调,PPARγ表达上调,阻断糖酵解,从而抑制Th17细胞分化并促进FOXP3+Treg细胞分化,从而减少炎性反应[30]。丁酸盐能够激活PPARγ促进T细胞代谢从糖酵解转变为OXPHOS,从而促进Treg细胞分化并抑制Th17细胞的分化[31]。此外,研究发现丁酸盐激活沉默信息调节因子1(silent information regulator 1,SIRT1)/mTOR调节Th17/Treg平衡,从而减轻DSS和艰难梭菌引起的结肠炎[32]。因此丁酸盐可能以恢复代谢重编程,调节Treg/Th17平衡成为治疗IBD的靶点。
3 丁酸盐的免疫调节机制
3.1 丁酸盐是组蛋白脱乙酰酶(HDAC)抑制剂 组蛋白脱乙酰酶(histone deacetylase,HDAC)分为18种异构体和4组,是可以从组蛋白和非组蛋白中去除乙酰基的酶家族,从而改变转录活性。HDAC与肠道炎症之间存在显著关联[33]。丁酸盐可以作为HDAC抑制剂发挥抗炎作用,用丁酸盐处理原始T细胞可以增强FOXP3的乙酰化,从而上调Treg细胞的分化[34]。HDAC泛抑制剂ITF2357可以下调原始T细胞中IL-6R并减少IL-6诱导的/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化,直接抑制ROR-γT并减少IL-17和Th17的产生。因此,IL-6/STAT3/IL-17信号通路对于通过抑制HDAC实现抗炎作用很重要[35]。HDAC是调节IBD中Th17/Treg细胞分化的靶点。丁酸盐以抑制HDAC1、阻断IL-6/STAT3/IL-17通路和激活FOXP3来维持Th17/Treg平衡,从而发挥抗炎作用。因此丁酸盐-HDAC1-T细胞轴是治疗炎症性肠病的潜在靶点。增殖和活化的Th17细胞会减少脂质氧化并快速增加糖酵解作为其能量来源[36]。c-Myc是一种细胞代谢调节因子,其维持T细胞中乳酸脱氢酶A(lactate dehydrogenase ,LDHA)和谷氨酰胺酶(glutaminase,GLS)的水平,从而调节糖酵解程序以及谷氨酰胺摄取和分解代谢[37]。丁酸盐抑制HDAC3降低T细胞中的下游c-Myc和c-Myc相关代谢酶(LDHA和GLS)的水平,从而抑制Th17细胞分化。丁酸盐可以为治疗炎症性疾病中减少Th17细胞提供新的选择[38]。此外,HDAC3对于巨噬细胞的活化很重要。用LPS刺激HDAC3缺陷型巨噬细胞后表现出炎性细胞因子表达水平降低。丁酸盐预处理能够增强组蛋白H3乙酰化,减少巨噬细胞中炎性细胞因子的产生[39]。因此丁酸盐可以通过作为HDAC抑制剂在IBD中发挥抗炎作用。
3.2 丁酸盐下调免疫炎症相关转录因子NF-κB、阻止其核转位 核因子κB(nuclear transcription factor-κB,NF-κB)是炎症的主要调节因子,以p50和p65的异二聚体的主要形式存在,其被紧密结合的抑制剂蛋白κB(inhibitor of NF-κB,IκB)家族的抑制蛋白螯合在细胞质中,当其被炎症诱导物刺激后,IκB被磷酸化、泛素化和降解,NF-κB转移到细胞核,与特定的启动子元件结合触发下游靶基因(炎性介质、细胞因子)的转录。丁酸盐抑制NF-κB从细胞质向细胞核的迁移,通过抑制NF-κB活化和IκBα降解来降低促炎细胞因子的表达[40]。调节NF-κB能够维持肠道稳态,在IBD患者的炎症黏膜以及DSS诱导的结肠炎中,NF-κB活性上调。抑制NF-κB是治疗IBD的一种治疗策略。丁酸盐可以抑制NF-κB的激活[41]。通过与IκBα等抑制性分子结合来调节NF-κB。其抑制了IκBα的降解和磷酸化,降低了NF-κB的DNA结合活性[39]。研究表明丁酸钠能够通过激活GPR109A、抑制蛋白激酶B(protein kinase B,AKT)和NF-κB p65的磷酸化从而改善TNBS诱导的炎性反应[42]。因此丁酸盐对于NF-κB的抑制可以为治疗IBD提供新的选择。
3.3 丁酸盐降低一氧化氮(NO)生成 NO是一种可以调节多种生理功能的小分子神经递质和免疫调节剂,根据其剂量和环境的不同发挥促炎或抗炎的作用[43]。诱导型NO合酶(inducible nitric oxide synthase,iNOS)可以通过免疫细胞激活诱导微摩尔水平的NO,从而引发慢性炎症性疾病[44]。脂蛋白是金黄色葡萄球菌引起IBD的主要毒力因子,导致NO等炎性介质过多产生。有研究证明丁酸盐抑制金黄色葡萄球菌脂蛋白(S.aureuslipoprotein,Sa.LPP)诱导的RAW264.7细胞和骨髓源性巨噬细胞中NO的产生,抑制Sa.LPP诱导的iNOS表达,抑制对于诱导巨噬细胞中iNOS转录至关重要的Sa.LPP诱导的NF-κB激活、干扰素-β(interferon-β,IFN-β)表达和STAT1磷酸化[45]。此外组蛋白脱乙酰酶(HDAC)抑制剂也可以减少Sa.LPP诱导的NO产生。先前的研究已经证明了PPARγ激动剂可以减少干扰素γ或LPS诱导的NO产生[46]和iNOS[47]表达。此外,丁酸钠作为组蛋白脱乙酰酶抑制剂可以增强其启动子上的H3K9Ac修饰来上调PPARα的表达。丁酸钠诱导PPARα激活后刺激脂肪酸β氧化,并通过蛋白质-蛋白质相互作用抑制NF-κB介导的炎症途径[48]。最近的研究表明PPARα激动剂以蛋白酶体途径增强iNOS蛋白降解,从而减少巨噬细胞中LPS诱导的iNOS表达和NO产生[49]。因此丁酸盐可能以减少NO产生作为靶点来缓解和治疗IBD。
3.4 GPCR途径 GPR109A是一种在先天免疫细胞和脂肪组织中高度表达的G蛋白耦联受体,其可被丁酸盐激活。固有淋巴细胞(innate lymphoid cells,ILCs)是能够诱导、调节和消退炎性反应的一个免疫细胞家族,ILCs受到微环境中的微生物和细胞因子刺激快速产生促炎和调节细胞因子。其中ILC3促进和调节肠道炎症,在IL-23和IL-1β刺激下表达转录因子RORγt并产生IL-17和IL-22。研究发现与IL-22相比,ILC3在GPR109A-/-Rag1-/-小鼠中显著增加了IL-17的产生。确定GPR109A抑制树突状细胞(dendritic cell,DC)产生IL-23从而抑制ILC3介导的结肠炎症[50]。此外,丁酸盐激活GPR109A后促进Treg细胞的分化,提高产生IL-10的Th2细胞和血浆IL-10水平,进而抑制促炎性IL-17[51],还能够增加肠上皮细胞中IL-18的分泌[52]。SCFAs对肠上皮细胞上GPR41的激活导致快速炎性反应[53],丁酸盐对其的刺激可阻止NO、IL-6和IL-12的释放[12],并且可以促进CD4+T细胞和ILCs中IL-22的产生[54]。GPR43受体通过β-制动蛋白2(β-arrestin2)信号通路降低NF-kB水平,减少NF-kB2个亚基p65和p50进入细胞核的量,抑制促炎细胞因子(IL-1β和IL-6)的转录[55]。并且丁酸盐在激活GPR43后会减少CD4+T细胞增殖并限制促炎细胞因子(例如IL-17和L-22)的分泌[56]。而另一项研究表明在各种慢性结肠炎小鼠模型中,GPR43 KO小鼠对结肠炎症更具抵抗力[57]。这些矛盾产生的原因尚不清楚,可能与肠道微生物群的差异和SCFAs生产水平的不同有关[58]。除此之外,免疫细胞和上皮细胞中的GPR109A、GPR41和GPR43激活可以刺激NLRP3炎症小体复合物[59]。丁酸盐可以抑制LPS诱导的Caco-2细胞中的自噬和NLRP3炎症小体激活[60]。因此丁酸盐作为GPR109A、GPR41、GPR43激动剂有望作为缓解和治疗IBD的潜在靶点。
3.5 丁酸盐诱导宿主防御肽表达 宿主防御肽(host defense peptides,HDPs),也称为抗微生物肽(Antimicrobial peptides,AMPs),能够保护宿主免受病原体感染、共生细菌抗原易位以及调节健康微生物群的组成[61]。SCFAs通过与GPR43的相互作用、c-Jun N-末端激酶(c-Jun N-terminal kinase,JNK)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)激酶(mitogen-activated extracellular signal-regulated kinase,MEK)/细胞外信号调节激酶(extracellular signal-regulated protein kinase,ERK)途径的激活以及细胞生长途径刺激肠上皮细胞(intestinal epithelial cell,IEC)合成HDPs。丁酸盐通过抑制HDAC促进单核细胞到巨噬细胞的发育,刺激巨噬细胞中HDPs的合成,增加巨噬细胞释放的HDPs的数量。研究表明,丁酸钠在西式饮食诱导的肥胖小鼠体内增强潘氏细胞的抗菌功能,诱导潘氏细胞分泌α-防御素来减轻肠道屏障功能障碍,并强调了HDAC抑制和STAT3信号在介导菊粉及其发酵产物对α-防御素的转录调控和诱导中发挥作用[62]。丁酸钠在牛乳腺上皮细胞中增强MAPK信号激活和组蛋白H3乙酰化来促进促炎细胞因子、趋化因子和β-防御素的表达,从而募集免疫细胞,促进病原体和刺激的消除,并促进感染后的恢复,增强LPS诱导的先天免疫反应[63]。在一项动物实验中,GPR43-/-小鼠中,IEC内再生胰岛衍生蛋白3γ(RegIIIγ)和β-防御素的产生受损,而给予GPR43激动剂增强小鼠和人IEC中HDPs的产生,丁酸盐促进了野生型(WT)而没有促进GPR43-/-肠上皮类肠中RegIIIγ和β-防御素的表达,表明GPR43参与HDPs的产生。丁酸盐以GPR43依赖的方式促进IEC RegIIIγ和β-防御素的产生。研究还证明了mTOR和STAT3的SCFA激活可以协同促进AMPs在IEC中的表达[64]。因此靶向丁酸盐介导的HDPs产生的内在途径的药物可能成为缓解和治疗IBD有前途的候选者。见图1。
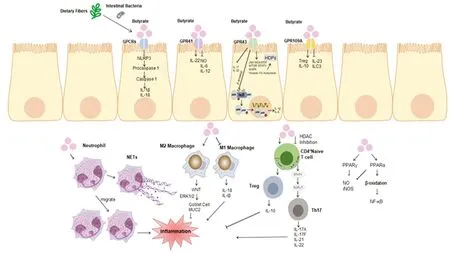
图1 丁酸盐在炎症性肠病中的免疫调节机制
综上所述,丁酸盐作为一种肠道微生物代谢产物,在调节免疫功能、上皮屏障功能和维持肠道稳态方面发挥着至关重要的作用。丁酸盐通过对免疫细胞的调节,抑制HDAC,阻止NF-κB核转位,减少NO合成,刺激GPR109A、GPR41、GPR43受体,诱导宿主防御肽表达等多种机制减轻炎症。丁酸盐可能是IBD的替代治疗方法,需要进一步的研究来确定丁酸盐在IBD发病中的作用以及丁酸盐是否是IBD的有效治疗方法。
