肠复方对葡聚糖硫酸钠诱导的急性溃疡性结肠炎小鼠的干预作用
2024-05-22张荣棋冯淬灵张银丽
张荣棋,冯淬灵,戴 中,张银丽
(1. 北京中医药大学东直门医院,北京 100700;2. 北京大学人民医院,北京 100044)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性非特异性肠道炎性疾病,病变主要涉及直肠和结肠,呈连续性弥漫性分布,临床症状常见反复发作的腹泻、腹痛、黏液脓血便,重症患者可发生中毒性巨结肠、直肠结肠癌变、消化道出血、肠穿孔等并发症,危及患者生命。我国UC的患病率约为11.6/10万[1],且近年来呈现爆发性增长趋势。本病病因和发病机制不清,病程长、易反复,暂无根治方法,常用药物包括美沙拉秦、皮质类固醇、免疫抑制剂、生物制剂等[2]。中医药治疗UC有悠久的历史,积累了大量经典方剂,如芍药汤、白头翁汤、参苓白术散、驻车丸等[3]。肠复方是北京大学人民医院中医科治疗UC的协定处方,对美沙拉秦治疗失败的UC患者仍有效,能够缓解活动期UC患者的临床症状,促进镜下黏膜修复,但肠复方治疗UC的机制尚不明确,故本研究通过观察肠复方对葡聚糖硫酸钠(DSS)诱导急性UC小鼠的疾病活动指数(DAI)及结肠组织炎症程度的影响,以期为肠复方的临床应用及机制研究提供参考。
1 实验材料与方法
1.1实验动物 SPF级雄性C57BL/6小鼠40只,6~8周龄,体重(20±2)g,由北京华阜康生物科技公司提供,许可证号:SCXK(京)2019-0008。小鼠饲养于北京大学人民医院动物实验室,饲养环境为屏障级,温度26 ℃,湿度(40±5)%,通风条件良好,12 h光照/黑暗交替,自由饮食、饮水,适应性饲养7 d。实验方案已获得北京大学人民医院伦理审查委员会批准(批准号:2022PHE035),实验操作流程严格按照实验动物管理规定进行。
1.2实验药物 肠复方组成:黄芪15 g、赤芍15 g、白芍15 g、白头翁15 g、马齿苋15 g、黄连6 g、白花蛇舌草15 g、炒槐花15 g、茜草15 g、金银花15 g、地榆炭15 g,上述剂量为60 kg成年人1 d药量,颗粒剂购自北京康仁堂,称取颗粒重量约为41.15 g。美沙拉秦缓释颗粒,上海爱的发制药有限公司,国药准字H20143164,规格:500 mg×10袋/盒,60 kg成人1 d药量为4 g。根据《药理实验方法学》[4]中标准体重小鼠(20 g)与成人(60 kg)给药剂量换算公式,可以确定小鼠的肠复方颗粒给药量约为0.17 g/d,美沙拉秦给药量约为0.016 g/d,根据小鼠标准灌胃量0.1 mL/10 g,可计算肠复方给药浓度约为0.85 g/mL,美沙拉秦给药浓度约为0.08 g/mL。实验时,用蒸馏水溶解中药颗粒,制备所需药物浓度;美沙拉秦缓释颗粒用研磨钵研磨过筛后称取所需量,用蒸馏水配置成混悬液。上述配置好的药液储存于4 ℃冰箱,使用前恢复至室温、摇晃均匀。
1.3主要试剂 DSS(分子量36~50 kDa,AbMole,货号:M9443-50g);粪便隐血定性检测试剂盒(邻联甲苯胺法,Leagene,货号:TC0511-300T);通用型组织固定液(主要成分为4%多聚甲醛,Servicebio,货号:G1101-3ML);苏木素-伊红(HE)染色试剂盒(Servicebio,货号:G1076-500ML);小鼠肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-4(IL-4)、白细胞介素-10(IL-10)酶联免疫检测试剂盒(Servicebio,货号分别为GEM0004、GEM0001、GEM0008、GEM0002);Actin、闭合蛋白-1(Claudin-1)、闭合小环蛋白-1(ZO-1)、HRP-山羊抗小鼠、HRP-山羊抗兔(Servicebio,货号分别为GB12001、GB112543、GB111402、GB23301、GB23303);TBST缓冲液(Servicebio,货号:G2150-1L)。
1.4主要器材 电子天平[梅特勒-托利多仪器(上海)有限公司,ME203E/02],高速组织研磨仪(Servicebio,KZ-II),台式高速冷冻离心机(大龙,D3024R),涡旋混合器(Servicebio,MX-F),酶标检测仪(BioTeK,Epoch),多功能型摇床(水平+钟摆+3D)(Servicebio,DS-3D100),电泳电源(可编程)(Servicebio,SPW-6S),抗体孵育盒(Servicebio,G9055-4),化学发光仪(CLINX,6100)。
1.5实验方法 使用随机数字表将小鼠随机分为空白组、模型组、肠复方组、美沙拉秦组,每组10只。实验第1~7天,模型组、肠复方组、美沙拉秦组小鼠自由饮用蒸馏水配置的3%DSS溶液,空白组小鼠自由饮用蒸馏水,期间至多3 d更换1次饮用水,以确保水质洁净。于实验第8天撤除3%DSS溶液,恢复蒸馏水自由饮用。实验第8~14天,肠复方组给予0.85 g/mL的肠复方颗粒溶液灌胃,美沙拉秦组给予0.08 g/mL的美沙拉秦缓释颗粒混悬液灌胃,空白组及模型组给予等体积蒸馏水灌胃,均1次/d,连续7 d。
1.6样本采集与处理 实验第14天灌胃后,禁食不禁水24 h,于第15天将所有小鼠以CO2安乐死。处置小鼠后迅速解剖,取出从肛门到盲肠末端的结肠和直肠段,测量长度后,于结肠远端剪取0.5 cm置于4%多聚甲醛溶液中固定以进行后续组织病理分析,剩余结肠组织通过取样管收集并储存于液氮中,用于后续ELISA及Western blot检测。
1.7检测指标及方法
1.7.1DAI 从实验第1天开始,参照Cooper等[5]的方法,每天观察小鼠精神状态、毛发稀疏程度、色泽、饮食状态、大便形态和肉眼血便情况,测量体重,以粪便隐血定性检测试剂盒(邻联甲苯胺法)检测粪便隐血情况,并计算DAI。DAI=(体重下降分数+粪便性状分数+隐血分数)/3,得分范围0~4分,0分代表正常,4分代表炎症最大活动度。具体评分标准见表1。

表1 溃疡性结肠炎疾病活动指数(DAI)评分标准
1.7.2结肠长度 取出小鼠肛门到盲肠末端的结肠和直肠段,于坐标纸上拉直(但不拉伸)后测量长度。
1.7.3结肠组织病理评分 从固定液中取出各组小鼠结肠组织样本,常规石蜡包理切片,行HE染色,由病理学专家于显微镜下盲法评估炎症细胞浸润程度及上皮组织损伤情况,参考Obermeier等[6]的评分标准(见表2),以两项分数之和为组织病理评分。

表2 溃疡性结肠炎组织病理评分标准
1.7.4结肠组织中TNF-α、IL-6、IL-4、IL-10水平 取适量结肠组织,置于匀浆器进行匀浆,离心,取上清液,按照 ELISA 试剂盒说明书操作,使用酶标仪,在450 nm波长处以空白对照孔调零后测各孔吸光值,根据标准品的浓度和吸光值做标准曲线,然后根据标准曲线方程计算出样本浓度。
1.7.5结肠组织中ZO-1、Claudin-1蛋白表达情况 采用Western blot法检测:取适量结肠组织,剪碎后置于匀浆管中,加入蛋白酶抑制剂、裂解液后于冰上进行充分匀浆、裂解,离心后收集上清,获取总蛋白溶液;将蛋白溶液与还原型蛋白上样缓冲液混合,经沸水浴变性后,配置分离胶,上样电泳,转膜,封闭,倒掉封闭液后加入配置好的一抗稀释液(Actin、ZO-1、Claudin-1稀释比分别为1∶2 000,1∶1 000,1∶3 000),于4 ℃孵育摇床过夜,回收一抗,TBST缓冲液快速洗脱3次,每次5min,将二抗用TBST按照1∶5 000的比例进行稀释后加入孵育槽中,摇床慢摇,室温孵育30 min,TBST缓冲液快速洗脱3次,每次5 min,将洗脱并吸干水分的PVDF膜进行化学发光,曝光完成之后,保存原始图为TIFF格式,用AIWBwellTM分析软件进行数据分析,计算指标灰度值/内参灰度值,即蛋白相对表达量。
1.8统计学方法 采用SPSS 25.0软件进行数据统计分析,计量资料如果符合正态分布且方差齐,两两比较采用t检验,多组之间比较使用标准单因素方差分析、Tukey的多重比较;数据符合正态分布但方差不齐,比较使用Brown-Forsythe和Welch单因素方差分析、Dunnett的T3多重比较;数据不符合正态分布的使用非参数检验。P<0.05表示差异有统计学意义。
2 结 果
2.1一般情况 整个实验过程,空白组小鼠饮食、饮水正常,体重呈增长趋势,活动状态良好,反应灵敏,毛色洁净光泽,无腹泻和血便,便隐血实验为阴性。实验第2天,各造模组部分小鼠便隐血试验阳性;实验第3天,各造模组部分小鼠大便变软;实验第4天,各造模组小鼠体重普遍较前下降,便隐血试验普遍阳性;实验第7天,小鼠普遍出现饮食饮水减少,精神不佳,毛发光泽变差且脱毛增加,活动度降低,排稀便且粘肛门,可见肉眼血便等;实验第8~14天,肠复方组和美沙拉秦组小鼠上述症状均较模型组减轻。
2.2DAI 开始造模后,除空白组外,各造模组小鼠的DAI持续升高,于实验第7天达到峰值,且均明显高于空白组(P均<0.05),各造模组之间比较差异均无统计学意义(P均>0.05)。停止造模、开始灌胃后,各造模组小鼠的DAI均逐渐下降。于实验第14天,模型组DAI明显高于空白组(P<0.05);肠复方组、美沙拉秦组DAI均明显低于模型组(P均<0.05),且与空白组比较差异均无统计学意义(P>0.05),肠复方组与美沙拉秦组比较差异无统计学意义(P>0.05)。见图1及图2。

图1 实验过程中空白组和急性溃疡性结肠炎各组小鼠疾病活动指数DAI评分

图2 空白组和急性溃疡性结肠炎各组小鼠实验第7天、第14天疾病活动指数DAI评分
2.3结肠长度 各造模组小鼠结肠长度均明显短于空白组(P均<0.05);肠复方组与美沙拉秦组小鼠结肠长度均明显长于模型组(P均<0.05),肠复方组与美沙拉秦组比较差异无统计学意义(P>0.05)。见图3。

图3 空白组和急性溃疡性结肠炎各组小鼠结肠外观及长度
2.4结肠组织病理形态及病理评分 空白组小鼠结肠黏膜上皮连续完整,排列规则,隐窝结构正常,未见中性粒细胞和淋巴细胞浸润,无病理损伤表现。模型组小鼠结肠结构破坏严重,杯状细胞、隐窝结构大面积缺失,炎性细胞浸润明显,病理评分明显高于空白组(P<0.05)。与模型组比较,肠复方组及美沙拉秦组小鼠结肠组织结构损伤较轻,炎性细胞浸润减少,病理评分明显降低(P均<0.05),肠复方组与美沙拉秦组病理评分比较差异无统计学意义(P<0.05)。见图4。
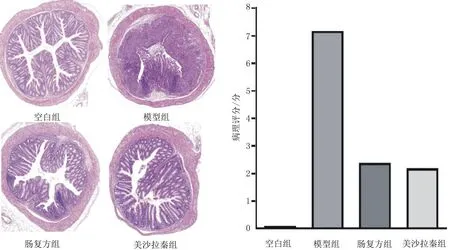
图4 空白组和急性溃疡性结肠炎各组小鼠结肠组织HE染色病理形态及病理评分
2.5结肠组织中TNF-α、IL-6、IL-4、IL-10水平 与空白组比较,模型组小鼠结肠组织中TNF-α、IL-6水平均明显升高(P均<0.05),IL-4、IL-10水平均明显降低(P<0.05);与模型组比较,肠复方组和美沙拉秦组小鼠结肠组织中TNF-α、IL-6水平均明显降低(P均<0.05),IL-4、IL-10水平升高,但差异均无统计学意义(P均>0.05);肠复方组和美沙拉秦组TNF-α、IL-6、IL-4、IL-10水平比较差异均无统计学意义(P均>0.05)。见图5。

图5 空白组和急性溃疡性结肠炎各组小鼠结肠组织中炎症因子水平
2.6结肠组织中ZO-1和Claudin-1蛋白表达情况 模型组小鼠结肠组织中ZO-1和Claudin-1蛋白相对表达量与空白组比较差异均无统计学意义(P均>0.05);肠复方组和美沙拉秦组小鼠结肠组织中ZO-1、Claudin-1蛋白相对表达量较模型组升高,但差异均无统计学意义(P均>0.05),且肠复方组和美沙拉秦组ZO-1、Claudin-1蛋白相对表达量比较差异均无统计学意义(P均>0.05)。见图6。

图6 空白组和急性溃疡性结肠炎各组小鼠结肠组织中ZO-1、Claudin-1蛋白表达情况
3 讨 论
现代医学认为UC的发病机制涉及遗传易感性、环境因素、肠道菌群紊乱、免疫反应失调、上皮屏障缺陷等,其中免疫反应失调与炎症因子调控异常密切相关,是UC发病的重要机制之一。炎症因子包括促炎因子及抗炎因子,主要由免疫细胞合成,健康状态下肠黏膜中促炎因子和抗炎因子处于平衡的稳态,病理状态下由于调控炎症因子的信号通路功能失常,导致肠黏膜促炎因子和抗炎因子之间的平衡被打破,进而出现炎症级联反应[7]。TNF-α是一种关键的促炎因子,其可促进中性粒细胞、巨噬细胞的增生、成熟和活化,进而刺激单核细胞、血管内皮细胞等产生细胞因子,从而引起级联反应,最终导致肠道的炎症损伤[8]。IL-6与TNF-α关系密切,亦是重要的促炎因子,二者激活路径相似、互相调节,共同参与UC肠道炎症与免疫调节过程[9]。IL-4与IL-10作为Th2细胞分泌的抗炎因子,可通过抑制TNF-α等多种促炎因子的合成、参与诱导Treg细胞分化等途径缓解UC肠道炎症程度[10-11]。
上皮屏障缺陷亦是UC的重要发病机制之一。紧密连接蛋白是肠道黏膜的重要组成,由不同的咬合蛋白(Occludin)、闭合蛋白(Claudin)及闭合小环蛋白(ZOs)组成,将相邻上皮细胞紧密连接,对维持肠黏膜上皮屏障功能的完整性起重要调控作用[12]。肠上皮屏障完整存在的情况下,只有少数管腔抗原能够进入固有层,此时黏膜能够耐受并阻止炎性反应的产生;但当紧密连接蛋白的调控异常,上皮屏障发生缺陷,更多的管腔抗原进入固有层,使局部免疫细胞受到足量刺激时,就会导致肠道炎症[9,13]。
近年来大量研究表明,中医药可通过修复肠道黏膜机械屏障、调控肠道微生物菌群、调节免疫反应等途径改善UC临床症状,促进黏膜愈合,改善生活质量,降低复发率等[14]。本团队根据UC活动期反复发作腹痛、腹泻伴黏液血便的临床特点,认为其主要病机为湿热蒸壅,气滞毒聚于肠腑,阻遏气机,久而化热,灼伤肠络,腐而成疡,热毒炽盛,下痢脓血。本实验所用肠复方是由芍药汤、白头翁汤、槐花散等治疗“痢疾”“便血”的经典方剂化裁而成,UC活动期应当以除肠中实邪为第一要务,故以黄连、白头翁、马齿苋、白花蛇舌草、金银花清除肠中湿热毒邪;再以白芍、赤芍、茜草、地榆炭凉血止痢,黄芪健脾益气;诸药合用以清热解毒、凉血止痢、健脾益气,共同调和肠道气血,正所谓“调气则后重自除,行血则便脓自愈”。现代药理研究表明,黄连、马齿苋、白花蛇舌草具有抗炎作用,可通过多种信号通路下调TNF-α、IL-6等促炎因子及IL-10等抗炎因子表达[15];黄芪、白芍亦能通过调节肠道免疫功能以减轻炎症损伤,还可以上调Occludin、Claudin-1、ZO-1等蛋白表达,促进肠黏膜屏障修复[16-17];茜草、地榆炭能调节免疫功能,减轻局部炎症反应[18-19]。
本实验通过3%DSS自由饮用建立小鼠急性UC,该模型与人类UC类似,除了体重减轻、腹泻及便血等典型症状外,结肠组织病理也常见UC病变特点,如远端病变较近端重、黏膜损伤较表浅等。此外,结肠长度也可以作为衡量结肠宏观炎症严重程度的指标,炎症程度高时,结肠长度缩短[20]。本研究中模型组小鼠体重减轻,伴有腹泻、便血,DAI明显升高,结肠明显缩短,结肠上皮组织损伤严重、炎性细胞广泛浸润,结肠组织中TNF-α、IL-6水平升高,IL-4、IL-10水平降低,证实DSS可成功诱导急性UC;肠复方可改善DSS诱导的急性UC小鼠的症状,降低结肠组织中TNF-α、IL-6水平,减轻结肠组织炎症程度,且其效果不劣于美沙拉秦。此外,本研究肠复方组小鼠结肠组织中ZO-1、Claudin-1蛋白相对表达量相比模型组有升高趋势,推测肠复方可能通过上调结肠黏膜紧密连接蛋白表达,从而对黏膜屏障起到保护作用,但需要进一步验证。
综上所述,肠复方可调节DSS诱导的急性UC小鼠结肠组织炎症因子表达,改善UC小鼠的症状,减轻结肠组织炎症反应,同时可能对结肠组织黏膜屏障有一定保护作用,且其作用不劣于美沙拉秦,为临床治疗UC提供了额外的选择,也为肠复方作用机制的进一步研究提供了参考,但肠复方具体通过何种信号通路对炎症因子进行调控仍不明确,需要更深层次的研究。
利益冲突:所有作者均声明不存在利益冲突。
