含紫苏油的肿瘤专用型肠内营养制剂对肺癌小鼠营养状况、免疫功能和肿瘤生长的影响
2024-05-22周金花赵燕云马双双
周金花,赵燕云,王 莹,马双双
(1. 海军军医大学附属长海医院,上海 200433;2. 上海市浦东新区光明中医医院,上海 201399;3. 盐城市第三人民医院,江苏 盐城 224005)
肺癌是全球范围内最常见的癌症类型之一,约占所有癌症病例的11.6%,也是全球癌症相关死亡的主要原因之一[1],其中吸烟、空气污染、长期接触石棉、家族遗传等是肺癌的主要危险因素[2]。早期肺癌的临床症状不典型且缺乏特异性诊断方法,大多数患者在就诊时已是癌症晚期,严重限制了治疗手段的选择且患者预后较差[3]。据报道,肺癌患者的5年生存率为10%~20%[4]。肺癌患者营养不良发生率高,约40%的肺癌患者在入院时已确定有营养不良[5],61.11%的患者在入院时已经存在营养不良的风险[6]。营养状况与肺癌患者的临床预后密切相关,因此开发安全有效的肿瘤专用型肠内营养制剂对改善肺癌患者的预后具有重大意义。紫苏是一种一年生唇形科草本植物,具有解表散寒、行气宽中和安胎的作用[7]。紫苏种子具有抗氧化、抗过敏、抗肿瘤、抗病毒等多种药理活性[8],紫苏油是从紫苏成熟种子中提取的一种高度不饱和的天然油脂,可以预防心血管疾病,抑制肿瘤的发生和发展[9]。本研究观察了含紫苏油肿瘤专用型肠内营养制剂对肺癌小鼠的营养状况、免疫功能和肿瘤生长的影响,以明确该营养制剂的作用,为其临床应用提供依据。
1 实验材料与方法
1.1实验动物 BALB/c雄性裸鼠30只,3~5周龄,体重(20±2)g, 购于上海斯莱克实验动物有限公司,动物合格证号:SCXK(沪)2017-0005。小鼠在海军军医大学动物实验中心无特殊病原体(SPF)的环境中饲养,室内温度22~24 ℃、相对湿度55%~65%,保持12∶12 h光/暗循环,小鼠自由获取饮水和食物。该动物实验已获得上海长海医院伦理委员会批准(批件号:CHEC2019-103)。
1.2实验细胞及肠内营养制剂 NCI-H460肺癌细胞(中科院上海细胞库提供)。含紫苏油肿瘤专用型肠内营养制剂(为西安力邦制药有限公司依据特殊医学用途配方食品通则设计的肿瘤全营养配方食品,主要配料为玉米油、亚麻籽油、紫苏油、中链甘油三酯、浓缩乳清蛋白粉、复合维生素、复合矿物质),每100 g提供能量509 kcal(1 cal=4.184 J);普通肠内营养制剂(安素,雅培,主要成分为蛋白质、脂肪、碳水化合物、维生素、矿物质),每100 g提供能量450 kcal。
1.3主要试剂与仪器 RPMI-1640培养基(Hyclone公司);胰蛋白酶(上海基尔顿生物科技公司);碘化丙啶(上海碧云天生物公司);超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(南京建成生物科技公司,货号分别为A001-3-2,A003-1-1,A005-1-2);苏木素、伊红(上海长岛生物技术有限公司);Fuji Dri-Chem 3500i全自动生化分析仪(Fujifilm Ltd, Japan);CX41正置显微镜(OLYMPUS,Japan); 200目的细胞网筛(北京索莱宝科技有限公司);流式细胞仪(美国BD Biosciences)。
1.4实验方法 取NCI-H460肺癌细胞,使用胰酶消化后重悬于无血清的培养基中,制备成单细胞悬液(浓度1×107个/mL),在每只小鼠右前肢肩部皮下接种0.1 mL细胞悬液。饲养1周后待皮下肿瘤可触及时,将小鼠随机分为模型组、普通肠内营养组、紫苏油肠内营养组,每组10只。模型组小鼠自由进食饮水;普通肠内营养组给予普通肠内营养制剂灌胃,紫苏油肠内营养组给予含紫苏油的肿瘤专用型肠内营养制剂灌胃,持续4周。根据先前的研究[10],普通肠内营养组和紫苏油肠内营养组小鼠每天所需的能量为731.5 kJ/kg,分4次灌胃,不限饮水。
1.5检测指标及方法
1.5.1小鼠体重 实验过程中,每3 d测量1次小鼠体重,称重时间为8:00-10:00。
1.5.2血清营养指标和免疫指标水平 末次灌胃后的次日,经小鼠眼眶后静脉丛采血0.5 mL,并通过吸入过量CO2对小鼠实施安乐死。使用Fuji Dri-Chem 3500i 全自动生化分析仪检测前白蛋白(PAB)、总蛋白(TP)、白蛋白(ALB)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)和免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白E(IgE)、白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、 转化生长因子-β(TGF-β)水平。
1.5.3肝脏组织中氧化应激标志物含量 取小鼠肝脏组织,使用匀浆机进行匀浆,按照试剂盒说明测定组织匀浆中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)含量。
1.5.4肿瘤体积和重量 实验过程中,每3 d使用游标卡尺测量1次小鼠皮下肿瘤的大小,并计算肿瘤体积[肿瘤体积(mm3)=(长×宽2)/2];实验结束后分离皮下肿瘤,称重并拍照。
1.5.5肿瘤细胞周期 将200目的细胞网筛浸泡在含有RPMI-1640培养基的6孔板中,然后将肿瘤置于细胞网筛中,使用眼科剪将组织剪碎,用2.5 mL注射器活塞的软头以打圈的方式研磨组织直至无明显组织块为止。使用PBS冲洗网筛2~3次,并将制备的细胞悬液用细胞筛网过滤。收集细胞悬液,300×g离心5 min,将细胞重悬于Binding Buffer中(浓度1×106个/mL)。加入400 μL碘化丙啶溶液(浓度为50 μg/mL),在暗处对细胞核进行染色10 min。终止染色后使用流式细胞仪检测各组细胞的DNA含量,分析细胞在各周期所占百分比。
1.5.6肿瘤组织中细胞凋亡情况 取小鼠肿瘤组织,用10%福尔马林溶液固定,梯度浓度乙醇(50%,70%,85%,95%直至纯酒精)脱水,2次纯二甲苯透明,石蜡包埋,切成5 μm厚的切片。石蜡切片脱蜡再水化,蒸馏水漂洗,苏木精染8 min,0.6%氨水反蓝,伊红染液中复染3 min。切片用无水酒精脱水,再次使用二甲苯透明,滴加中性树胶对已透明的切片进行封片,正置显微镜下观察并拍照。
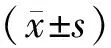
2 结 果
2.1各组肺癌小鼠的体重比较 干预第15,18,21,24,27天,紫苏油肠内营养组小鼠体重明显高于模型组和普通肠内营养组(P均<0.05),普通肠内营养组小鼠体重均明显高于模型组(P均<0.05)。见图1。
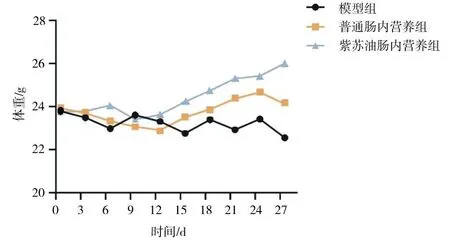
图1 肺癌各组小鼠实验过程中体重变化
2.2各组肺癌小鼠血清营养指标水平比较 普通肠内营养组血清PAB、TP、ALB、LDL-C水平均明显高于模型组(P均<0.05), 紫苏油肠内营养组血清PAB、TP、ALB、TC、TG、HDL-C、LDL-C水平均明显高于模型组和普通肠内营养组(P均<0.05)。见表1。
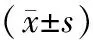
表1 肺癌各组小鼠血清营养指标水平比较
2.3各组肺癌小鼠血清免疫指标水平比较 紫苏油肠内营养组血清IgA、IgM、IgE、IL-2、IL-6、TNF-α水平均明显高于模型组和普通肠内营养组(P均<0.05),血清TGF-β水平明显低于模型组和普通肠内营养组(P均<0.05),模型组和普通肠内营养组各指标水平比较差异均无统计学意义(P均>0.05)。见表2。
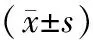
表2 肺癌各组小鼠血清免疫指标水平比较
2.4各组肺癌小鼠肝组织中氧化应激指标含量比较 紫苏油肠内营养组SOD和GSH-Px含量明显高于模型组和普通肠内营养组(P均<0.05), MDA含量明显低于模型组和普通肠内营养组(P均<0.05),模型组和普通肠内营养组SOD、GSH-Px、MDA含量比较差异均无统计学意义(P均>0.05)。见图2。
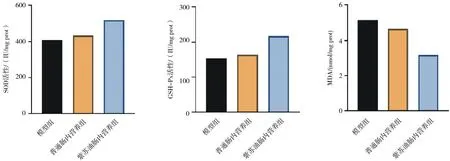
图2 肺癌各组小鼠肝脏组织中氧化应激指标含量
2.5各组肺癌小鼠肿瘤体积比较 干预第9,12,15,18,21,24,27天,紫苏油肠内营养组小鼠皮下肿瘤体积均明显小于模型组和普通肠内营养组(P均<0.05),模型组和普通肠内营养组各时间点比较差异均无统计学意义(P均>0.05)。见图3。
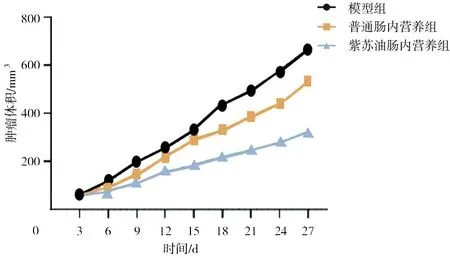
图3 肺癌各组小鼠实验过程中肿瘤体积变化
2.6各组肺癌小鼠肿瘤重量比较 紫苏油肠内营养组小鼠肿瘤重量明显低于模型组和普通肠内营养组(P均<0.05),模型组和普通肠内营养组比较差异无统计学意义(P>0.05)。见图4。
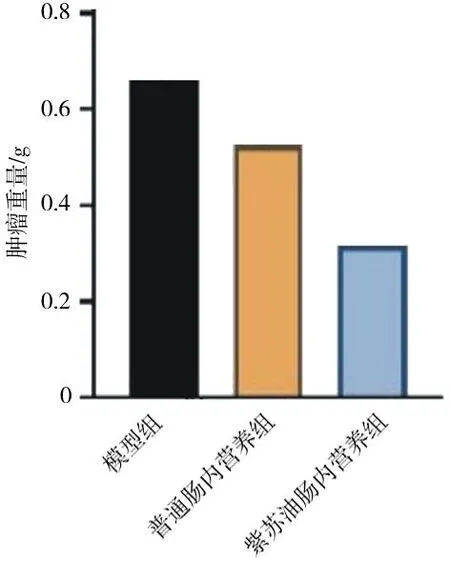
图4 肺癌各组小鼠肿瘤重量
2.7各组肺癌小鼠肿瘤细胞周期和细胞凋亡情况与模型组和普通肠内营养组相比,紫苏油肠内营养组肿瘤细胞周期进展受到抑制。见图5。

图5 肺癌各组小鼠肿瘤细胞周期情况
2.8各组肺癌小鼠肿瘤细胞凋亡情况 模型组和普通肠内营养组肿瘤组织呈实性片状分布,细胞核大深染,胞浆丰富;紫苏油肠内营养组细胞核浓缩固染,包浆呈淡红色。见图6。
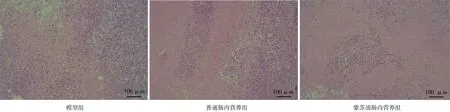
图6 肺癌各组小鼠肿瘤组织中细胞凋亡情况
3 讨 论
紫苏具有抗癌、抗氧化、抗炎、抗菌、抗过敏等广泛的药理活性,紫苏叶提取物可以降血糖、抗动脉粥样硬化[11];紫苏叶醇提取物可以抑制结肠癌和肺癌细胞增殖、迁移和黏附[12];紫苏油可以时间和浓度依赖性方式抑制乳腺癌细胞增殖并诱导细胞凋亡[13]。紫苏油肿瘤专用型肠内营养制剂是一种加入紫苏油的高脂高能量低碳水化合物配方制剂,配方中补充了多种氨基酸,如亮氨酸、精氨酸、谷氨酰胺、β-羟基-β-甲基丁酸钙等,能够促进蛋白合成并抑制蛋白降解,所含的中链甘油三酯能够快速给机体供能,紫苏油中含有的α-亚麻酸具有增强免疫力的作用。
本实验结果显示,普通肠内营养制剂对肺癌小鼠血清TC、TG、HDL-C水平影响不明显,而紫苏油肿瘤专用型肠内营养制剂可明显提高肺癌小鼠血清TC、TG、HDL-C水平,说明紫苏油肿瘤专用型肠内营养制剂主要是通过增强脂质代谢为机体提供更多的能量。在机体防御反应中,IgM作为B细胞抗原受体的主要成分参与体液免疫;IgA作为黏膜局部抗感染免疫的主要抗体参与机体的早期防御;IgE作为介导因素参与变态反应;TGF-β作为一种免疫抑制因子可以诱导肿瘤免疫逃逸,下调血清中TGF-β水平可以抑制肺癌小鼠皮下肿瘤的生长[14],抑制TGF-β的表达可以抑制肺癌细胞增殖并促进细胞凋亡[15]。本实验结果显示,普通肠内营养制剂对肺癌小鼠血清免疫指标水平均没有明显影响,而紫苏油肿瘤专用型肠内营养制剂可明显提高肺癌小鼠血清IgA、IgM、IgE、IL-2、IL-6、TNF-α水平和降低TGF-β水平,表明紫苏油肿瘤专用型肠内营养制剂可以改善肺癌小鼠的免疫功能。本实验结果还显示,普通肠内营养制剂对肺癌小鼠体重、肿瘤体积、瘤重及肿瘤组织中细胞周期、细胞凋亡影响不明显,而紫苏油肿瘤专用型肠内营养制剂可明显增加肺癌小鼠的体重,缩小皮下肿瘤体积,减轻瘤重,并抑制肿瘤组织中细胞周期,诱导细胞凋亡。上述结果提示,紫苏油肿瘤专用型肠内营养制剂可通过增加免疫球蛋白(IgA、IgM、IgE)水平和细胞因子(IL-2、IL-6、TNF-α)的释放提高机体的防御状态,同时通过减少TGF-β的释放抑制肺癌细胞增殖,进而发挥抗癌作用。
氧化应激损伤是癌症的重要危险因素之一,肝脏作为调控三大营养物质(糖、蛋白质、脂肪)代谢和抵御氧化应激损伤的重要器官在癌症治疗过程中发挥至关重要的作用。氧化氢酶(CAT)、GSH-Px、SOD是重要的抗氧化物质,而MDA作为脂质过氧化物的重要产物是诱导氧化损伤的主要物质之一[16]。有研究指出,氧化应激与肺癌细胞增殖、迁移、侵袭等细胞功能密切相关[17],通过上调小鼠肝脏中CAT和GSH-Px的含量可以提高小鼠肝脏抗氧化应激的能力,并起到保护肝脏的作用[18-19]。α-亚麻酸为紫苏油中最主要的成分,含量高达61%,大剂量紫苏油或α-亚麻酸可显著增强小鼠脑组织中SOD活力,抑制MDA的表达[20-21]。本实验结果表明,紫苏油肿瘤专用型肠内营养制剂可明显上调肺癌小鼠肝脏组织中SOD和GSH-Px含量,明显降低MDA含量,有助于肺癌小鼠抵御肝脏氧化应激损伤。
综上所述,紫苏油肿瘤专用型肠内营养制剂不仅可为肺癌小鼠提供高脂高能量营养,促进机体释放免疫球蛋白及细胞因子,提高小鼠的防御状态,减轻肝脏氧化应激损伤,还可抑制肿瘤细胞周期及诱导细胞凋亡,具有一定抗癌作用。
利益冲突:所有作者均声明不存在利益冲突。
