麦洼牦牛粪便纤维素降解菌的筛选、鉴定及产酶条件优化
2024-05-22姜立春付丹阳赵欣悦蒋道玉张雨洁宋晚晴
姜立春 付丹阳 赵欣悦 蒋道玉 张雨洁 宋晚晴


姜立春,付丹阳,赵欣悦,等. 麦洼牦牛粪便纤维素降解菌的筛选、鉴定及产酶条件优化[J]. 江苏农业科学,2024,52(7):223-230.
doi:10.15889/j.issn.1002-1302.2024.07.030
(绵阳师范学院生命科学与技术学院,四川绵阳 621000)
摘要:为从麦洼牦牛粪便中筛选出具有高纤维素降解能力的菌株,通过羧甲基纤维素钠(CMC-Na)培养基分离培养,再利用滤纸条崩解和刚果红平板透明圈试验进行初筛,将获得的菌株使用DNS法测定CMC酶活力进行复筛。根据菌体形态学观察及16S rRNA序列测定及序列同源性比较结合构建的系统发育树分析,确定该菌分类地位。结果表明,从麦洼牦牛粪便中筛选出1株酶活性为11.88 U/mL的纤维素酶产生菌株,经菌种初步鉴定该菌为溶杆菌属,命名为Lysobacter sp. MY16。以菌株MY16发酵产酶的最优培养基配方为:最适碳源蔗糖(50 g/L),最适氮源尿素(7 g/L)为基础,对其培养条件采用Plackett-Burman试验和最陡爬坡试验,结合Box-Benhnken试验响应面法分析,得出培养条件优化结果为温度41 ℃、接种量8.1%、时间21 h。在最适条件下,培养CMCase活性为36.12 U/mL,比优化前提高了2.04倍。综上可知,本研究筛选出了1株具有高CMC酶活性的菌株MY16,可为纤维素的生物高值转化提供优质的菌种资源。
关键词:纤维素降解菌;牦牛粪便;纤维素酶;单因素法;响应面优化
中图分类号:S182 文献标志码:A 文章编号:1002-1302(2024)07-0223-08
纤维素是一种非常丰富的资源,广泛存在于秸秆和畜禽类粪便等农业废弃物中。我国是世界上农作物秸秆产量最大的国家[1],秸秆可用作肥料、燃料、饲料等,具有高利用价值。但由于焚烧占比大,每年秸秆损失氮素高达20万t[2]。并且秸秆焚烧会对环境、社会及农田生态系统造成危害[3]。近年来养殖业发展迅速,随之而来的问题便是大量的畜禽粪便未得到资源化利用或无害化处理。未处理的粪污可形成有害物质,污染环境、威胁人类健康;大量粪便占用土地,制约畜禽养殖业的发展[4]。因此,纤维素高效、循环利用对于充分利用资源本身,甚至对于环境、社会等综合效益均有非常重要的意义。
纤维素是一种呈链状的高分子化合物,由D-葡萄糖以β-1,4糖苷键联结起来形成非常稳定的刚性结构,水分子、化学试剂等难以进入与之结合[5],这些特点使纤维素很难被降解利用。在过去的科学研究中,有科学家曾采用酸、碱的化学处理法[6-7]和蒸汽加热的物理处理法[8]来处理纤维素,相较于物理法和化学法而言,生物处理法因为反应条件更温和并且对环境无污染而被广泛使用。
生物法常以自然界中筛选的高效降解纤维素菌株为基础,而食草性动物的消化系统及粪便因具有较多纤维素降解功能的菌群可作为优质菌源。张智等从大熊猫粪便中筛选得到1株需氧的纤维素降解菌,初步鉴定该菌株为Paenibacillus cookii LZ033[9]。何静等从双峰驼粪便中分离筛选得到1株能够降解纤维素的纤维化纤维微菌(Cellulosimicrobium cellulans)[10]。牦牛(Bos grunniens),属于牛亚科动物,草食性反刍家畜,分布于青藏高原及其相邻高寒地区。因牦牛生活在特殊的生态环境,对高原高寒少氧、降水少、日照短、辐射强等恶劣的环境条件有极高适应性[11],形成了耐粗饲的特性[12]。所以牦牛消化道及粪便中的微生物具有极高的研究价值。聂远洋等从不同年龄的牦牛大肠内容物中分离到微需氧菌和厭氧菌共90株细菌[13]。繁萍等通过宏基因组法分析牦牛粪便中的物种DNA信息,共注释物种数8 774种,其中,注释细菌8 099个种[14]。本研究以麦洼牦牛粪便为菌源,拟筛选出1株纤维素酶活性较高的菌株,并从形态学及分子生物学上进行菌种鉴定。对该菌株培养基配方进行单因素优化,并在培养基配方优化的基础上采用Plackett-Burman和最陡爬坡试验,结合Box-Benhnken及响应面分析对其培养条件进行优化。优化产酶条件,提高产酶能力,为该菌株的应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
试验样品来自于四川省红原县天然牧场饲养的4岁龄健康麦洼牦牛的新鲜粪便。
1.1.2 培养基
羧甲基纤维素钠琼脂培养基(g/L)[JP]:CMC-Na 5.0 g、琼脂17.0 g、KH2PO4 1.0 g、NaNO3 3.0 g、KCl 0.5 g、FeSO4 0.01 g(pH值5.5~6.0)[15];牛肉膏蛋白胨(BPD)培养基:NaCl 5.0 g、牛肉膏5.0 g、琼脂18.0 g、蛋白胨10.0 g(pH值7.4~7.6);滤纸培养基:蒸馏水1 L、滤纸条(1 cm×5 cm),酵母粉3.0 g、MgSO4 0.5 g、KH2PO4 1.0 g(pH值7.0~7.2);种子培养基:蒸馏水1 L、NaCl 5.0 g、牛肉膏5.0 g、蛋白胨10.0 g(pH值7.1~7.3);液体产酶鉴定培养基:蒸馏水1 L、蛋白胨10.0 g、NaCl 4.0 g[JP]、酵母膏5.0 g、KH2PO4 4.0 g、CMC-Na 10.0 g(pH值6.8~7.4)。
1.2 试验方法
1.2.1 纤维素降解菌的分离
取1 g麦洼牦牛粪便至250 mL锥形瓶中,加入99 mL无菌蒸馏水,在30 ℃条件下振荡10 min。取5 mL菌悬液加入 95 mL 的富集培养基中富集培养3 d。将富集后的培养液逐级稀释至10-7~10-2。分别吸取 0.2 mL 10-7~10-4浓度梯度的稀释液涂布至羧甲基纤维素钠选择培养基,在30 ℃恒温培养箱中培养7 d。选择其中最适宜的稀释浓度梯度继续进行多次纯化培养,直至得到纯化的单菌落。
1.2.2 降解菌的初筛
将纯化后的菌落接种至羧甲基纤维素钠(CMC-Na)平板培养基上,35 ℃培养3 d,待菌落生长完成后,测量菌落直径(d)。覆盖质量浓度为1 mg/mL的刚果红(CR)溶液,染色30 min后,倒去CR溶液,采用0.9% NaCl溶液冲洗2~3次,测量水解圈直径(D)。计算D/d,菌株纤维素水解能力与该值呈正比[16],选出比值较高的即纤维素水解能力强的菌株。把初步分离的菌株置于种子培养基中制成种子液,35 ℃摇床振荡培养3 d后再分别接种于滤纸条培养基中,置于 30 ℃、130 r/min 恒温摇床中培养7 d,观察并记录滤纸的崩解情况,崩解程度越高说明菌株纤维素水解能力越强[17]。
1.2.3 降解菌的复筛
1.2.3.1 粗酶液的制备
将初筛得到的菌株分别接种于液体发酵培养基,在30 ℃、130 r/min条件下振荡培养5 d后,离心20 min,除去培养基及菌体残渣,收集上清液作为粗酶液,用于CMCase的活性测定。
1.2.3.2 标准曲线的制作
分别加入不同浓度(0.0、0.3、0.6、0.9、1.2、1.5、1.8 mg/mL)的葡萄糖标准液和DNS溶液2.0 mL于试管中,在100 ℃水浴中加热5 min,把溶液冷却至室温,加蒸馏水定容至10 mL,混合均匀,测定540 nm下的吸光度(D),绘制标准曲线。
1.2.3.3 酶活力测定
通过标准曲线回归方程,代入D值计算出葡萄糖浓度,再根据羧甲基纤维素酶(CMCsae)活性的测定参照标准QB 2583—2003[18]得出其CMC酶活性,选择酶活性相对较高的菌种进行后续研究。
1.2.4 菌株的鉴定
1.2.4.1 形态学观察
将最终筛选出的菌株于牛肉膏蛋白胨培养基上30 ℃恒温培养3 d,观察菌株形态。参考《常见细菌系统鉴定手册》[19]和《伯杰氏细菌鉴定手册》[20],根据菌落形状大小、颜色变化、表面状况、边缘是否光滑、菌落质地软硬、是否透明等判断菌种类型。
1.2.4.2 分子生物学鉴定
使用试剂盒提取细菌的DNA,采用16S rDNA通用引物F27和R1492进行PCR扩增,经电泳检测,将符合条件的PCR产物送至生物技术公司测序。测序完成后根据NCBI数据库中已有的序列进行同源性对比,通过MEGA 11.0软件进行系统发育分析,确定该菌株的系统发育学地位。
1.2.5 培养基单因素优化
对培养基的碳源(果糖、蔗糖、微晶纤维素、淀粉、玉米粉CMC-Na、葡萄糖、麦芽糖、乳糖)和氮源(酵母浸粉、胰蛋白胨、牛肉膏、NH4Cl、NH4NO3、(NH4)2SO4、KNO3、NaNO3、玉米粉、尿素)采用单因素法测定其对CMCase活性的影响。其中,碳源和氮源质量浓度范围分别为20、30、40、50、60、70、80 g/L和1、3、5、7、9、12 g/L,分别测定CMC酶活性。
1.2.6 响应面优化
在上述单因素优化培养基配方条件的基础上,采用Design-Expert 8.0.6软件对培养温度、接种量、装液量、转速、培养时间、初始pH值这6个产酶影响因素进行P-B试验设计,得到对产酶培养条件影响显著的因子。再通过爬坡实验确定显著影响因子的中心范围,以CMCase活性为优化目标根据B-B试验设计进行3因素3水平的响应面分析,并使用模型推测和实际相结合的最适培养條件进行3次平行试验,对模型的准确性进行验证。
2 结果与分析
2.1 纤维素降解菌的筛选
2.1.1 菌株初筛
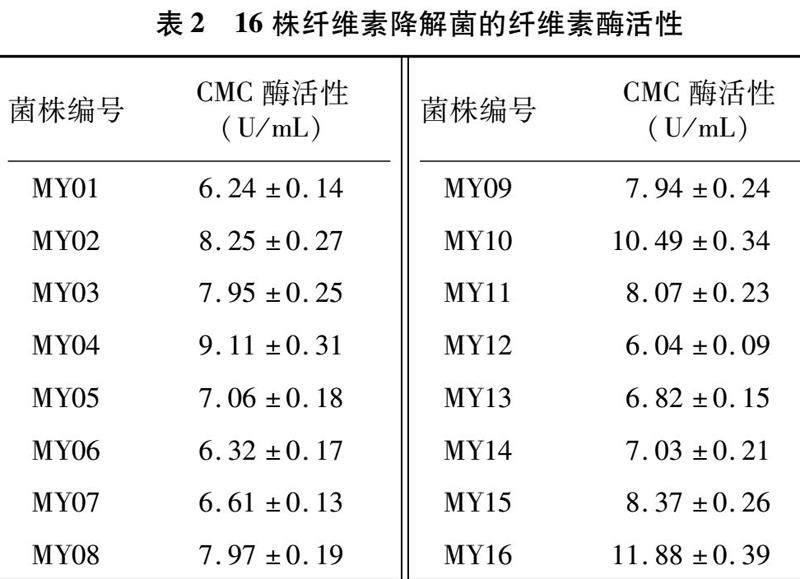
以麦洼牦牛粪便为菌源,经过富集培养与羧甲基纤维素钠培养基的初步筛选,获得16株能降解纤维素的菌株,命名为MY01~MY16。经刚果红染色法与滤纸条试验法进一步判断其是否具有产纤维素降解酶的能力及产酶能力大小。由表1可知,通过水解圈比值(D/d)大小得出16株纤维素降解菌均具有一定的纤维素降解能力,且2种不同的试验方法得出的结果具有较好相关性,总体上来说水解圈比值越大滤纸崩解情况越强。其中,菌株MY04、MY10、MY16对纤维素的作用较大,D/d>5且远大于其他菌株,在试验7 d后滤纸失去形状或直接呈糊状。
2.1.2 菌株复筛
为验证菌株产酶能力的准确性,还需要对获得的菌株使用DNS法测定CMC酶活性进行复筛。通过标准曲线数据,得到回归曲线方
程:y=0.04 383x+0.00 092(r2=0.99 902)。根据16株菌株的吸光度分别计算葡萄糖浓度,再测定其CMCase活性。由表2可知,其中,菌株MY04、MY10酶活力较高,MY16最高,为11.88 U/mL。综合上述试验结果,选MY16菌株作为后续的研究对象。
2.2 菌株的鉴定
2.2.1 形态学观察
菌株MY16在培养基上培养48 h后进行观察,发现菌落生长前期呈乳白色且形成较慢,菌落形成前后菌株开始快速生长,颜色加深并带有乳黄色。菌落形态较小,表面圆滑润湿、有突起,正反面颜色相同、稍透明,且质地柔软,与培养基结合不牢固,易被挑取。
2.2.2 分子生物学鉴定
通过对菌株MY16的16S rDNA序列同源性比对,使用MEGA 11.0软件构建系统发育树,由图1可知,菌株MY16的16S rDNA序列与溶杆菌属的同源性为99%,在系统发育树中与溶杆菌属的细菌并于一个分支。结合形态学观察,初步确定菌株MY16为溶杆菌,命名为Lysobacter sp. MY16。
2.3 单因素优化试验
2.3.1 培养基的单因素优化
以相同质量浓度的9种不同碳源配制培养基,测定CMC酶活性。由图2-a可知,在本次试验中当以蔗糖为碳源时CMC酶活性达到最高,为12.35 U/mL。因此,选用蔗糖为最适碳源。
以不同浓度的蔗糖为碳源发酵培养,测定发酵后菌液中的CMC酶活性。由图2-b可知,当蔗糖浓度为20 g/L时,CMC酶活性为4.38 U/mL。当蔗糖浓度为70 g/L时,CMC酶活性为14.27 U/mL,达最大值。在这之间酶活力随着蔗糖浓度的逐渐增大而呈波浪式上升。其浓度为80 g/L时,CMCase活性为11.35 U/mL。考虑到所用培养菌种为细菌,碳源浓度过高可能导致培养基过于黏稠,不利于菌种生长,且在50 g/L时,酶活力也达到了小高峰。因此,最适蔗糖浓度为50 g/L。
以相同质量浓度的9种不同氮源配制培养基,测定CMC酶活性。由图2-c可知,当以尿素为氮源时CMCase活性达到最高,为14.72 U/mL。因此,选用尿素为最适碳源。
以不同浓度的尿素为碳源发酵培养,测定发酵后菌液中的CMC酶活性。由图2-d可知,当尿素浓度为1 g/L时,CMCase[JP2]活性为15.95 U/mL,其浓度为 7 g/L 时的CMCase活性为23.89 U/mL,且为最大值,酶活性上升趋势较为平缓,其浓度超过7 g/L后CMCase活性缓慢下降,前后变化趋势相似,整个图像为钟罩形。因此,选用最适氮源浓度为7 g/L。
2.4 培养条件的响应面优化
2.4.1 Plackett-Burman试验
利用Design-Expert(8.0)软件对培养温度、接种量、装液量、转速、培养时间、初始pH值这6个酶活性的影响因素进行P-B试验设计(表3)。对模型方差进行分析,得到影响力的显著性排序(表4)。数据分析得到该菌株CMC酶活性的多元一次方程为:CMCase活性=26.54+1.58X1+2.09X2-0.33X3+0.42X4+1.77X5-0.16X6。该模型的R2=0.953 1,说明模型的相关性良好,得到的数据可靠。由表4可知,影响CMC酶活性的关键因素的显著性顺序为X2(接种量)>X5(培养时间)>X1(培养温度)>X4(初始pH值)>X3(装液量)>X6(转速)。其中,X1(培养温度)、X2(接种量)和X5(培养时间)为极显著影响因素(P<0.01),所以确定其为进一步优化的关键因素进行响应面分析。
2.4.2 最陡爬坡试验结果
为确定对产酶影响极显著的3个因子的试验最大響应值所在区域,逐步增大这3个因素的试验水平,采用最陡爬坡路径方法,将温度(A)、接种量(B)和时间(C)分别设置为30~50 ℃、6%~10%、16~24 h,以CMC酶活性作为判定指标。各显著因素的变化方向和试验结果,由表5可知, 试验号为2、3、4处理对应的酶活性最高,可达33.98 U/mL。综上所述,温度、接种量和时间最适范围分别为35~45 ℃、7%~9%、18~22 h。
2.4.3 Box-Benhnken响应面优化结果
通过对PB试验结果与最陡爬坡试验结果的充分分析,在逼近最大响应的区域内,以温度(35~45 ℃)、接种量(7%~9%)和时间(18~22 h)为自变量、CMCase活性为响应值进行B-B响应面优化试验,对菌株的产酶培养条件进行优化。由试验设计与结果(表6)可知,对试验数据进行多元线性回归拟合分析,得到影响CMCase活性的回归方程为:CMCase酶活力=34.95+0.90A+0.84B+2.30C+0.06AB+0.43AC+0.23BC-2.55A2-4.00B2-3.28C2。
对模型回归方程进行方差分析,结果见表7。失拟项F=0.98>0.05(不显著),P<0.000 1(极显著水平)。[JP2]根据回归方程的决定系数R2=0.987 7>[JP]0.9和校正系数R2Adj=0.971 9>0.9,可知98%数据的可变性可用此模型来解释,并且预测值与实际值间的相关性较好。综上所述,该回归模型具有较好的拟合效果,用来确定最适产酶条件是可靠的。分析回归模型可发现,交互项AB、AC、BC对CMCase活性的影响不显著,而一次项A、B、C和二次项A2、B2、C2对CMCase活性均有极显著影响(P<0.01)。由图3可知,由多元二次回归方程所做的响应曲面图及其等高线,可直观地观察各因素间对CMC酶活性的交互影响作用,由图3可知,在试验范围内,A、B、C存在极大值点。利用Design-Expert 8.0.6软件进行回归模型的优化分析,得到最优试验点为(41.05、8.12、20.74),即培养温度为41.05 ℃、接种量为8.12%、培养时间为20.74 h。在此点预测的CMCase活性可达35.513 9 U/mL。为验证以上结果,结合实际情况把培养条件优化为41 ℃、8.1%、21 h,[JP2]在最适产酶培养基配方和最适产酶培养条件下进行试验,测得CMC酶活性为36.12 U/mL,[JP]与预测值相近,并且比优化前提高了2.04倍。
3 讨论与结论
采用生物法对纤维素进行高值转化可推进资源的合理利用,对农林业的可持续发展具有深远意义[21]。国内外对纤维素降解微生物的研究正在不断深入完善,食草动物由于其食性特点,其消化系统及粪便是纤维素降解菌的优质菌株来源。牦牛作为一种在青藏高原上生长的食草动物,具有抵御恶劣环境及耐粗饲的特性。毛婷等从天祝牦牛的粪便中分离筛选出1株降解玉米秸秆的Bacillus pumilus菌株[22]。本研究以麦洼牦牛粪便为菌源,通过初筛复筛,筛选出了1株纤维素降解能力较高的菌株,命名为MY16,经形态学和分子生物学鉴定,可初步确定MY16菌株为溶杆菌属。
杨波等从鹿粪中筛选出了纤维素降解细菌A27和A36,其CMCase[JP]活性分别为0.158、0.042 U/mL[23]。崔登雪筛选分离了1株为枯草芽胞杆菌Bacillus subtils的菌株JK7,其纤维素酶活性最高可达 12.16 U/mL[24]。两者相对来说纤维素酶活较低且差别较大,除了酶活性计算方法可能存在差异,还在于菌株自身的降解能力不同及产酶条件等尚需进一步优化。对产纤维素酶发酵条件的优化,通常采用的是单因素法。曾文婷等从竹鼠肠道中分离鉴定出了1株名为枯草芽孢杆菌GL-4的纤维素降解菌,并对其培养条件采用了单因素优化法,得出其FPAase活性在温度37 ℃、pH值8.0、时间 24 h 的培养条件时最高[25]。但单因素法仅能分析单一条件对酶活力的影响,不能考察多个条件间旳交互作用,而响应面分析法能同时评价影响过程的各因素水平及其交互作用从而对过程进行优化。本研究在对MY16菌株进行培养基单因素优化的条件下,采用P-B试验筛选出影响其产酶条件的3个显著性因素,再用最陡爬坡试验法确定其最适浓度范围,最后对MY16菌株的产酶培养条件采用 B-B 响应面分析法进行优化。确定菌株MY16的最佳培养条件为温度41 ℃、接种量8.1%、时间 21 h,在最适培养基配方和最适培养条件下,CMCase活性可达36.12 U/mL,与优化前相比,提高了2.04倍。与郭晓杰的试验结果[26]相比较,本研究的酶活力优化效果更为明显。
目前,已经发现了主要有细菌、放线菌和真菌这3种类别的具有纤维素分解能力的微生物[27]。其中,细菌拥有生长速度快、耐酸碱程度高、抗逆性强的特点,使其在纤维素降解的应用上拥有巨大的应用潜力[28]。本研究筛选出了1株Lysobacter sp. MY16(纤维素分解溶杆菌MY16),为纤维素降解微生物提供了更广阔的选择。随着基因工程技术的发展,通过诱变育种的方式提高产酶能力的方法已日渐运用到菌种选育工作中。在今后的研究中,将采用诱变育种的方法对菌株进行改良,以期为农业废弃物中纤维素的降解提供更优质的菌种。
参考文献:
[1]王仁耀,王 娟,李德茂,等. 微生物降解秸秆的研究进展[J]. 应用化工,2022,51(12):3648-3651.
[2]高祥照,马文奇,马常宝,等. 中国作物秸秆资源利用现状分析[J]. 华中农业大学学报,2002,21(3):242-247.
[3]毕于运,王亚静,高春雨. 我国秸秆焚烧的现状危害与禁烧管理对策[J]. 安徽农业科学,2009,37(27):13181-13184.
[4]王如意,靳淑敏,李 伟. 畜禽粪便资源化处理技术在环境污染防治中的应用[J]. 中国动物检疫,2010,27(2):13-14.
[5]李振东,陈秀蓉,杨成德,等. 线叶嵩草内生产纤维素酶细菌分离及初步鉴定[J]. 草业科学,2014,31(1):48-55.
[6]Haykiri-Acma H,Yaman S. Effects of dilute phosphoric acid treatment on structure and burning characteristics of lignocellulosic biomass[J]. Journal of Energy Resources Technology,2019,141(8):082203.
[7]Bartos A,Anggono J,Farkas A E,et al. Alkali treatment of lignocellulosic fibers extracted from sugarcane bagasse:composition,structure,properties[J]. Polymer Testing,2020,88:106549.
[8]Montipó S,Roslander C,Camassola M,et al. Steam pretreatment of rice hulls to release fermentable saccharides:an approach to improve recovery of (hemi)cellulosic sugars through multivariate design[J]. Rice Science,2021,28(5):501-510.
[9]张 智,尹文哲,雅 男,等. 大熊猫粪便中纤维素降解菌的筛选及其产酶条件的优化[J]. 动物营养学报,2017,29(8):2817-2825.
[10]何 静,李国伟,海 勒,等. 双峰驼粪便中纤维素分解菌的筛选及酶学特性分析[J]. 西北農业学报,2019,28(11):1750-1759.
[11]李君风. 牦牛瘤胃中高效纤维素降解菌的分离、鉴定及其在青贮中的应用研究[D]. 南京:南京农业大学,2018.
[12]曹阳春,杨红建,沈博通. 高产纤维降解酶牦牛瘤胃厌氧真菌分离株的筛选与鉴定[J]. 中国农业大学学报,2010,15(3):70-74.
[13]聂远洋,邓 岳,刘戎梅,等. 不同年龄麦洼牦牛肠道菌群的分离鉴定及其群落结构的变化[J]. 中国测试,2016,42(12):53-59.
[14]繁 萍,魏聪聪,李 茹,等. 祁连藏羊牦牛粪便微生物多样性比较分析[J]. 青海畜牧兽医杂志,2022,52(5):14-17,46.
[15]贺军军,罗 萍,陈永辉,等. 甘蔗渣纤维素降解菌的筛选及鉴定[J]. 微生物学杂志,2011,31(1):39-42.
[16]张 超,李艳宾,张 磊,等. 纤维素―刚果红培养基鉴定产纤维素酶真菌的机理研究[J]. 纤维素科学与技术,2007,15(2):39-44.
[17]李日强,辛小芸,刘继青. 天然秸秆纤维素分解菌的分离选育[J]. 上海环境科学,2002,21(1):8-11.
[18]全国食品工业标委会工业发酵分委会. 纤维素酶制剂:QB/T 2583—2003[S]. 北京:中国轻工业出版社,2004:7-9.
[19]Cai M Y,Dong X Z. Manual of identification ofcommon bacteria system[M]. Beijing:Science Press,2001,364-379.
[20]Kreig N R,Holt J G,Murray R G E,et al. Bergeys manual of systematic bacteriology[M]. New York:Springer Science & Business Media,1989,89-100.
[21]左 旭. 我国农业废弃物新型能源化开发利用研究[D]. 北京:中国农业科学院,2015:6-7.
[22]毛 婷,魏亚琴,杨红建,等. 牦牛粪便中纤维素降解菌的筛选及产酶优化[J]. 中国农业大学学报,2019,24(11):106-116.
[23]杨 波,邬慧慧,荆焕松,等. 鹿粪纤维素降解细菌的筛选及堆肥应用[J]. 经济动物学报,2022,26(2):138-145.
[24]崔登雪. 产纤维素酶芽胞杆菌的筛选鉴定及产酶条件优化[D]. 哈尔滨:东北农业大学,2017:9-37.
[25][JP2]曾文婷,覃绍敏,吴健敏,等. 竹鼠肠道纤维素降解菌的分离鉴定及其产酶特性研究[J]. 动物营养学报,2021,33(7):4142-4152.[JP]
[26]郭晓杰. 纤维素降解菌的筛选鉴定及降解条件优化[D]. 山东:烟台大学,2020:43-47.
[27]许从峰,艾士奇,申贵男,等. 木质纤维素的微生物降解[J]. 生物工程学报,2019,35(11):2081-2091.
[28]Hasunuma T,Okazaki F,Okai N,et al. A review of enzymes and microbes for lignocellulosic biorefinery and the possibility of their application to consolidated bioprocessing technology[J]. Bioresource Technology,2013,135(39):513-522.
基金項目:四川省阿坝藏族羌族自治州应用技术研究与开发资金(编号:19YYJSYJ0031);四川省绵阳市应用基础研发项目(编号:17YFNY007)。
作者简介:姜立春(1977—),男,吉林梨树人,博士,教授,主要从事应用微生物方面研究。E-mail:jiang_lichun@126.com。
