饲料中添加串叶松香草对团头鲂幼鱼生长性能、抗氧化能力和脂肪代谢的影响
2024-05-20胡颂钦史秀兰迟长虹缪凌鸿董在杰
胡颂钦, 林 艳, 史秀兰, 迟长虹, 严 盈,缪凌鸿,, 董在杰,*
(1. 南京农业大学无锡渔业学院,江苏 无锡 214081;2. 中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室,江苏 无锡 214081)
随着我国水产养殖业的快速发展,水产品提供的动物蛋白占人均动物蛋白消费量的1/3 以上,为国民的粮食保障作出了重要贡献[1]。但是,水产养殖的可持续发展正面临着原料资源短缺和健康养殖两大重要问题。在大宗淡水鱼饲料中,鱼粉、豆粕、棉粕、菜粕等植物性原料是主要的蛋白来源[2]。鱼粉是饲料行业重要的原料,其蛋白含量高、氨基酸平衡且适口性好,被广泛应用于水产动物饲料配方中[3]。豆粕作为第一植物蛋白,由于其产量受种植面积的限制,我国豆粕产需缺口较大,因此严重依赖于进口。菜粕价格低廉,是水产饲料的重要原料,但由于其存在抗营养因子,影响水产动物对饲料的利用率[4]。为了避免水产动物与人争粮,寻求新饲料原料成为当前水产养殖健康发展的重要方向。
串叶松香草(Silphium perfoliatum)又名松香草,为菊科(Asteraceae)松香草属(Sliphium)植物,适应我国盐碱化、沙漠化土壤种植,具有 “不与粮争地” 的种植优势[5]。串叶松香草根系强壮、支根繁多,高度通常为2~3 m。有实心茎质、宽大叶片,叶色为深绿色。开有头状花序,形似菊芋花序,花盘直径约为2~3 cm[5]。串叶松香草中生物活性成分丰富,富含生物碱、核黄素、黄酮类和抗氧化酶等物质,具有良好的药用价值[6-7]。近年来,有关其提取物(如多糖、核黄素、黄酮等生物活性物质)的抗氧化和免疫促进的功能性研究越来越多[8-9]。在畜禽动物中,新鲜的串叶松香草可以替代目前使用的玉米青贮饲料,是一种潜在的饲料原料。因其具有产量高、草质好、适应性广、抗逆性强等特点,已成为多种动物青饲料的主要来源[10]。胡利珍等[11]用串叶松香草饲喂兴国灰鹅,能显著降低生产成本。许美解等[12]用串叶松香草替代10%、20%、30%的基础饲料饲喂特种野猪,发现20%替代组的生长性能与对照组相比无显著差异,而30%的替代会对其生长产生负效应。目前,有关串叶松香草在水产动物中的应用研究尚处空白,但已有研究报道了同类菊科植物在水产动物饲料中的应用。黄金鲤(Yamabaki ogon)饲料中添加0.04%的万寿菊(Tagetes erecta)粉能显著改善其生长性能[13]。暗纹东方鲀(Takifugu obscurus)幼鱼饲料中添加0.5%菊粉对其生长性能无负面影响,但可增强消化酶活性与非特异性免疫酶活性[14]。团头鲂(Megalobrama amblycephala)是我国特有的杂食性经济鱼类,其生长速率快、肉质鲜美,2021 年全国养殖产量达到了76.4 万t[15]。因此,本实验以团头鲂幼鱼为对象,根据其营养需求[16]和串叶松香草的营养组成,设置串叶松香草在团头鲂饲料中的添加水平分别为0%、2%、4%、6%,通过分析团头鲂幼鱼的生长、抗氧化能力等指标,评估串叶松香草作为水产动物饲料原料的可能性,为保障水产饲料行业多元化健康发展提供支撑。
1 材料与方法
1.1 实验饲料
本实验所用串叶松香草粉为串叶松香草植株茎叶风干后粉粹而成。实验饲料以鱼粉、豆粕、菜粕、棉粕为主要蛋白源,以豆油为脂肪源配制基础饲料。在此基础上,添加0%、2%、4%、6%的串叶松香草粉,配制成4 组等氮等能的饲料,分别命名为SP0、SP2、SP4 和SP6 组(饲料配方及营养组成见表1)。配方中的原料过60 目筛,逐级放大混匀后,与大豆油、水混合,制成颗粒状饲料,自然风干后,-15 °C 密封保存备用。

表1 饲料配方及营养组成Tab. 1 Formulation and proximate composition of the diets
1.2 实验鱼及养殖实验
实验期间,操作者严格遵循实验动物福利伦理规范,并按中国水产科学研究院淡水渔业研究中心学术委员会制定的规章制度执行。本实验选用来自于团头鲂良种场的 “华海1 号” (湖北武汉),首先在中国水产科学研究院淡水渔业研究中心南泉基地可控温的循环水养殖系统中暂养,暂养期间投喂商品饲料(通威,无锡)。暂养1 周后,挑选大小均一、体质健壮、初始体重为(3.85±0.50) g的团头鲂240 尾进行养殖实验。将实验鱼分到12 个可控温循环水桶(规格为φ820 mm×700 mm)中,随机分为4 个实验组,每组设定3 个重复,每个重复20 尾鱼。每日3 次(7:00、12:00 和18:00)按照总体重的3%~5%定量饲喂,使鱼体表观饱食而无饲料剩余,养殖8 周。养殖水质:水温26~28 °C,溶解氧>6.0 mg/L,pH 6.5~7.0,氨氮含量<0.10 mg/L,亚硝酸氮<0.10 mg/L。
1.3 样本采集
养殖实验结束后,禁食24 h。用丁香油快速麻醉后计数并称量总重,随后,每一养殖桶中随机捞取6 尾,测量体长并称重,用于计算生长性能和个体指数。采用1 mL 的一次性无菌注射器在尾部静脉处取血,取血液样品于抗凝管中4 °C 下静置,离心分离血浆,用于血浆生化指标测定。随后,快速剖开腹腔,将内脏团、肝脏、肠道等组织分离,再将内脏团和肝脏称重。将肝脏和肠道组织置于离心管中,-20 °C 低温保存,用于测定肝肠抗氧化指标与肠道消化酶指标。另取部分肝脏组织放入液氮低温冷冻,后将其放置-80 °C进行保存。最后,取实验鱼背部无鳞肌肉,-20 °C低温保存,进行肌肉营养成分检测。
1.4 肝脏急性氧化损伤应激实验
50% CCl4溶液按照CCl4(分析纯,天津市富宇精细化工有限公司)与橄榄油(化学纯,上海源叶生物科技有限公司) 1∶1 (体积比)配制,现用现配,并经过超微过滤确保无菌。养殖实验结束后,在各养殖桶中随机捞出12 尾实验鱼,用丁香油快速麻醉后,按照每100 g 鱼体重腹腔注射0.5 mL 50% CCl4溶液,诱导急性肝损伤。在注射CCl4溶液24 h 后,从每个养殖桶中随机捞取3 尾,采取其肝脏组织检测其抗氧化指标,并制作组织切片进行病理学观察。同时,注射后0、6、9、12、24、48、72 和96 h 统计鱼的死亡数量。
1.5 检测指标
生长指标计算 生长性能指标按以下公式进行计算:
式中,W0为鱼初始均重(g);Wt为鱼终末均重(g);t为饲喂天数(d);F为每尾鱼平均摄食饲料总量(风干基础) (g);G1为实验末鱼肝脏重(g);G2为实验末鱼内脏团重(g);Wb为每尾鱼末体重(g);L为每尾鱼末体长(cm);
常规营养成分测定 肌肉营养成分参照国标规定方法进行测定,采用常压干燥法(GB/T 6435—2014)测定水分含量,采用凯氏定氮法(GB/T 6432—2018)测定粗蛋白质含量,采用索氏抽提法(GB/T 6433—2006)测定粗脂肪含量,采用马弗炉550 °C 灼烧法(GB/T 6438—2007)测灰分含量。
血浆生化指标测定 血浆葡萄糖(glucose,GLU)、总胆固醇(cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白(high-density lipoprotein,HDL)及低密度脂蛋白(low-density lipoprotein,LDL)含量采用深圳迈瑞全自动生化分析仪(BS-400 Q2080)测定,试剂盒购自深圳迈瑞有限公司。
组织抗氧化酶活性测定 分别将肝脏、肠道样品与无菌生理盐水按质量体积比1∶9 匀浆后离心,收集上清液,制备10%组织匀浆液,用于肝脏、肠道抗氧化指标测定。过氧化氢酶(CAT)活性、超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量的测定采用南京建成生物工程研究所的试剂盒,详细测定方法见说明书。
肠道消化酶活性测定 将肠道样品与无菌生理盐水按质量体积比1∶9 匀浆后离心,收集上清液,制备10%组织匀浆液,用于肠道消化酶活指标测定。α-淀粉酶(AMS)活性、胰蛋白酶(tTPS)活性、脂肪酶(LPS)活性的测定均采用南京建成生物工程研究所的试剂盒,详细测定方法见说明书。
基因相对表达量测定 使用Trizol 法提取团头鲂肝脏组织中总RNA,用NanoDrop 2000(Thermo Fisher Scientific,美国)测定RNA 浓度和质量,选择OD260nm/OD280nm值在1.8~2.0 之间的RNA,利用PrimeScriptTMRT reagent Kit with gDNA Eraser 反转录试剂盒(TaKaRa) (大连)合成cDNA。使 用TB Green®Premix ExTaq™ Ⅱ两 步 法 试 剂盒 (TaKaRa) (大 连)进 行RT-PCR 反 应(Biorad CFX96) (美国)。荧光定量程序:95 °C 30 s,95 °C 5 s,60 °C 30 s(39 个循环);95 °C 10 s,60 °C 60 s,95 °C 10 s。基因mRNA 相对表达水平用 2-ΔΔct方法来计算。
用qPCR 测定肝脏中脂蛋白脂酶(lpl)、脂肪合成酶(fas)、过氧化物酶体增殖物激活受体α(pparα)、过氧化物酶体增殖物激活受体β(pparβ)、肝脏固醇调节元件结合蛋白1c (srebp1c)和肉毒碱棕榈酰基转移酶1a (cpt1a)的基因表达量,以团头鲂β-肌动蛋白(β-actin) (XM_048192430.1)为内参基因,引物序列见表2。引物均由上海生工生物工程股份有限公司合成。

表2 RT-PCR 的引物序列Tab. 2 Primer sequences of RT-PCR
1.6 数据分析
实验数据用SPSS 26.0 软件进行统计分析,数据均符合正态分布和方差齐性检验,采用单因素方差分析(One-way ANOVA),进行Duncan 氏多重比较检验,P<0.05 为差异显著,所有结果均以平均值±标准误表示。
2 结果
2.1 饲料中添加串叶松香草对团头鲂生长和脏器系数的影响
养殖实验期间,各组团头鲂摄食正常,无疾病和死亡现象。随着串叶松香草添加量的增加,生长性能呈下降趋势,且饵料系数上升(表3)。其中,SP2 组FBW、WGR、SGR 和FCR 与SP0 组相 比 均 无 显 著 差 异(P>0.05);SP4 组 的FBW 与FCR 与SP0 组相比无显著差异(P>0.05),而WGR、SGR 均显著降低(P<0.05);SP6 组的FBW、WGR、SGR 均显著低于SP0 组(P<0.05),且FCR 显著高于其他各组(P<0.05)。从形态学指标上看,SP0 组团头鲂幼鱼VSI 均显著降低(P<0.05),SP2 组鱼体CF 显著低于其他各组(P<0.05),各组间HSI 无显著差异。

表3 饲料中添加串叶松香草对团头鲂幼鱼生长和脏器系数的影响Tab. 3 Effects of dietary S. perfoliatum on growth and visceral index of juvenile M. amblycephala
2.2 饲料中添加串叶松香草对团头鲂幼鱼肌肉成分的影响
养殖8 周后,摄食不同实验饲料对团头鲂幼鱼肌肉中的水分、粗蛋白、粗灰分的含量无显著影响(P>0.05) (表4)。而肌肉粗脂肪随着饲料中串叶松香草添加量的增加而升高,SP4、SP6组肌肉粗脂肪含量显著高于SP0 组和SP2 组(P<0.05)。

表4 饲料中添加串叶松香草对团头鲂幼鱼肌肉成分的影响Tab. 4 Effects of dietary S. perfoliatum on muscle composition of juvenile M. amblycephala %
2.3 饲料中添加串叶松香草对团头鲂幼鱼血浆生理指标的影响
串叶松香草添加组血浆中的GLU 含量显著低于SP0 组(P<0.05) (表5)。与SP0 组相比,低水平串叶松香草的添加(SP2)对团头鲂幼鱼血浆中的TG、TC、HDL 无显著影响(P>0.05),而SP4组的TG 和LDL、SP6 组的TG、TC、LDL 及HDL与SP0 组相比均显著升高(P<0.05)。
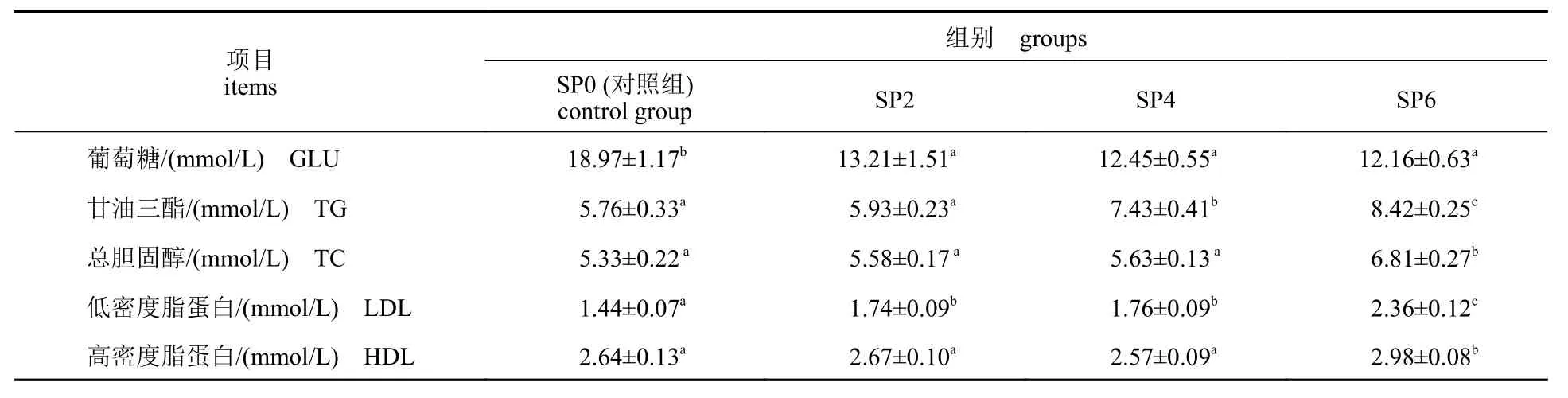
表5 饲料中添加串叶松香草对团头鲂幼鱼血浆生理指标的影响Tab. 5 Effects of dietary S. perfoliatum on the plasma biochemistry of juvenile M. amblycephala
2.4 饲料中添加串叶松香草对团头鲂幼鱼肠道消化酶和抗氧化能力的影响
团头鲂幼鱼肠道脂肪酶的活性随着饲料中串叶松香草添加量的增加而呈现降低的趋势,其中SP4、SP6 组肠道脂肪酶活性显著低于SP0 组与SP2 组(P<0.05) (表6)。各组间鱼体肠道淀粉酶与胰蛋白酶均无显著差异(P>0.05)。从抗氧化指标来看,不同实验饲料对鱼体肠道SOD、CAT 活性影响显著,SP2 组肠道中的SOD、CAT 的活性相较于SP0 组显著提升(P<0.05)。团头鲂幼鱼肠道中GSH 和MDA 含量则均不受饲料中串叶松香草添加量的影响(P>0.05)。

表6 饲料中添加串叶松香草对团头鲂幼鱼肠道消化酶和抗氧化能力的影响Tab. 6 Effects of dietary S. perfoliatum on intestinal digestive enzyme activity and antioxidant capability of juvenile M. amblycephala
2.5 饲料中添加串叶松香草对急性肝损伤后团头鲂的保护作用
养殖8 周后,对团头鲂幼鱼进行腹腔注射CCl4溶液,刺激诱导急性肝脏损伤,注射后观察并统计鱼体死亡情况(图1)。从饲料中的串叶松香草添加量来看,SP2 组的死亡率最低,SP4、SP6组的死亡率高于SP0 组。其中,注射9 h 后SP2组的死亡率趋于稳定,为22.2%~27.8%。注射96 h后,SP2 组的累计死亡率显著低于其他各组(P<0.05)。从肝脏抗氧化指标来看,饲料中添加串叶松香草饲喂8 周后(CCl4溶液注射前)对团头鲂肝脏中SOD 和CAT 活性、GSH 和MDA 含量无影响(P>0.05)。注射CCl4溶液急性损伤肝脏组织24 h后,SP2 组肝脏的超氧化物歧化酶(SOD)活性显著高于SP0 和SP4 组(P<0.05) (表7)。

图1 饲料中添加串叶松香草对50% CCl4 溶液注射后团头鲂幼鱼的累计死亡率影响不同字母表示注射96 h 后累计死亡率差异显著(P<0.05)。Fig. 1 Effects of dietary S. perfoliatum on the mortality of juvenile M. amblycephala after 50% CCl4 solution injection Different letters indicates a significant difference of mortality at 96 h post-injection (P<0.05).

表7 饲料中添加串叶松香草对四氯化碳溶液胁迫前后团头鲂幼鱼肝脏抗氧化能力的影响Tab. 7 Effects of dietary S. perfoliatum on the hepatic antioxidant capacity of juvenile M. amblycephala before and after 50% CCl4 solution injection
2.6 饲料中添加串叶松香草对团头鲂肝脏脂肪代谢相关基因表达量的影响
随着串叶松香草添加量的增加,脂质合成相关基因fas和srebp1c的表达呈上调趋势,而脂质分解相关基因lpl和cpt1a的表达量呈下调趋势(图2)。其中,SP6 组fas表达显著高于SP4 组(P<0.05),且SP4 组显著高于SP0 和SP2 组(P<0.05),而SP0 和SP2 组无显著差异(P>0.05)。SP2 和SP4组srebp1c的表达无显著差异(P>0.05),但均显著高于SP0 组(P<0.05),且均显著低于SP6 组(P<0.05)。SP2 组的lpl和cpt1a的相对表达量与SP0组相比无显著差异(P>0.05),SP6 组lpl、cpt1a相对表达量显著低于SP0 和SP2 组,SP4 组cpt1a的相对表达量显著低于SP0 和SP2 组,且显著高于SP6 组(P<0.05)。SP0 组pparβ的表达高于其他各组,且与SP2 和SP6 组差异显著(P<0.05)。各组间pparα的表达不受串叶松香草添加量的影响(P>0.05)。

图2 饲料中添加串叶松香草对团头鲂幼鱼肝脏脂肪代谢相关基因表达量的影响数据柱形标注不同字母表示组间差异显著(P<0.05)。Fig. 2 Effects of dietary S. perfoliatum on the expression of genes related to liver lipid metabolism of juvenile M. amblycephala Different letters on columns indicate significant differences between groups (P<0.05).
3 讨论
3.1 饲料中添加串叶松香草对团头鲂幼鱼生长性能的影响
渔用饲草是一种营养价值高,能满足草食性鱼类正常生长发育需求的优质新型饲料原料[17]。近年来,水产上对于渔用饲草的应用研究日益增多。饲喂新鲜黑麦草的鲂鲌杂交种的体重增加率和特定生长率均显著低于配合饲料组,但可提高鱼肉滋味值[18],草鱼(Ctenopharyngodon idella)的增重率与特定生长率随着精饲料中浮萍(Lemna minor)干粉的增加而降低[19]。这与本实验的结果类似,饲料中串叶松香草粉添加量增加至2%对团头鲂幼鱼的生长性能无影响,而当增加至6%时,增重率和特定生长率显著下降,且饵料系数显著上升。串叶松香草中的粗纤维含量较高,当串叶松香草添加量过高时可能会导致团头鲂幼鱼对饲料消化吸收能力降低,进而抑制生长。
3.2 饲料中添加串叶松香草对团头鲂幼鱼肝肠抗氧化能力的影响
氧化应激是由于机体内产生大量自由基导致的,是造成动物疾病的主要因素[20-21]。自由基为正常代谢中间产物,能氧化细胞内多种物质,破坏机体正常功能[22]。在呼吸和代谢过程中,鱼体会产生氧自由基。对机体所产生的过量自由基进行及时清理,可降低其氧化损伤程度[23]。机体抗氧化系统主要由酶促抗氧化系统与非酶促抗氧化系统共同组成,SOD 与CAT 为主要的酶促抗氧化系统,是衡量机体抗氧化能力的重要指标[24-25]。MDA 是脂质过氧化作用的最终分解产物,其含量高低可以反映机体的脂质过氧化水平[26]。本研究发现,饲料中添加2%的串叶松香草对肝脏抗氧化能力无影响,但能显著提升团头鲂幼鱼肠道的SOD 与CAT 活性。串叶松香草富含的生物碱、核黄素、黄酮类和抗氧化酶类等成分,具有抗氧化和免疫促进的功能[6-7]。在小鼠的实验中发现,串叶松香草SOD 能提高小鼠血清中SOD、CAT及GSH-Px 的活性,降低其MDA 含量[8]。在本研究中也发现,饲料中添加适量串叶松香草可使团头鲂幼鱼肠道抗氧化功能获得一定程度的强化和改善,这可能与串叶松香草中富含的SOD 有关。进一步的急性肝损伤诱导实验显示,在饲料中添加2%的串叶松香草能大大降低团头鲂幼鱼在诱导急性肝损伤后的死亡率,同时显著提升肝脏SOD 活性,并降低肝脏中MDA 的含量。急性肝损伤是短时间内由于外界因素引发的急性肝脏炎症性疾病[27]。CCl4是诱导实验动物急性肝损伤使用最广泛的化学性毒物,广泛应用于评估小鼠、畜禽、水产动物肝脏毒性和开发肝脏药物的经典模型[28-33]。串叶松香草中含有的SOD 可以通过清除CCl4在肝脏内代谢产生的大量自由基,从而增强机体抗氧化能力[10]。这也解释了在饲料中添加2%的串叶松香草能显著提升CCl4诱导肝损伤后团头鲂幼鱼的存活率与抗氧化能力。
3.3 饲料中添加串叶松香草对团头鲂幼鱼脂肪代谢的影响
一般而言,饲料脂肪水平的增加会导致肌肉粗脂肪含量增加,而饲料中粗纤维的增加可能降低肌肉粗脂肪含量[34]。有研究报道,用青饲料饲喂或饲料中添加青饲料会显著降低肌肉的粗脂肪含量,如,鲂鲌杂交种摄食新鲜黑麦草(Secale cereale)后肌肉中的粗脂肪含量显著降低[18];草鱼肌肉中粗脂肪含量随着饲料中浮萍干粉量的增加而显著降低[19]。不同的是,本研究发现饲料中串叶松香草添加量的增加(4%与6%)显著提高了团头鲂幼鱼肌肉粗脂肪含量。另一方面,从鱼体的肥满度和脏体比来看,饲料中添加串叶松香草(2%、4%与6%)会提高鱼体脏体比指数。TG 和TC 主要在肝脏中合成,是反映机体脂质代谢的重要指标[35]。血浆中TG 水平上升意味着机体脂肪沉积增加,分解代谢能力降低[36]。HDL 和LDL 在机体中起着运输TC 的作用,TC 含量增加反映了机体脂肪合成能力的提高[37]。当饲料中串叶松香草添加量为6%时,团头鲂幼鱼血浆TG、TC、HDL、LDL 均显著上升,说明饲料中添加过量串叶松香草会导致HDL、LDL 转运增加,从而促使血浆中TC 水平升高,TG 也随之上升,破坏机体脂质代谢稳态,这在肝脏脂肪代谢中也得到了印证。脂肪酶(LPS)主要作用于饲料中脂类物质的消化,肠道中脂肪酶活性增加有助于脂肪分解能力的提高[38]。本研究发现,虽然SP4 和SP6 组肌肉粗脂肪含量增加,但是团头鲂幼鱼肠道中LPS活性显著降低。已发表的研究中也有类似发现,在齐口裂腹鱼(Schizothorax prenanti)饲料中添加300 mg/kg 胆汁酸,其LPS 活性显著提高,而肌肉粗脂肪含量显著降低[39]。在黄颡鱼(Pelteobagrus fulvidraco)饲料中添加0.50%酸化剂,其肠道LPS 活性相较于未添加组显著提高,肌肉粗脂肪含量则显著降低[40],但是二者之间可能的关系及具体的发生原因仍需要进一步研究。串叶松香草中的纤维素属于非淀粉多糖,研究发现非淀粉多糖能与肠道中的脂肪酶耦联,使其活性降低[41]。因此,当其添加量为4%与6%时,团头鲂幼鱼肠道中的脂肪酶活性显著降低,说明此时肠道脂肪分解的能力降低。
肝脏是鱼类脂肪生成的重要场所,这是由于相较其他组织,肝细胞中的脂肪生成酶活性更高[42]。固醇调节元件蛋白(SREBP1c)是维持脂质稳态的关键因子,能通过调节脂肪合成中的关键酶(如FAS)来调控机体的脂肪合成[43-45],fas基因表达量直接影响FAS 活性水平,其活性升高会促进TG的合成,从而增加脂质聚积[46-47]。本实验进一步检测了鱼体肝脏中脂肪代谢调控基因mRNA 水平的表达量,发现脂肪合成相关基因srebp1c与fas的相对表达量随着饲料中串叶松香草添加量的增加而增加,说明在饲料中添加串叶松香草对脂肪的生成具有促进作用,这与本实验中血浆TG、TC 的变化趋势一致。脂肪酸的氧化供能是多种酶共同作用的结果,其中就包括LPL 与CPT1[48-49]。LPL 是脂质代谢的关键限速酶,能将TG 分解为游离脂肪酸[50-51]。棕榈脂酰肉碱转移酶A (CPT1A)是肝细胞脂肪酸β-氧化的调节酶,可促进脂肪酸的分解,调控机体脂质沉积[49,52]。本实验结果显示,随着饲料中串叶松香草的增加,团头鲂肝脏中lpl和cpt1a的相对表达量均呈显著下降趋势,同样说明饲料中串叶松香草添加量的增加会降低鱼体肝脏脂质分解的能力,最终造成机体脂质的过度沉积,这些说明饲料中添加4%和6%串叶松香草会提高肝脏脂质合成能力,同时又降低脂质分解能力,从而影响脂质代谢稳态,引起机体脂肪沉积。
4 结论
综上所述,饲料中添加2%的串叶松香草能够提高肠道的抗氧化能力,并降低鱼体由于CCl4诱导急性肝损伤的死亡,提高肝脏抗氧化应激损伤的能力。当饲料中串叶松香草的添加量增加至4%和6%,会抑制鱼体生长,并引起团头鲂幼鱼机体脂肪沉积。
(作者声明本文无实际或潜在的利益冲突)
