脑室注射葡萄糖对翘嘴鳜摄食和糖代谢的影响
2024-05-20曾妍芝李红燕王广军田晶晶龚望宝李志斐郁二蒙
曾妍芝, 李红燕,3*, 王广军,3, 谢 骏,3, 田晶晶,3, 龚望宝,3,夏 耘,3, 张 凯,3, 李志斐,3, 郁二蒙,3*
(1. 上海海洋大学,水产科学国家级实验教学示范中心,上海 201306;2. 中国水产科学研究院珠江水产研究所,农业农村部亚热带热带水产资源利用与养殖重点实验室,广东 广州 510380;3. 中国水产科学研究院海南创新研究院,海南 三亚 572000)
碳水化合物(糖)是动物重要的营养素来源,可以分解产生能量为机体生命活动供能,其代谢中间产物可转化为其他含碳化合物,进而合成氨基酸、脂肪等营养物质[1]。碳水化合物来源丰富、价格低廉,具有节约饲料蛋白质和成本、保护渔业资源和减少养殖过程中氮排泄对水环境的污染等重要作用,因而被广泛应用于水产饲料中[1-2]。然而,鱼类对饲料碳水化合物的利用能力较差,且不同食性的鱼类对饲料糖的耐受性不同[3]。相较杂食性和草食性鱼类,肉食性鱼类对饲料糖高度不耐受[4],表现为肉食性鱼类如翘嘴鳜(Siniperca chuatsi)[5]、大 口 黑 鲈(Micropterus salmoides)[6]和虹鳟(Oncorhynchus mykiss)[7]等在摄食高糖饲料后出现持续的餐后高血糖症。另外,高糖饲料养殖抑制水产动物生长,导致机体肝脏糖代谢紊乱和脂肪蓄积等负面效应[8]。
高糖饲料抑制鱼类摄食的现象在多种鱼类中均有报道,且在肉食性鱼类鳜中表现尤为明显。鳜隶属于鲈形目(Perciformes),是我国特有的本土淡水名贵鱼类。据统计,2021 年全国鳜养殖年产量37.39 万t,其中广东省鳜产量14.23 万t,为全国第一[9]。鳜食性独特,自开口起以鲜活饵料为食,难摄食死饵和人工饲料。有关鳜驯化摄食人工饲料的研究自20 世纪90 年代开始开展,目前已实现通过驯化使其摄食人工饲料[10]。人工饲料养殖鳜的推广有助于减少饵料鱼饲养带来的环境污染,降低养殖成本,提高质量安全。然而,作为典型的凶猛肉食性鱼类,鳜对饲料糖高度不耐受,由高糖饲料引起的摄食减退甚至厌食现象尤为显著,严重阻碍了鳜的生长和规模化养殖的推广[11-12]。鳜人工配合饲料养殖是当前鳜养殖产业发展的重点方向,因此解决高糖饲料诱导的厌食反应和糖利用问题是鳜产业发展亟需解决的瓶颈。
当前研究表明,鱼类的摄食行为和食欲调控是由复杂的中枢神经系统、外周器官分泌的激素及非激素信号共同组成的[13]。下丘脑是鱼类食欲和摄食行为的主要调控中心,可以感知并整合多种营养物质信号、激素和节律性信号,进而调节食欲及摄食行为[13-14]。越来越多的研究表明,鱼类存在对葡萄糖、脂肪酸和氨基酸等营养物质的感知机制[15-16]。中枢神经系统可以直接通过感知营养物质水平调控促食欲或抑食欲神经肽的表达调控摄食,并引起肝脏代谢及激素分泌的变化,进而影响鱼类的代谢[17]。因此,探究鱼类中枢神经系统对葡萄糖的感知机制是研究高糖影响其摄食的重要前提条件。
下丘脑AMPK (AMP-activated protein kinase)和mTOR (mammalian target of rapamycin)是连接机体营养物质水平感知和发挥中枢神经系统摄食调控作用的重要桥梁[18]。下丘脑葡萄糖激酶GK可以通过AMPK 信号通路发挥对摄食食欲的调控作用[19]。研究表明,禁食或低血糖机体下丘脑AMPK 被激活,进而促进促食欲神经肽NPY(neuropeptide Y) / AgRP (agouti gene-related protein),并通过抑制抑食欲神经肽POMC (Pro-opiomelanocortin) / CART (cocaine and amphetamine regulated transcript)的表达来促进摄食[20]。 脑室注射(intracerebroventricular, ICV)是探究鱼类下丘脑感应系统和食欲调节作用的重要手段。研究表明,对鳜脑室注射辛酸后4 h,下丘脑agrp的mRNA水平降低,摄食量显著减少[21]。脑室注射不同氨基酸,通过对TOR 信号通路调控作用的不同而影响鳜的摄食,表明鳜下丘脑氨基酸感知机制的存在[22-23]。哺乳动物中,大鼠(Rattus norvegicus)脑室注射葡萄糖显著抑制其摄食量[24]。另外,脑室注射葡萄糖增加小鼠(Mus musculus)下丘脑pomc和cart,降低npy和agrp的基因表达水平进而抑制摄食[25]。然而,鳜是否存在脑室葡萄糖感知系统及其如何调控AMPK和mTOR信号通路影响摄食和糖代谢的机制尚不明确。
综上,本研究以翘嘴鳜为对象,通过脑室注射葡萄糖和2-DG (葡萄糖代谢拮抗剂,2-deoxy-Dglucose),探究对鳜摄食和糖代谢的影响,验证下丘脑是否存在葡萄糖感知系统,并阐述AMPK/mTOR信号通路在食欲调控中的作用机制。研究结果将阐述鳜下丘脑葡萄糖感知系统的存在及高糖对鳜的摄食调控和糖代谢影响及机制,为鳜对饲料糖的高效利用提供理论依据。
1 材料与方法
1.1 实验鱼及暂养管理
实验所用翘嘴鳜和饵料鱼均来自广东省佛山市某鳜养殖场,实验在中国水产科学研究院珠江水产研究所养殖基地进行。实验开始前,将实验鱼放置于水泥池(4.5 m×4.5 m×1.1 m)中暂养2 周,每天表观饱食投喂饵料鱼2 次(09:00 和17:00),直至适应实验环境条件。正式实验在室内循环水系统玻璃缸(1.2 m×0.6 m×0.5 m)中进行。实验期间检测水体水质指标,其中pH 为6.5~7.8,溶解氧含量(DO) 5.7~7.6 mg/L,氨氮浓度 ≤ 0.20 mg/L,水温为28.0~33.0 °C。本研究获得了中国水产科学研究院珠江水产研究所实验动物管理和使用伦理委员会批准(LAEC-PRFRI-2022-08-58),实验过程中操作人员严格遵守中国水产科学研究院珠江水产研究所实验动物管理和使用伦理委员会伦理规范,并按照中国水产科学研究院珠江水产研究所伦理委员会制定的规章制度执行。
1.2 脑室注射实验及摄食量统计
正式实验开始前将所有实验鱼禁食24 h,挑选体表无伤、大小均一的翘嘴鳜[(209.00±6.71) g] ,使 用 麻 醉 剂(MS-222, 60 mg/L, Sigma, E10521)麻醉后进行称重。分别对鳜进行脑室注射生理盐水、高浓度葡萄糖(10 mg/kg,沪试,63 005 518)和2-DG (100 mg/kg,MedChemExpress,HY-13 966),每组设置3 个重复,每个重复10 尾实验鱼。脑室注射实验采用25 μL 量程微量注射器(1705N,Hamilton,罗马尼亚)进行,注射位置为鳜眼眶后5 mm 位置处,深度约5 mm。注射完毕后使用凡士林涂抹以避免感染,然后将鳜放入室内循环水系统玻璃缸中。脑室注射完成后,每个玻璃缸放入相同数量且体重均衡的饵料鱼[(14.60±0.38) g] ,分别于注射后3、6 和12 h 记录每缸剩余饵料鱼的数量,以统计不同处理组的饵料鱼摄食量。
1.3 样品采集
脑室注射实验后,分别于3、6 和12 h 进行解剖取样。将实验鱼用麻醉剂(MS-222,60 mg/L,Sigma,GYT0202813)麻醉后,每缸随机选取3 尾,采用肝素钠抗凝剂(0.02%,Aladdin,H123383)润洗过的无菌注射器从尾静脉取血,于无菌离心管中4 000 r/min 离心10 min 后获取上清液,保存在-80 °C 超低温冰箱。冰浴无菌条件下解剖肝脏和下丘脑组织,放入液氮速冻并于-80 °C 冰箱冷冻保存,用于后续实验分析。
1.4 血浆葡萄糖含量测定
血浆葡萄糖含量测定原理为葡萄糖氧化酶法,具体操作步骤依据试剂盒(A154-1-1,南京建成生物工程研究所)使用说明书进行。
1.5 总RNA 提取及实时荧光定量 PCR (qRTPCR)分析
使用TRIzol 法分别提取翘嘴鳜下丘脑和肝脏组织的总RNA,通过琼脂糖凝胶电泳确认RNA的纯度、完整性后于分光光度计下测定其浓度,并采用逆转录试剂盒合成cDNA。qRT-PCR 在Light Cycler®96-Time PCR Detection System (Roche,瑞士)仪器上进行。选取β-actin作为内参基因,基因相对表达水平的计算根据Pfaffl[26]的方法来计算。实验用基因引物序列如表1 所示。

表1 实时荧光定量PCR 引物Tab. 1 Primer sequences used for qRT-PCR
1.6 数据分析
本实验所有数据采用SPSS 22.0 软件进行统计分析,实验结果采用平均值±标准误(mean±SE,n=6)表示。分析方式为单因素方差分析(One-Way ANOVA),各实验组间存在显著差异时,采用Duncan 氏进行多重比较,以P<0.05 表示统计学差异显著。
2 结果
2.1 摄食量和血浆葡萄糖含量
鳜脑室注射葡萄糖和2-DG 后摄食量和不同时间点血浆葡萄糖含量如图1 所示。与对照组相比,脑室注射葡萄糖显著降低鳜摄食量(P<0.05),而脑室注射2-DG 对鳜摄食量无显著影响(P>0.05)。脑室注射后3、6 和12 h,所有处理组间血浆葡萄糖含量均无显著差异(P>0.05)。

图1 脑室注射葡萄糖和2-DG 下鳜摄食和不同时间点血浆葡萄糖水平1. 对照组,2. 葡萄糖代谢拮抗剂,3. 葡萄糖组;不同大写字母表示不同实验组间统计学差异显著(P<0.05)。Fig. 1 Food intake and plasma glucose levels in S. chuatsi after ICV administration of glucose and 2-DG at different times 1. control, 2. 2-DG, 3. glucose; different capital letters indicate significant statistical differences between different groups (P<0.05).
2.2 下丘脑基因表达
糖代谢相关基因 鳜脑室注射葡萄糖和2-DG 后不同时间点下丘脑糖代谢相关基因表达如图2 所示。研究结果显示,鳜脑室注射葡萄糖显著促进下丘脑gk(6 h)和pk(3 h)的基因表达量(P<0.05),而insra和insrb在鳜脑室注射高糖6 h表达量显著下调。脑室注射2-DG 显著抑制鳜下丘脑insra(3 h)的基因表达量(P<0.05)。脑室注射葡萄糖或2-DG 后12 h 各处理组间糖代谢相关基因表达均无显著性差异(P>0.05)。

图2 脑室注射葡萄糖和2-DG 不同时间点鳜下丘脑糖代谢相关基因相对表达量不同大写字母表示同一时间点不同实验组间统计学差异显著(P<0.05),下同。Fig. 2 Relative expression of genes involved in glucose metabolism in the hypothalamus of S. chuatsi after ICV administration of glucose and 2-DG at different times Different capital letters indicate significant statistical differences between different groups at the same time (P<0.05), the same below.
调控因子 鳜脑室注射葡萄糖和2-DG 后不同时间点下丘脑AMPK和mTOR表达量如图3所示。研究结果显示,与对照组相比,脑室注射葡萄糖提高鳜下丘脑mTOR(12 h)的基因表达量,而脑室注射2-DG 显著提高鳜下丘脑AMPK(12 h)的基因表达量(P<0.05)。在其他时间点,脑室注射葡萄糖或2-DG 对鳜下丘脑AMPK和mTOR基因表达均无显著影响(P>0.05)。

图3 脑室注射葡萄糖和2-DG 不同时间点鳜下丘脑AMPK 和mTOR 的相对表达量Fig. 3 Relative expression of AMPK and mTOR in the hypothalamus of S. chuatsi after ICV administration of glucose and 2-DG at different times
食欲基因 脑室注射葡萄糖和2-DG 后不同时间点鳜下丘脑食欲基因表达如图4 所示。研究结果显示,脑室注射葡萄糖显著提高鳜下丘脑抑制食欲基因cart(3 h) (P<0.05)。然而,脑室注射2-DG 不同时间点鳜下丘脑食欲基因表达量均无显著差异(P>0.05)。
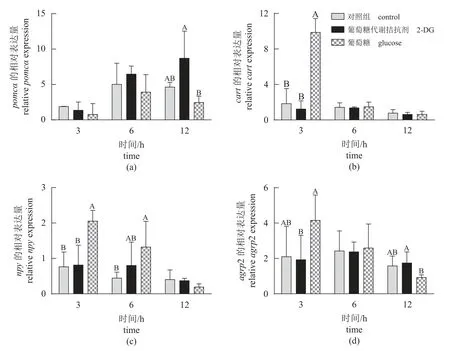
图4 脑室注射葡萄糖和2-DG 不同时间点鳜下丘脑食欲基因的相对表达量Fig. 4 Relative expression of appetite genes in the hypothalamus of S. chuatsi after ICV administration of glucose and 2-DG at different times
2.3 肝脏基因表达
糖代谢相关基因 脑室注射葡萄糖和2-DG 后不同时间点鳜肝脏糖代谢相关基因表达如图5 所示。研究结果显示,鳜脑室注射葡萄糖显著提高肝脏pk(3 h)、insra(6 h)和glut2 (3 h)的基因表达量(P<0.05)。除脑室注射2-DG 鳜肝脏gk(6 h)和glut2 (12 h)表达量显著增加外,其他时间点鳜肝脏糖代谢相关基因表达量均无显著差异。
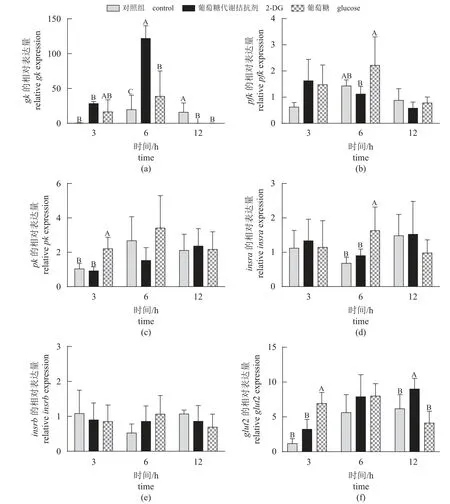
图5 脑室注射葡萄糖和2-DG 不同时间点鳜肝脏糖代谢相关基因相对表达量Fig. 5 Relative expression of glycolysis genes in the liver of S. chuatsi after ICV administration of glucose and 2-DG at different times
调控因子 脑室注射葡萄糖和2-DG 后不同时间点鳜肝脏AMPK和mTOR的相对表达量如图6 所示。研究结果显示,脑室注射葡萄糖显著上调鳜肝脏AMPK(3 h)和mTOR(6 h)的基因表达量(P<0.05)。脑室注射2-DG 显著提高AMPK在3 h 和6 h 的基因表达量,而对不同时间点肝脏mTOR的基因表达量均无显著影响(P>0.05)。
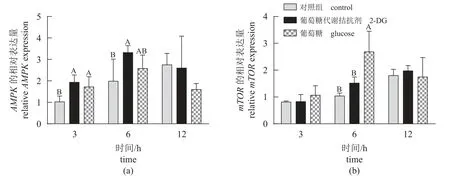
图6 脑室注射葡萄糖和2-DG 不同时间点鳜肝脏AMPK 和mTOR 的表达量Fig. 6 Relative expression of AMPK and mTOR in the liver of S. chuatsi after ICV administration of glucose and 2-DG at different times
3 讨论
碳水化合物是参与动物机体代谢的重要营养物质,而食物中碳水化合物的含量在一定程度上影响动物的摄食。高糖抑制动物摄食的现象在多种动物中均有所报道,例如哺乳动物摄食富含碳水化合物的食物会抑制餐后的食欲[27]。大鼠摄入高糖食物后2 h 内食欲受到抑制[28]。其他动物如狗(Canis lupus familiaris)在摄入高糖后摄食量也有所下降[29]。在水产动物中,相比无糖饲料,虹鳟(Oncorhynchus mykiss)摄入高糖饲料摄食量显著降低[30]。鳜作为肉食性鱼类,摄食含有8%碳水化合物水平的人工饲料时摄食量减半,甚至出现不摄食的现象[31]。另外,研究表明脑室注射葡萄糖可以显著抑制鼠的摄食[24-25]。本研究中,对翘嘴鳜进行脑室注射高浓度葡萄糖,12 h 内其摄食量显著降低,表明脑室注射高糖抑制翘嘴鳜的摄食,这与鼠的研究结果表现出一致性。另外,鱼类摄食高糖饲料对血浆葡萄糖水平具有显著影响,如虹鳟[32]、草鱼(Ctenopharyngodon idella)[33]和长吻鮠(Leiocassis longirostris)[33]。腹腔注射葡萄糖显著提高团头鲂(Megalobrama amblycephala)[34]和尼罗罗非鱼(Oreochromis niloticus)[35]血浆葡萄糖水平。然而在本实验中,脑室注射葡萄糖不同时间点鳜的血浆葡萄糖水平无显著差异,这可能是由于注射方式差异导致的。由此可见,脑室注射葡萄糖显著抑制翘嘴鳜的摄食,但其作用机制仍需进一步探究。
鱼类的葡萄糖感知系统主要由葡萄糖激酶(glucokinase, GK)、葡萄糖促进转运蛋白2 (glucose transporter 2, glut2)和ATP 依赖的内向整流钾通道(K+ATP)的典型机制驱动。GK 是机体葡萄糖感知系统的重要感受器。葡萄糖经GLUT2,被GK 感知后进入糖酵解途径,增加胞内ATP/ADP的比例,导致K+ATP的关闭并诱发细胞膜的去极化,进而诱导摄食相关神经肽的分泌、肠道激素或肝脏代谢的变化[36-37]。研究表明,虹鳟可以通过下丘脑的葡萄糖感受器GK 感知到血糖水平的高低,进而影响摄食[38]。在鳜的营养感知系统上,国内有关研究团队已经证明了鳜下丘脑存在脂肪酸和氨基酸的感知系统并发挥摄食调节功能[39-40],然而有关鳜下丘脑是否存在葡萄糖感知系统尚不明确。本研究中,脑室注射高糖显著刺激鳜下丘脑gk(6 h)和肝脏glut2 (3 h)的基因表达量,表明鳜下丘脑gk 对脑室葡萄糖水平做出响应,即鳜下丘脑可能存在葡萄糖感知系统。哺乳动物和鱼类中,AMPK 是机体能量平衡的感应器,通过响应中枢神经系统和外周组织中的激素和营养信号发挥能量感知和调控功能。下丘脑AMPK 和mTOR可以感知机体营养物质水平进而发挥中枢神经系统摄食调控作用[18]。研究表明,亮氨酸添加促使哺乳动物下丘脑mTOR的基因表达水平和磷酸化水平增加[41-42]。本实验中,鳜脑室注射葡萄糖后mTOR在下丘脑(12 h)和肝脏(6 h)中的基因表达水平显著上调,表明其可能通过促进mTOR 的表达促进机体合成代谢并影响摄食。因此,上述研究表明,鳜下丘脑gk 可对脑室葡萄糖水平做出响应,同时可能存在脑室葡萄糖感知系统,推测通过gk和glut2 对葡萄糖的感知调控mTOR 的表达,影响机体的代谢和摄食。
鱼类中枢神经系统的食欲调控主要由下丘脑弓状核ARC 区域(arcuate nucleus,ARC)共表达的促食欲神经肽Y (NPY)、神经肽刺鼠相关蛋白(AgRP)和共表达的抑食欲神经肽阿片促黑素细胞皮质素原(POMC)、可卡因和苯丙胺调节转录肽(CART)组成[43]。中枢神经系统调控这两类食欲神经肽的生成和释放,并整合机体的代谢和内分泌信号,共同调控食欲和摄食过程[43]。研究发现,虹鳟在脑室注射或腹腔注射葡萄糖后,下丘脑npy的基因表达水平降低,而cart和pomc的基因表达水平均显著升高[44-45]。食欲基因的表达与机体AMPK和mTOR表达水平密切相关。虹鳟[46]和团头鲂[47]摄食富含脂质的饲料后mTOR的表达增加并抑制食欲。在花鲈(Lateolabrax japonicas)中,下丘脑mTOR 的激活调节pomc和npy的表达[48]。本研究中,鳜脑室注射葡萄糖后下丘脑抑制食欲基因cart(3 h)基因表达显著升高,表明mTOR 的激活可能通过调控食欲基因来调控鳜的食欲,最终影响摄食。因此,脑室注射葡萄糖可能通过激活下丘脑mTOR 调控食欲神经肽表达进而抑制鳜摄食。
肝脏是动物机体中间代谢调控的重要组织器官,在鱼类糖代谢过程中发挥重要调控作用。糖酵解是糖代谢过程的重要途径,己糖激酶(HK)是糖酵解途径中的第一个限速酶,能催化葡萄糖磷酸化产生葡萄糖-6-磷酸,HK-Ⅳ也被称作葡萄糖激酶(GK)。磷酸果糖激酶(PFK)能催化果糖-6-磷酸形成果糖-1,6-二磷酸,进而由丙酮酸激酶(PK)最终催化合成丙酮酸作为其他反应的底物。在水产动物中,高糖饲料显著诱导大口黑鲈和金头鲷(Sparus aurata)等鱼类肝脏糖酵解相关基因(GK、PK和PFK)的表达和酶活性[18]。腹腔注射和灌喂葡萄糖后,牙鲆(Paralichthys olivaceus)肝脏GK和PK 活性分别在5 h 和7 h 显著升高[49]。本研究中,脑室注射葡萄糖显著提高鳜肝脏gk(6 h)和pk(3 h)的基因表达量,表明促进了机体糖酵解过程。肝脏AMPK基因表达量在脑室注射葡萄糖后3 h 显著增高,表明鳜通过促进AMPK的表达抑制合成代谢。因此,脑室注射葡萄糖对鳜肝脏合成代谢的抑制和糖酵解过程的显著增强,表明脑室葡萄糖水平的升高可以通过促进肝脏的糖酵解为机体供能,进而影响机体代谢过程。
综上所述,脑室注射葡萄糖显著抑制鳜摄食量,这一食欲抑制是通过促进下丘脑抑食欲基因cart(3 h)的表达来实现的。高糖注射显著诱导下丘脑gk(6 h)的基因表达,表明鳜下丘脑gk对脑室葡萄糖水平做出响应,其可能存在葡萄糖感知系统。下丘脑gk的激活可能通过调控mTOR的激活发挥食欲基因的调控作用。另外,脑室注射葡萄糖,对肝脏mTOR和糖酵解关键基因进行了调控,抑制合成代谢并促进糖酵解过程为机体供能进而影响机体代谢过程。本研究首次确认了鳜下丘脑gk 对脑室葡萄糖的感知响应,表明其下丘脑可能存在葡萄糖感知系统,为鳜对饲料糖的高效利用和食欲调控研究提供了理论依据。
(作者声明本文无实际或潜在的利益冲突)
