团头鲂嗅觉器官的发育及代表性嗅觉受体基因的表达模式
2024-05-20关素华王卫民
刘 宁, 关素华, 王卫民, 刘 寒
(华中农业大学水产学院,农业农村部淡水生物繁殖重点实验室,湖北 武汉 430070)
嗅觉是鱼类最重要的化学感官之一,可广泛感知各类气味信息,在鱼类摄食选择、洄游及躲避敌害中起重要作用。鱼类嗅觉器官由外鼻孔、内鼻腔、嗅囊、嗅球、嗅束及嗅神经组成[1-2]。嗅囊包含嗅基板、嗅轴及嗅囊膜[3]。不同鱼类嗅囊的位置和形态与嗅基板的数量存在差异,这被广泛应用于鱼类分类学中[4]。目前研究发现,多数真骨鱼类嗅觉器官发生发育机制相同,均在胚胎时期头部前段外胚层开始发生,左右对称发育嗅板,嗅板不断加厚,中间内凹形成嗅孔。嗅孔逐渐在底部沿着嗅轴方向形成褶皱,并在嗅轴两侧长出嗅基板,之后嗅基板开始细胞分化多类嗅觉神经元,最终发育为成熟的嗅觉器官[5-11]。
嗅觉机能在不同鱼类及不同时期中差异较大,这与嗅基板数量、嗅囊表面积、嗅觉神经元分布及嗅觉受体基因(olfactory receptor genes,ORs)的表达水平等密切相关。多数鱼类在嗅觉发育过程中,嗅基板数目和单个嗅基板隆起高度会随体长增长而增加。例如乌鳢(Channaargus)嗅囊中缺乏次级嗅基板,嗅觉机能提高主要依靠增加初级嗅基板数量和嗅基板隆起高度来增大嗅囊表面积,提高内腔使用效率[12]。研究人员对79 种鲤科(Cyprinidae)鱼类嗅囊发育过程对比发现,嗅基板数目在同种类不同体长个体间存在差异[3],如中华须鳗(Cirrhimuraenachinensis)嗅基板数目会随体长增长而增加,并在一定体长范围内保持一致[13]。
哺乳动物嗅觉信号转导通路目前研究比较透彻,气味分子首先与分布在嗅囊上的嗅觉受体结合引起细胞化学信号,进一步化学信号转导成电信号,经过神经冲动传递至嗅觉初级中枢嗅球,最终传递给大脑,形成嗅觉感知。可见嗅觉受体(olfactory receptors,ORs)参与嗅觉识别[14-15],是鱼类嗅觉产生的基础。ORs 在嗅觉神经元中表达,由体内最大的ORs基因家族编码。随着基因组计划的开展,科学家们陆续在多个物种中鉴定并发现ORs,探索基因进化与嗅觉功能的关系。2009 年,Niimura[16]基于比较基因组学的方法对23 种脊椎动物的ORs家族系统进行进化分析,将所有的嗅觉受体基因划分为a、β、γ、δ、ε、ζ、η、θ1、θ2、κ和λ共11 个亚型。其中,a和γ亚型主要在陆生动物中存在,识别空气中挥发性气味(airborne odorants);δ、ε、ζ和η亚型主要分布在鱼类,在陆生动物中缺失,识别水环境中的水溶性气味(water-soluble odorants);β亚型在陆生动物及水生动物中均存在,具有双重气味识别功能。可见,ORs基因与动物机体辨别气味的能力密切相关。
团头鲂(Megalobramaamblycephala)又称武昌鱼,隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)鲌亚科(Culerinae)鲂属(Megalobrama),主产于长江中下游,因其味道鲜香、肉质滑嫩、适应性强而成为我国重要的淡水经济养殖鱼类之一。近年来,对鱼类嗅觉器官发育的研究不断展开,但主要集中在海水鱼类,淡水鱼类嗅觉器官研究显得十分匮乏,对ORs时空表达模式变化研究也鲜有报道。因此,本研究旨在对淡水鱼类团头鲂不同时期的嗅觉器官发育进行组织学及形态学研究,并对代表性ORs的时空表达模式进行比较,共同探讨嗅觉在团头鲂的发育进程与规律,为阐明鱼类的嗅觉识别机理及配合饲料的研制和人工养殖积累理论基础。
1 研究方法
1.1 样品采集
团头鲂受精卵、仔稚鱼及成鱼均采自于湖北省华中农业大学水产学院养殖基地。在水温(26±2) °C 下养殖,24 h 曝气,每天早晚各投喂1 次,保证鱼体吃食活跃,健康无病。所有实验鱼均经华中农业大学实验动物管理委员会及实验动物伦理委员会批准。
之后采集不同时期团头鲂嗅觉组织固定样本以及RNA 样品,包括胚胎发育时期:2 细胞期、8 细胞期、32 细胞期、囊胚期、胚孔闭合期、体节形成期、嗅板期、晶体出现期、心跳期和出膜期。胚胎时期的样本经连续观察及采样获得,每个时期采3 管,每管包含20 个胚胎(表1)。仔稚鱼期:受精后的3、5、10、15、30、45 和60 d(days post fertilization,dpf);仔稚鱼期3~15 dpf 采集全鱼,每个样本采3 管,每管包含20 尾;30 dpf 后分别采集头部和尾部样本,每个样本各采3 管,每管包含10 尾;幼鱼至成鱼发育时期:3月龄、6 月龄、1 龄(12 月龄)、18 月龄、2 龄(24月龄)。此发育时期(3、6、12、24 月龄)分别采集嗅囊(OE)、嗅球(OB)、脑及肌肉4 种组织,每个时期及组织各采3 管,3 及6 月龄每管包含3 尾,12 及24 月龄鱼每管包含1 尾(表2)。各个发育时期的团头鲂采样前均用MS-222 麻醉10 min,测量记录其形态学数据和特征,采集完成的组织迅速置于液氮中冻存,然后转入-80 °C 冰箱长期保存。
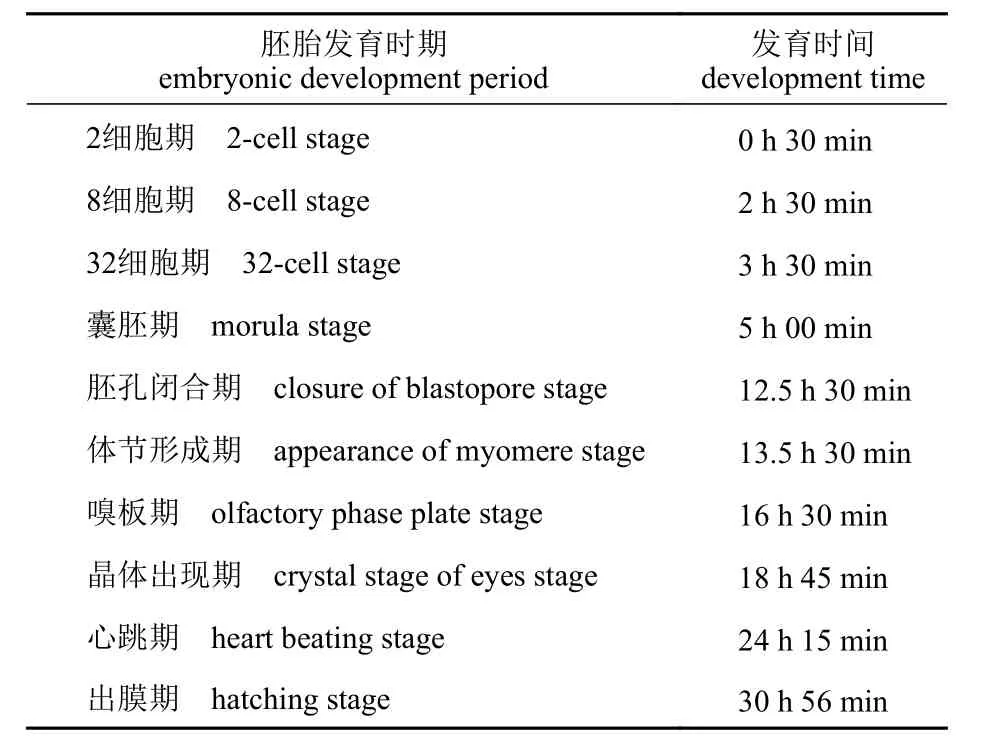
表1 不同胚胎时期发育时间Tab. 1 Development time at different embryonic stages
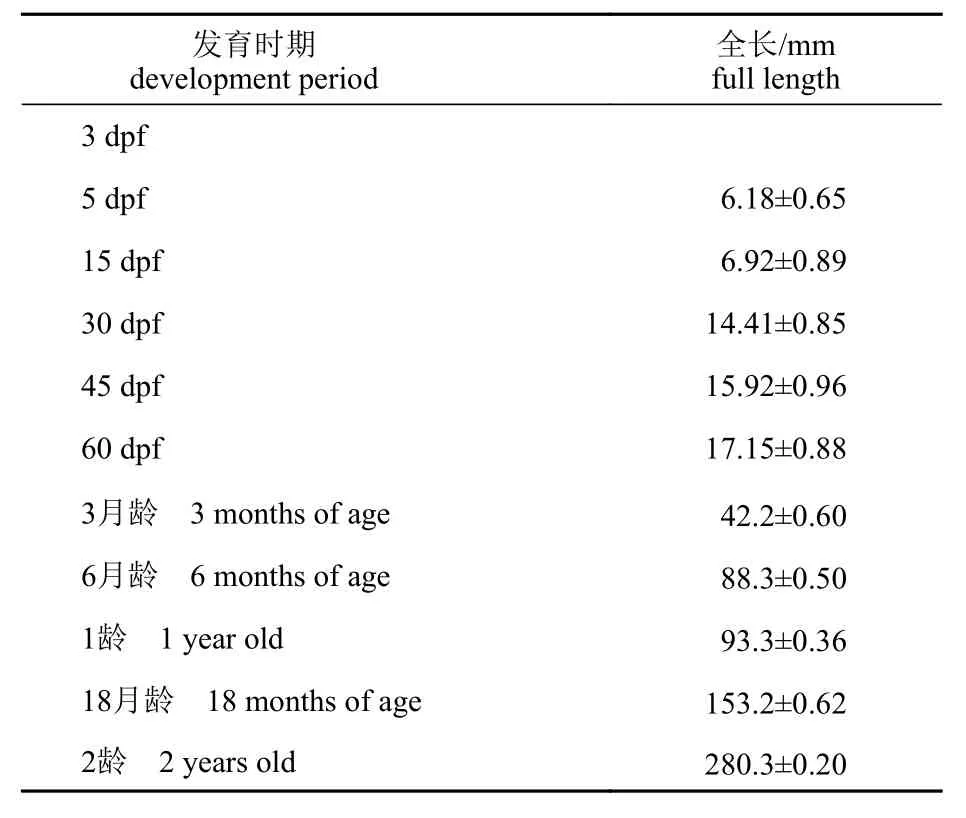
表2 仔稚鱼至成鱼期的不同发育时期的全长Tab. 2 Full length at developmental stages from juvenile to adult
1.2 解剖学观察
将实验鱼置于MS-222 麻醉10 min,之后观察鼻孔形状、位置和数量,用直尺测量其全长、体长、眼径、嗅囊长径(mm),然后剥去鼻孔周围部分皮肤,暴露嗅囊,观察嗅囊形状并用直尺测量长径,在解剖镜下对嗅基板进行观察计数,最后采集嗅囊用于组织学切片观察。
1.3 嗅囊组织学切片及染色观察
团头鲂仔稚鱼及幼鱼经多聚甲醛固定液固定24 h 后,将鱼头剪下脱钙,每隔3 d 更换1 次脱钙液,最终以尖锐镊子可刺穿骨头为界停止脱钙。之后将固定后的组织通过一系列梯度的乙醇溶液脱水,在二甲苯溶液中透明;接着将头部浸入60°C 的石蜡中按照横纵切面进行包埋。蜡块冷却后在切片机上制备切片,切片厚度5 μm。对于团头鲂成鱼,先取下头部并去掉下颌,将多聚甲醛固定液从鼻孔滴注到嗅囊腔内暂时固定0.5 h,之后剪下带骨头支撑的完整嗅囊组织块投入固定液中固定24 h 以上,使用EDTA 脱钙液慢脱约1 个月,以尖锐镊子可刺穿骨头为界,之后对组织进行脱水、透明、包埋处理,然后进行横向切片,切片厚度 6 μm。最后将符合要求的组织切片经过脱蜡、脱水、苏木精-伊红(hematoxylin-eosin staining,H.E)染色、封片后,置于光学显微镜下观察。
1.4 不同时期代表性ORs 在嗅觉组织的表达模式研究
为探讨不同时期团头鲂ORs表达模式与团头鲂嗅觉器官发育之间的关系,将本实验室前期已在全基因组中鉴定出的团头鲂223 个ORs与已明确嗅觉受体亚型物种的ORs构建系统发育树进行亚型分类鉴定[17],之后在水溶性气味识别受体β、ε亚型中各选取4 个表达量高的代表性ORs,即Beta-2、Beta-9、Beta-10、Beta-11;Epsilon-6、Epsilon-7、Epsilon-10 和Epsilon-13 (表3)。不同时期组织RNA 检测合格后,按照反转录试剂盒说明书进行cDNA 合成,应用qRT-PCR 对不同时期团头鲂代表性ORs表达水平进行分析。使用Microsoft Excel 2010 和SPSS 19.0 软件对数据进行整理统计,用 2-ΔΔct的方法[18]分析定量数据。所有数据最终以3 个独立重复实验数据的平均值±标准差(mean±SE)呈现。使用SPSS 19.0 软件对归一后的数据进行单因素方差分析(One-Way ANOVA),事后多重检验使用Scheffe 法,P<0.05 和P<0.01 分别为统计学显著性差异和极显著差异。

表3 嗅觉受体基因(ORs)引物信息Tab. 3 The sequences of the ORs primers
2 结果
2.1 团头鲂嗅觉感受系统
团头鲂成鱼侧扁,背高,嗅觉器官位于后背部和两侧眼睛前方,鼻瓣将其分为前鼻孔和后鼻孔,前鼻孔靠近嘴巴,后鼻孔靠近眼睛(图1-a~d)。嗅囊呈椭圆形,紧贴于嗅腔底部,嗅球连接于嗅囊后方,嗅基板沿着头尾方向平行排列,通过前后鼻孔与外界相通(图1-e~f)。
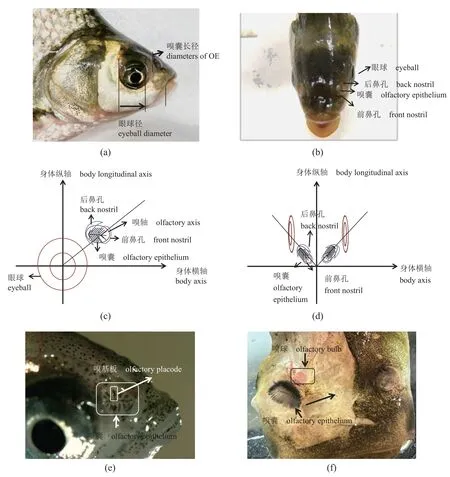
图1 团头鲂外部嗅觉器官及嗅囊外部形态Fig. 1 External olfactory organs and olfactory epithelium of M. amblycephala
2.2 团头鲂眼球径与嗅囊长径的变化
团头鲂在全长19 mm 时,嗅囊长径与眼球径的比值为0.20,在全长61 mm 时增长至0.33,全长102 mm 时未变化,全长128 mm 时略微降低为0.31,在全长为289 mm 的成鱼中为0.60,平均值为0.40,表明团头鲂嗅囊长径与眼球径的比值随体长增长而增大(表4)。
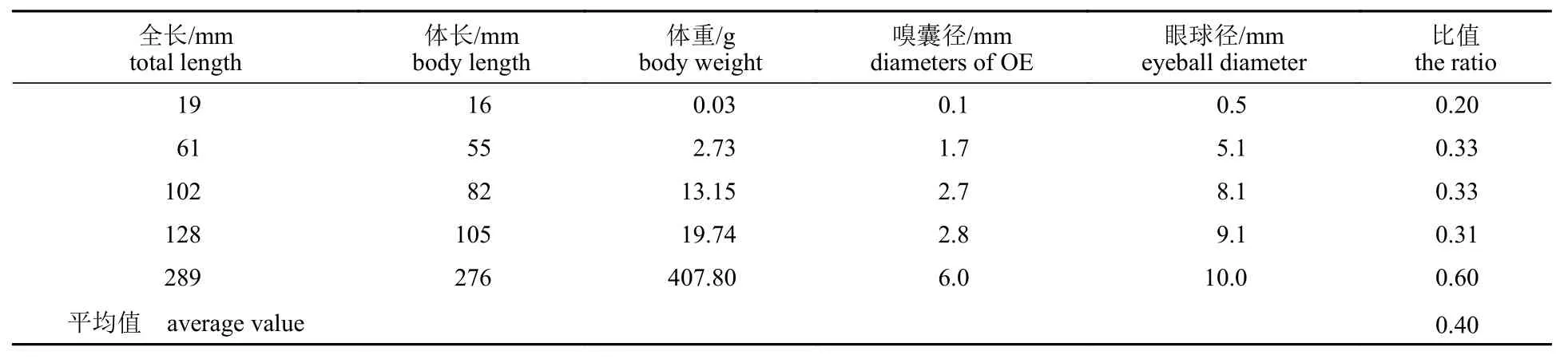
表4 团头鲂眼球径与嗅囊长径的变化Tab. 4 Changes of eyeball diameter and olfactory epithelium diameter of M. amblycephala
2.3 团头鲂的嗅囊发育组织切片染色观察
团头鲂刚孵化时,在眼前方出现嗅觉外围凹进的痕迹,凹进处很快长出嗅窝。在嗅窝顶端和底部形成向内的突起,两个突起逐渐向中心延伸至末端。在全长6.9 mm 时未出现嗅基板(图版-1),在全长9.7 mm 左右时出现1 个嗅基板(图版-2);在11.2 mm 时出现2 个嗅基板(图版-3);全长17.2~33.5 mm 出现3~5 个嗅基板(图版-4,5);全长37.1 mm 时两突起长合成隔膜(图版-6)即鼻瓣,鼻瓣把嗅窝分隔为前鼻孔和后鼻孔;全长45.2~52.0 mm 时已有11~13 个嗅基板(图版-7~9);全长85.0~87.0 mm 时约有17 个嗅基板(图版-10,11),此时的鼻瓣已完全愈合,形状变宽大,可以覆盖分隔开的前后鼻孔,并前后摆动;全长104.5 mm 有18 个嗅基板(图版-12);全长127.5 mm 有20 个嗅基板(图版-13);全长235.2 mm 有32 个嗅基板(图版-15);全长272.6 mm 有38 个嗅基板(图版-16)。整体来说,团头鲂单个嗅囊初级嗅基板随着鱼体的生长发育,排列由疏松逐渐紧密,数量逐渐增加,在成鱼趋于稳定。
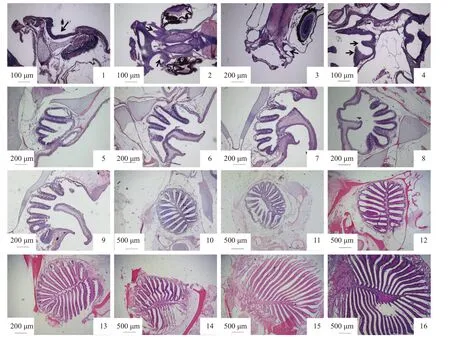
图版 不同发育时期团头鲂嗅囊切片观察Plate Observation on OE slices at different developmental stages of M. amblycephala
2.4 团头鲂嗅囊平均厚度及初级嗅基板的数量和总高度的变化
研究结果显示,团头鲂嗅囊平均厚度,仔鱼期随着初级嗅基板数量增多而减小,幼鱼期随着初级嗅基板数量增多而增大,成鱼期随着初级嗅基板数量的稳定又开始减小;团头鲂初级嗅基板隆起高度随生长发育和初级嗅基板数量增加而显著增大,特别是较大嗅基板隆起高度成倍增加,可见团头鲂嗅囊表面积随发育而显著增大(表5)。
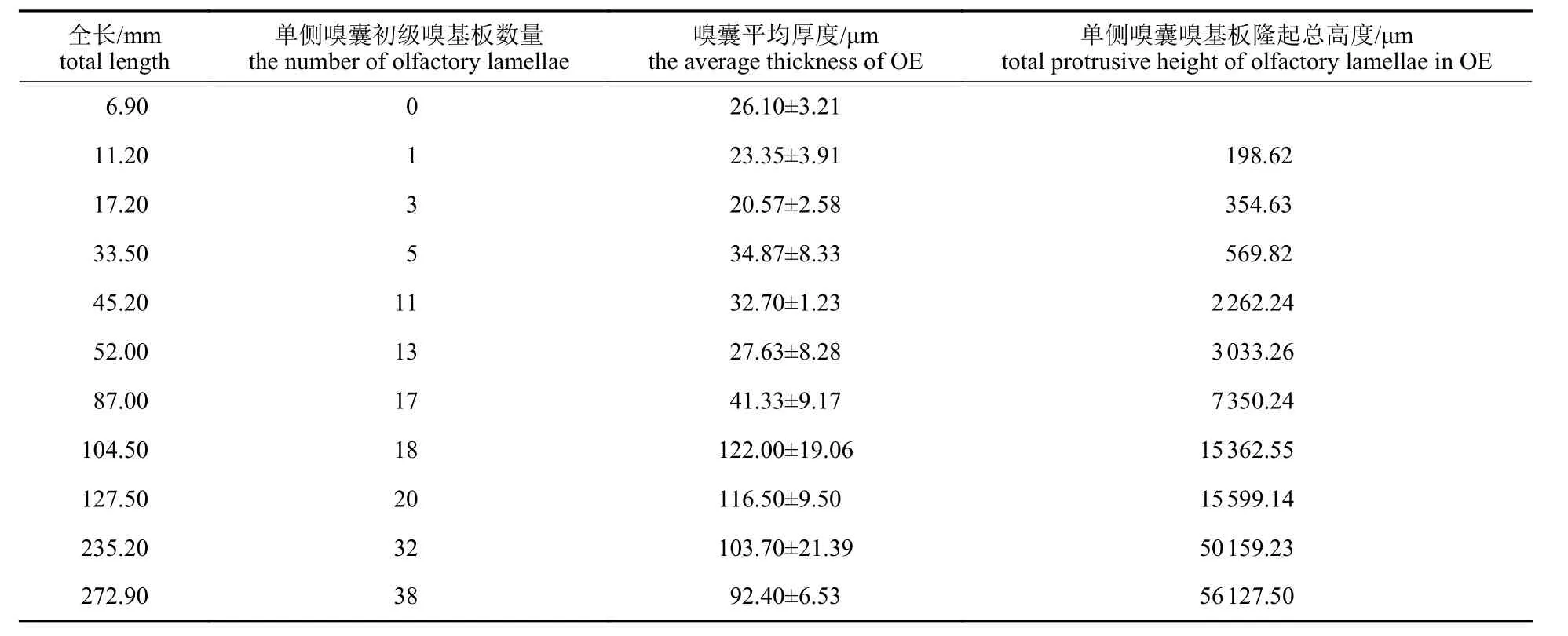
表5 不同全长团头鲂单侧嗅囊厚度、嗅基板数量及总高度的变化Tab. 5 Changes of thickness of olfactory epithelium, number and total height of primary olfactory lamellae of M. amblycephala
2.5 代表性ORs 在团头鲂不同时期的表达模式
团头鲂不同时期的ORs表达模式随着生长发育而变化。在团头鲂胚胎发育期,代表性ORBeta基因在囊胚期、胚孔闭合期及嗅板期高表达(P<0.01),在其他时期有微弱表达;此外Beta-2在晶体出现期高表达(P<0.01),Beta-9 在心跳期高表达(P<0.01);ORs-Epsilon基因仅Epsilon-6 在嗅板期、晶体期高表达(P<0.01),Epsilon-10 在32 细胞期高表达(P<0.01),Epsilon-13 在胚孔闭合期高表达(P<0.01),其他ORs在胚胎发育其他时期低表达(P<0.01) (图2,图3)。
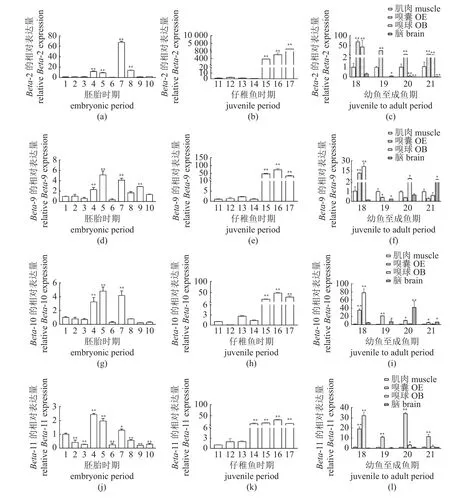
图2 团头鲂4 个OR Beta 基因在不同阶段及不同组织中的表达模式胚胎时期:1. 2 细胞期;2. 8 细胞期;3. 32 细胞期;4.囊胚期;5.胚孔闭合期;6.体节形成期;7.嗅板期;8.晶体出现期;9.心跳期;10.出膜期,2 细胞期为参考对照;仔稚鱼时期:11. 3 dpf;12. 5 dpf;13. 15 dpf;14. 20 dpf;15. 30 dpf;16. 45 dpf;17. 60 dpf,3 dpf 时期为参考对照;幼鱼至成鱼期:18. 3 月龄;19. 6 月龄;20. 1 龄;21. 2 龄,4 个时期的肌肉组织为参考对照;*代表差异显著(P<0.05);**代表差异极显著(P<0.01),下同。Fig. 2 Expression patterns of four OR Beta genes in different stages and tissues of M. amblycephala Embryonic period: 1. 2-cell stage; 2. 8-cell stage; 3. 32-cell stage; 4. blastocyst stage; 5. blastopore closure; 6. the formation of body segments; 7. olfactory lamellae stage; 8. crystal emergence stage; 9. heartbeat period; 10. membrane emergence stage, 2-cell stage as reference control; juvenile period: 11.3 dpf; 12. 5 dpf; 13. 15 dpf; 14. 20 dpf; 15. 30 dpf; 16. 45 dpf; 17, 60 dpf, 3 dpf period as the reference control; juvenile to adult period: 18. 3 months old;19. 6 months old; 20. 1 year old; 21. 2 years old, muscle tissue at the four stages as the reference control;* means significant difference (P<0.05); **means extremely significant difference (P<0.01), the same below.

图3 团头鲂4 个OR Epsilon 基因在不同阶段及不同组织中的表达模式Fig. 3 Expression patterns of four OR Epsilon genes in different stages and tissues of M. amblycephala
代表性ORs在团头鲂仔稚鱼期,包括3、5、15、20、30、45 和60 dpf 的表达模式相似。Beta-2、9、10、11 和Epsilon-7 在3、5 和15 dpf 发育时期有微弱表达,在30、45 和60 dpf 显著高表达(P<0.01);Epsilon-6 在3、5、15 及20 dpf 有微弱表达,在30 和45 dpf 发育时期高表达(P<0.01);Epsilon-10 在15 dpf 发育时期有较高表达(P<0.05),在45 和60 dpf 发育时期高表达(P<0.01);Epsilon-13 在15 和30 dpf 发育时期高表达(P<0.01) (图2,图3)。
代表性ORs在团头鲂幼鱼期至成鱼期(3、6、12 和24 月龄)的不同组织中表现出各异的表达模式变化。8 个代表性ORs,其中Beta-2、Beta-10、Beta-11、Epsilon-10 及Epsilon-13 在4 个阶段嗅囊中高表达(P<0.05),Beta-9 在3 月龄嗅囊中高表达(P<0.01),Epsilon-6 及Epsilon-7 在12 及24 月龄嗅囊中高表达(P<0.05);Epsilon-6 在4 个阶段嗅球中不表达,Beta-2、9、10、11,Epsilon-7、10、13 在3 月龄嗅球中高表达(P<0.01);Beta-2、Beta-11 在4 个阶段脑中低表达(P<0.05);Beta-9、Epsilon-6 在24 月 龄 脑 中 有 较 高 表达(P<0.05),Beta-10 在12 月龄鱼脑中高表达(P<0.01),Epsilon-7、10 在6 至24 月 龄 脑 中 高 表达(P<0.01),而Epsilon-13 仅在3 月龄脑中高表达(P<0.01) (图2,图3)。
3 讨论
不同鱼类嗅觉器官外部结构与内部构造存在差异,这与鱼类本身遗传特性、生长习性及生长环境密切相关。陈星玉[3]对79 种鲤科鱼类嗅觉发育比较研究及Pfeiffer[19]对墨西哥管鼻鲷(Hoplopagrusguentherii)嗅囊发育研究发现,同种鱼类嗅基板数目在不同体长中存在差异,即嗅基板数会随体长增长而增加。例如,鲫(Carassiusauratus)单侧嗅囊嗅基板数在体长55 mm 时为16 个,74 mm时为18 个,112 mm 时为22 个。在本研究中,团头鲂单侧嗅囊嗅基板数量也随体长增长而增加,在幼鱼期维持在20 个左右,在成鱼期维持在40个左右,与以上鱼类嗅觉器官发育规律一致。此外团头鲂嗅基板数量虽在不同体长中存在差异,但嗅囊嗅轴形态一直保持直线型,并以嗅中轴呈对称分布,在发育过程中不随生长发育而有显著变化。
有研究认为,嗅囊长径与眼径的比值大小与鱼类活动依赖嗅觉或是视觉相关。陈星玉[3]对79种鲤科鱼类的嗅觉器官研究发现,鲤科鱼类嗅囊长径一般小于眼径,比值小于1,嗅觉总体不发达。本研究中发现团头鲂成鱼嗅囊长径与眼径比值为0.6,与相同食性草鱼(Ctenopharyngodon idella)成鱼一致,属于视、嗅觉鱼类,偏向视觉。视觉虽在团头鲂与草鱼生命活动中占主导地位,但嗅觉对其在湖泊的中下层光线不强的水域寻找食物或者识别信息过程中起着重要作用。鳜(Sinipercachuatsi)为底层肉食性鱼类,其嗅囊长径远小于眼径长度,嗅觉不发达,捕食行为实验表明其主要靠视觉感受运动来攻击猎物。圆口铜鱼(Coreiusguichenoti)为底栖杂食性鱼类,其嗅囊长径是眼径的1.4 倍,视觉不发达,嗅觉发达,这是为了适应底栖生活,视觉逐渐退化的结果。由此说明,鱼类嗅觉器官的发达程度与鱼类自身的生活习性和生存环境密切相关。
嗅觉系统发育有多个阶段,如嗅基板发育、嗅觉感觉细胞分化与成熟及各类嗅觉器官的发育等。值得注意的是,ORs并不是在嗅觉系统发展完全才能发挥作用[20]。事实上,鱼类嗅囊由胚胎发育时期的嗅板发育而来,由各种细胞迁移和聚集形成[21]。团头鲂代表性ORs,包括Beta-2、9、10、11,主要在胚胎时期的嗅板期显著高表达(P<0.01),推测ORs-Beta类基因可能参与嗅板发育的过程。Wang 等[22]对鲤胚胎进行转录组分析,发现大部分ORs在原肠后期表达,推测这种表达模式与嗅基板的形成发生相关。团头鲂嗅基板上以中央对称分布着纤毛神经元、微绒毛神经元、隐窝神经元及其他非受体细胞[23]。仔稚鱼及幼鱼发展到成鱼时期的过程中,神经元数量会随嗅基板数量的增加而增加,即仔稚鱼及幼鱼与成年的团头鲂相比,神经元数量远低于成鱼的分布密度,这解释了仔稚鱼前期ORs仅有微弱表达,而在后时期高表达,说明ORs在团头鲂的嗅觉神经元分化与成熟进程中发挥着重要作用。大部分代表性ORs,包 括Beta-2、10、11 及Epsilon-10、13 在3~24 月龄鱼的嗅囊中高表达(P<0.05),这与本实验室前期研究结果一致[17],说明在不同发育时期,ORs主要表达的部位均在嗅囊中,这为进一步探究ORs的功能提供理论支持,并为其他鱼类ORs的研究奠定基础。
(作者声明本文无实际或潜在的利益冲突)
