超快速冷却对生鲜羊肉中糖酵解酶表达量的影响
2024-05-20摆玉蔷吴赛赛侯成立李金活张德权
摆玉蔷,任 驰,吴赛赛,方 菲,侯成立,2,李 欣,2,*,李金活,张德权
(1.中国农业科学院农产品加工研究所,农业农村部农产品质量安全收贮运管控重点实验室,北京 100193;2.中国农业科学院农产品加工与营养健康研究院(沧州),河北 沧州 061019;3.河北金宏清真肉类有限公司,河北 定州 073000)
生鲜肉在宰后加工、贮藏、流通等过程中发生的品质劣变造成了肉类资源的巨大浪费、环境污染和经济损失[1]。由于僵直前的肉味道鲜美,在中国的消费市场中受到消费者广泛欢迎[2-3]。然而如何在减少经济损失的同时保持僵直前的肉品质,成为肉类产业关注的重点和难点。
糖酵解是宰后重要的生理生化过程,在宰后肌肉到肉的转变过程中发挥着重要的作用[4]。随着糖酵解的进行,ATP含量和pH值降低导致肌肉僵直[5]。糖酵解酶是糖酵解过程的核心[6],其表达量与肉品质密切相关。在不同嫩度、肉色和持水力的肉中,磷酸甘油酸激酶(phosphoglycerate kinase,PGK)的表达量差异显著[7],葡萄糖磷酸变位酶可能是糖酵解酶中丰度与肉品质关系最紧密的蛋白[8]。作为糖酵解途径的关键酶之一,烯醇化酶与肉的嫩度[9]和颜色[10]密切相关。糖酵解酶的丰度在不同类型的肌肉中也存在显著差异[11]。根据糖酵解酶在不同品质肉和不同部位肉中表达量的差异,丙酮酸激酶、PGK、磷酸葡萄糖变位酶、烯醇化酶、肌球蛋白结合蛋白C、肌球蛋白调节轻链2和肌钙蛋白I可以作为表征和预测羊肉品质特征的强有力生物标志物[11]。
冷却是宰后生鲜肉必须经历的环节,超快速冷却凭其高效的冷却效果受到广泛关注[12]。超快速冷却是指在宰后5 h内将肌肉的中心温度快速降温至-1 ℃的过程[13]。超快速冷却既可通过抑制胴体表面嗜冷细菌的数量保持肉品新鲜度[14],又可以保持肉品质。处于僵直前状态的羊肉经过超快速冷却处理后剪切力减小,肌原纤维小片化指数升高[15]。超快速冷却处理促进骨架蛋白降解,改善嫩度[15]。超快速冷却处理包括降温和贮藏两个环节,不同的降温速率和贮藏温度糖酵解进程均存在差异。其中较快的降温速率通过影响糖原磷酸化酶(glycogen phosphorylase,PYGM)、磷酸果糖激酶(phosphofructokinase,PFKM)、PGK、磷酸果糖异构酶和醛缩酶(aldolase,ALDOA)等多种糖酵解酶的磷酸化和乙酰化,延缓糖酵解过程,从而改善肉品质[12]。研究表明,与25、15 ℃和4 ℃贮藏相比,-1.5 ℃贮藏能够显著抑制肉中肌浆蛋白磷酸化水平和pH值下降速率[16]。总地来说,超快速冷却通过影响宰后肉的僵直进程改善肉品质。因此,本研究分析不同超快速冷却条件对5 种糖酵解关键酶(PYGM、ALDOA、PFKM、PGK和磷酸丙糖异构酶1(triosephosphate isomerase 1,TPI1))表达量的影响,旨在探究超快速冷却通过糖酵解调控肉品质的机理。
1 材料与方法
1.1 材料与试剂
降温速率实验用小尾寒羊背最长肌购自河北金宏清真肉类有限公司;超快速冷却结合贮藏温度实验用小尾寒羊背最长肌购自北京二商穆香源清真肉类有限公司。
蛋白酶抑制剂、磷酸酶抑制剂 瑞士Roche公司;BCA蛋白浓度测定试剂盒 美国Thermo Fisher Scientific公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜美国Millipore公司;增强型化学发光(enhanced chemiluminescence,ECL)显色液 美国Bio-Rad公司;PYGM抗体 中国博奥森生物技术有限公司;ALDOA抗体、TPI1抗体、PGK抗体 美国Proteintech公司;PFKM抗体、辣根过氧化酶标记的羊抗鼠免疫球蛋白(immunoglobulin,Ig)G 武汉爱博泰克生物科技有限公司;全蛋白提取试剂盒、葡萄糖含量、糖原含量和乳酸含量试剂盒 北京索莱宝科技有限公司;异丙醇、甲醇、乙醇(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
Mini-PROTEAN Tetra电泳槽、Mini Trans-Blot转膜设备、ChemiDocTMMP成像系统 美国Bio-Rad公司;JYH-103恒温恒湿培养箱 上海跃进医疗器械有限公司;Ultra Turrax Disperser S25分散器 德国IKA公司;205便携式pH计 德国Testo公司。
1.3 方法
1.3.1 样品处理
降温速率实验:选择30 只生长发育水平一致的7 月龄小尾寒羊,屠宰后立即取双侧背最长肌,随机分成3 组,在宰后1 h放置在不同的冷却温度中。对照组:样品在0~4 ℃冷却间冷却(降温速率:4.8 ℃/h);降温处理组1:样品在-20 ℃冷冻库(降温速率:23.0 ℃/h)中冷却至样品中心温度-1 ℃时转至-1~0 ℃恒温培养箱中;降温处理组2:样品在-35 ℃冷冻库(降温速率:25.1 ℃/h)中冷却至样品中心温度-1 ℃时转至-1~0 ℃恒温培养箱中[12]。分别在宰后1 h、6 h、12 h、1 d、3 d和5 d留样,液氮速冻。
超快速冷却结合贮藏温度实验:选取30 只生长发育水平一致的7 月龄小尾寒羊,屠宰后立即取双侧背最长肌,在宰后1 h内置于-35 ℃冷冻库中,宰后90 min肉的中心温度稳定在4 ℃,降温处理结束(平均降温速率:22.1 ℃/h)。降温完成后样品随机分为3 组,分别放置在4(冷藏)、-1.5 ℃(冰温)和-4 ℃(超冰温)贮藏。分别在贮藏0 h、2 h、12 h、1 d、3 d和5 d留样,液氮速冻。
1.3.2 pH值测定
便携式pH计探头插入肌肉中的深度为2 cm,连续测定3 次,结果取平均值。
1.3.3 蛋白质提取
取0.5 g背最长肌,加入6 倍体积的全蛋白提取液[12,17]。冰上匀浆,室温孵育2 min,15 000×g离心2 min后取上清液。利用BCA法调节蛋白质浓度,与等量上样缓冲液混合后沸水浴5 min。
1.3.4 葡萄糖含量测定
利用葡萄糖含量试剂盒测定,取约0.1 g背最长肌组织,加入1 mL蒸馏水,匀浆,沸水浴10 min,冷却至室温后8 000×g离心10 min,取上清液。加入工作液后涡旋混匀,于37 ℃恒温培养箱反应15 min后,于505 nm波长处测定吸光度。
1.3.5 糖酵解潜力(glycolytic potential,GP)测定
利用试剂盒测定糖原和乳酸含量,根据下式计算GP[18-19]:
1.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和蛋白免疫印迹
采用10%的分离胶和4%的浓缩胶,样品上样量20 μg[12]。电泳初始电压为70 V,随后调整为110 V。当溴酚蓝指示带距离凝胶底部0.5 cm处停止电泳。电泳结束后,将凝胶上的蛋白质转移到PVDF膜上(100 V,150 min)。转膜后,用Tris含吐温-20缓冲盐溶液(Tris buffered saline with Tween-20,TBST)(137 mmol/L氯化钠、20 mmol/L Tris、0.1% 吐温-20,pH 7.6)洗涤、封闭液(5%脱脂牛奶,溶剂为TBST溶液)封闭、一抗(稀释倍数1 000)孵育过夜、TBST溶液洗涤、二抗(稀释倍数1 000)室温孵育80 min、TBST溶液洗涤、ECL显色后成像。用Quantity One软件分析图像,以单个蛋白的灰度值与全蛋白的灰度值之比表示糖酵解酶的表达量。
1.4 数据分析
利用SPSS 21.0软件进行统计学数据分析。采用一般线性方程分析不同温度条件对pH值和糖酵解酶表达量的影响;采用最小显著性差异法进行差异显著性分析(P<0.05);利用多元线性回归计算相关系数。
2 结果与分析
2.1 降温速率对糖酵解进程的影响
2.1.1 降温速率对糖酵解代谢物的影响
由图1可知,在宰后6 h~3 d,降温处理组2的pH值最高;在宰后6 h和1~3 d,对照组的pH值显著低于其他处理组(P<0.05)。在宰后贮藏过程中,不同处理组的pH值均下降,对照组pH值在宰后3 d达到极限,降温处理组在宰后5 d达到极限。在宰后6~12 h内,对照组和降温处理组1的葡萄糖浓度无显著差异(P>0.05),均显著低于降温处理组2。不同处理组的葡萄糖含量随宰后时间的延长逐渐上升,宰后1 d后趋于稳定。宰后1 h之后降温处理组2的GP显著低于其他两个处理组。对照组和降温处理组1的GP在宰后1 d内上升,随后趋于稳定。降温处理组2的GP在宰后5 d内无显著差异。
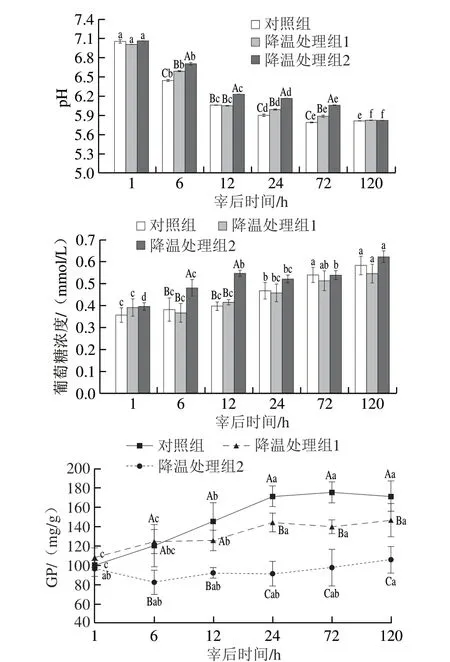
图1 不同降温速率处理肉中pH值、葡萄糖浓度和GP在宰后不同时间的变化Fig.1 Changes in pH,glucose content and glycolytic potential in meat with different chilling rates at different times postmortem
随着宰后时间延长,糖酵解过程生成的乳酸和ATP水解生成的氢离子积累,导致pH值下降[20]。葡萄糖通过转化生成葡萄糖-1-磷酸为宰后糖酵解过程提供底物,同时糖原和一些大分子糖类转化生成葡萄糖[21-22]。肌糖原贮存和糖原降解为葡萄糖相关的代谢过程和分子过程影响宰后肌肉转化为肉的生化过程,特别是pH值下降速率的影响[23-24]。葡萄糖含量升高是由于转化生成的葡萄糖多于糖酵解过程的消耗量,这与先前研究结果一致[21]。因此降温处理组2中较高的葡萄糖含量可能是由于葡萄糖消耗慢、转化生成量较高或者两者共同作用。与对照组相比,降温处理延缓了pH值的下降和葡萄糖的消耗,但并没有改变肉中的极限pH值和葡萄糖含量,因此宰后1~5 d内葡萄糖和糖原均是糖酵解的底物。有研究表明,宰后1~5 d内不同处理组葡萄糖含量无显著差异,糖原含量显著下降[12],因此宰后1~5 d内降温处理组糖酵解的底物可能是以糖原为主。GP可以更好地体现从肌肉到肉转化过程中能量变化的能力,反映通过糖酵解可以转化为乳酸的底物含量和产生的乳酸含量[19]。在糖酵解过程中,一分子糖原或葡萄糖生成两分子乳酸[25]。与对照组和降温处理组1相比,贮藏过程中降温处理组2中GP变化不显著,表明糖原经糖酵解生成乳酸的过程处于动态平衡[26]。降温处理后生鲜肉中的GP显著低于对照组(P<0.05),再次表明降温处理延缓了宰后糖酵解的进程。
2.1.2 降温速率对糖酵解酶表达量的影响
由图2可知,在宰后贮藏过程中,降温处理组2显著上调PYGM、ALDOA和TPI1的表达量,下调PFKM和PGK的表达量。降温处理组1下调了PFKM和ALDOA的表达量;对照组和降温处理组1对PYGM、TPI1和PGK表达量的影响基本一致。随着宰后时间的延长,PYGM和PFKM的表达量逐渐上调,其他3 个酶的表达量先上升后下降,在12 h~1 d达到峰值。


图2 不同降温速率处理肉中ALDOA、PFKM、PGK、PYGM和TPI1表达量在宰后不同时间的变化Fig.2 Changes in the expression of ALDOA,PFKM,PGK,PYGM and TPI1 in meat with different chilling rates at different times postmortem
作为一种参与糖原代谢的重要酶,PYGM的表达对机体组织能量供应起重要作用。降温处理后,肌肉中的温度下降更快,机体内需要更多的能量从而保持正常的代谢,因此降温处理组的PYGM表达量更高。PYGM表达量高意味着对能量的需求较高,在对成年牛和胎牛6 个组织中PYGM的表达量进行分析发现,能量需求最高的心脏中PYGM的表达量最高[27]。另一方面,由于降温处理延缓了糖酵解的进行,当糖原含量较高时,需要更多PYGM催化糖原降解[20]。研究表明,糖尿病患者体内的PYGM水平异常升高且明显高于健康机体[28],证明糖原含量对PYGM表达量有影响。PFKM催化Mg2+、ATP依赖的果糖-6-磷酸形成ADP和果糖-1,6-二磷酸,以及刺激6-PFKM的活性控制机体的糖酵解代谢[29]。伊犁马PFKM基因在心脏、肝脏、夹肌、斜方肌、背阔肌、臀中肌、半腱肌以及腹外斜肌8 种组织部位中都有表达,在心脏中相对表达量最高[30],研究证实PFKM基因的相对表达量直接影响糖酵解的反应速率[31-32]。降温处理后PFKM的表达量降低,这是由于降温处理延缓了肌肉中葡萄糖的消耗,糖酵解速率减慢。PFKM的表达量与游离葡萄糖显著负相关[33],PFKM表达量升高引起线粒体结构损伤,降低细胞抗凋亡能力和细胞能量代谢效率[34]。推测其原因可能是PFKM催化生成果糖-1,6-二磷酸是糖酵解过程中第一个耗能的环节,机体为了节约能量,减少了PFKM的表达。医学领域的研究表明,PFKM的表达量升高能够改善患者体内氧化应激水平,有效调节红细胞糖代谢状态[35],与本研究中较低的PFKM表达量和较慢的糖酵解结果一致。为了最大限度将果糖-1,6-二磷酸转化生成甘油醛-3-磷酸,ALDOA和TPI1的表达量显著上升。ALDOA与高铁肌红蛋白还原活性负相关[36],ALDOA介导的糖酵解增强是促进肿瘤细胞增殖和转移的因素之一。ALDOA在肺癌及胰腺癌等多种疾病中高表达[37],促进细胞周期蛋白的表达[38]和卵巢颗粒细胞的糖酵解和增殖[39]。TPI1的高表达与肝内胆管癌的复发与不良预后显著相关[40]。TPI1在肉色稳定的牛背最长肌中过表达,与高铁肌红蛋白还原活性正相关[36],TPI1的丰度与剪切力和硬度正相关[41],TPI1还被认为是蛋白降解酶发挥活性的标志,其条带完整性作为嫩度的指标[42]。在宰后肌肉中,降温处理导致ALDOA的高表达并不能加快糖酵解速率。PGK催化糖酵解过程中的第一个产能反应,降温处理后较低的PGK表达量与延缓的糖酵解速率相一致。研究表明肿瘤细胞中PGK的高表达促进了肿瘤细胞对葡萄糖的摄取及利用,增加了乳酸的产生[43]。
总而言之,糖酵解酶对降温处理的响应不一致(图3),降温处理抑制了PFKM和PGK的表达量,较低的PFKM和PGK表达量与延缓的糖酵解速率相印证。PYGM、ALDOA和TPI1等单一酶过表达可能改变代谢物水平,但可能不足以控制糖原代谢的整个途径[24]。针对屠宰和超快速冷却这类外界应激,不同糖酵解酶的变化都向着维持机体稳态的方向发展[12],超快速冷却处理增加了这种效应。在25.1 ℃/h的降温速率条件下,PGK和PFKM的表达量对糖酵解变化的贡献更大。

图3 降温处理组2对5 种糖酵解酶表达量的调节作用Fig.3 Regulatory effect of chilling treatment II on the expression levels of five glycolytic enzymes
2.2 贮藏温度对糖酵解进程的影响
2.2.1 贮藏温度对糖酵解代谢物的影响
由图4可知,降温处理后,在贮藏2 h~1 d内,-4 ℃贮藏的pH值显著高于4 ℃贮藏(P<0.05);不同贮藏温度肉中pH值逐渐下降,-1.5 ℃和-4 ℃在贮藏3 d时达到极限pH值。在贮藏过程中-1.5 ℃贮藏组中葡萄糖浓度显著低于其他两个处理组(P<0.05),4 ℃贮藏组葡萄糖浓度最高。在贮藏12 h~3 d内,4 ℃和-1.5 ℃贮藏组中GP无显著区别(P>0.05),显著低于-4 ℃贮藏组(P<0.05)。不同贮藏温度组中葡萄糖浓度和GP逐渐上升。

图4 不同贮藏温度肉中pH值、葡萄糖含量和GP在宰后不同贮藏时间的变化Fig.4 Changes in pH,glucose content and glycolytic potential of meat during postmortem storage at different temperatures
未经超快速冷却处理的生鲜肉在4 ℃贮藏组的pH值下降速率大于-1.5 ℃贮藏,且-1.5 ℃贮藏组pH值显著高于4 ℃组(P<0.05),说明宰后贮藏温度升高促进糖酵解进程的发生,导致pH值下降速率更快[16]。在本研究中,与-1.5 ℃贮藏相比,降温处理后4 ℃贮藏组的pH值仅在贮藏2 h和12 h时较低,表明超快速冷却处理削弱了贮藏温度对生鲜肉pH值的调节作用。-4 ℃贮藏减缓了pH值下降速率,这是由于ATP水解生成氢离子的速率较慢[16]。-1.5 ℃贮藏组葡萄糖浓度显著低于4 ℃和-4 ℃贮藏组(P<0.05),表明葡萄糖可能是超快速冷却处理后-1.5 ℃贮藏机体内糖酵解的主要底物。与-1.5 ℃贮藏相比,4 ℃延缓了葡萄糖的消耗,但是两者之间GP无显著差异(P>0.05),这表明糖原可能是4 ℃组糖酵解过程的主要底物。与-1.5 ℃贮藏相比,-4 ℃贮藏肉中GP较大,表明其糖酵解生成乳酸的速率快[23]。糖原含量低、乳酸含量高的肌肉在宰后早期的糖酵解速率高于糖原含量高、乳酸含量低的肌肉[23]。从代谢物的变化可以看出降温处理后-1.5 ℃贮藏和4 ℃贮藏对糖酵解的延缓作用一致,-4 ℃贮藏延缓了pH值下降,但提升了GP。
2.2.2 贮藏温度对糖酵解酶表达量的影响
由图5可知,贮藏过程中4 ℃和-1.5 ℃条件下PYGM的表达量先上升后下降,-4 ℃贮藏下PYGM表达量无显著变化(P>0.05)。贮藏过程中4 ℃和-4 ℃贮藏组中PGK表达量先上升后下降,-1.5 ℃贮藏组中PGK表达量随贮藏时间的延长而下降。在贮藏过程中-1.5 ℃的PYGM表达量显著高于-4 ℃贮藏组。ALDOA的表达量在不同贮藏温度条件下均先上升后下降,4、-1.5 ℃和-4 ℃分别在贮藏2、12 h和1 d时达到极值。不同贮藏温度条件下肉中PFKM表达量随贮藏时间的延长逐渐下降,仅在贮藏5 d时4 ℃贮藏组的PFKM表达量显著低于其他温度贮藏组(P<0.05)。随着贮藏时间的延长,不同温度贮藏组中TPI1表达量先上升后下降。-1.5 ℃贮藏温度条件下TPI1的表达量在贮藏12 h时最高,贮藏3 d时最低。
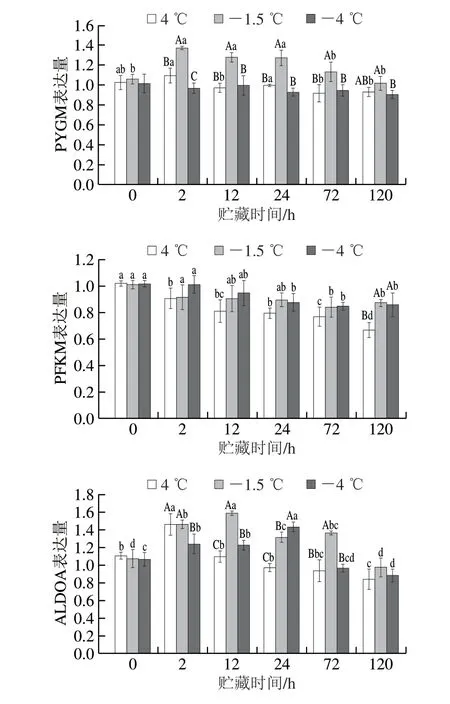
与-1.5 ℃贮藏相比,4 ℃和-4 ℃贮藏肌肉中PYGM表达量较低,这可能是由于体系内糖原含量低。-4 ℃贮藏组中较高的PFKM和PGK表达量也证明了其较快的糖酵解速率[33]。较高的PFKM表达量伴随ATP的生成,机体内因为ATP水解导致的游离氢离子减少,因此-4 ℃贮藏组pH值下降速率慢。总之,经过相同降温速率处理后,不同贮藏温度对糖酵解酶表达量的影响存在差异。-1.5 ℃贮藏和4 ℃贮藏对糖酵解酶表达量的影响相同,不改变降温速率对糖酵解酶表达量的调控作用,均通过抑制PGK的表达量延缓糖酵解,而-4 ℃贮藏通过上调PGK的表达量促进了糖酵解过程(图6)。结合不同降温速率糖酵解酶表达量的结果,超快速冷却中降温处理对糖酵解速率的调控作用更强,降温处理后4 ℃和-1.5 ℃贮藏不改变降温处理对糖酵解的延缓作用,且降温处理后糖酵解的主要底物是葡萄糖。
2.3 不同处理条件对糖酵解和糖酵解酶表达量的相关性分析
选择糖酵解底物葡萄糖和5 个糖酵解酶的表达量进行相关性分析,结果如表1 所示,在不同降温速率条件下,葡萄糖水平与PFKM表达量显著负相关(P<0.05),与PYGM的表达量极显著正相关(P<0.01),与其他蛋白的表达量无显著相关性(P>0.05)。在不同贮藏温度条件下,葡萄糖水平与PFKM和PYGM的表达量呈显著负相关(P<0.05)。

表1 不同降温速率和贮藏温度肉中葡萄糖水平和糖酵解酶表达量回归系数参数估计值Table 1 Regression coefficient parameter estimates for glucose contents and expression levels of glycolytic enzymes in meat at different chilling rates and storage temperatures
在宰后糖酵解过程中,葡萄糖和糖原分解生成乳酸和氢离子,导致pH值下降[20]。葡萄糖是糖酵解过程的底物,与pH值负相关。在不同降温速率和贮藏温度处理中PFKM和PYGM的表达量与葡萄糖含量存在相关性,表明PFKM和PYGM的表达量在一定程度上反映糖酵解的进程。不同温度条件下PYGM表达量与葡萄糖含量相关性的差异表明,随着宰后贮藏条件变化和宰后时间延长,糖酵解过程底物含量的变化模式不同。降温处理时,糖酵解以糖原为主要底物;在不同贮藏温度条件下,糖酵解主要消耗的底物是葡萄糖。虽然葡萄糖水平随不同温度条件变化显著,但是并不改变糖原是糖酵解过程的有效底物[44]。高表达量的PFKM可能有助于糖酵解的进行,为后续甘油醛-3-磷酸的生成提供底物。总而言之,PFKM的表达量可以表征不同降温速率和贮藏温度处理对糖酵解反应速率的影响,PFKM的高表达与较快的糖酵解速率相关。
3 结论
超快速冷却显著延缓生鲜羊肉中pH值和葡萄糖含量的下降,抑制了糖酵解速率。降温处理是延缓糖酵解的核心环节,25.1 ℃/h的降温速率通过下调PFKM和PGK的表达量,上调PYGM、ALDOA和TPI1的表达量实现延缓糖酵解。降温处理后冷藏和冰温贮藏不改变降温速率对糖酵解过程的延缓作用。超快速冷却处理后生鲜羊肉中的糖酵解底物以葡萄糖为主,生鲜羊肉中葡萄糖含量与PFKM的表达量之间的负相关进一步体现了超快速冷却处理后PFKM对糖酵解速率的调控作用,PFKM可能是超快速冷却过程中调控糖酵解的关键酶。
